Introducción
La agricultura ha experimentado en la última década un fuerte proceso de intensificación productiva, reducción del número de cultivos sembrados y adopción generalizada de la siembra directa1)(2. Esto ha resultado en un aumento significativo de las problemáticas sanitarias causadas por patógenos necrotróficos, lo que ha derivado en el in-cremento del uso de fungicidas3, con el consecuente impacto económico y ambiental que esto conlleva. En estos sistemas, el reducido número de cultivos, la fuerte presión que ejercen los mercados y el amplio rango de hospede-ros de algunos patógenos, condicionan algunas medidas de fuerte impacto para el manejo de las enfermedades4)(5.
En este contexto, surge la necesidad de generar información que contribuya al desarrollo de un manejo sustentable de las enfermedades. El control biológico es una herramienta que ha sido poco explorada en sistemas agrícolas extensivos, y que puede reducir el impacto de las enfermedades en el marco de un manejo integrado de las mismas.
Diversos trabajos muestran que la introducción masi-va de Trichoderma spp. en espigas y hojas de trigo logra-ron reducir el desarrollo de las enfermedades causadas por Fusarium graminearum, Zymoseptoria tritici, Bipolaris sorokiniana y Drechslera tritici-repentis6)(7)(8)(9. Por otra parte, la aplicación de agentes de biocontrol al rastrojo ha resultado en la reducción de la presión de inóculo de algunos patógenos de importancia económica5)(10. Pese a los resultados alentadores, una constante en este tipo de enfoques ha sido la falta de adaptabilidad de los agentes de biocontrol al patosistema donde fueron introducidos, y la ausencia de un ambiente que permita la expresión del antagonismo, resultando en efectos efímeros y/o inconsistentes, cuando se evalúan en condiciones de campo.
Una estrategia que ha mostrado mayor estabilidad en los resultados es el desarrollo de ambientes supresivos de enfermedades, donde elevadas poblaciones nativas de microorganismos benéficos logran suprimir el desarrollo de epidemias11. Existen abundantes antecedentes enfocados al manejo de poblaciones de biocontroladores nativos (adaptados a los patosistemas). La generación de ambientes que favorecen una elevada densidad poblacional del biocontrolador, permite una mejor actividad antagónica del controlador, minimizando el impacto de las enfermedades12)(13)(14.
En este sentido, Trichoderma es un género de hongos que habita naturalmente los suelos y que mediante la diseminación de esporas y el crecimiento micelial puede colonizar al rastrojo y antagonizar los microorganismos allí presentes. Varias especies dentro de este género han mostrado ser eficientes biocontroladores de un amplio grupo de patógenos de importancia económica7)(8. A su vez, se ha demostrado la potencialidad de manejar la población de Trichoderma spp. en el suelo mediante la secuencia de cultivos15)(16)(17, así como también, mediante cambios en las propiedades químicas del suelo18. Sin embargo, no existen antecedentes sobre la dinámica poblacional de Trichoderma spp. en el rastrojo.
El presente estudio tuvo como objetivo determinar el efecto de la rotación de cultivos sobre la población de Trichoderma spp. que habita el suelo y los rastrojos en un sistema de agricultura continua en siembra directa, y comprender qué componentes de la secuencia de cultivos permiten el mantenimiento de altas poblaciones nativas de Trichoderma.
Materiales y métodos
Sitio experimental
El monitoreo de la población de Trichoderma spp. se realizó en un experimento que incluyó cuatro secuencias de cultivos sembrados sin laboreo instalado en 1999 en la Estación Experimental Mario A. Cassinoni (EEMAC, 32°21’58.46"S; 58°3’56.35"O), Paysandú, Uruguay. Este estudio se llevó a cabo entre el 2009 y el 2012, por lo cual las secuencias de cultivo ya estaban estabilizadas, o sea, habiendo pasado todos los cultivos al menos por dos secuencias de cultivos completas. Dicho experimento presenta las siguientes secuencias de cultivos: 1- trigo-soja, 2- trigo-soja-cebada-girasol, 3- trigo-soja-cebada-sorgo-avena-maíz, 4- trigo-soja-cebada-girasol-avena con lotus-lotus 2º año. A su vez, con el objetivo de eliminar el efecto año, el experimento se diseñó con 10 tratamientos de manera que todos los cultivos de las cuatro secuencias estuvieron presentes todos los años. Estas secuencias de distinta duración compuestas de diferentes especies botánicas, permitieron evaluar la población de Trichoderma spp. en diversos microambientes.
El experimento tuvo un diseño experimental de bloques completos con parcelas aleatorizadas con tres re-peticiones. Las parcelas fueron de 10 m x 30 m, con 3 m de separación entre parcelas y 10 m entre bloques. Los cultivos se manejaron como cultivos comerciales, con densidad de siembra, fertilización, y manejo de plagas de acuerdo a lo requerido por cada cultivo. No se aplicó ningún fungicida en el experimento, de modo de reducir el impacto de estos sobre las poblaciones fúngicas.
Condiciones climáticas: los datos de lluvia y tempera-tura fueron obtenidos de la estación meteorológica de la EEMAC (estación meteorológica automática DAVIS VANTAG2 PRO2 L.R., U.S.A.), ubicada a 1,3 km del experimento (32°22’41.48"S; 58° 3’57.00"O).
Muestreo de rastrojo
Se realizaron muestreos de rastrojo en dos momentos del año (primavera y otoño), durante tres años consecutivos: primavera 2009 (Prim 2009), otoño 2010 (Ot2010), primavera 2010 (Prim2010), otoño 2011 (Ot2011), prima-vera 2011 (Prim2011) y otoño 2012 (Ot2012). Las mues-tras de rastrojo se colectaron utilizando cuadros de mues-treo de 50 cm x 50 cm, realizando cinco lanzamientos al azar por parcela y colectando todo el rastrojo que se encontraba en la superficie del suelo dentro del cuadro. El rastrojo colectado en todos los lanzamientos era colocado en una bolsa de papel generando una muestra compuesta, representativa de cada parcela. Se procedió a secar el rastrojo en estufa de aire forzado (FANEM® modelo 315, Brasil) a 40 °C durante 24 horas, y se determinó el peso seco del mismo.
En los muestreos de primavera 2011 y otoño 2012, se seleccionó el componente principal constituido por el rastrojo del último cultivo cosechado, y se cuantificó el mismo, expresado como porcentaje del peso total de la muestra. De esta forma, en las muestras colectadas en otoño predominaba el rastrojo del último cultivo de invierno, y en las de primavera predominaba el rastrojo del último cultivo de verano. Ambos rastrojos al momento de ser colecta-dos tuvieron aproximadamente seis meses de descomposición en el campo. Las muestras fueron conservadas en bolsas de papel a temperatura ambiente, en un ambiente seco y oscuro hasta su procesamiento, por no más de siete días.
Muestreo de suelo
Las muestras de suelo fueron colectadas al mismo momento que las muestras de rastrojo, en dos veces al año, en dos años consecutivos: primavera 2009, otoño 2010, primavera 2010 y otoño 2011. Las mismas fueron colectadas con calador desde los 5 cm superficiales del suelo (profundidad de 0 a 5 cm). En cada parcela se colectaron 20 tomas que se mezclaron en una misma bolsa de modo de tener una muestra compuesta. Las muestras fueron conservadas por no más de siete días en bolsas de plástico en heladera a 4 ºC hasta su procesamiento.
Cuantificación de la población de Trichoderma spp. en suelo y rastrojo
La densidad poblacional de Trichoderma spp. en suelo y rastrojo en cada muestra fue determinada siguiendo el método propuesto por Vargas Gil y otros19 con modificaciones. Sub-muestras de 10 g de rastrojo o de suelo, se colocaron en matraces Erlenmeyer de 250 ml y se suspendieron en 150 ml y 100 ml de suero fisiológico estéril, respectivamente, homogeneizado por agitación durante 30 minutos a 200 rpm en un agitador orbital (Felisa®, Modelo FE315, México). De cada suspensión se tomó 1 ml y se realizó una dilución en 9 ml de suero fisiológico estéril. Una alícuota de 300 µl de cada suspensión y su correspondiente dilución 1/10 se sembró en placas con medio semiselectivo para Tri-choderma20. Se sembraron cuatro placas por dilución, dos placas un día y al día siguiente otras dos placas para tener repetición en el tiempo. Las mismas fueron incubadas a 25 ºC en oscuridad, y luego de seis días se contó el número total de colonias de Trichoderma spp., expresando el resultado como unidades forma-doras de colonias por gramo seco (UFC/g) de suelo o rastrojo, respectivamente. Para corroborar que las colonias cuantificadas pertenecieran al género Trichoderma se aislaron distintas variaciones morfológicas de las colonias creciendo en medio de cultivo, y se identificaron en forma molecular mediante la amplificación y secuenciamiento de la región del ITS del operón del ADN ribosomal.
Determinación de las propiedades químicas del suelo
Se tomaron sub-muestras de suelo de todas las unidades experimentales colectadas en otoño 2011, y se enviaron al laboratorio de Suelos y Aguas del Instituto Nacional de Investigación Agropecuaria (INIA) La Estanzuela, donde se realizó el análisis de nitrógeno total (N) por combustión a 900 ºC y posterior detección de N2 por conductividad térmica y potasio (K) en solución de acetato de amonio a pH 7 y emisión atómica. Los análisis de materia orgánica (MO), pH y fósforo (P) fueron realizados en el Laboratorio de Suelos y Agua de la Estación Experimental Mario A. Cassinoni. El contenido de materia orgánica se estimó a través del método Walkley-Black21. El pH fue calculado en una solución de cloruro de potasio 1 N y en agua destilada. El P se determinó a través de la técnica BRAY Nº122.
Análisis estadístico
El análisis estadístico de los conteos de colonias se realizó mediante un modelo lineal generalizado, con distribución Poisson usando el procedimiento Glimmix mediante el paquete estadístico SAS23.
Cuando el análisis permitió rechazar la hipótesis nula, se procedió a la comparación de medias mediante la prueba de Wald, y los P-valor fueron ajustados por Tukey (P = 0,05). Para contenido de materia orgánica, pH y contenido de nutrientes del suelo fue realizado el análisis de la varianza. Cuando este permitió rechazar la hipótesis nula, las medias fueron separadas mediante la prueba de Tukey (P < 0,05). La regresión lineal entre dos variables fue estimada por medio del método de estimación de mínimos cuadrados (P < 0,05).
Resultados
Condiciones climáticas
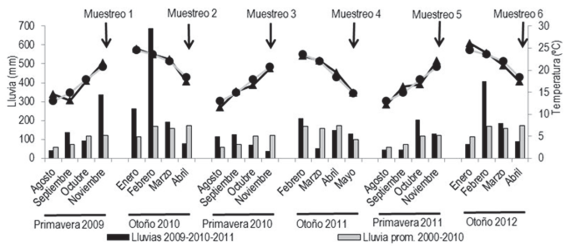
Las condiciones climáticas previas a cada uno de los muestreos fueron diferentes entre sí (Figura 1). La precipitación acumulada en los cuatro meses previos a cada muestreo fue mayor al promedio del período 2000-2010 en Prim2009, Ot2010, y Ot2012, indicando mayores condiciones de humedad tanto en el suelo como en el rastrojo. En comparación a estos, en los meses previos al muestreo de Ot2011 y Prim2011 ocurrieron menos precipitaciones acumuladas y por tanto menor humedad en suelo y rastrojo. El período previo al muestreo Prim2010 fue en donde se registró menor cantidad de precipitaciones acu-muladas. Las temperaturas fueron similares al promedio histórico en los períodos anteriores a los seis muestreos. La temperatura media diaria fue en aumento en los mues-treos de primavera, (20-22 ºC en los meses del muestreo), y decreciente en los muestreos de otoño (15-18 ºC al momento de los muestreos).
Población de Trichoderma spp. en el rastrojo de cada cultivo
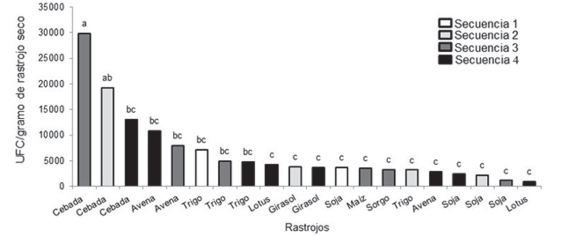
Trichoderma spp. fue recuperada de todos los rastrojos de los cultivos analizados. La cebada fue el componente botánico que presentó significativamente mayor población de Trichoderma spp. (P < 0,05). No obstante, se encontraron diferencias significativas en la densidad poblacional entre los rastrojos de cebada pertenecientes a distintas secuencias de cultivos (Figura 2). Por otra parte, los rastrojos de avena y trigo (a excepción del rastrojo de trigo y avena de la secuencia 2 y 4, respectivamente), presentaron niveles poblacionales intermedios entre los rastrojos de cebada y de los cultivos de verano. Estos últimos, junto con el rastrojo aportado por las praderas de lotus, presentaron una menor población de Trichoderma spp.
Población de Trichoderma spp. en el rastrojo y en el suelo de cada secuencia de cultivos
Se encontraron diferencias significativas entre las secuencias en el Ot2010, tanto para la población en el suelo como en el rastrojo. En los demás muestreos no se observaron diferencias significativas entre las secuencias (datos no mostrados). Al analizar la población de Trichoderma en el rastrojo total (todo el rastrojo presente en superficie), la secuencia con predominancia de rastrojo de cebada en Ot2010 presentó significativamente mayor población que el resto de las secuencias (Figura 3).
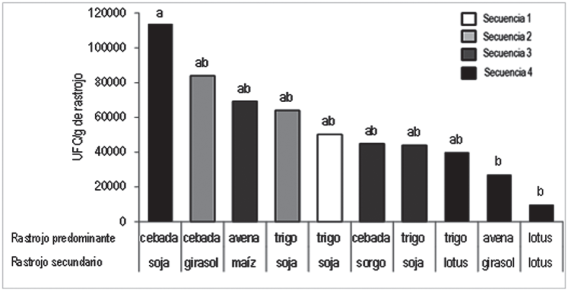
Figura 3: Densidad poblacional de Trichoderma spp. en los rastrojos de cada rotación según secuencia en otoño de 2010. Barras con distinta letra representan medias que difieren significativamente entre sí (P < 0,05).
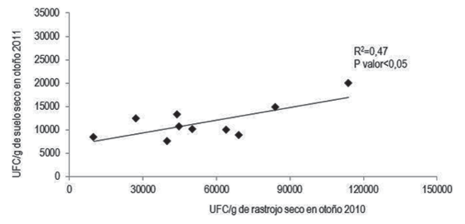
A su vez en Ot2011 hubo diferencias significativas entre los distintos tratamientos respecto a la población de Trichoderma spp. en el suelo (Cuadro 1). Allí la densidad poblacional del hongo fue significativamente mayor en la rotación 9 en relación a las rotaciones 7 y 8 (las tres rotaciones corresponden a la misma secuencia de cultivos), ubicándose el resto de los tratamientos en una posición intermedia. Asimismo la densidad poblacional de Trichoderma spp. en el rastrojo en Ot2010 tuvo una correlación significativa con la densidad poblacional en el suelo cuantificada en Ot2011 (R2 = 0,47, estadísticamente significativo con P < 0,05) (Figura 4).
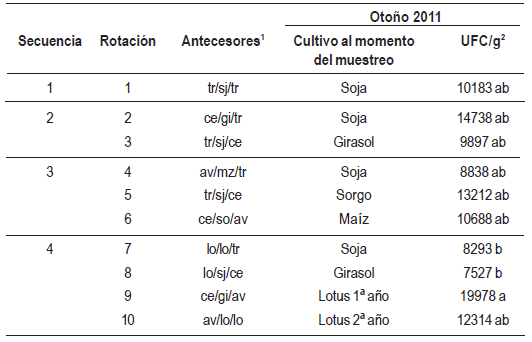
Cuadro 1: Densidad poblacional de Trichoderma spp. en el suelo (UFC/g) según secuencia y rotación de cultivos en el otoño 2011.
Relación entre las propiedades químicas del suelo y la población de Trichoderma spp. en el suelo
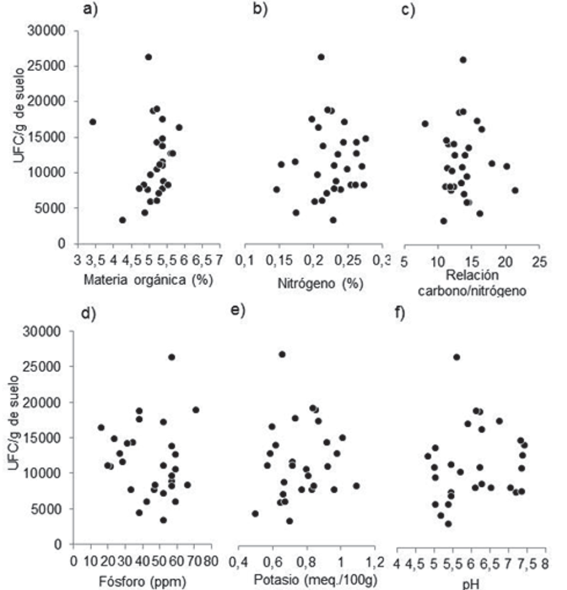
El contenido de materia orgánica promedio fue de 5,2 %, el de fósforo 44,2 ppm, el pH del suelo 6,1, el contenido de nitrógeno promedio 0,22 %, el de potasio 0,78 meq/100g de suelo y la relación carbono/nitrógeno del suelo fue en promedio 13,7. Las distintas rotaciones de cultivos no tuvieron efecto significativo sobre las propiedades químicas mencionadas (ANOVA no significativo con P < 0,05). No hubo correlación significativa entre las poblaciones de Trichoderma spp. en el suelo y las propiedades químicas del mismo (Figura 5).
Discusión
Los diferentes cultivos evaluados tuvieron un impacto diferencial sobre la densidad poblacional de Trichoderma spp. presente tanto en el suelo como en el rastrojo, donde el rastrojo de cebada, presentó consistentemente una mayor población Trichoderma spp. respecto a otros cultivos. Esto determina la posibilidad de manejar la población de Trichoderma spp. a través de los componentes de las secuencias de cultivos, y a su vez identificar ambientes propicios para el mantenimiento de altas poblaciones de Trichoderma ante eventuales inoculaciones inundativas con este agente de biocontrol.
Estos resultados coinciden con los mencionados por numerosos autores respecto a la posibilidad de manejar comunidades microbianas benéficas del suelo para el control de enfermedades12)(14)(15)(16)(17. El aumento poblacional logrado con el cultivo de cebada coincide con estudios realizados in-vitro donde se ha encontrado mayor densidad poblacional y actividad de Trichoderma favorecidas por la presencia de sustratos con relación carbono/nitrógeno similar a la de los rastrojos de cebada, avena y trigo (tan altas como 80/1)24. Asimismo, investigaciones a partir de muestras colectadas de sistemas agrícolas muestran que el rastrojo de cebada presentó mayores niveles de colonización de Trichoderma spp. que otros cultivos extensivos, inclusive que otros cultivos de invierno como raigrás y trigo25.
Las diferencias encontradas en la densidad poblacional de Trichoderma spp. en el rastrojo de cebada correspondiente a distintas secuencias, indican que existió también un efecto de la secuencia de cultivos más allá del efecto directo de la cebada. Al respecto, Pereyra y otros25 encontraron que el rastrojo de ceba-da colectado de sistemas en agricultura continua pre-sentaba mayor densidad poblacional de Trichoderma spp. que el colectado en sistemas agrícolas en rotación con praderas. Estas diferencias generadas por los cultivos antecesores posiblemente están definidas por la población inicial de Trichoderma spp. en el momento en que el rastrojo de cebada es incorporado al sistema (luego de la cosecha), siendo menor la población en el rastrojo de cebada de la secuencia que rota con pasturas (secuencia 4 del experimento), probable-mente debido al efecto depresivo que mostró la pradera de Lotus sobre la población del hongo, tanto en suelo como en rastrojo.
La preferencia de las poblaciones de Trichoderma spp. por los rastrojos de los cultivos de invierno evidenciadas en este estudio (principalmente cebada), determina que la población será más abundante en la medida que aumente la cantidad de ese tipo de rastrojos en la secuencia de cultivos. Esto es así principalmente en los meses de otoño, cuando es mayor su presencia relativa en el conjunto de rastrojos y las condiciones ambientales son más favorables para el crecimiento de Trichoderma en relación a las de verano e invierno debido a las altas y bajas tempe-raturas, respectivamente, registradas en esas estaciones. En relación a esto Cabrera13 muestra que el rango de temperatura óptimo para cepas nativas de Trichoderma se ubica en los rangos de temperaturas registrados en los meses de primavera y otoño en Uruguay.
Por otra parte, las poblaciones de Trichoderma spp. en el suelo tuvieron una respuesta significativa a los tratamientos. Varios autores han demostrado que las densidades poblacionales de Trichoderma spp. en el suelo responden a distintas prácticas de manejo, inclusive a la rotación de cultivos15)(17)(18. Vargas Gil y otros18 encontraron mayor población de Trichoderma spp. luego del cultivo de maíz en comparación con soja y maní. Estos autores adjudica-ron el incremento de la población del hongo al aumento en el contenido de materia orgánica del suelo por la inclusión de gramíneas C4 en la rotación. Estos resultados difieren de los obtenidos en el presente estudio, donde el contenido de materia orgánica del suelo no se vio modificado por las distintas rotaciones de cultivos. A su vez, tampoco se encontró efecto de la rotación sobre las demás propiedades químicas de los suelos evaluadas, lo cual posiblemente haya determinado que no se encontraran asociaciones entre ellas y la población de Trichoderma spp., como ya se ha descrito en varios estudios18)(26.
No obstante, se constató una regresión lineal significativa entre la densidad poblacional de Trichoderma spp. en el rastrojo en Ot2010 y su nivel poblacional en el suelo en Ot2011. Esto significaría que en las condiciones de este estudio una parte de la variabilidad de la densidad poblacional de Trichoderma spp. en el suelo estuvo asociada al nivel poblacional en el rastrojo de los cultivos de la secuencia. Estos resultados resaltan el impacto directo de los cultivos como fuente de carbono sobre la población de Trichoderma spp. en el suelo más allá de su efecto sobre las propiedades químicas del suelo.
Sin embargo, en condiciones de sustrato no limitante, la temperatura y la humedad gobiernan el crecimiento de los hongos27. Debido a que la evolución de la temperatura y las lluvias ocurridas fueron diferentes a lo largo del período de estudio, es altamente probable que haya existido un efecto diferencial de esta variable sobre la población de Trichoderma spp. en las distintas estaciones. Futuros trabajos deberían apuntar a evaluar el efecto de las condiciones ambientales (micro y macro-climáticas) a nivel de campo sobre la población de Trichoderma spp., ya que existe muy poca información al respecto.
Estos resultados permiten identificar ambientes favorables para Trichoderma spp. que resultan en mayores poblaciones nativas del hongo. En este sentido, la composición botánica del rastrojo es un factor a tener en cuenta para el manejo de la población de Trichoderma spp. En el marco de una estrategia inoculativa con cepas nativas de Trichoderma, los resultados obtenidos evidencian que, en otoño y con predominancia de rastrojo de cebada, hay mayores probabilidades de mantener altos niveles poblacionales de Trichoderma spp. Este enfoque ha permitido obtener resultados más consistentes y duraderos en relación al manejo tradicional de las inoculaciones28)(29. Se sostiene la premisa que el problema no es la falta de microorganismos antagonistas sino la falta de un ambiente que mantenga elevadas sus densidades poblacionales y actividades relacionadas al control biológico18. Esta línea de investigación constituye un insumo clave para futuros trabajos que busquen reducir el efecto de las enfermedades en la producción de cultivos, a través del manejo de las poblaciones de Trichoderma, incluyendo inoculaciones a nivel de campo.