Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Agrociencia (Uruguay)
versão impressa ISSN 1510-0839versão On-line ISSN 2301-1548
Agrociencia Uruguay vol.19 no.1 Montevideo jun. 2015
Recolonización natural por bosque ribereño en margen izquierda del embalse de Salto Grande. Identificación de especies pioneras
González Silvia1, Cadenazzi Mónica2
1Facultad de Agronomía, Universidad de la República, Regional Norte. General Rivera 1350. 50000 Salto, Uruguay. Correo electrónico: silviagonzalez188@gmail.com
2Facultad de Agronomía, Estación Experimental Mario A. Cassinoni (EEMAC), Universidad de la República. Ruta 3 km 363, 60000 Paysandú, Uruguay
Recibido: 10/4/14 Aceptado: 30/4/15
Resumen
El embalse de Salto Grande, formado en 1979 al finalizar la construcción de la represa homónima, ocupa la última porción del curso medio del río Uruguay. Estas obras determinaron la inundación de numerosas hectáreas en los departamentos de Artigas y Salto en Uruguay y en Entre Ríos, Argentina, con destrucción de bosques ribereños e isleños de elevada diversidad. A más de tres décadas de este disturbio ha sido posible observar regeneración natural de fajas boscosas sobre sus riberas. La composición florística y los caracteres de la vegetación de estos bosques han sido estudiados mediante recorridas exhaustivas y muestreos en 16 lugares a orillas del embalse, realizándose análisis estadísticos de los datos. En toda el área se contabilizaron 100 especies leñosas: 83 nativas y 17 exóticas pertenecientes a 34 familias. No obstante, el número de especies registradas en cada local es mucho menor, con mínimos de 10, 12, 17 especies por recorrida; dos, siete, nueve especies por muestreo en algunos bosquecitos; y un máximo de 48 y 33 especies (por recorrida y muestreo respectivamente) en el local más norteño. En las comunidades del embalse estudiadas se repiten y son predominantes Erythrina crista-galli, Vachellia caven (Acacia caven), Sesbania virgata, Sebastiania schottiana, Terminalia australis y otras, reconocidas como especies pioneras o sucesionales tempranas. La familia dominante es Fabaceae. En islas próximas a Bella Unión, al norte del embalse se conserva la vegetación de selva con pocas alteraciones, constituyendo fuentes de propágulos.
Palabras clave: BOSQUE RIBEREÑO, EMBALSE DE SALTO GRANDE, SUCESIÓN ECOLÓGICA, ESPECIES PIONERAS
Summary
Natural Recolonization by Riparian Forest on the Left Bank of the Salto Grande Reservoir. Identification of Pioneer Species
The reservoir of Salto Grande, formed in 1979 when the building of the homonymous dam was completed, covers the last stretch of the middle section of the Uruguay river. These works caused the flooding of numerous hectares in the departments of Salto and Artigas in Uruguay, and in the province of Entre Ríos in Argentina, destroying woods of great diversity on the riverside and on the islands. After more than three decades of this disruption, it has been possible to observe natural regeneration of wooded strips on the banks. The composition of the flora and the characters of the vegetation in these woods have been thoroughly studied on rounds of observation and samplings performed on 16 places on the banks of the reservoir and statistical analysis of the data have been done. One hundred woody species have been counted all over the area: 83 native ones and 17 exotic ones belonging to 34 families. Nevertheless, the number of species listed in each location is much less, with a minimum of 10, 12, 17 species per observation round; two, seven, nine species per sampling in some small woods; and a maximum of 48 and 33 species (per round and per sampling, respectively) in the most northern location. In the communities of the reservoir which were studied Erythrina crista-galli, Vachellia caven (Acacia caven), Sesbania virgata, Sebastiania schottiana, Terminalia australis and others recognized as pioneers or early successional species are recurrent and predominant. The predominant family is Fabaceae. On the islands near Bella Unión, to the north of the reservoir, the forest vegetation remains with few alterations, thus being a source of propagules.
Keywords: RIPARIAN FORESTS, SALTO GRANDE RESERVOIR, ECOLOGICAL SUCCESSION, PIONEER SPECIES
Introducción
El río Uruguay nace en la Serra do Mar, Santa Catarina, Brasil, siendo su curso superior torrentoso. Su curso medio presenta numerosas islas desde la desembocadura del Cuareim, la mayoría de las cuales quedaron sumergidas al formarse el embalse. El bajo Uruguay se extiende entre Salto Grande y Punta Gorda (Colonia, Uruguay), desembocando en el Río de la Plata (Abadie, 1998).
En sus 1.838 km el río Uruguay transcurre por diversos territorios biogeográficos: la Mata Atlántica, la Mata de Araucarias, la Selva Misionera, el Espinal y la Provincia Pampeana (Cabrera y Willink, 1973) actuando como vía dinámica de dispersión de especies subtropicales y tropicales hacia latitudes templadas y generando ambientes marginales para el desarrollo de bosques. Constituye así un corredor biogeográfico de características similares al corredor Paraguay-Paraná (Oakley et al., 2005) donde muchas especies encuentran el límite meridional de su distribución, disminuyendo la riqueza a medida que aumenta la latitud (Chebataroff, 1969; Brussa y Grela, 2007).
Los bosques de islas del Uruguay medio son zonas de interés biogeográfico para Uruguay, con vegetación de selva subtropical y alta riqueza de especies (Brussa y Grela, 2007; Escudero, 2004), reconocidos como «hotspots» de la «Flora occidental» (Grela, 2004). La mayoría sufrió devastación en la década de 1970 por obras de Salto Grande. En las islas remanentes crecen especies «exclusivas» del litoral noroeste de Uruguay como Inga vera Willd. subsp. affinis (DC.)T.D.Penn., Albizia inundata (Mart.) Barneby & J.W.Grimes, Eugenia repanda O.Berg, Handroanthus heptaphyllus (Mart.) Mattos, Combretum fruticosum (Loefl.) Stuntz, Terminalia australis Cambess., Peltophorum dubium (Spreng.) Taub., Lonchocarpus nitidus (Vogel) Benth., Poecilanthe parvifolia Benth., Diospyros inconstans Jacq., Calliandra parvifolia (Hook. & Arn.) Speg., Tabernaemontana catharinensis A. DC., Coccoloba argentinensis Speg., Croton urucurana Baill., Pouteria gardneriana (A.DC.) Raldk., Dalbergia frutescens (Vell.) Britton, Acacia praecox Griseb., Aspidosperma quebracho-blanco Schltd., junto a especies de amplia distribución y otras comunes a las quebradas del noreste (Grela, 2004; González, 2013). Los bosques del bajo Uruguay no fueron talados al construirse la represa pero desde el período colonial han sido objeto de explotación para abastecer de leña y carbón a ciudades (Montevideo, Colonia, Buenos Aires) y a hornos de cal. En el siglo XIX se intensificó su explotación con la utilización de carbón de leña para la maquinaria a vapor de saladeros y del ferrocarril y en crisis energéticas de 1940 para fabricar gasógenos (Escudero, 2004; Gautreau, 2005; Carrère, 2010).
En 1979 entró en funcionamiento la represa hidroeléctrica de Salto Grande. Su embalse ocupa 783 km², tiene 140 km de longitud y 35,5 m de cota (De León y Chalar, 2003). Su formación produjo grandes cambios a orillas del río Uruguay, determinando relocalización de centros poblados en ambas márgenes, trazado de rutas, puentes, etc. (Otaegui, 1994). Frente a los departamentos de Artigas y Salto desaparecieron 19 islas, quedando emergidas las más norteñas: Timboy, Rica, Zapallo, del Padre e Itacumbú (Sierra et al., 1977). En Uruguay se deforestó el vaso del lago de Salto Grande con eliminación total de bosques isleños y en galería del río Uruguay, algarrobales y espinillares (CTM Salto Grande, 1983). Esta perturbación de intensidad y severidad extremas en área amplia causó pérdida completa de biodiversidad (Otaegui, 1994).
Según datos de Censos Agropecuarios, entre 1966 y 1980 en el departamento de Salto la superficie boscosa pasó de 34600 hectáreas a 31100 y en Artigas de 38900 a 34200 hectáreas, siendo esta reducción en gran parte atribuible a las obras de Salto Grande (Carrère, 1990).
La elevación del nivel del agua del embalse en más de 30 metros trasladó las riberas hacia zonas más altas, generándose condiciones de humedad propicias para la implantación natural de vegetación boscosa en lugares de pradera y/o bosques xerofíticos (Espinillares / Algarrobales), sobre suelos no forestales (Escudero, 2004). El inicio de una sucesión boscosa a orillas del embalse es un fenómeno en marcha: en distintas localidades han surgido espontáneamente parches de vegetación leñosa. La sucesión implica procesos direccionales y continuos de colonización y extinción de poblaciones en una localidad, con arribo, implantación y sustitución de especies en el tiempo. Una visión inicial, determinista de la sucesión ecológica, postulaba que los cambios sucesionales conducen a una situación de equilibrio: la comunidad clímax (Clements, 1916). Investigadores posteriores pusieron énfasis en los diferentes disturbios y sus consecuencias evolutivas para las comunidades, concibiendo la dinámica sucesional como una serie de «estados y transiciones» (Westoby et al., 1989).
La recolonización natural boscosa a orillas del embalse es afectada por distintas perturbaciones: fluctuaciones de nivel del agua, sequías, antropización de la zona, explotación ganadero- agrícola y citrícola (observación personal). Los objetivos de este estudio fueron: describir la composición florística de los bosquecitos de la margen izquierda del embalse de Salto Grande y elaborar un listado de especies y familias para el área; describir la diversidad de cada comunidad boscosa incipiente: número de especies, Índice de Shannon y Equitatividad; muestrear las comunidades y determinar frecuencia, abundancia, dominancia (absolutas y relativas) e índice de valor de importancia (IVI) de sus especies; reconocer las especies pioneras y determinar su importancia en cada localidad; y reconocer la familia o familias dominantes en el área.
Materiales y métodos
El área de estudio se localiza sobre la margen izquierda del río Uruguay al noroeste de la República Oriental del Uruguay, departamentos de Artigas y Salto, desde la desembocadura del arroyo Itacumbú (30º 22’ S, 57º 39’ W) hasta la Represa de Salto Grande (31º 16´ S; 57º 56´W).
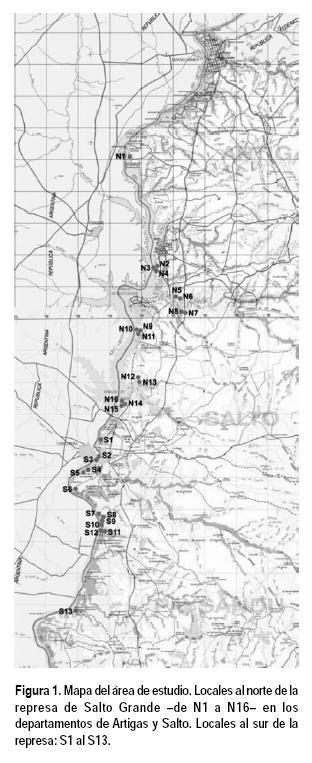
Luego del reconocimiento del área y estudio de cartografía e imágenes satelitales se seleccionaron 16 lugares con criterio preferencial (Matteucci y Colma, 1982) –de N1 a N16– (Figura 1) que presentan diferentes ubicaciones geográficas y topográficas, variedad de sustratos geológicos, de suelos y de fertilidad y diferentes manejos según los establecimientos (Tabla 1).
Los bosquecitos están en las orillas o distantes dos o tres metros del agua, formando parches discontinuos separados por áreas desprovistas de vegetación leñosa; tienen escaso ancho y poca densidad. En general presentan reducido número de especies. No se verifica una clara disposición de especies en franjas asociadas al gradiente hídrico, aunque están presentes hidrófitas, mesófitas, subxerófitas y xerófitas. Su altura no sobrepasa los 3-4 m, salvo donde ocurren Peltophorum dubium, Salix humboldtiana o Melia azedarach, cuyas copas sobresalen por encima de especies de menor porte, siendo la estratificación vertical incipiente o nula (observación personal). Los ambientes sobre los que se desarrollan son variados: los bosques más próximos a la represa ocupan colinas de areniscas y cantos rodados de la Formación Salto, con suelos pobres de las unidades Salto y Constitución. Los de la desembocadura del río Arapey se asientan sobre la cuesta basáltica, con suelos de la unidad Itapebí-Tres Árboles, de mayor fertilidad pero superficiales. Más al norte los bosquecitos se desarrollan sobre suelos fértiles (unidad Espinillar) sobre sedimentos holocénicos (Bossi y Navarro, 1991; Durán y García, 2007) (Figura 1 y Tabla 1).
Antes del embalse, los establecimientos donde hoy hay bosques tenían manejo de ganadería extensiva (vacunos y ovinos) y en algunos agricultura; actualmente estas prácticas se mantienen con incorporación eventual de riego.
Se estudiaron adicionalmente bosques maduros al sur de la represa (departamentos de Salto y Paysandú) (Figura 1).
Para estudiar estos bosques se usó un método cualitativo –recorridas exhaustivas– y otro cuantitativo: muestreo. Recorriendo exhaustivamente el bosque de cada local se relevó la totalidad de especies leñosas. Se identificaron a campo, mediante consulta a herbarios y a literatura nacional y regional (Lombardo, 1964; Burkart et al., 1974, 1979, 1987, 2005; Izaguirre y Beyhaut, 1998, 2003; Brussa y Grela, 2007).
Se realizó un muestreo usando el método de cuadrantes centrados en un punto (Cottam y Curtis, 1956; Mitchell, 2007). Las áreas muestreadas son fajas de pocos metros de ancho; difieren en longitud y en superficie (Tabla 1), presentando límites naturales o artificiales (arroyos, barrancos, alambrados, caminos). En cada local se trazaron transectas paralelas a la orilla considerando la disposición de las especies en fajas paralelas al agua según gradiente de hidromorfía. La primer transecta se situó en la zona de mayor humedad, cercana a la orilla y las demás distantes a 20 metros hacia zonas más secas (Braun Blanquet, 1979; Matteucci y Colma, 1982; Causton, 1988). Se georeferenció el inicio y el final de cada transecta. Cada 20 metros se dispusieron sistemáticamente puntos muestrales sobre transectas. En cada punto se marcaron cuatro cuadrantes, seleccionándose en cada cuadrante el individuo más cercano cuyo DAP fuera igual o superior a 2,5 cm (atendiendo el predominio de juveniles).
Los datos de campo se recogieron en una planilla: nombre científico del ejemplar, distancia al punto central, DAP. Con ellos se calculó la frecuencia, la abundancia o densidad y la dominancia en términos absolutos y relativos para cada especie en cada transecta y en cada local. Se usaron las variables relativas (frecuencia, abundancia y dominancia relativas) para calcular el IVI (Índice de Valor de Importancia) de cada especie por transecta y por local, a fin de poder realizar comparaciones entre locales de diferente tamaño. El IVI de las familias presentes en los locales y en toda el área se calculó por sumatoria de IVI de sus especies constitutivas.
También se calcularon el Índice de Shannon y la Equitatividad de cada comunidad.
Se registraron factores ambientales de cada local: topografía, geología, suelos, fertilidad (Tabla 1) mediante observación y consulta bibliográfica (Bossi y Navarro, 1991; Durán y García, 2007). Se revisó índice de Coneat (usado en Uruguay para clasificar padrones rurales según suelos y aptitud productiva) e información sobre suelos (CONEAT, s.f.).
Con igual metodología se relevaron datos en 13 bosques maduros del río Uruguay al sur de la represa de Salto Grande (Figura 1). Los datos de S4, S5, S6, S7, S10, S12 y S13 se compararon con los de bosques del embalse.
Resultados y discusión
Los bosques del embalse de reciente implantación natural tienen diversidad relativamente baja reflejada en el escaso número de especies relevadas en recorridas exhaustivas y muestreos (mínimos en locales N5, N6, N12, N13). Los valores de índice de Shannon (que fluctúan entre 1 y 5 bits) son bajos: 0,61 bits en N6; 1,83 bits en N7; 1,70 bits en N4. El máximo es de 2,84 bits en N1 (local del extremo norte) y 2,85 bits en N9 (relictual). Los valores de Equitatividad (escala de 0 a 1) se ubican entre 0,71 y 0,92 (Tabla 1).
En los 16 locales del embalse se contaron por recorrida exhaustiva 100 especies leñosas: 83 nativas y 17 exóticas pertenecientes a 34 familias. Por muestreos fueron registradas 71 especies: 62 nativas y nueve exóticas pertenecientes a 30 familias. Hubo 29 especies –21 autóctonas y ocho exóticas– observadas en recorridas exhaustivas que no fueron muestreadas debido a su baja frecuencia o escaso tamaño (Tabla 2).

Las 83 especies leñosas autóctonas registradas en el área embalse representan un valor relativamente elevado comparado con las 103 especies leñosas nativas que Grela (2004) reporta para las orillas del Uruguay.
Se registraron 34 familias en el área embalse por recorrida y 30 por muestreos, siendo Fabaceae, Myrtaceae, Euphorbiaceae, Asteraceae y Anacardiaceae las más diversas.
Especies pioneras: se observó que en bosques del embalse que Erythrina crista-galli, Vachellia caven (Acacia caven), Sesbania virgata, Sebastiania schottiana yTerminalia australis eran muy habituales y se repetían en distintas localidades, presentando numerosas plántulas y juveniles.
Los estudios fitosociológicos muestran que estas especies exhiben altos valores de frecuencia, abundancia y dominancia relativas y de IVI, mientras que otras no aparecen o presentan valores bajos de variables. Una especie se presentará en una localidad siempre y cuando sea capaz de llegar a ella y existan condiciones y recursos adecuados y los competidores, los depredadores y los parásitos no la eliminen (Begon et al., 1999). Las mencionadas Erythrina crista-galli, Vachellia caven, Sesbania virgata, Sebastiania schottiana y Terminalia australis, a las que se suman Sapium haematospermum, Parkinsonia aculeata, Phyllanthus sellowianus, Schinus longifolius, Aloysia gratissima, Salix humboldtiana, Peltophorum dubium, Melia azedarach y Myrcianthes cisplatensis son «especies pioneras» o «colonizadoras tempranas» (Tabla 3): llegaron tempranamente y prosperaron en riberas antes no ocupadas por bosques, colonizando parches mediante semillas. Esto corresponde a estadíos iniciales de la sucesión (Connell y Slatyer, 1977; Begon et al., 1999).
Las especies pioneras presentan una serie de características biológicas que les permiten establecerse en espacios no ocupados por vegetación leñosa: tienen alta capacidad de colonizar nuevos ambientes a partir de semillas, son intolerantes a la sombra: no germinan ni crecen en sitios sombreados ocupados por árboles adultos, y lo hacen rápidamente en áreas alteradas. Sus semillas presentan largas dormancias y germinación estimulada por la luz (heliófitas). Tienen rápido crecimiento vegetativo, leño poco denso, madurez reproductiva precoz y producción abundante de diásporas (Connell y Slatyer, 1977; Pickett y White, 1985).
Las leguminosas Vachellia caven, Erythrina crista-galli, Parkinsonia aculeata y Sesbania virgata exhiben tales caracteres; con su capacidad de fijar nitrógeno en simbiosis tienen ventajas frente a otras plantas para establecerse en suelos pobres e iniciar un mecanismo sucesional de facilitación: a medida que aumentan el nitrógeno fijado y la sustancia orgánica en el ambiente, van mejorando las condiciones para el establecimiento de otras especies. Esto puede ser importante en suelos de fertilidad baja al inicio de la sucesión (Walker, 2005).
Vachellia caven y Erythrina crista-galli predominan en la mayoría de locales alcanzando elevadas frecuencias relativas e IVI (Tabla 3). La primera formaba en la zona extensas comunidades de parque –espinillares–; de manera «oportunista» se recluta muy bien en las nuevas orillas formando franjas paralelas al agua, lo que sugiere su dispersión hidrócora. La presencia de espinas es un carácter positivamente seleccionado en ambientes pastoreados. No obstante no tienen comportamiento de pioneras Prosopis affinis ni Prosopis nigra, otros integrantes espinescentes del bosque de parque del área.
Erythrina crista-galli, «pionera de vida larga» notoriamente abundante sobre el embalse, alcanza porte y longevidad considerables combinados con caracteres de pionera: semillas grandes, dispersión hidrócora, germinación y crecimiento rápidos, madera poco lignificada, temprana madurez, dos floraciones y fructificaciones por año.
Sesbania virgata, arbusto de vida breve muy común en los bosquecitos estudiados, aparece en todas las recorridas pero fue muestreada sólo en seis locales pues raramente alcanza diámetros medibles. Parkinsonia aculeata en general no exhibe altas frecuencias.
Sebastiania schottiana, Terminalia australis y Sapium haematospermum son elementos importantes, presentes en menor número de locales con menores frecuencias e IVIs. Salix humboldtiana, Peltophorum dubium y Melia azedarach (exótica) alcanzan en pocos años tallas considerables; presentes en seis-siete locales con frecuencias bajas, son elementos conspicuos debido a sus altos valores de DAP y dominancia (e IVI) (Tabla 3).
Estas especies pioneras están poco representadas y tienen bajos valores de variables e IVI en bosques maduros del río Uruguay, donde dominan las sucesionales tardías (Tabla 4).
De acuerdo a las características ambientales varía el ensamble de especies pioneras y otras, predominando las hidrófitas Salix humboldtiana, Erythrina crista-galli, Sebastiania schottiana, Phyllanthus sellowianus, Terminalia australis en locales inundables y las xerófilas Schinus longifolius, Aloysia gratissima, Myrcianthes cisplatensis en locales de costa más alta y seca.
La sumatoria de los IVIs de especies de cada familia y de cada local permitió determinar las familias más importantes del área de estudio. Leguminosae o Fabaceae es la familia dominante: acumula 2594 de la sumatoria de los IVIs de sus especies (56,3 % del total del IVI). La siguen con valores de IVI mucho menores, Euphorbiaceae: IVI: 525 (11,4 %), Myrtaceae: IVI: 307 (6,7 %), Combretaceae: IVI: 209 (4,5 %); Meliaceae: IVI: 154 (3,3 %), Anacardiaceae: IVI: 150 (3,3 %), Salicaceae: IVI: 128 (2,8%). Verbenaceae, Rubiaceae, Sapindaceae y Rhamnaceade presentan valores bajos de IVIs acumulados de sus especies constitutivas. Las especies pioneras pertenecen a las familias mayores o más importantes.
Las pioneras exhiben mecanismos dispersales abióticos (hidrocoria, anemocoria) combinando algunas varios mecanismos (policoria). La dispersión hidrócora es especialmente importante en crecidas a juzgar por sus frutos o semillas flotantes, por la disposición de individuos en franjas coincidentes con la cota máxima del embalse y por la presencia de sus diásporas y plántulas en la resaca (observación personal).
Se destaca la ausencia o participación muy escasa en los bosques del embalse de especies paradigmáticas de los bosques maduros del río Uruguay como Sebastiania commersoniana, Pouteria salicifolia, Nectandra angustifolia, Eugenia uniflora, Ruprechtia laxiflora y Ruprechtia salicifolia, que están bien representadas en comunidades del bajo Uruguay (Tabla 4).
El local N9 (Cerro Bosque) presenta altos valores de IVI de especies sucesionales tardías como Nectandra angustifolia, Sebastiania commersoniana, Scutia buxifolia, Allophyllus edulis, Cupania vernalis, etc., que contrastan con otras comunidades del embalse. Atendiendo a su fisonomía, el elevado número de especies en pequeña área, la presencia de ejemplares añosos altos y de grandes DAP, la canopea cerrada, los altos valores de Índice de Shannon y de Equitatividad, la zoocoria predominante, todos indicadores de mayor complejidad estructural, se considera que esta es una comunidad relictual del antiguo bosque del río Uruguay medio que escapó por su posición topográfica elevada a la tala y a la inundación del embalse y que constituye una fuente de propágulos (Tablas 1 y 4).
Conclusiones
Se contaron 83 especies leñosas nativas por recorrida en 16 locales de la margen izquierda del embalse, valor relativamente importante comparado con las 103 especies leñosas de la flora uruguaya del río Uruguay contabilizadas por Grela (2004). El área del embalse que sufriera una perturbación extrema en 1978-1979, que destruyó la mayor parte de su dendroflora, presenta luego de 34-35 años una buena recuperación de taxa leñosos, lo que indica que desde el punto de vista florístico se está restableciendo rápidamente.
Desde el punto de vista vegetacional, los bosquecitos del embalse con poco más de tres décadas de implantación espontánea tienen baja diversidad y complejidad estructural escasa, estando integrados por pocas especies, algunas fuertemente dominantes. Se trata de especies sucesionales tempranas (pioneras) que han colonizado las orillas. Estos caracteres están en relación con estados iniciales de sucesión (Begon et al., 1999; Pickett y White, 1985) y difieren mucho de los bosques multiespecíficos maduros que persisten en el bajo río Uruguay (González, 2013). Para la margen izquierda del embalse de Salto Grande se reconocen como pioneras Erythrina crista-galli, Vachellia caven, Sapium haematospermum, Terminalia australis, Sebastiania schottianna, Sesbania virgata, Parkinsonia aculeata, Phyllanthus sellowianus y en menor grado Aloysia gratissima, Schinus longifolius, Salix humboldtiana, Peltophorum dubium, Melia azedarach y Myrcianthes cisplatensis. No todas están presentes en todos los locales y se combinan entre sí en distintas proporciones y con otras especies de menor importancia.
Fabaceae es la familia dominante en el área del embalse; las demás presentan valores bajos de IVI (Euphorbiaceae, Myrtaceae, Combretaceae y Anacardiaceae, etc.).
En estas comunidades iniciales la policoria es común, junto con modos de dispersión abióticos (hidrocoria preferencial, anemocoria); la zoocoria es incipiente en algunas.
Se identificó una pequeña comunidad relictual del desaparecido bosque del río Uruguay medio (N9 Cerro Bosque) con mayor número de especies, individuos altos y de grandes DAP, mayor complejidad (densidad, estratificación vertical, zoocoria elevada, etc.). En ella las pioneras no están bien representadas.
El proceso de restauración florística se está operando, como lo indican la presencia de numerosos familias, géneros y especies. El proceso de restauración de las comunidades llevará tiempo y estará condicionado al manejo y a otras perturbaciones.
Nota: este trabajo se realiza con datos recogidos para la tesis de maestría en Biología, opción Botánica, PEDECIBA: «Estudio de la composición florística y estructura de los bosques ribereños del río Uruguay al norte y al sur de la represa de Salto Grande, en los departamentos de Artigas, Salto y Paysandú (Uruguay)».
Bibliografía
Abadie JP. 1998. El río Uruguay, empleo histórico y posibilidades futuras. Paysandú : CARU. 107p.
Begon M, Harper J, Townsend C. 1999. Ecología : Individuos, Poblaciones y Comunidades. 3a ed. Barcelona : Ediciones Omega. 1148p.
Bossi J, Navarro R. 1991. Geología del Uruguay. Montevideo : Universidad de la República. 2v.
Braun Blanquet J. 1979. Fitosociología : Bases para el estudio de las comunidades vegetales. Madrid : Blume. 820p.
Brussa C, Grela I. 2007. Flora arbórea del Uruguay :con énfasis en las especies de Rivera y Tacuarembó. Rivera : Cofusa. 544p.
Burkart A, Bacigalupo N, Botta S, Cristóbal C, Diehl V, Dietrich W, Ezcurra C, Ferrucci S, Guaglianoni R, Kiesling R, Krapovickas A, Múlgura M, Pedersen T, Raven P, Zardini E, Tortosa R, Tur N, Ulibarri E. 2005. Flora Ilustrada de Entre Ríos : Parte IV : Dicotiledóneas Arquiclamídeas (Geraniales a Umbelliflorales). Buenos Aires : INTA. 227p.
Burkart A, Añón D, Bacigalupo N, Boelcke O, Botta S, Diehl V, Giusti L, Guaglianoni R, Legrand D, Martínez J, Múlgura M, Palacios R, Pedersen T, Ragonese A, Romanzuck C, Rotman A, Sorarú S, Troncoso N, Tur N, Ulibarri E. 1987. Flora Ilustrada de Entre Ríos : Parte III : Dicotiledóneas Metaclamídeas. A: Salicales a Rosales (Incluso Leguminosas). Buenos Aires : INTA. 763p.
Burkart A, Bacigalupo N, Botta S, Bravo L, Cabrera A, Crespo S, Dawson G, Fabris H, Meyer T, Múlgura M, Pérez Moreau R, Rahn N, Sorarú S, Troncoso N, Ulibarri E. 1979. Flora Ilustrada de Entre Ríos : Parte V : Dicotiledóneas Metaclamídeas (Gamopétalas) (Primulales a Plantaginales). Buenos Aires : INTA. 606p.
Burkart A, Bacigalupo N, Cabrera A, Martínez R, Sorarú S. 1974. Flora Ilustrada de Entre Ríos : Parte VI : Dicotiledóneas Metaclamídeas (Gamopétalas) B: Rubiales, Cucurbitales, Campanulales (incluso Compuestas). Buenos Aires : INTA. 554p.
Cabrera A, Willink A. 1973. Biogeografía de América Latina. Washington : Secretaría General de la Organización de los Estados Americanos. 117p.
Carrère R. 2010. Monte indígena : Mucho más que un conjunto de árboles. Montevideo : Nordan, Guayubira, Ciedur, EGP.
Carrère R. 1990. Desarrollo forestal y medio ambiente en el Uruguay. 6. El bosque natural uruguayo : inventario y evolución del recurso [En línea]. Montevideo : CIEDUR. Consultado 28 mayo 2015. Disponible en: http://www.guayubira.org.uy/monte/Ciedur6.html].
Causton DR. 1988. Introduction to vegetation analysis : Principles, practice and interpretation. London : Unwin Hyman. 342p.
Chebataroff J. 1969. Rasgos fitogeográficos del Uruguay [En línea]. En: Talice RV, Chebataroff J. Geografía de la Vida. Montevideo : Nuestra Tierra. (Nuestra Tierra ; 40). pp. 19 - 29. Consultado 28 mayo 2015. Disponible en: http://www.periodicas.edu.uy/Nuestra_tierra/pdfs/Nuestra_tierra_40.pdf.
Clements FE. 1916. Plant succession : An analysis of the development of vegetation. Washington : Carnegie Institute of Washington. 512p. (Publication ; N° 242).
CONEAT. s.f. CONEAT digital [En línea]. Consultado 28 mayo 2015. Disponible en: www.prenader.gub.uy/coneat/.
Connell J, Slatyer R. 1977. Mechanisms of succession in natural communities and their role in community stability and organization. The American Naturalist, 111(982): 1119 – 1144.
Cottam G, Curtis JT. 1956. The use of distance measures in phytosociological sampling. Ecology, 37: 451 – 460.
CTM Salto Grande. 1983 Informe final : Cuarta Reunion sobre aspectos de desarrollo ambiental y regional en el proyecto Salto Grande. Salto : CTM. 469p.
De León L, Chalar G. 2003. Abundancia y diversidad del fitoplancton en el Embalse de Salto Grande (Argentina – Uruguay) : Ciclo estacional y distribución espacial. Limnetica, 22(1-2): 103 – 113.
Durán A, García F. 2007. Suelos del Uruguay : origen clasificación, manejo y conservación. Montevideo : Hemisferio Sur. 2v.
Escudero R. 2004. Informe de consultoría : subcomponente Bosque Nativo. Montevideo. Consultado 28 mayo 2015. Disponible en: http://www.guayubira.org.uy/monte/DiagnsticoBosqueNativo.pdf.
Gautreau P. 2005. La evolución histórica de los montes nativos del actual Uruguay desde el siglo XVIII : lo que no(s) cuentan las fuentes [En línea]. En: Seminario Compartiendo conocimientos sobre el monte indígena. Consultado 28 mayo 2015. Disponible en: http://www.guayubira.org.uy/monte/seminario/ponencias/Gautreau1.pdf.
González S. 2013. Estudio de la composición florística y estructura de los bosques ribereños del río Uruguay al norte y al sur de la represa de Salto Grande, en los departamentos de Artigas, Salto y Paysandú (Uruguay) [Tesis de Maestría]. Montevideo : Facultad de Ciencias. 288p.
Grela I. 2004. Geografía florística de las especies arbóreas de Uruguay : propuesta para la delimitación de dendrofloras [Tesis de Maestría]. Montevideo : Pedeciba. 97p.
Izaguirre P, Beyhaut R. 2003. Las Leguminosas en Uruguay y regiones vecinas. Montevideo : Hemisferio Sur. 302p.
Izaguirre P, Beyhaut R. 1998. Las Leguminosas en Uruguay y regiones vecinas : parte 1.Papilionoideae. Montevideo : Hemisferio Sur. 549p.
Lombardo A. 1964. Flora Arbórea y Arborescente del Uruguay : con clave para determinar las especies. 2a ed. Montevideo : Concejo Departamental de Montevideo. 151p.
Matteucci S, Colma A. 1982. Metodología para el estudio de la vegetación. Washington : OEA. 168p. (Colección de Monografías Científicas. Serie de Biología ; no. 22).
Mitchell K. 2007. Quantitative analysis by the point-centered quarter method [En línea]. Consultado 28 mayo 2015. Disponible en: http://arxiv.org/pdf/1010.3303.pdf.
Oakley LJ, Prado D, Adámoli J. 2005. Aspectos Biogeográficos del Corredor Fluvial Paraguay-Paraná [En línea]. Consultado 28 mayo 2015. Disponible en: http://insugeo.org.ar/libros/misc_14/19.htm.
Otaegui A. 1994. Calidad de las Aguas del Embalse de Salto Grande. Eutroficación : Indicadores Físico-Químicos - Valores de Referencia. Salto Grande : Comisión Técnica Mixta de Salto Grande. 136p.
Pickett STA, White P S. 1985. The ecology of natural disturbance and patch dynamics. San Diego : Academic Press. 472p.
Sierra B, Osorio H, Langguth A, Soriano J, Maciel E, Mora O, Ayup R, Lombardo A, Palermo E, González J, Achával F. 1977. Ecosistemas afectados por la construcción de la represa de Salto Grande : introducción a su prospección ecológica en territorio uruguayo. En: Seminario sobre Medio Ambiente y Manejo de Represas; 2 - 14 mayo; Montevideo. Montevideo : OEA. pp. 89 - 129.
Walker LR. 2005. Margalef y la sucesión ecológica. Ecosistemas, 14(1): 66 - 78.
Westoby M, Walker B, Noy Meyr I. 1989. Opportinistic management for rangelands not at equilibrium. Journal of range management, 42(4): 266 - 274.