Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Odontoestomatología
versão impressa ISSN 0797-0374versão On-line ISSN 1688-9339
Odontoestomatología vol.25 no.42 Montevideo 2023 Epub 01-Dez-2023
https://doi.org/10.22592/ode2023n42e419
Reporte de caso
Leucoplasia verrugosa proliferativa simulando liquen plano oral: reporte de caso y revisión de la literatura
1 São Paulo State University, Institute of Science and Technology, Department of Biosciences and Oral Diagnosis, São José dos Campos, São Paulo, Brazil. e-mail: mateus.dutra@unesp.br
2 São Paulo State University, Institute of Science and Technology, Department of Biosciences and Oral Diagnosis, São José dos Campos, São Paulo, Brazil.
3 University of Chile, Faculty of Dentistry, Department of Pathology and Oral Medicine, Santiago, Chile.
4 São Paulo State University, Institute of Science and Technology, Department of Biosciences and Oral Diagnosis, São José dos Campos, São Paulo, Brazil.
5 São Paulo State University, Institute of Science and Technology, Department of Biosciences and Oral Diagnosis, São José dos Campos, São Paulo, Brazil.
Palabras clave: Leucoplasia oral; Liquen plano oral; CD20; Syndecan-1; Linfócitos B.
Keywords: Oral leukoplakia; Oral lichen planus; CD20; Syndecan-1; B- Lymphocytes
Palavras-chave: Leucoplasia oral; Líquen Plano Oral; CD20; Syndecan-1; Linfócitos-B
INTRODUCCIÓN
La leucoplasia verrugosa proliferativa (LVP) es un tipo no homogéneo de leucoplasia oral (LO). Se caracteriza por placas blancas multifocales de crecimiento lento que son refractarias a los procedimientos terapéuticos y presentan altas tasas de recidiva y malignidad (1-3), oscilando entre el 70 y el 100% de todos los casos (4-7).
En las fases iniciales, puede presentar aspectos clinicopatológicos similares al liquen plano oral (LPO) (3,8), una enfermedad mucocutánea mediada inmunológicamente con una tasa de transformación maligna de aproximadamente 1,4% (9). Clínicamente, ambos pueden manifestarse como placas o estrías blancas multifocales que afectan bilateralmente a la mucosa bucal y el reborde alveolar, la encía adherida, la lengua y los labios (10,11). La conformación verrugosa formada por queratina superficial es un hallazgo clínico importante que contribuye a la distinción entre LVP y LPO (12-14). Ambas afectan predominantemente a mujeres en torno a los 60 años que no consumen tabaco ni alcohol (15,16). Puesto que las características clínicas y epidemiológicas de LVP y LPO se superponen, resulta insuficiente basarse únicamente en estos factores para el diagnóstico. Por lo tanto, la evaluación microscópica se hace imperativa (11,17).
Los hallazgos microscópicos de LPO pueden ser similares a los de LVP, pero la LVP puede presentar displasia leve a severa o incluso revelar un carcinoma de células escamosas (5). Sin embargo, la LVP no presenta uniformidad, por lo que tejidos de un mismo paciente y de diferentes ubicaciones anatómicas pueden diferir entre sí (12,18). Las áreas afectadas por LVP pueden presentar un infiltrado linfocítico en banda y, al combinar las características clínicas y microscópicas, puede establecerse un diagnóstico erróneo de LPO, especialmente en casos tempranos donde no hay displasia epitelial (13,18-20).
Este reporte presenta los aspectos clínicos y microscópicos observados en un caso de LVP simulando LPO y analiza la expresión proteica de CD20 y CD138 para la identificación de linfocitos B en el infiltrado inflamatorio subepitelial de las lesiones. Se realiza una revisión de la literatura sobre casos de LVP simulando LPO a fin de esbozar un perfil clínico y epidemiológico de estos pacientes, así como el tiempo promedio de cambio desde el diagnóstico a la LVP y el tiempo promedio de transformación maligna.
REPORTE DE CASO
Mujer de 66 años, Latinoamericana, acude a la Clínica de Estomatología del Instituto de Ciencia y Tecnología de la Universidad Estatal Paulista (ICT-UNESP) por manchas blancas en la boca y sensación de quemazón. A la anamnesis, refiere no tener adicciones como tabaquismo y alcoholismo e informa ser hipertensa y tomar el antihipertensivo Losartana® 25 mg, una vez al día, por vía oral. Al examen físico general, se observan manchas violáceas en la piel, en la región de la articulación tibiofemoral. Al examen físico intraoral, se observan estrías blancas bilaterales en la mucosa bucal (Figuras 1A y B).
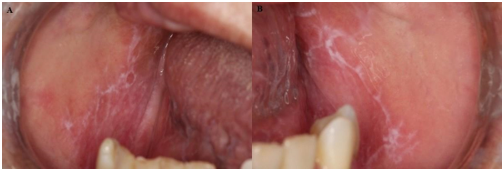
Figura 1: Fotos de las manifestaciones clínicas iniciales, estrías blancas en la mucosa bucal. A. Mucosa bucal derecha. B. Mucosa bucal izquierda.
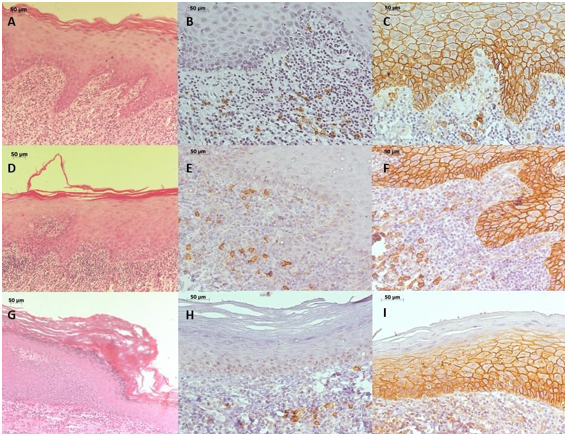
Ante la sospecha clínica de LPO y reacción liquenoide (RL), se realizó una biopsia incisional en la mucosa bucal derecha. El examen microscópico reveló un fragmento de mucosa cubierto por epitelio plano estratificado con hiperqueratosis, crestas epiteliales en forma de “dientes de sierra”, exocitosis hacia la porción inferior del epitelio e infiltrado linfocítico inflamatorio en banda en la lámina propia subyacente al epitelio (Figura 2A).
Para descartar la hipótesis clínica de RL al Losartan®, se le solicitó al médico que sustituyera el fármaco antihipertensivo. Esto mejoró el cuadro clínico, y se confirmó el diagnóstico de LPO. No obstante, debido a la pandemia de COVID-19, la paciente regresó para una visita de seguimiento tres años después del diagnóstico inicial de LPO. Se observaron estrías blancas en el labio inferior y en el borde lingual, múltiples placas blancas de superficie coriácea de 5 mm de diámetro máximo localizadas en el suelo bucal, encía adherida y reborde alveolar de la mandíbula en los lados izquierdo y derecho que se extendían a la mucosa bucal, de forma no homogénea y con áreas de aspecto verrugoso (Figuras 3A-D).
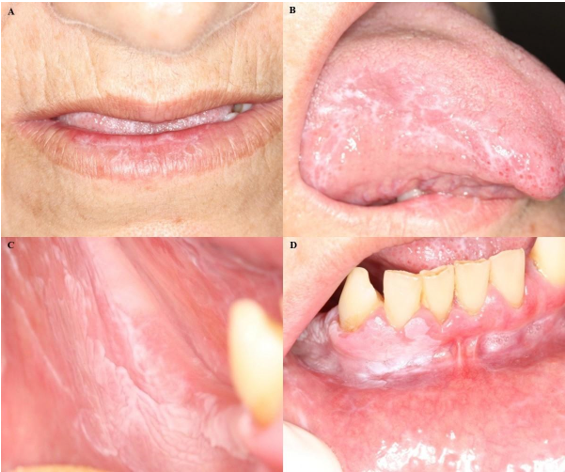
Figura 3 Fotografías de las manifestaciones clínicas antes de la segunda biopsia que revela estrías blancas. A. Labio inferior. B. Borde lingual. Placa blanca de aspecto no homogéneo y verrugoso. C) Mucosa bucal. D. Cresta alveolar inferior derecha.
Se realizaron biopsias incisionales en la mucosa bucal derecha y en la encía anterior inferior, bajo la hipótesis de LVP. Microscópicamente, los fragmentos de la mucosa bucal presentaban epitelio plano estratificado ortoqueratinizado, con áreas de capa granular evidente, atrofia, espongiosis y exocitosis linfocítica. En la lámina propia, se observó una banda de infiltrado linfocítico inflamatorio en la región subepitelial (Figura 2. D), y el diagnóstico histopatológico fue compatible con LPO. El examen de la encía adherida anterior inferior mostró un epitelio plano estratificado queratinizado, con capa granular evidente y cambio brusco en el patrón de queratinización, un área de atrofia intensa, rectificación de la capa basal y algunas mitosis no restringidas a esta capa. La lámina propia exhibía un infiltrado inflamatorio crónico, difuso y moderado. El diagnóstico histopatológico fue hiperqueratosis con displasia epitelial moderada (Figura 2G). En base a las características clínicas de las lesiones y las histopatológicas, se llegó al diagnóstico final de LVP y, actualmente, la paciente está en seguimiento.
Se realizaron reacciones inmunohistoquímicas para las proteínas CD20 y CD138 (Tabla 1). En todas las biopsias realizadas se observó marcaje difuso de CD20 y CD138 en las células inflamatorias del tejido conjuntivo. Las uniones intercelulares epiteliales fueron positivas para CD138 (Figuras 2. B, C, E, F, H e I).
REVISIÓN DE LA LITERATURA
Se utilizó la base de datos PubMed para buscar casos de LVP con presentación inicial como RL o LPO, hasta abril de 2023. Los términos MesH para la búsqueda fueron “proliferative verrucous leukoplakia” AND “oral lichen planus” and “proliferative verrucous leukoplakia” AND “lichenoid”. Las búsquedas arrojaron 59 y 22 resultados, respectivamente. De estos, solo se estudiaron informes de casos y series, lo que resultó en 5 artículos. Como criterio de inclusión, los artículos debían estar publicados en inglés y los pacientes debían tener diagnóstico definitivo de LVP, pero precedido por un diagnóstico o apariencia clínica de RL o LPO. De los 5 artículos, solo 3 cumplieron con todos los criterios de inclusión y se incluyeron en la revisión.
La información recopilada fue: género, edad al diagnóstico inicial, consumo de tabaco y alcohol, diagnóstico inicial, tiempo promedio desde el diagnóstico de RL/LPO hasta LVP, un diagnóstico clínico o histopatológico definitivo de LVP, hallazgos histológicos, información sobre áreas verrugosas o no, si hubo transformación maligna y cuánto tiempo después del diagnóstico de LVP.
Los datos epidemiológicos de los casos (n=22) se resumen en la Tabla 2. La prevalencia se registró en mujeres (n=19), que al momento del diagnóstico no consumían tabaco (n=22) ni alcohol (n=12), presentando la manifestación inicial de áreas liquenoides en torno a los 59 años como edad media.
Tabla 2 Datos extraídos de los casos incluidos en la revisión de la literatura.
| Lopes et al., 2015 | Garcia-Pola et al., 2016 | McCarthy et al., 2022 | |
| Número de casos | 1 (100%) | 14 (100%) | 7 (100%) |
| Femenino | 1 (100%) | 11 (78,57%) | 7 (100%) |
| No fumador/ex-fumador | 1/0 (100/0%) | 11/3 (78,58/21,42%) | 5/2 (71,42/28,57%) |
| Consumo de alcohol | 0 (0%) | 3 (21,42%) | NR |
| Edad promedio al diagnóstico inicial (años) | 64 | 56 | 57 |
| Diagnóstico inicial | clínico | clínico/histológico | clínico/histológico |
| Diagnóstico de LVP | clínico/histológico | clínico/histológico | clínico/histológico |
| Intervalo medio de diagnóstico de LPO/RL a LVP (años) | NR | 4 | 8 |
| Hallazgos histológicos | displasia epitelial leve/moderada | hiperqueratosis e hiperplasia verrugosa | hiperplasia verrugosa y displasia epitelial severa |
| Áreas verrugosas | 0 | 14 (100%) | 7 (100%) |
| Diagnóstico de cáncer bucal-número de casos | 1 (100%) | 4 (28,57%) | 3 (42,85%) |
| Diagnóstico de cáncer bucal- tiempo transcurrido desde el diagnóstico de LVP | 15 meses | promedio de 9 años | promedio de 11 meses |
NR: no reportado.
En 21 casos, el diagnóstico inicial de RL o LPO fue confirmado por biopsia, y el tiempo promedio en que cambió el diagnóstico de RL o LPO a LVP fue de 6 años. El diagnóstico de LVP se realizó clínica e histológicamente y solo un caso no tenía un aspecto verrugoso. 8 de 22 casos progresaron a carcinoma de células escamosas, con una mediana de 3.7 años después del diagnóstico inicial de LVP (Tabla 2).
DISCUSIÓN
Este estudio presenta el caso de una paciente que inicialmente manifestó características clínicas y microscópicas similares a RL y LPO, ya que presentaba estrías blancas en la mucosa bucal y tomaba medicamentos antihipertensivos (21,22). El médico reemplazó el medicamento antihipertensivo y no hubo cambios en sus lesiones, por lo que se descartó el diagnóstico de RL (21). Luego de 4 años del seguimiento, hubo un cambio en el escenario clínico y se formuló la hipótesis de LVP, ya que presenta una epidemiología similar a la descrita para LPO (15,16). La LVP se caracteriza por placas blancas multifocales, que pueden o no tener una superficie verrugosa (8,15). Además, en etapas iniciales, puede presentar un patrón estriado como en el LPO (23).
La LVP y el LPO también comparten características microscópicas similares, ya que la LVP puede presentar un infiltrado linfocítico en banda, predisponiendo a que se efectúe un diagnóstico erróneo de RL o LPO (5,10,11,13,17,19,24-26). Las biopsias incisionales de la mucosa bucal en el presente caso cumplían los criterios microscópicos de LPO. No obstante, uno de los fragmentos de la segunda biopsia reveló la presencia de displasia epitelial y un cambio brusco en el patrón de queratinización, favoreciendo el diagnóstico de LVP.
Aunque no existen biomarcadores para diferenciar entre LVP y LPO, algunas proteínas como CD20 y CD138 pueden contribuir al pronóstico. CD138 es útil para revelar la cohesión entre las células epiteliales: a mayor grado de displasia, menor tinción de CD138 en las uniones intercelulares epiteliales (24). En este reporte, se observó inmunopositividad para CD138 en las células epiteliales, debido a la displasia moderada. Su hipoexpresión indica desregulación de la adhesión celular, aumentando la diseminación de las células neoplásicas, asociada a un peor pronóstico (30-32). CD138 también se observó en células inflamatorias de la lámina propia, revelando la presencia de linfocitos B o células plasmáticas, que normalmente no se observan en el LPO (33). Estos hallazgos contrastan con los de Mahdavi et al. (34), quienes informaron de la presencia de células B en el infiltrado inflamatorio del LPO a través de la expresión proteica de CD20. En este informe, la expresión de CD20 se observó en el infiltrado inflamatorio subepitelial. Aunque la caracterización de las células con CD20 y CD138 no fue útil para distinguir entre LPO y LVP, el análisis de la expresión de CD138 es válido para evaluar la cohesión entre las células epiteliales.
Se ha discutido si el LPO se transforma en LVP o si la LVP se presenta inicialmente con características de LPO. Lopes et al. (13) relataron el caso de una mujer que presentaba estrías blancas y áreas atróficas en la mucosa bucal, con la hipótesis de RL excluida después de reemplazar restauraciones metálicas sin resultado. Las biopsias incisionales revelaron hiperqueratosis, acantosis y displasia epitelial leve, sugiriendo el diagnóstico de LVP, similar al presente informe. Sin embargo, después de 15 meses, otra biopsia reveló el diagnóstico de carcinoma de células escamosas. Nuestra paciente ha estado en seguimiento durante 48 meses sin signos de transformación maligna.
En nuestro reporte, el tiempo de transición de LPO a LVP fue similar a los hallazgos de García-Pola et al. (26), quienes informaron que 4 años era el tiempo promedio para el desarrollo de lesiones verrugosas multifocales. En algunos casos, también se observó una transformación maligna durante el período de seguimiento (11, 26, 35).
La transformación maligna del LPO es un tema ampliamente debatido y se presenta en el 1,4% de los casos (9). Por lo tanto, los casos descritos anteriormente podrían corresponder a casos de LVP diagnosticados erróneamente como LPO, dado que la LVP puede presentarse inicialmente como manchas blancas con características liquenoides, evolucionando posteriormente hacia las características clínicas clásicas. Debe considerarse en el diagnóstico diferencial de lesiones con cambios liquenoides, tanto a nivel clínico como microscópico (27, 35).
No existe un consenso sobre si la LVP se desarrolla a partir del LPO, si su presentación inicial simula un LPO o si ambas lesiones pueden coexistir simultáneamente en el mismo paciente. No obstante, actualmente no existen informes en la literatura en inglés que respalden esta última hipótesis. La hipótesis de que la LVP simula un LPO resulta la más plausible para el presente reporte, ya que la biopsia realizada durante el período de seguimiento mostró características clínicas y microscópicas similares al LPO, mientras que la otra mostró similitudes con la LVP.
CONCLUSIONES
Las lesiones blancas compatibles con RL o LPO deben investigarse y diferenciarse de la LVP. Los pacientes diagnosticados con lesiones blancas deben ser vigilados de cerca, ya que pueden producirse cambios clínicos que afecten al diagnóstico. Esto es especialmente importante en los casos de LVP, dado su mal pronóstico y las elevadas tasas de transformación maligna.
Además, concluimos que los casos reportados de LVP simulando LPO son más frecuentes en mujeres que no fuman ni consumen alcohol. La manifestación inicial de áreas liquenoides generalmente ocurre alrededor de los 59 años, y el diagnóstico de LVP se establece, en promedio, seis años después. En8 de los 22 casos reportados hubo transformación maligna, con un promedio de 3.7 años después del diagnóstico final de LVP.
REFERENCIAS
1. Warnakulasuriya S, Kujan O, Aguirre-Urizar JM, Bagan JV, González-Moles MÁ, Kerr AR, et al. Oral potentially malignant disorders: A consensus report from an international seminar on nomenclature and classification, convened by the WHO Collaborating Centre for Oral Cancer. Oral Dis. 2021 Nov;27(8):1862-1880. [ Links ]
2. Hansen LS, Olson JA, Silverman S Jr. Proliferative verrucous leukoplakia. A long-term study of thirty patients. Oral Surg Oral Med Oral Pathol. 1985;60:285-98. [ Links ]
3. Warnakulasuriya S. Clinical features and presentation of oral potentially malignant disorders. Oral Surg Oral Med Oral Pathol Oral Radiol. 2018;125:582-90. [ Links ]
4. Pentenero M, Meleti M, Vescovi P, Gandolfo S. Oral proliferative verrucous leucoplakia: are there particular features for such an ambiguous entity? A systematic review. Br J Dermatol. 2014;170:1039-47. [ Links ]
5. Villa A, Menon RS, Kerr AR, De Abreu Alves F, Guollo A, Ojeda D, et al. Proliferative leukoplakia: Proposed new clinical diagnostic criteria. Oral Dis. 2018;24:749-60. [ Links ]
6. Iocca O, Sollecito TP, Alawi F, Weinstein GS, Newman JG, De Virgilio A, et al. Potentially malignant disorders of the oral cavity and oral dysplasia: A systematic review and meta-analysis of malignant transformation rate by subtype. Head Neck. 2020;42:539-555. [ Links ]
7. Alkan U, Bachar G, Nachalon Y, Zlotogorsky A, Levin EG, Kaplan I. Proliferative verrucous leukoplakia: a clinicopathological comparative study. Int J Oral Maxillofac Surg. 2022;51:1027-1033. [ Links ]
8. Aguirre-Urizar JM. Proliferative multifocal leukoplakia better name that proliferative verrucous leukoplakia. World J Surg Oncol. 2011;9:122. [ Links ]
9. González-Moles MÁ, Ramos-García P, Warnakulasuriya S. An appraisal of highest quality studies reporting malignant transformation of oral lichen planus based on a systematic review. Oral Dis. 2021;27:1908-1918. [ Links ]
10. van der Meij EH, van der Waal I. Lack of clinicopathologic correlation in the diagnosis of oral lichen planus based on the presently available diagnostic criteria and suggestions for modifications. J Oral Pathol Med. 2003;32:507-12. [ Links ]
11. McCarthy C, Kazmi A, Austin T, Ho MW, Chengot P, Rajlawt BP, et al. The development of Proliferative Verrucous Leukoplakia on a background of oral lichen planus: A case series. Adv in Oral and Maxil Surg. 2022;6:100263. [ Links ]
12. Gillenwater AM, Vigneswaran N, Fatani H, Saintigny P, El-Naggar AK. Proliferative verrucous leukoplakia (PVL): a review of an elusive pathologic entity! Adv Anat Pathol. 2013;20:416-23. [ Links ]
13. Lopes MA, Feio P, Santos-Silva AR, Vargas PA. Proliferative verrucous leukoplakia may initially mimic lichenoid reactions. World J Clin Cases. 2015;3:861-863. [ Links ]
14. Gilligan G, Garola F, Piemonte E, Leonardi N, Panico R, Warnakulasuriya S. Lichenoid proliferative leukoplakia, lichenoid lesions with evolution to proliferative leukoplakia or a continuum of the same precancerous condition? A revised hypothesis. J Oral Pathol Med. 2021;50:129-135. [ Links ]
15. Carrozzo M, Porter S, Mercadante V, Fedele S. Oral lichen planus: A disease or a spectrum of tissue reactions? Types, causes, diagnostic algorhythms, prognosis, management strategies. Periodontol. 2019;80:105-125. [ Links ]
16. González-Moles MÁ, Warnakulasuriya S, González-Ruiz I, González-Ruiz L, Ayén Á, Lenouvel D, et al. Worldwide prevalence of oral lichen planus: A systematic review and meta-analysis. Oral Dis. 2021;27:813-828. [ Links ]
17. Cerero-Lapiedra R, Baladé-Martínez D, Moreno-López LA, Esparza-Gómez G, Bagán JV. Proliferative verrucous leukoplakia: a proposal for diagnostic criteria. Med Oral Patol Oral Cir Bucal. 2010;15:e839-45. [ Links ]
18. Ranganathan K, Kavitha L. Oral epithelial dysplasia: Classifications and clinical relevance in risk assessment of oral potentially malignant disorders. J Oral Maxillofac Pathol. 2019;23:19-27. [ Links ]
19. Morton TH, Cabay RJ, Epstein JB. Proliferative verrucous leukoplakia and its progression to oral carcinoma: report of three cases. J Oral Pathol Med. 2007;36:315-8. [ Links ]
20. Goodson ML, Sloan P, Robinson CM, Cocks K, Thomson PJ. Oral precursor lesions and malignant transformation--who, where, what, and when? Br J Oral Maxillofac Surg. 2015;53:831-5. [ Links ]
21. van der Waal I. Oral lichen planus and oral lichenoid lesions; a critical appraisal with emphasis on the diagnostic aspects. Med Oral Patol Oral Cir Bucal. 2009 Jul 1;14:E310-4. [ Links ]
22. Serrano-Sánchez P, Bagán JV, Jiménez-Soriano, Sarrión G. Drug-induced oral lichenoid reactions. A literature review. J Clin Exp Dent. 2010;2:e71-5. [ Links ]
23. Barba-Montero C, Lorenzo-Pouso AI, Gándara-Vila P, Blanco-Carrión A, Marichalar-Mendía X, García-García A, et al. Lichenoid areas may arise in early stages of proliferative verrucous leukoplakia: A long-term study of 34 patients. J Oral Pathol Med. 2022;51:573-581. [ Links ]
24. Müller S. Oral manifestations of dermatologic disease: a focus on lichenoid lesions. Head Neck Pathol. 2011;5:36-40. [ Links ]
25. Abadie WM, Partington EJ, Fowler CB, Schmalbach CE. Optimal Management of Proliferative Verrucous Leukoplakia: A Systematic Review of the Literature. Otolaryngol Head Neck Surg. 2015;153:504-11. [ Links ]
26. Garcia-Pola MJ, Llorente-Pendás S, González-Garcia M, García-Martín JM. The development of proliferative verrucous leukoplakia in oral lichen planus. A preliminary study. Med Oral Patol Oral Cir Bucal. 2016;21:e328-34. [ Links ]
27. Müller S. Oral epithelial dysplasia, atypical verrucous lesions and oral potentially malignant disorders: focus on histopathology. Oral Surg Oral Med Oral Pathol Oral Radiol. 2018;125:591-602. [ Links ]
28. Davidova LA, Fitzpatrick SG, Bhattacharyya I, Cohen DM, Islam MN. Lichenoid Characteristics in Premalignant Verrucous Lesions and Verrucous Carcinoma of the Oral Cavity. Head Neck Pathol. 2019;13:573-9. [ Links ]
30. Wang H, Leavitt L, Ramaswamy R, Rapraeger AC. Interaction of syndecan and alpha6beta4 integrin cytoplasmic domains: regulation of ErbB2-mediated integrin activation. J Biol Chem. 2010;285:13569-79. [ Links ]
31. Anttonen A, Kajanti M, Heikkilä P, Jalkanen M, Joensuu H. Syndecan-1 expression has prognostic significance in head and neck carcinoma. Br J Cancer. 1999;79:558-64. [ Links ]
32. Gharbaran R. Advances in the molecular functions of syndecan-1 (SDC1/CD138) in the pathogenesis of malignancies. Crit Rev Oncol Hematol. 2015;94:1-17. [ Links ]
33. Gupta S, Jawanda MK. Oral Lichen Planus: An Update on Etiology, Pathogenesis, Clinical Presentation, Diagnosis and Management. Indian J Dermatol. 2015;60:222-9. [ Links ]
34. Mahdavi N, Aminishakib P, Soltani N. Presence of B Cells and Plasma Cells in Oral Lichen Planus. J Dent. 2020;21:209-214. [ Links ]
35. McParland H, Warnakulasuriya S. Lichenoid morphology could be an early feature of oral proliferative verrucous leukoplakia. J Oral Pathol Med. 2021;50:229-235. [ Links ]
Declaración de Conflictos de interés: Los autores no presentan conflicto de intereses en la publicación del artículo
Nota contribución de autoría: Contribución de los autores 1.Concepción y diseño del estudio 2.Adquisición de datos 3.Análisis de datos 4.Discusión 5.Redacción y corrección del manuscrito 6.Aprobación de la versión final del manuscrito MJD ha contribuido en: 1, 2, 3, 4, 5 y 6. KAS ha contribuido en: 3, 5 y 6. DAF ha contribuido en: 3, 4, 5 y 6. ALA ha contribuido en: 2, 3, 4 y 6. EK ha contribuido en: 1, 2, 3, 4, 5 y 6.
Recibido: 20 de Julio de 2023; Aprobado: 12 de Noviembre de 2023











 texto em
texto em 
 Curriculum ScienTI
Curriculum ScienTI