Introducción
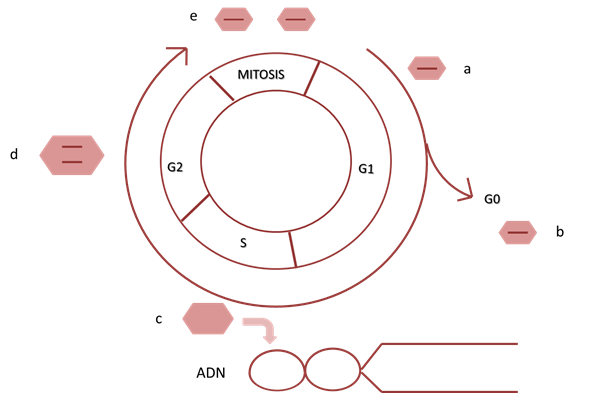
La formación de nuevas células se genera a partir de células preexistentes a través de una serie ordenada de eventos denominada ciclo celular. El mismo se divide en 4 etapas que son la G1, S, G2 y M (Fig.1). Al abordaje conceptual del ciclo se puede comenzar desde cualquier etapa, siendo lo más común su análisis a partir de la etapa G1, esta etapa es la inmediata a la mitosis (M), en ella se produce crecimiento celular como consecuencias de diferentes eventos que incluyen la síntesis de ARN, proteínas y otros elementos celulares. La fase siguiente se denomina S, en esta etapa la célula produce una copia de todo el ADN cromosómico, produciendo el fenómeno de duplicación. Se duplican también los centriolos y el centrosoma, hecho que será fundamental para el desarrollo de la fase M (mitosis), del ciclo en cuestión.
La fase siguiente se denomina G2, es la fase que separa la fase S de la mitosis, se produce un mayor crecimiento y se activan mecanismos moleculares de seguridad respecto al ADN, mediante los cuales se buscan errores en la secuencia del mismo, que de detectarse no poder corregirlos, se inician mecanismos que impiden que el ciclo continúe. Al corroborarse la ausencia de errores y completarse G2 ingresamos en la fase M, que es donde se desarrolla el proceso de la mitosis, el cual se divide en cuatro etapas (profase, anafase, metafase y telofase), donde la célula madre diploide dará lugar a dos células hijas también diploides 1.
Algunas células pueden permanecer en un estado de metabolismo basal sin dividirse ni replicar su ADN. Estas células están en fase G0 o en estado de reposo (Fig. 1), que puede ser un estado transitorio en donde la célula, bajo un estímulo, vuelve a entrar al ciclo celular o ser un estado permanente, en el cual la célula nunca volverá a dividirse 1.
La proliferación celular es el incremento del número de células, resultado de la división celular, es más activa durante la embriogénesis y el desarrollo de un organismo, pero continúa durante toda la vida siendo necesaria para la homeostasis tisular 1.
El control de esta es fundamental para la integridad del genoma, por lo que hay múltiples proteínas regulando este proceso. La pérdida de esta regulación es la causa de enfermedades como el cáncer donde una célula forma una línea celular con capacidad de proliferación celular ilimitada e incontrolada debido a mutaciones genéticas 1.
La identificación de las proteínas que intervienen en el ciclo celular permite utilizarlas como biomarcadores de proliferación celular (mediante inmunohistoquimica, técnica esencial en el diagnóstico anatomo-patológico del cáncer) los cuales son útiles para el diagnóstico, pronostico y plan de tratamiento de diferentes neoplasias, como se ha sugerido en diferentes trabajos de investigación experimental.
Nuestro objetivo, es tratar de recoger evidencias existentes especto al complejo MCM2-7 (proteínas biológicas intervinientes en el ciclo celular y su control) tratando de identificarla y así marcar las mitosis defectuosas, particularmente en aquellas patologías bucales pre-malignas o cancerizables como la leucoplasia (en sus distintas variedades) la queilitis actínica, lupus eritematoso y liquen plano, tendientes todas a convertirse en lesiones cancerosas.
Métodos
Se realizó una revisión bibliográfica electrónica usando la base de datos de PubMed, en el correr del año 2017, la cual incluyó artículos publicados en los últimos 15 años y textos de referencia en la temática motivo de la revisión, empleando los siguientes términos en inglés: “complex MCM2-7, cellularproliferation, cancer”. Se incluyeron 45 artículos en idioma inglés para orientar la presente revisión bibliográfica.
Desarrollo
Complejo MCM2-7 (minichromosome maintenance)
El complejo MCM2-7 fue reconocido en el año 1980. Tiene una forma toroidal y está compuesto por 6 proteínas diferentes (MCM2, MCM3, MCM4, MCM5, MCM6, MCM7) 2.
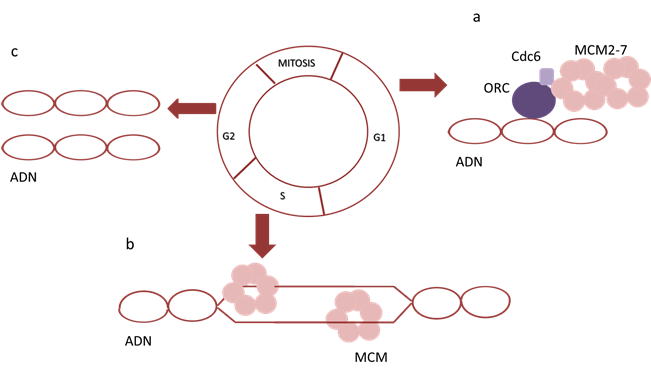
El complejo MCM2-7 forma parte del complejo pre-replicativo por lo que tienen un rol esencial en la replicación del ADN 3 (Fig. 2) y por lo tanto conocer cómo interviene en el ciclo celular podría ser una herramienta útil para comprender uno de los mecanismos biológicos que se ven afectados en el cáncer.
Complejo pre-replicación
La proteína MCM7, junto aMCM2,MCM4yMCM6, poseen actividadADN-helicasa, por lo que podrían actuar comoenzimasde desenrollamiento del ADN.
A finales de la mitosis e inicios de G1 se forma el complejo pre-replicativo conformado por el complejo de reconocimiento de orígenes (ORC), cell división cycle 6 (Cdc6) y MCM2-7 4-5) (Fig. 2). Este complejo marca el fragmento de ADN donde se dará inicio a la replicación, en la fase S del ciclo celular el complejo pre-replicativo se activa dando lugar a la replicación del ADN 6-7) (Fig. 2). Una vez que la replicación ha sido culminada se produce la disolución del complejo y la destrucción de sus componentes 4.
La actividad de las proteínas MCM está sumamente regulada por la actividad de una quinasa dependiente de ciclina (CDK), esta se encuentra en bajos niveles a finales de la mitosis y comienzos de G1 promoviendo la formación del complejo pre-replicativo, y aumenta a finales de la fase S y M, lo que conduce a la fosforilación de los componentes del complejo MCM2-7, haciendo que salgan al citoplasma y se degraden 4-5.
Funciones MCM.
Como mencionamos anteriormente el complejo tiene un rol esencial en la replicación del ADN 8-9.
1- Inicia la replicación, permitiendo que esta se de en el momento oportuno para lo cual debe cambiar su estructura tridimensional. El complejo MCM2-7 cuando está inactivo presenta una discontinuidad reversible en su estructura toroidal, al unirse las proteínas MCM2 y MCM5 cierran esta discontinuidad permitiendo así activar el complejo MCM2-7 10-11 (Fig. 3).
2- Función helicasa: una vez que se cierra la discontinuidad MCM2-5, el complejo MCM2-7 comienza a desenrollar las dos hebras del ADN para que se pueda dar la replicación. La actividad helicasa se ha demostrado in vitro para el subcomplejo MCM4, 6 y 7 12
3- Detiene la replicación: Si se detectan daños en al ADN, el complejo MCM2-7 detiene su actividad helicasa 13.
4- Cuida que todo el ADN sea replicado: Debido al gran tamaño de los cromosomas se necesitan miles de sitios para dar origen a la replicación 7, pero de los múltiples sitios que presentan el complejo pre-replicativo, solo algunos se utilizan, los otros permanecen latentes y en caso de stress de replicación se activan, lo cual es importante para que la totalidad del ADN sea replicado 14
5- Evita la replicación del ADN más de una vez 15. Ya que, una vez replicado el ADN, salen al citoplasma y degradan sus componentes 4
Según Nguyen 2000, todas las proteínas que forman el complejo MCM2-7 tienen el mismo patrón de localización en el ciclo celular y estas, una vez culminada la replicación, se transportan al citoplasma.
Pero, al contrario de este autor, investigaciones genéticas y bioquímicas más nuevas muestran funciones diferentes de las subunidades del complejo MCM2-7 16-18.
Como mencionamos anteriormente la actividad helicasa se ha demostrado in vitro para el subcomplejo MCM4, 6 y 7 12, mientras que MCM2, 3 y 5 son las encargadas de activar y desactivar el complejo 10,-11).
Dado la alta actividad de MCM2-7 presente en las células que están en el ciclo celular, y que estas proteínas están ausentes en células quiescentes, las diferentes proteínas que forman el complejo MCM2-7 podrían ser buenos marcadores de proliferación celular 19, posibles marcadores biológicos de diagnóstico y pronóstico 20-21 y futuros blancos terapéuticos 22. Se ha demostrado que varios supresores tumorales pueden inhibir la actividad de MCM 2-7 22.
Rol en la carcinogénesis
La sobreexpresión de las proteínas MCM se ha demostrado en una variedad de neoplasias. La expresión de MCM2 se ve aumentada en carcinoma de vejiga (23, adenocarcinoma de ovario 24, Leucoplasia verrugosa proliferativa25, oligodendrogliomas 26, carcinoma renal 27 y cáncer de mama 28. Por su parte, MCM3 en carcinoma papilar de tiroides 29, MCM4 en cáncer de pulmón de células pequeñas 30 y melanoma cutáneo 31, MCM5 en adenocarcinoma gástrico 32, carcinoma de vejiga 23, adenocarcinoma de ovario 24, carcinoma de células escamosas de piel 33, carcinoma de cuello uterino 34, carcinoma escamocelular de mucosa (35y Leucoplasia verrugosa proliferativa25, MCM6 en Carcinoma hepatocelular 36 y MCM7 en cáncer de próstata 37, cáncer de colon 38 y adenocarcinoma pulmonar 39.
Estos son algunos de los tantos estudios, que han demostrado la sobreexpresión de las diferentes proteínas del complejo MCM en diversas neoplasias, permitiéndoles concluir que dichas proteínas podrían ser buenos marcadores de proliferación celular.
Se ha demostrado que la desregulación de las proteínas MCM es un evento temprano en el desarrollo de los tumores, por lo tanto se sugiere que estos biomarcadores pueden ser muy útiles en el diagnóstico primario y la vigilancia tumoral (28, 40-41).
Según Williams, 1998, MCM5 tiene alta sensibilidad y especificidad para detectar, en frotis de cuello uterino, las células precursoras malignas mediante el uso de inmunoperoxidasa o inmunofluorescencia. Propone este método diagnostico como estudio complementario al PAP para disminuir los falsos negativos 40. Por otra parte Williams, 1998, Strober 2002, entienden que los niveles elevados de MCM5 en orina son altamente predictivos cáncer de vejiga 40-41.
Varios son los autores que concluyen que estas proteínas son superiores a los marcadores convencionales como Ki-67, ya que tienen una mayor expresión y por lo tanto presentan una mayor sensibilidad diagnóstica (25, 42-43).
La mayor expresión de este complejo, comparado con la expresión de Ki67, se puede explicar por dos motivos:
1- Como mencionamos anteriormente encontramos más complejos pre-replicativos de los que se utilizan para dar comienzo a la replicación, los otros permanecen latentes para activarse en caso de que haya problemas en algunas de las horquillas de replicación. Esta cantidad de complejos pre-replicativos, y por consiguiente del complejo MCM 2-7, es lo que se denomina “exceso de MCM” 42.
2- KI-67 se expresa a mediados de la fase G1 44, mientras que como mencionamos anteriormente el complejo pre-replicativo y por lo tanto MCM2-7 se expresa a principios de la fase G1 45.
Conclusiones
Según lo demostrado, las proteínas del complejo MCM, y más específicamente MCM 2 y 5, podrían comportarse como buenos marcadores biológicos de proliferación celular, como se deduce de los resultados de las investigaciones realizadas. La inmunoexpresión tisular alterada o defectuosa, sería un buen instrumento auxiliar para diagnóstico y pronóstico, así como futuros blancos terapéuticos. Por ello, debemos profundizar en su conocimiento tanto del punto de vista funcional, como de su participación en los distintos procesos biológicos; lo cual ayudaría en la clínica a la detección temprana de lesiones neoplasicas entre ellas del cáncer bucal y por tanto la selección adecuada de la terapia a efectuar.











 texto en
texto en