Introducción
La leishmaniosis es un grupo de enfermedades infecciosas parasitarias de transmisión principalmente vectorial que afectan a los seres humanos, a los animales domésticos y silvestres alrededor del mundo (Miró y col., 2001). La leishmaniosis visceral ocasionada por Leishmania infantum es una zoonosis potencialmente mortal, con una amplia distribución en humanos y caninos en cuatro continentes (Solano-Gallego y col., 2009), siendo los vectores flebotomíneos de los géneros Phlebotomus y Lutzomyia (Quiroz Romero, 1990; Miró y col., 2001).
En nuestro continente existen 12 países con leishmaniosis visceral endémica ocasionada por L. infantum (Solano-Gallego, 2013; Ministerio de Salud Pública, 2016) y el vector bien establecido en América del Sur es Lutzomyia longipalpis (Dantas-Torres, 2009).
En Brasil la enfermedad es endémica en el norte, noreste, medio oeste y sudeste. Los registros próximos a Uruguay indican que la leishmaniosis visceral canina fue reportada en el año 2008 en la municipalidad de Uruguaiana y en la ciudad vecina de São Borja, y en 2010 el primer caso autóctono en el municipio de Santa María, Río Grande del Sur (Da Silva y col., 2011).
En Argentina, Lu. longipalpis fue hallado en la Provincia de Formosa, frontera con Paraguay en el año 2004. El primer caso humano autóctono fue diagnosticado en 2006 en Posadas, Misiones y en 2008-2009 en Monte Caseros, Corrientes la presencia de Lu. longipalpis y de leishmaniosis visceral humana y canina (Salomón y col., 2009; Goud y col., 2013). En el año 2010, el flebotomíneo se reportó en Chajarí, Entre Ríos, próximo a la frontera con la Provincia de Corrientes mostrando su dispersión hacia el sur (Goud y col., 2013).
En Uruguay fue hallado Lu. longipalpis en el año 2010 en las ciudades de Bella Unión y Salto, y precisamente en esta última ciudad mencionada, se reportaron perros seropositivos a L. infantum en febrero de 2015 (Salomón y col., 2011; Satragno y col., 2017), produciendo un cambio epidemiológico para nuestro país al confirmarse casos autóctonos (Grill y Zurmendi, 2017).
El ciclo de vida de L. infantum comprende dos etapas morfológicamente bien diferenciadas, el promastigote flagelado que ingresa al hospedador al ser inoculado por el vector y se transforma en el amastigote inmóvil luego de ser fagocitado por los macrófagos, se multiplican hasta ocasionar su rotura e infectan nuevas células (Gállego y Riera, 2000; Miró y col., 2001; Baneth y Solano-Gallego, 2011).
Los principales factores de riesgo se relacionan a las condiciones ambientales que favorecen la proliferación del vector y a la falta de tenencia responsable de los perros (Organización Panamericana de la Salud, 2013; Ministerio de Salud Pública, 2016).
Los perros se reconocen como los reservorios urbanos de la leishmaniosis visceral, siendo la fuente de infección para los vectores (Gállego, 2004; Ministerio de Salud, Presidencia de la Nación, 2010; Organización Mundial de la Salud, 2010). La edad de los perros parece ser un factor de riesgo que influye en el desarrollo de la enfermedad. Se ha registrado que según la distribución etaria se presentan dos picos, uno en perros jóvenes, entre 2 y 4 años, y otro en mayores de 7 años. En relación a las razas de los perros, se indicaría mayor susceptibilidad de enfermar en Bóxer, Cocker spaniel, Rottweiler y Pastor alemán (Miró y col., 2001; França-Silva y col., 2003; Miranda y col., 2008). También se vio que los perros de pelo corto tienen mayor prevalencia frente a los de pelo largo (França-Silva y col., 2003) y habría predisposición de los machos a desarrollar la enfermedad (Miranda y col., 2008).
Las manifestaciones clínicas de la leishmaniosis visceral se consideran muy amplias y variables debido a los tipos de respuesta inmunitaria, a la multiplicidad de los mecanismos patogénicos y a factores del hospedador (Miró y col., 2001; Solano-Gallego, 2013). La infección es crónica, pudiendo presentarse como asintomática o una enfermedad de moderada a grave que puede llevar a la muerte (Bottero y col., 2006; Solano-Gallego y col., 2009). Los signos clínicos más comunes corresponden a lesiones cutáneas, adelgazamiento, linfadenomegalia y debilidad (Solano-Gallego, 2013), pudiendo afectar a todos los sistemas del animal (Ferrer y col., 1991; Ciaramella y col., 1997; Koutinas y col., 1999; Miró y col., 2001).
El diagnóstico clínico-epidemiológico es poco específico debido a la diversidad de signos con que puede presentarse, adquiriendo un valor presuntivo (Miró y col., 2001).
Frente a la reciente aparición de esta zoonosis, resulta relevante analizar la presentación de la leishmaniosis visceral en los perros seropositivos a Leishmania infantum en la ciudad de Salto, Uruguay. En este sentido, se propuso describir la distribución por sexo, edad, raza, tamaño y signos clínicos de la población canina afectada.
Materiales y métodos
Descripción del área de estudio
El área de estudio comprendió a la ciudad capital del departamento de Salto, ubicada en el litoral oeste, en el margen oriental del río Uruguay (31°23'18.0"S, 57°57'38.0"W) (Figura1).
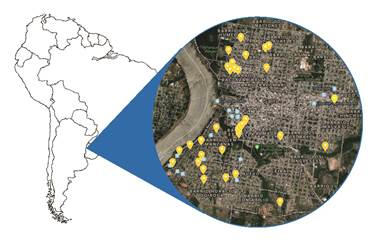
Figura 1: Ubicación del área de estudio. Mapa satelital de la ciudad de Salto, Uruguay indicando con marcadores amarillos los lugares de donde procedieron los perros analizados.
En cuanto a las características climáticas, la temperatura media anual se ubica en el entorno de los 18-19°C, con máximas en los meses de enero y febrero y mínimas en junio y julio (Red Académica Uruguaya) y alcanzando un promedio de precipitaciones de 1400 mm anuales, derivando en un comportamiento típico “subtropical templado” (Ministerio de Turismo).
El trabajo se llevó a cabo durante el período de agosto de 2017 a marzo de 2018.
Población animal involucrada
Se realizó una investigación transversal utilizando una subpoblación de perros (Canis familiaris) que previamente se había detectado en forma indirecta la presencia del protozoario, al evidenciar anticuerpos anti-Leishmania mediante la técnica de inmunocromatografía y el antígeno recombinante rk39 (Kalazar Detect Canine Rapid Test, InBios). Los perros pertenecieron a propietarios de hogares de la ciudad de Salto y se incluyeron en la muestra a medida que se iban diagnosticando, hasta alcanzar un mínimo de 40 animales que permitió obtener resultados significativos, sin considerar edad, raza, sexo o estado clínico.
Registro epidemiológico
Para cada perro evaluado se confeccionó una ficha clínica que consistió en un cuestionario estandarizado donde se especificó la fecha, los datos del propietario (nombre, dirección y teléfono) y del animal (nombre, raza, sexo, edad, largo del pelo y tamaño). Se realizó la anamnesis sanitaria, ambiental, remota y próxima. Los animales fueron sometidos a un examen objetivo general y particular correspondiente a los órganos afectados (Ettinger, 2007), con una descripción detallada de los signos atribuibles a la leishmaniosis canina (Solano-Gallego y col., 2011).
Análisis estadísticos
La relación sexo de los perros y la infección con L. infantum se evaluó determinando el porcentaje de machos y hembras infectados y se comparó con una población de referencia para el país (COTRyBA y Equipo consultores, 2017), usando la prueba de contingencia χ² (Sokal y Rohlf, 2002).
En relación a la edad de los perros seropositivos se calculó la media, el desvío estándar y el valor mínimo y máximo. Para describir la distribución de los perros según edad, se agruparon en cuatro categorías: cachorros (0-1 año), adultos jóvenes (2-4 años), adultos (5-6 años) y gerontes (>6 años), de acuerdo a Miranda y col. (2008).
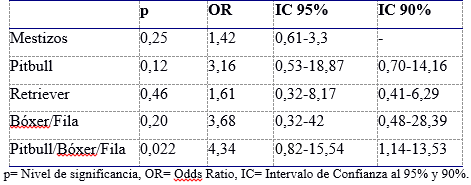
Se calculó los porcentajes de mestizos y razas caninas puras infectadas. La relación leishmaniosis y razas caninas se evaluó al comparar con la población de referencia para el país (COTRyBA y Equipo consultores, 2017), empleando una prueba de Odd Ratio (OR) para estimar el grado de asociación y se fijaron intervalos de confianza (IC) del 95% (p<0,05) y del 90% (p<0,1), siendo estadísticamente significativos cuando el IC no incluya el 1 e interpretando una asociación positiva si OR>1 y negativa si OR<1 (Sokal y Rohlf, 2002). En los análisis se evaluaron las razas con presencia de tres o más ejemplares. A su vez, los perros Labrador retriever y Golden retriever formaron un único grupo Retrievers, al igual que la clasificación de Perego y col. (2014) y los ejemplares de la raza Bóxer/Fila y Pitbull se analizaron por separado y luego juntos debido a la alta relación a nivel genético que presentan (Parker y col., 2004, 2017).
En la distribución de los perros según el tamaño, se consideró cuatro categorías: miniatura o Toy, pequeño, mediano y de talla grande.
Los perros fueron clasificados de acuerdo a la ausencia/presencia de signos clínicos como asintomáticos (sin signos aparentes de enfermedad) o sintomáticos (con signos clínicos compatibles de leishmaniosis visceral canina) y, dentro de este último en los subgrupos oligosintomáticos (menos de 3 signos clínicos), polisintomáticos (de 3 a 6 signos clínicos) e hipersintomáticos (con más de 6 signos clínicos) (modificado de Pozio y col., 1981). Se registró la frecuencia de los signos clínicos y de los cuadros clínicos discriminados en sistémico, cutáneo, ocular, renal y otros.
El nivel de confianza utilizado en los análisis fue del 95%, exceptuando la determinación de los OR de las razas analizadas, que además se realizó al 90%. Los programas estadísticos utilizados fueron Microsoft Excel y R Package.
Resultados
Caracterización de la población canina estudiada
La población de perros positivos a L. infantum (n= 43) fue de 67,44% (29) machos y 32,56% (14) hembras, mientras que los porcentajes correspondientes en la población de referencia de Uruguay (n= 1742000) son de 50% machos y 50% hembras (COTRyBA y Equipo consultores, 2017). Por lo tanto, la proporción de machos en la población infectada fue significativamente mayor que la de hembras (p= 0,02216791).
En relación con la edad de los animales afectados, se presentó una amplitud de variación entre 7 meses a 13 años, con una media de 4,97 años y una desviación de ±2,88 años. La positividad a la infección se encontró en un 4,65% en perros menores a un año y alcanzó su pico máximo (46,51%) en los adultos jóvenes de 2 a 4 años, descendiendo gradualmente a medida que progresa la edad, con un 25,58% de los perros entre los 5 y 6 años y 23,26% en mayores de 6 años.
De la totalidad de los perros seropositivos, el 55,81% fue mestizo y el 44,19% de razas puras, integradas por un 11,63% Pitbulls, 6,98% Labrador Retrievers, 4,65% Bóxer y un 2,32% de Pastor Alemán, Golden Retriever, Doberman, Caniche, Pinscher miniatura, Fila brasilero, Beagle, Cimarrón y Dachshund.
La Tabla 1 resume la relación de las razas más frecuentes encontradas en este estudio con la frecuencia racial en la población de referencia en Uruguay (COTRyBA y Equipo consultores, 2017), registrando que no se visualizó una asociación estadísticamente significativa con la positividad a la infección a un nivel de significación del 95% y del 90%. Sin embargo, al agrupar las razas Pitbull y Bóxer/Fila la relación fue significativa al 90%.
Tabla 1: Relación de las razas caninas seropositivas a L. infantum con la frecuencia racial de la población de referencia de Uruguay utilizando intervalos de confianza del 95% y 90%.
En cuanto al tamaño, el 7% de los perros se consideraron miniatura o Toy, 32% pequeños, 49% medianos y 12% fueron perros grandes.
En relación con el largo del pelo, la mayoría de los perros positivos presentó pelo corto (90,69%) y todos los casos permanecían en el exterior de la vivienda durante las horas de mayor actividad del vector.
Descripción de las manifestaciones clínicas en los perros seropositivos
Del total de los casos, solamente el 14% fue considerado asintomático, un 21% oligosintomático, el 30% polisintomático y un 35% fue hipersintomático.
Las manifestaciones clínicas más comunes de la enfermedad fueron una variedad de lesiones cutáneas presentes en el 78,38%, adelgazamiento en el 72,97%, palidez en las mucosas en el 56,76%, mientras que la linfadenomegalia fue hallada en el 51,35% de los animales. En orden decreciente se observó conjuntivitis y la manifestación por parte de los propietarios de poliuria/polidipsia en un 45,95% de los casos (Figura 2 y 3).
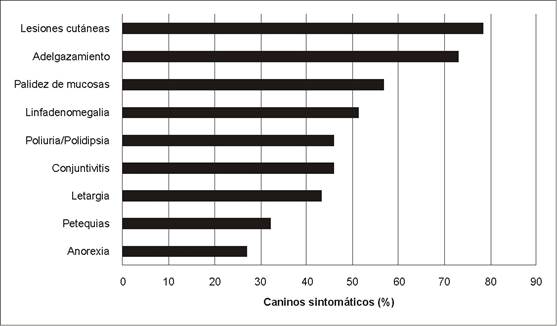
Figura 2: Frecuencia de los principales signos clínicos relacionados a leishmaniosis visceral en perros sintomáticos.
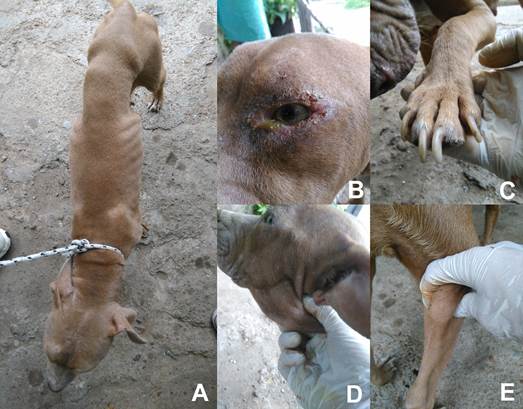
Figura 3: Manifestaciones clínicas de leishmaniosis visceral canina: A) adelgazamiento, B) conjuntivitis, C) onicogrifosis, D) y E) aumento de linfonódulos submandibular y poplíteo.
Sobre la base de la presencia de todas las manifestaciones clínicas atribuibles a leishmaniosis canina detectada en el examen clínico, los signos se agruparon en 5 cuadros clínicos. El cuadro clínico con signos sistémicos incluyó adelgazamiento, letargia, palidez de mucosas, petequias, anorexia, aumento de temperatura y agrandamiento de los nódulos linfáticos palpables. El cuadro clínico cutáneo integró la dermatitis descamativa, alopecias, prurito, onicogrifosis, hiperqueratosis nasal o podal, úlceras y nódulos. Con respecto al cuadro ocular se incluyó a la blefaritis y la conjuntivitis. También se consideró el cuadro renal que incorporó los casos de poliuria/polidipsia y en otros cuadros clínicos las manifestaciones de diarrea, vómitos, claudicación, estornudos, etc.
Los signos clínicos presentes en mayor cantidad fueron los referidos al cuadro clínico cutáneo (44%), luego los correspondientes al cuadro sistémico (37%) y en menor medida los cuadros oculares (6%), renales (6%) y otros cuadros clínicos (7%).
Las manifestaciones clínicas cutáneas incluyeron dermatitis descamativa (14,84%), onicogrifosis (10,94%), hiperqueratosis nasal (10,94%), alopecia a nivel de los pabellones auriculares (10,16%), alopecia periorbital (8,59%), alopecia nasal dorsal (8,59%), hiperqueratosis de las almohadillas podales (7,81%), alopecia de una o más articulaciones (6,25%), ulceraciones (6,25%), dermatitis perioral (5,47%), alopecia difusa (4,69%), prurito (3,13%), alopecia generalizada (1,56%) y dermatitis nodular (0,78%) (Figura 4). Las ulceraciones se vieron en 5 perros, presentándose en uniones mucocutáneas (n=3), puntos de presión sobre articulaciones (n=2), orejas (n=2) y escroto (n=1).
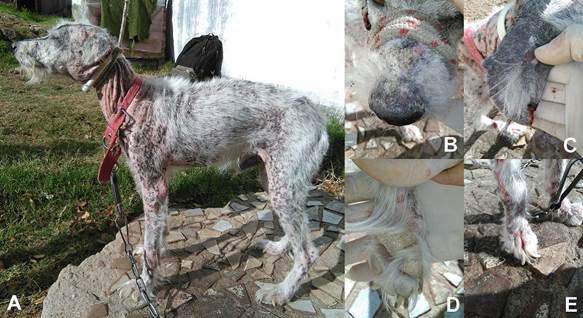
Figura 4: Manifestaciones clínicas cutáneas de leishmaniosis visceral canina: A) lesiones dermatológicas múltiples, B) alopecia nasal dorsal con presencia de escamas y costras, C) alopecia a nivel de pabellón auricular con presencia de ulceración, D) hiperqueratosis en almohadillas podales, E) onicogrifosis.
La dermatitis descamativa se caracterizó por escamas que se extendían usualmente por todo el cuerpo, más prominente alrededor de los ojos, en los pabellones auriculares y en la región dorsal de la nariz y tronco. Las escamas variaban en tamaño desde pequeñas a grandes, secas, de color usualmente blanco nacarado y adheridas o no a la superficie de la piel. En la mayoría de los casos el pelo estaba seco y quebradizo.
La onicogrifosis fue el segundo signo clínico cutáneo hallado, caracterizándose por la hipertrofia y curvatura anormal de las uñas, y ocasionalmente con onicorrexis.
La hiperqueratosis tanto nasal como de las almohadillas podales se destacaron por la presencia de escamas grisáceas, gruesas y secas, fuertemente adheridas a la piel subyacente y produciendo agrietamiento, fisuras profundas y dolorosas en situaciones avanzadas.
Las alopecias que afectan la región facial fueron signos habituales en los perros seropositivos a L. infantum, estas lesiones incluyeron en primer lugar a los pabellones auriculares, seguidos por las zonas periorbital y dorsal de la nariz.
Dentro de los signos sistémicos, el más frecuente fue el adelgazamiento (25%), alcanzando el estado de caquexia en 4 casos, incluidos los dos perros de raza Bóxer. En orden decreciente se registró la palidez de membranas mucosas (19,41%), el aumento de los nódulos linfáticos palpables (17,59%), letargia (14,81%), petequias en las membranas mucosas (11,11%), anorexia (9,25%) y aumento de temperatura (2,78%) (Figura 5).
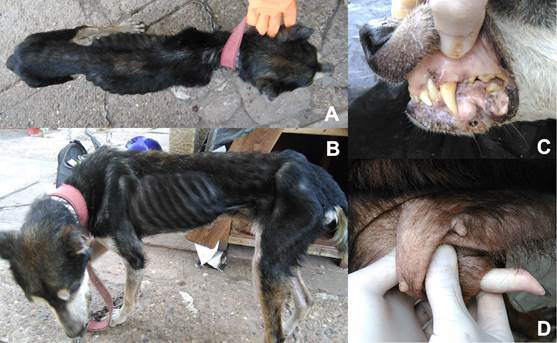
Figura 5: Manifestaciones clínicas sistémicas de leishmaniosis visceral canina: A) y B) caquexia, vista dorsal y lateral, C) y D) palidez de membranas mucosas oral y peneana.
El cuadro clínico ocular estuvo compuesto por casos de blefaritis y conjuntivitis, presentando en ocasiones un corrimiento purulento.
Discusión
Caracterización de la población canina estudiada
Se observó una proporción significativamente mayor de seropositivos en machos, concordando con trabajos realizados en otras partes del mundo. En España, Ferrer y col. (1988) observaron que de 43 perros con signos clínicos cutáneos de leishmaniosis, el 55,81% fueron machos, y Miranda y col. (2008) constataron una proporción de machos infectados significativamente superior (p= 0,002). En Italia, Perego y col. (2014) vieron que, de 100 casos de leishmaniosis canina con sintomatología cutánea, el 62% fueron machos. También Slappendel (1988) en los Países Bajos analizó 95 perros positivos a la infección de los cuales el 62,10% eran machos. Asimismo, en Brasil Schwardt y col. (2012), en una muestra de 40 perros con diagnóstico parasitológico de leishmaniosis visceral, el 65,5% fueron machos.
Por su parte, Koutinas y col. (1999) en Grecia a pesar de obtener una positividad del 56,3% en machos, sostienen la hipótesis de que la leishmaniosis visceral canina se encuentra igualmente distribuida en ambos sexos. Ciaramella y col. (1997) examinaron 150 perros seropositivos en una gran área endémica del sur de Italia, de los cuales un 64,7% fueron machos pero se atribuyó a su preponderancia en la muestra. Abranches y col. (1991) en Portugal, no evidenciaron diferencias significativas en la distribución por sexo de la infección por Leishmania.
Por el contrario, en Grecia, Koutinas y col. (1992) informaron un predominio de hembras en una proporción de aproximadamente 2:1 en perros con diagnóstico parasitológico de Leishmania.
Los trabajos que mencionan el mayor predominio de la infección por Leishmania en machos o hembras no indican una posible razón biológica que explique ese comportamiento. Sin embargo, hay que considerar que los perros machos se utilizan más frecuentemente como guardianes en el exterior de los domicilios, quedando más expuestos a las picaduras de los flebotomíneos y por ende aumentando la probabilidad de enfermar, como lo sugiere Amusategui y col. (2003). Por otra parte, a pesar de que la infección vectorial es la principal ruta de transmisión de los parásitos, se debe resaltar el papel de las hembras enteras infectadas al ser reportada la transmisión vertical, a consecuencia del pasaje de amastigotes a través de la placenta favorecido por el gran flujo de sangre (da Silva y col., 2009; Boggiatto y col., 2011 ). Por lo tanto, se puede considerar que en ausencia de un vector competente, la ruta transplacentaria podría ser un modo primario de transmisión de L. infantum en perros (Boggiatto y col., 2011). Además, la transmisión venérea ha sido asociada al tropismo de L. infantum por el sistema genital masculino (particularmente epidídimo, prepucio y glande) permitiendo el pasaje al semen (Silva y col., 2009). A su vez, hay trabajos que sugieren la posibilidad de transmisión de L. infantum por transfusión sanguínea entre perros (de Freitas y col., 2006).
En relación a la edad, se obtuvo un único pico de incremento de la detección de la infección por L. infantum en los perros de 2 a 4 años, que posteriormente descendió a medida que aumentó la edad. Ciaramella y col. (1997) también reportaron un único pico con mayor incidencia pero entre los perros de 3 a 7 años de edad. En cambio, esta presentación difiere a lo comunicado por Miranda y col. (2008) y Abranches y col. (1991) quienes consideran un comportamiento bimodal, con un nuevo incremento de casos positivos en perros gerontes mayores de 7 y 9 años, respectivamente. El hallazgo de la disminución de la prevalencia de la infección a medida que aumenta la edad posterior a los 4 años pudo deberse al efecto de acortamiento de vida que produce la enfermedad y al poco tiempo de establecida en Uruguay, considerando que el primer caso autóctono diagnosticado fue en el año 2015 (Satragno y col., 2017).
Se encontraron dos perros seropositivos menores de 1 año, siendo uno de ellos un Bóxer de 7 meses, raza con sensibilidad particular a la infección que permitiría el desarrollo de la enfermedad a una edad más temprana (Miranda y col., 2008). En cambio, el otro caso correspondió a un perro mestizo de 11 meses de edad, pero en ninguna de las dos situaciones se descarta la posibilidad de transmisión transplacentaria.
Las razas más frecuentes en el presente trabajo fueron Pitbull, Retriever y Bóxer. Estas han sido reportadas por Rondon y col. (2008) y Perego y col. (2014) como unas de las más prevalentes en adquirir la infección, aunque el último reporte supone que la alta incidencia de los Retriever y el Bóxer reflejaría la composición de la población estudiada.
El Pastor alemán también fue reportado como una de las razas más prevalentes en adquirir la infección (Ciaramella y col., 1997; Miranda y col., 2008; Rondon y col., 2008; Perego y col., 2014). Sin embargo, a pesar de ser una de las razas más predominantes en el país (COTRyBA y Equipos consultores, 2017), en este trabajo fue encontrado un solo ejemplar infectado.
La baja positividad a L. infantum en razas miniatura o Toy encontrada en este estudio, se puede atribuir a su estilo de vida de permanecer en el interior de las viviendas, lo que probablemente reduce sus posibilidades de contacto con los flebotomíneos. No obstante, los ejemplares mencionados de este tamaño permanecían mayoritariamente en el exterior de los domicilios. Otros autores han coincidido con esta situación, tanto Ciaramella y col. (1997) como Miranda y col. (2008) vieron que estas razas estuvieron menos involucradas entre la población infectada.
Con respecto a la relación de razas caninas y positividad a L. infantum, no se encontró una asociación estadísticamente significativa entre estatus racial o presencia de determinada raza con mayor predisposición a desarrollar la enfermedad utilizando intervalos de confianza del 90% y 95%, aunque esto pudo deberse a un número reducido de ejemplares por raza analizado. En igual sentido, Slappendel (1988) y Leontides y col. (2002) no evidenciaron predisposición racial. A pesar de no detectar asociación significativa, se encontró mayor cantidad de perros mestizos infectados al igual que lo analizado por Ciaramella y col. (1997), pero esto puede reflejar la presencia de más animales con esta característica en el país y en el contexto socio-económico donde se llevó a cabo el estudio. Esto difiere de lo observado por Koutinas y col. (1999) y por Perego y col. (2014) quienes obtuvieron mayor porcentaje de infección en razas puras, aunque en esta última investigación más de un tercio de los animales analizados provenían de criaderos de razas y tiendas de mascotas.
Aunque no se encontró asociación estadísticamente significativa al 95% con la positividad a la infección, se debe resaltar que los Pitbull y Bóxer/Fila tuvieron 3 veces más probabilidad de adquirir la parasitosis. Sin embargo, al realizar el análisis con intervalo de confianza del 90% se obtuvo una asociación estadísticamente significativa con la positividad a la infección del grupo de razas integrado por Pitbull, Bóxer y Fila. Esto se podría explicar por una incapacidad de ciertas razas de emplear una respuesta inmunitaria adecuada para eliminar los parásitos (França-Silva y col., 2003; Miranda y col., 2008).
La mayoría de los perros afectados fueron de tamaño mediano, coincidiendo con la característica de talla más representada en Uruguay (COTRyBA y Equipos consultores, 2017) y con lo reportado por Ciaramella y col. (1997).
Por su parte, los perros seropositivos fueron predominantemente de pelo corto, siendo posible que la infección por L. infantum esté asociada también con la longitud del pelo de la raza. Rondon y col. (2008) argumentan que la esquila en perros con pelaje naturalmente largo como el Cocker Spaniel o Caniche, incrementa la exposición a la picadura de los flebotomíneos y explicaría su alta seroprevalencia (França-Silva y col., 2003).
La totalidad de los perros analizados permanecían en el exterior del domicilio durante las horas de mayor actividad del vector, concordando con la situación en Uruguay en donde el 96% de la población canina vive el mayor tiempo al aire libre (COTRyBA y Equipos consultores, 2017). La seropositividad en perros en esta situación puede explicarse por el hecho de que se encuentran expuestos continuamente a los flebotomíneos al ser el peridomicilio un lugar habitual de éstos y por mantenerse vulnerables durante las horas de mayor actividad de los vectores. El riesgo de infección se incrementa en las viviendas con presencia de abundante vegetación al aportar las condiciones favorables para el desarrollo del ciclo biológico del vector (Rondon y col., 2008). Arribando a igual resultado, Abranches y col. (1991) y Ciaramella y col. (1997) sugieren que los perros que habitan el interior de los domicilios están menos expuestos a la infección.
Análisis de las manifestaciones clínicas presentadas en los perros seropositivos
El estudio evidenció en los perros seropositivos a L. infantum un 14% de asintomáticos, cercano al 17% comunicado por da Costa-Val y col. (2007) en Brasil. En cambio, esta condición clínica fue superior en la mayoría de los reportes bibliográficos.
Por su parte, en Brasil Mendonça y col. (2013), Nicolato y col. (2013) y Schwardt y col. (2012) encontraron casos asintomáticos en el 22%, 26% y 40%, respectivamente. En Portugal, esta condición fue reportada por Abranches y col. (1991) en un 54% y en España, Solano-Gallego y col. (2001) informaron que un 58% no tenía presencia de signos clínicos compatibles con leishmaniosis canina.
En cuanto a la cantidad de signos clínicos, se encontró un 21% de perros oligosintomáticos y un 65% de poli e hipersintomáticos. Al respecto, se ha reportado que los casos oligosintomáticos fluctuaron entre un 30% y un 52%, mientras que los poli e hipersintomáticos entre un 31% y 44% (da Costa-Val y col., 2007; Mendonça y col., 2013; Nicolato y col., 2013).
Con respecto a las manifestaciones clínicas de la leishmaniosis, las lesiones cutáneas fueron las más frecuentes, seguidas por la disminución de peso progresiva, la palidez de mucosas y la linfadenomegalia. Estos signos como los principales en perros infectados, aunque en diferente orden de presentación, han sido reportadas por diversos autores (Melo y col., 2014; Perego y col., 2014; Lopes Macau y col., 2017; Sales y col., 2017).
En lo que respecta a las lesiones dermatológicas, se observó que la dermatitis descamativa fue el signo clínico cutáneo de mayor frecuencia. Según reportes bibliográficos, esta característica representa la alteración cutánea más común en la leishmaniosis canina (Ferrer y col., 1988; Ciaramella y col., 1997; Koutinas y col., 1999; Perego y col., 2014). Este signo clínico se presenta primero en la piel facial, comúnmente en un patrón simétrico, incluyendo el área periocular, los pabellones auriculares y parte dorsal de la nariz. Puede que aparezca solamente en la cabeza, aunque tiende a involucrar progresivamente el tronco y las extremidades (Ferrer y col., 1988; Solano-Gallego, 2013; Perego y col., 2014).
En segundo orden, se encontraron tanto hiperqueratosis nasal como onicogrifosis y alopecia de los pabellones auriculares, que fueron signos evidenciados con alta frecuencia por Slappendel (1988), Abranches y col. (1991), Koutinas y col. (1992, 1999). La onicogrifosis ha sido reportada desde un 25% a un 91% de la población infectada (Ciaramella y col., 1997; Mendonça y col., 2013; Sales y col., 2017). Sin embargo, Perego y col. (2014) apenas reportaron un 9% de animales con onicogrifosis e hiperqueratosis nasodigital.
Las úlceras cutáneas no fueron de los signos más comúnmente hallados a diferencia de otros trabajos, pero si coincidiendo la ubicación de las mismas como ser en las uniones mucocutáneas, puntos de presión en articulaciones y orejas (Slappendel, 1988; Abranches y col., 1991; Ciaramella y col., 1997; Koutinas y col., 1999).
Al igual que lo descrito por Slappendel (1988), el prurito fue un signo clínico raramente encontrado, mientras que Koutinas y col. (1992) lo reportaron en un 18% de los casos.
Por otro lado, Foglia Manzillo y col. (2013) vieron que los signos cutáneos se presentaron muy raramente durante los primeros 22 meses del transcurso de la enfermedad, concluyendo que son el resultado de un proceso crónico que normalmente requeriría más de 2 años después de la infección para manifestarse clínicamente.
Es importante señalar que la mayoría de los animales tenía más de una presentación dermatológica al mismo tiempo, lo que destaca la extrema variabilidad de signos clínicos de esta enfermedad y la dificultad para describirlos con exactitud. En este sentido, Koutinas y col. (1992), Perego y col. (2014); Saridomichelakis y Koutinas (2014), informaron formas dermatológicas múltiples.
La presencia de signos clínicos oculares como conjuntivitis y blefaritis se observó en casi la mitad de los animales analizados. Esto también fue reportado por Sales y col. (2017) y Koutinas y col. (1999) aunque en una tercera y cuarta parte de los perros infectados, respectivamente. Sin embargo, en otras investigaciones estas manifestaciones no se observaron tan frecuentemente, oscilando entre un 13% y un 16% (Koutinas y col., 1992; Ciaramella y col., 1997; Mendonça y col., 2013). Por su parte, Abranches y col. (1991) habían reportado que la conjuntivitis fue un signo clínico raramente hallado en los animales infectados.
La ausencia de otros signos oculares podría deberse a que la leishmaniosis visceral canina es una enfermedad reciente en nuestro país, y de acuerdo a Foglia Manzillo y col. (2013) se necesitan más de 2 años post infección para manifestarse clínicamente las lesiones en otras estructuras del ojo.
En cuanto a la presencia de poliuria/polidipsia en el 46% de los animales, concuerda con lo registrado por Slappendel (1988), y difiere de los pocos casos documentados por Ciaramella y col. (1997).
Las manifestaciones de otros signos clínicos como estornudos, vómitos, diarrea o claudicación no fueron predominantes, coincidiendo con Slappendel (1988) y Ciaramella y col. (1997). Sin embargo, el primer autor mencionado registró el doble de casos con presencia de signos digestivos, aunque no superando el 30% de los animales afectados.
Conclusiones
Los perros seropositivos a L. infantum fueron en mayor proporción machos y el grupo etario más representado estuvo comprendido entre los 2 y 4 años de edad.
En general no se encontró asociación significativa entre razas definidas y la positividad a la infección, salvo cuando se integró en un sólo grupo a los Pitbull, Bóxer y Fila.
En la totalidad de la población canina infectada, el 86% presentó signos clínicos diversos, destacándose principalmente las lesiones cutáneas, adelgazamiento, palidez de mucosas y linfadenomegalia.
Los signos dermatológicos estuvieron representados mayormente por la dermatitis descamativa, la onicogrifosis y la hiperqueratosis nasal.
Si bien se reconoce un conjunto de signos clínicos más frecuentes, la variabilidad de presentación de la leishmaniosis visceral canina conlleva a incluirla en el diagnóstico diferencial de afecciones con manifestaciones compatibles, principalmente en las zonas epidemiológicamente comprometidas.















