Introducción
La acuicultura es la actividad de producción animal que más se ha expandido en las últimas décadas a nivel mundial, superando en ritmo de crecimiento anual al resto de las producciones animales y supliendo casi el 50% de los productos acuáticos que se consumen actualmente (FAO, 2018). En este contexto Uruguay se destaca como el mayor productor de caviar en Sudamérica y uno de los diez principales productores a nivel mundial (Bronzi y Rosenthal, 2014), con una producción anual que supera las 600 toneladas de carne de esturión y las siete toneladas de caviar (DINARA, 2014). A su vez, el cultivo de peces ornamentales se destaca como una rama de la actividad de importancia a nuestra escala país, con una producción anual de 250.000 animales en promedio (Carnevia y col., 2013).
Al igual que en otras producciones animales, en los establecimientos de piscicultura intensiva ocurren epizootias por diversos patógenos, dentro de los que se destacan por su prevalencia e importancia las bacterias Gram negativas (Austin y Austin, 2007). La septicemia por Aeromonas móviles (SAM) es la enfermedad infecciosa más importante en la piscicultura nacional, afectando tanto peces ornamentales como para consumo humano, siendo Aeromonas hydrophila y A. veronii las especies más prevalentes en nuestra acuicultura (Perretta y col., 2018).
Estos microorganismos, ubicuos en toda la biosfera microbiana, han adquirido relevancia para la salud en las últimas décadas, debido por un lado al aumento y la gravedad de los casos clínicos observados en pacientes humanos y por otro lado a las importantes pérdidas económicas provocadas en la acuicultura (Janda y Abbott, 2010; Rasmussen-Ivey y col., 2016).
El elevado número de mortandades que puede provocar la enfermedad sin tratamiento y la carencia de herramientas de prevención, hacen que los piscicultores nacionales, tanto de peces ornamentales como para consumo, optan por la terapia con antimicrobianos para controlar epizootias. Las dificultades para el acceso en el país a formulaciones específicas para acuicultura y la carencia a su vez de información farmacológica para las especies y condiciones de cultivo nacionales, provocan en muchos casos un uso indebido de los fármacos con el consecuente riesgo de desarrollo de resistencia a los antimicrobianos.
A pesar de la importancia que poseen los aeromonadales tanto para la salud humana como animal, para Janda y Abbott (2010) la susceptibilidad in vitro de Aeromonas spp. a los antimicrobianos es un área clave del conocimiento de los aeromonadales que ha recibido poca atención en las últimas décadas.
El objetivo de este trabajo fue caracterizar los perfiles de resistencia a los antimicrobianos desarrollados por un número representativo de aeromonadales aislados de peces cultivados en nuestro país.
Materiales y Métodos
Origen de los aislamientos
Se emplearon 33 aislamientos de Aeromonas spp. obtenidos de distintas especies de peces de agua dulce con signos clínicos de SAM (6% A. allosaccharophila, 6% A. bestiarium, 3% A. caviae, 15% A. punctata, 36% A. hydrophila y 33% A. veronii). Los animales afectados provinieron de acuarios comerciales (6.2%), bioterios (21.9%) y criaderos de peces ornamentales y para consumo (71.9%), todos ellos ubicados dentro del territorio nacional.
Mediante entrevista a los encargados de la sanidad de cada establecimiento se determinó el tipo y la frecuencia de uso de antimicrobianos. Se evaluó la susceptibilidad de cada aislamiento hacia diez antimicrobianos entre los que se incluyen aquellos empleados en la acuicultura nacional, a saber: amoxicilina ácido clavulánico (AMC 2:1, 20µg), ampicilina (AP 10µg), ampicilina dicloxacilina (AMD 10:1, 10µg), enrofloxacina (ENO 30µg), eritromicina (ER 15µg), nitrofurantoína (NF 300µg), oxitetraciclina (OT 30µg), penicilina (P 10U), tiamfenicol (TFM 65µg) y sulfametoxazole-trimetropim (SXT 19:1, 25µg). Para la determinación de sensibilidad se empleó el método de difusión simple en agar (Bauer y col., 1966) según el protocolo que figura en el manual M42-P del Clinical and Laboratory Standards Institute (CLSI) (CLSI, 2005). Se empleó la cepa tipo de A. hydrophila ATCC 7966® como control de calidad del procedimiento.
La discriminación entre bacterias sensibles, resistentes e intermedias se basó en los estándares especificados por CLSI para Aeromonas hydrophila (CLSI, 2006). En los casos en los que dicho estándar no posee información para el antimicrobiano empleado, se utilizó la información existente para drogas de la misma familia o el estándar de sensibilidad aportado por el fabricante de los Sensi-Discs ® (Bekton Dickinson, BD) (ver Cuadro 1).
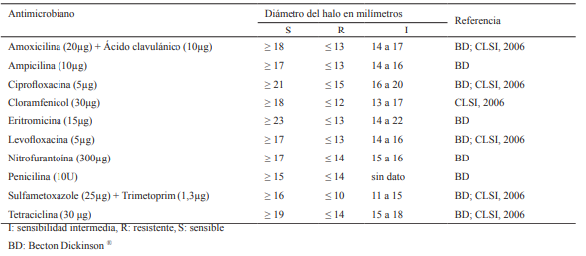
Cuadro 1: Estándares de sensibilidad empleados para la determinación de resistencia en los aislamientos de Aeromonas spp. móviles provenientes de peces cultivados en Uruguay mediante el método de difusión en placa (Kirby-Bauer).
Se consideraron aislamientos susceptibles a la acción de un antimicrobiano determinado a aquellos cuyos halos de inhibición correspondieron tanto a la categoría "resistente", como "intermedia". Este criterio se basa en que los estándares de resistencia existentes en la actualidad no han sido evaluados en patógenos de organismos acuáticos y a su vez no se han desarrollado modelos farmacométricos en peces para dichas drogas (del Río-Rodríguez y Turnbull, 2002; Smith y col., 1994).
Se determinaron las diferencias de susceptibilidad entre especies mediante el empleo del test de Chi2 con un nivel de confianza del 95% (software Statgraphics versión 16.1.18).
Se calculó a su vez el "Índice de Multirresistencia a Antimicrobianos" (MAR), como el cociente entre el número de antimicrobianos a los que un aislamiento fue susceptible sobre el número de antimicrobianos evaluados para ese aislamiento. Valores de MAR mayores o iguales a 0,2 son indicativos de aislamientos con alto riesgo de proceder de ambientes donde se hace uso habitual de antibimicrobianos, los valores inferiores o iguales a 0,2 indican aislamientos procedentes de ambientes donde el uso de antimicrobianos es mínimo o nulo (Krumperman, 1983). Para aumentar la confiabilidad de los resultados se excluyeron los antimicrobianos β-lactámicos de este análisis debido a que para algunos autores este grupo bacteriano es naturalmente resistente a la acción de estos fármacos (Aoki, 1999; Martin-Carnahan y Joseph, 2005)
Resultados
En el cuadro 2 se presentan los perfiles de sensibilidad desarrollados por los distintos aislamientos ante los diferentes antimicrobianos evaluados. Todos los aislamientos evaluados son resistentes a las penicilinas, ya sea naturales o sintéticas. La adición de un inhibidor de las β-lactamasas (ácido clavulánico), permite desarrollar sensibilidad al 11,8% de los aislamientos analizados. Se destaca a su vez, el escaso número de aislamientos sensibles a los macrólidos (11,8% de aislamientos sensibles a la Eritromicina).
Los aislamientos procedentes de un mismo brote epizoótico poseen perfiles de sensibilidad similares entre sí, salvo en una ocasión en que dos aislamientos epizootiológicamente relacionados no comparten el mismo perfil de sensibilidad (V3-V4).
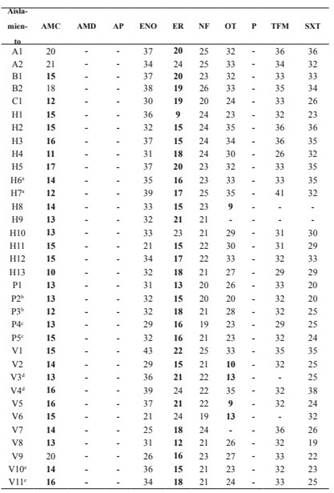
AMC: amoxicilina ácido clavulánico (2:1, 20µg), AMD: ampicilina dicloxacilina (10:1, 10µg), AP: ampicilina (10µg), ENO: enrofloxacina (30µg), ER: eritromicina (15µg), NF: nitrofurantoína (300µg), OT: oxitetraciclina (30µg), P: penicilina (10U), TFM: tiamfenicol (65µg), SXT: sulfametoxazole trimetropim (19:1, 25µg). Se destacaron en negrita aquellos halos correspondientes a sensibilidad intermedia o resistencia según estándar de CLSI y/o especificaciones del fabricante de los sensidiscos empleados. (-) corresponde a aquellos casos donde no se detectó inhibición del crecimiento bacteriano. a, b, c, d, e: letras iguales indican aislamientos procedentes de un mismo brote epizootiológico
Cuadro 2: Resultados del antibiograma realizado sobre Aeromonas spp. móviles aisladas de peces cultivados en Uruguay, método de difusión en placa según documento M45-P de CLSI (los valores corresponden al diámetro del halo de inhibición en milímetros)
En la Figura 1 se muestra la proporción de aislamientos que adoptan cada uno de los valores de Índice MAR calculados. Cabe destacar que 82,3% de los aislamientos nacionales de Aeromonas spp. son multirresistentes a los antimicrobianos.
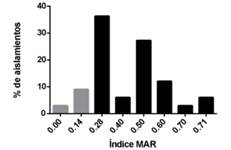
Figura 1: Gráfico en el que se representan los diferentes valores del Índice de Multirresistencia a los antimicrobianos (MAR) observado en aislamientos de Aeromonas spp. móviles obtenidos de peces cultivados en Uruguay. Las barras de color gris corresponden a aislamientos no multirresistentes (Índice MAR˂0.2) y las de color negro corresponden a aislamientos multirresistentes.
Discusión
Este es el primer estudio que analiza la resistencia a los antimicrobianos desarrollada por un número representativo de microorganismos aeromonadales aislados de peces procedentes de la acuicultura nacional. A partir de los resultados obtenidos es posible advertir el elevado número de Aeromonas spp. resistentes que se aíslan de los peces que se cultivan en nuestro país, ya sea ornamentales o para consumo humano.
Existe consenso en afirmar que la resistencia a los antimicrobianos en este grupo bacteriano se ha visto incrementada en los últimos años, por un lado debido al desarrollo de cepas multirresistentes procedentes de las aguas residuales urbanas y hospitalarias y por otro lado debido al uso indiscriminado de antimicrobianos que ha hecho históricamente la acuicultura (Schmidt y col., 2000; Kaskhedikar y Chhabra, 2010; Saavedra, 2012).
Aeromonas spp. aisladas de sistemas de cultivo de peces son particularmente resistentes a los antimicrobianos y frecuentemente contienen plásmidos e integrones con múltiples genes de resistencia, lo que genera dificultades en el tratamiento de las enfermedades provocadas por este grupo bacteriano (Baquero y col., 2008; Odeyemi y col., 2012).
Teniendo en cuenta la clasificación de susceptibilidad a los antimicrobianos establecida por Janda y Abbott (2010) para Aeromonas spp., los aislamientos nacionales deben considerarse en general resistentes a los macrólidos y penicilinas naturales y de espectro ampliado (˂12% de aislamientos susceptibles); con susceptibilidad variable hacia los anfenicoles y tetraciclinas (79 a 88%) y susceptibles a los antifolatos, quinolonas y nitrofuranos (94 a 100%); hallazgos coincidentes con los realizados por dichos autores a partir de la revisión de una extensa bibliografía.
A pesar de esto es preciso destacar que en Aeromonas spp. procedentes de la acuicultura es común observar diferencias en la resistencia a los distintos fármacos debido a la expresión de distintos mecanismos de resistencia en aislamientos que se hayan expuestos a presión de selección inducida por el uso de diferentes antimicrobianos (Yi y col., 2014). Del mismo modo es común encontrar aislamientos de Aeromonas spp. multirresistentes debido principalmente a la adquisición por transferencia horizontal de elementos móviles del genoma que poseen varios genes de resistencia (Rhodes y col., 2000; Ndi y Barton, 2011; Saavedra, 2012)
Si bien existen pocas investigaciones que comparen la susceptibilidad entre especies, algunos autores destacan que A. hydrophila es más resistente a los antimicrobianos que A. caviae y A. sobria, especialmente a las penicilinas y cefalosporinas (Motyl y col., 1985; Chang y Bolton, 1987). En nuestro caso, no se encontraron diferencias entre especies en lo que respecta a la susceptibilidad desarrollada para el conjunto de los antibióticos analizados (Chi2=104,627; g.l.: 306; p=1,0).
Los hallazgos realizados en el marco de esta investigación revelan el elevado número de aislamientos de Aeromonas spp. multirresistentes que ocurren en la acuicultura nacional, hecho que reviste gran importancia, no solo por las dificultades en el tratamiento de las aeromoniasis que puedan ocurrir en las pisciculturas, sino además por la capacidad de actuar de reservorios de genes de resistencia que poseen estos microorganismos y la facilidad de dispersión de los mismos hacia otros ecosistemas a través del medio acuático (Janda y Abbott, 2010; Igbinosa y col., 2013; Patil y col., 2016).
Teniendo en cuenta lo anterior, resulta fundamental el establecimiento de correctos planes terapéuticos en los sistemas de acuicultura de nuestro país, basados en un adecuado diagnóstico y antibiograma de los microorganismos actuantes y en la investigación de aspectos farmacométricos aplicados a las especies ícticas de interés para el país.
Conclusiones
Existe un elevado porcentaje (82.3%) de aislamientos de Aeromonas spp. procedentes de peces cultivados en nuestro país que son multirresitentes a los antimicrobianos.
Todos los aislamientos analizados fueron susceptibles a la acción de los antimicrobianos enrofloxacina y nitrofurantoína.















