Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Veterinaria (Montevideo)
versão impressa ISSN 0376-4362versão On-line ISSN 1688-4809
Veterinaria (Montev.) vol.51 no.197 Montevideo maio 2015
Biofilm: importancia en la práctica veterinaria
Biofilm: importance in clinical practice veterinary
1 Facultad de Medicina Veterinaria y Ciencias afines, Programa de Medicina Veterinaria y Zootecnia, Grupo GMAC, Corporación Universitaria del Huila. Campus Quirinal, Calle 21 N° 6-01, Neiva, Huila.
*Correo electrónico: erodriguezvster@gmail.com
Recibido: 11/11/2013 Aceptado: 4/11/2014
Resumen
La formación de biofilm sugiere que los microorganismos y organismos eucariotas como los hongos, al dejar su condición de vida libre (planctónica), conforman una comunidad biológica en donde experimentan modificaciones a nivel de fenotipo lo que sugiere cambios en el genotipo reflejados en la organización, desarrollo espacial y metabolismo. El propósito de esta revisión es evidenciar la importancia del concepto biofilm en la práctica clínica veterinaria, teniendo en cuenta que las infecciones recurrentes e intrahospitalarias así como el fenómeno de resistencia a medicamentos cada día está en aumento.
Palabras clave: biofilm, bacterias, hongos, calidad del aire, enfermedades
Summary
Biofilm formation suggests that microorganisms and eukaryotic organisms such as fungi, leaving free-living status (planktonic) form a community where they experience changes in the phenotype, indicating in genotype changes and reflected in the organization, spatial development and metabolism. The purpose of this review is show importance of the biofilm concept in veterinary Clinical practice, considering that recurrent and intrahospital infections well as mechanisms of resistance to drugs every day is increasing.
Keywords: biofilm, bacteria, fungi, air quality, diseases
Introducción
El biofilm es una comunidad heterogénea dinámica y compleja constituida por bacterias y hongos (Phillips y col., 2010) .En algunos casos, la biopelícula la conforma una sola especie fúngica o bacteriana, aunque usualmente contiene muchas especies bacterianas o fúngicas (Dowd y col., 2008).
Los estudios sugieren que bacterias como Staphylococcus, Streptococcus, Pseudomonas y Escherichia coli forman microcolonias que se adhieren al cabo de 2 a 4 horas y en un plazo de 16 horas desarrollan el exopolisacárido mostrando resistencia a antibióticos, fungicidas, antisépticos y desinfectantes (Costerton, 1984).
En la práctica clínica veterinaria, el papel del biofilm bacteriano, fúngico o mixto como factor de virulencia ha sido poco estudiado (Jacques y col., 2010) y varios de los tratamientos indicados para el paciente animal actualmente siguen considerando la línea de ataque a células individuales y no a consorcios que es el caso del biofilm (Gardner y col., 2011), situación que dificulta el éxito terapéutico.
Biofilm bacteriano
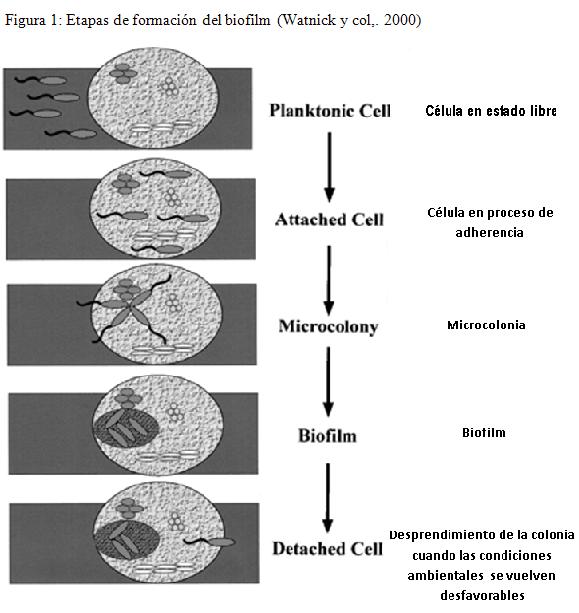
Constituye una comunidad microbiana exitosa en el ejercicio de colonización de superficies vivas o inertes, que reviste de importancia en la práctica clínica veterinaria a razón de su ubicuidad y responsabilidad en la aparición de infecciones recurrentes crónicas (Castrillón y col., 2010) con respuesta pobre frente a los tratamientos antibacterianos.
En la formación del biofilm (Figura 1), es fundamental el quorum sensing, evento que favorece la autoinducción en la síntesis de exopolisacárido, logrando así que la biopelícula madure y adquiera una conformación tridimensional, conduciendo a la formación de canales de agua (Keller y Surette, 2006) que favorecen los ejercicios de nutrición al interior del biofilm. Las moléculas responsables del proceso de autoinducción en bacterias GRAM (+) y GRAM (-) son diferentes, siendo en las primeras responsables de dicho proceso, los derivados de la acilhomoserina lactona (acil HSL), mientras que en el caso de las GRAM (-) los autoinductores corresponden a péptidos (Whitehead y col., 2001). La composición del biofilm varía, pero en general contiene, agua que constituye cerca del 97% del total del contenido, naturalmente células bacterianas, polímero extracelular y macromoléculas, como proteínas, DNA (Betancourth y col., 2004).
Biofilm fúngico
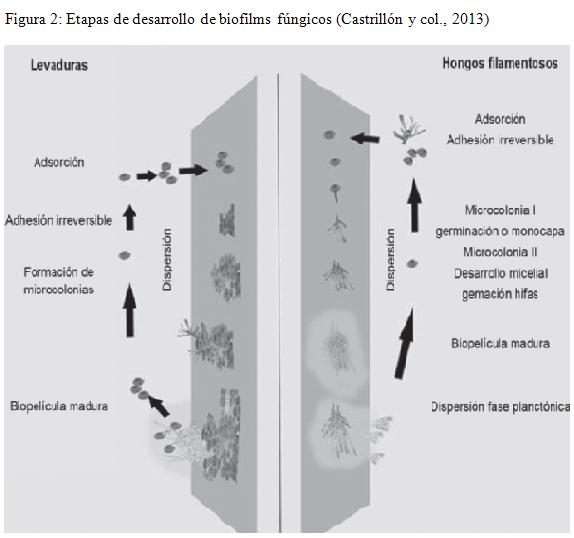
La formación de biopelículas por hongos oportunistas (Figura 2), es un evento complejo que implica diversas interacciones de las células fúngicas con el entorno ambiental e inclusive con bacterias (biofilm mixtos), adquiriendo así importancia en el ámbito clínico, a razón de su facilidad para colonizar superficies de catéteres y dispositivos médicos (San Jose y Orgáz, 2012), por lo tanto constituyen potencialmente una carga a considerar en procesos infecciosos que pueden condicionar procesos patológicos en el paciente animal, si se tiene en cuenta que no existen procedimientos estandarizados para valorar la sensibilidad del biofilm a drogas antifúngicas.
En el caso del biofilm fúngico, se ha observado que Candida, Aspergillus, Fusarium, Cryptococcus y Pneumocystis forman biopelículas mixtas, es decir, asociados a bacterias, observándose la formación de microcolonias en 6 horas y en un plazo de 24 a 48 horas desarrollan una arquitectura compleja que corresponde al biofilm maduro (Quindós y col., 2009) . Desde la década de los 90, se maneja que el biofilm bacteriano o fúngico se forma sobre superficies inertes (dispositivos e instrumental médico) y heridas, en estudios de microscopía a biopsias de heridas crónicas se ha observado estructuras de biofilm (James y col., 2008).
Mecanismos de resistencia del biofilm
Dentro de los mecanismos de resistencia, se han descrito inicialmente, el proceso de inactivación de antibióticos por acción de los polímeros extracelulares que parece ser impiden la unión del antibiótico sobre todo en el caso de aquellos de carga positiva como los aminoglicósidos (Herrera, 2004) y retardan la difusión del mismo facilitando su degradación, en segundo lugar, la baja tasa de crecimiento producto de una menor disponibilidad de nutrientes o metabolismo retardado, esta situación de alguna manera restringe el éxito de los antibióticos a razón de que la gran mayoría de estos son efectivos cuando las células están más vulnerables, es decir, en fase de crecimiento exponencial y por último, los cambios en el fenotipo que son favorecidos por un ejercicio de regulación génica diferente, estudios sugieren que en una misma bacteria el 30% de sus genes pueden tener un patrón de expresión diferente (Neu y col., 1994).
Teniendo en cuenta que un biofilm bacteriano o fúngico puede estar conformado por organismos con una alta habilidad para intercambio genético (Ramadan, 2006), es posible entonces que aumente la transferencia de factores de resistencia a antibióticos, o de adhesión que favorezcan la permanencia del biofilm en una superficie viva o inerte.
Si bien es cierto, los anteriores factores juegan un papel crucial en el fenómeno de resistencia mostrado por la comunidad al interior del biofilm, sin duda, es necesario considerar la comunicación (Dekievit y Iglewski, 2000), un ejercicio de señalización química que entre las células bacterianas favorece no sólo la activación génica sino también la represión de genes implicados en la formación del biofilm.
Evidencias que relacionan el biofilm con enfermedades en animales
Aunque las infecciones producidas por biofilms son ciertamente difíciles de resolver y pueden ser manifestadas como infecciones recurrentes o crónicas, a razón de que los organismos que hacen parte del biofilm muestran un nivel muy bajo de susceptibilidad a antibióticos o antifúngicos e inclusive a las defensas del hospedero, se ha evidenciado la asociación de biofilm a procesos infecciosos como dermatitis, neumonía, mastitis, enfermedades nosocomiales de vías urinarias y septicemia (Watnick y Kolter, 2000). Un estudio en caninos reveló la habilidad de Staphylococcus pseudintermedius una bacteria oportunista responsable de infecciones de la piel y heridas, para conducir la formación de biofilm. Los resultados mostraron que el 96% (136/140) de los aislados clínicos de S. pseudintermedius pueden formar biofilm (Singh y col., 2013), lo que podría explicar la presencia de manera recurrente de este patógeno en clínicas veterinarias.
En otro estudio, se evidenció formación de biofilm por especies de Staphylococcus, E.coli y Streptococcus uberis responsables de mastitis (Melchior, 2011), aspecto que puede explicar la condición de persistencia de la infección.
En términos de carga oral en animales, si bien es cierto, existen diferencias en términos de especies microbianas con la reportada en humanos, lo cierto es que, la carga residente normal formará inevitablemente biofilms sobre la superficie dentaria, donde cada grupo de bacterias ocupa microambientes.
Los estudios experimentales en animales, han revelado que la habilidad para formar caries dental no es exclusivo de una especie en particular, además de evidenciar que las especies más agresivas son los estreptococos del grupo mutans (Streptococcus mutans y S. sobrinus) (Marsh, 1999).
En caninos, la enfermedad periodontal se manifiesta durante toda la vida y es ciertamente compleja de abordar a razón de haber diferentes microambientes, como la mucosa masticatoria, mucosa dorso lingual, saliva y superficies duras (superficies dentales y materiales de restauración) (García y col., 2012). La enfermedad periodontal, es la causa principal de pérdida de dientes en animales domésticos (Williams, 1997), en un estudio, se estableció que los géneros más frecuentemente aislados de la cavidad bucal corresponden a Staphylococcus y Pasteurella inclusive luego de la terapia antibiótica (Da Fonseca y col., 2011), lo que hace pensar en una resistencia. Pasteurella, llama la atención a razón de estar presente en heridas producidas por mordeduras de caninos (Talan y col., 1999).
Conclusiones
Es claro que, la formación de biofilms es un evento multifactorial, cuyo éxito depende directamente de la superficie escogida, del tiempo de contacto, cepas bacterianas o fúngicas (heterogeneidad) y las condiciones del microambiente en el que se desarrolle. De manera que, se hace necesario considerar tres enfoques: en primer lugar, el mejoramiento de los procesos de limpieza y desinfección o lo que sería más apropiado el desarrollo de nuevos productos que impidan la colonización de superficies e instrumental quirúrgico, en segundo lugar, realizar estudios de actividad enzimática con el fin de destruir la matriz de exopolisacáridos, sino hay matriz no hay biofilm, y en tercer lugar diseñar un método que permita medir la sensibilidad de los antibióticos directamente sobre el biofilm porque los métodos de sensibilidad que se tienen miden la acción sobre células de vida libre.
Estudios sugieren que enfermedades bacterianas o fúngicas que se resisten a los tratamientos terapéuticos o a los mecanismos defensivos inmunológicos se asocian a la colonización y la formación de biopelículas. En este sentido, buscando dar calidad de vida al paciente animal y disminuir carga bacteriana o fúngica que pueda condicionar procesos infecciosos generados por consorcios, es importante implementar programas de valoración microbiológica de ambientes, superficies, equipos e instrumental quirúrgico en conjunción con programas de limpieza y desinfección estandarizados, con el fin de eliminar los consorcios fúngicos o bacterianos que puedan estar presentes.
En la práctica clínica veterinaria, el concepto de biofilm fúngico, bacteriano o mixto, desafortunadamente no tiene la misma importancia que ha adquirido en los procesos infecciosos de humanos, por lo tanto se hace necesario desde la academia introducir este concepto, de manera que el futuro Médico Veterinario al momento de indicar un tratamiento a un paciente animal considere que el proceso infeccioso puede estar direccionado por un consorcio bacteriano, fúngico o mixto, de manera que escoja la mejor opción de tratamiento dirigido a este estilo de colonia estructurada (células bacterianas, fúngicas o mixtas).
Bibliografía
1. Betancourth M, Botero J, Rivera S. (2004). Biopelículas: Una comunidad microscópica en desarrollo. Colombia Médica 35:34-39.
2. Castrillón R, LE, Palma R, A y Padilla D, MC. (2010). Importancia de las biopelículas en la práctica médica. Dermatología Rev Mex 54:14-24.
3. Costerton JW. (1984). The etiology and persistence of cryptic bacterial infections: a hypothesis. Rev Infect Dis 6:608-616.
4. Da Fonseca SA, Galera PD, Brito LD, Perecmanis S y col. (2011). Análise microbiológica da placa bacteriana da doença periodontal em cães e o efeito da antibioticoterapia sobre ela. Ciencia Rural. 4:1424-1429.
5. Dekievit TR, Iglewski, BH. (2000). Bacterial quorum sensing in pathogenic relationship. Infect Immun. 68:4839-4849.
6. Dowd SE, Sun Y, Secor PR, Sun Y. (2008). Survey of bacterial diversity in chronic wounds using pyrosequencing , DGGE and full ribosome shotgun sequencing. BMC Microbiol. 8:43.
7. García CA, Guerra BM, Soca PM, Rodríguez S, Domínguez LHA. (2012). Flora bucal en perros de la raza Beagle con enfermedad periodontal inducida. RedVet 13:1-10.
8. Gardner AJ, Percival SL, Cochrane CA. (2011). Biofilms and role to infection and disease in Veterinary Medicine. Springer Series on Biofilms. 6:111-128.
9. Herrera, MT. (2004). El papel del biofilm en el proceso infeccioso y la resistencia. NOVA. 2:71-80.
10. Jacques M, Aragon M, Tremblay YDN. (2010). Biofilm formation in bacterial pathogens of veterinary importance. Animal Health Research Reviews. 11:97-121.
11. James GA, Swogger E, Wolcott R. (2008). Biofilms in chronic wounds. Wound Repair Regen 16:37-44.
12. Keller L, Surette GM. (2006). Communication in bacteria: an ecological and evolutionary perspective. Nat Rev Microbiol. 4:249-258.
13. Marsh PD. (1999). Microbiologic aspects of dental plaque and dental caries. Dent Clin North Am .43:599-614.
(2011). Bovine mastitis and biofilms. Springer Series on Biofilms. 6:205-221.
15. Neu TR, Verkerke GJ, Herrmann IF, Schutte HK, Van der Mei HC, Busscher HJ. (1994). Microflora on explanted silicone rubber voice protheses: taxonomy, hydrophobicity and electrophoretic mobility. J. Appl. Bacteriol. 76:521-528.
16. Phillips PL, Wolcott RD, Fletcher J, Schultz GS. (2010). Biofilms made easy. Intl Wounds J 1:1-6.
17. Quindós G, Villar-Vidal M, Eraso E. (2009). Actividad de la micafungina contra las biopelículas de Candida. Rev Iberoam Micol 26:49-55.
18. Ramadan HH. (2006). Chronic rhinosinusitis and bacterial biofilms. Curr Opin Otolaryngol Head Neck Surg. 14:183-186.
19. San Jose M, Orgáz B. (2012). Las biopelículas microbianas, un búnker de uso habitual. Monografías de la Real Academia Nacional de Farmacia. Monografía XXXI: 130-145. Disponible en: www.analesranf.com
20. Singh A, Walker M, Rousseau J, Weese JS. (2013). Characterization of the biofilm forming ability of Staphylococcus pseudintermedius from dogs. BMC Vet Res 9:93.
21. Talan DA, Citron DM, Abrahamian FM, Moran GJ, Goldstein EJ. (1999). Bacteriologic analisis of infected dog and cat bites. N Engl J Med 340:85-92.
22. Watnick P, Kolter R. Biofilm. (2000). City of Microbes. J Bacteriol 182:2675–2679.
23. Whitehead AN, Barnard MLA, Slater H. (2001). Quorum-sensing in Gram-negative bacteria. FEMS Microbiol Rev. 25:365-404.
24. Williams RC. (1997). Odontologia. Afecção periodontal. In: ETTINGER, S.J.; FELDMAN, E.C. Tratado de Medicina Interna Veterinária. Moléstias do cão e do gato. 4. ed. São Paulo: Manole, 2, p.1523-1524.