Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Archivos de Medicina Interna
versão impressa ISSN 0250-3816versão On-line ISSN 1688-423X
Arch. Med Int vol.37 no. 3 Montevideo nov. 2015
Caso clínico de interés
Síndrome de Brugada: a propósito de dos casos clínicos
Brugada Syndrome: report of two cases
Dra. Verónica Ventura
Médico Internista. Asistente Clínica Médica
Dra. Mercedes Perendones
Médico Internista. Profesor Adjunto Clínica Médica
Dra. Melina Rubiños
Médico Internista. Asistente Clínica Médica
Dr. Marcos Pintos
Médico Internista. Ex Asistente Clínica Médica
Dr. Gustavo Vega
Médico Cardiólogo.
Recibido: 16/02/15- Aceptado: 1/09/15
Trabajo de: Clínica Médica 2. Facultad de Medicina. UdelaR.
Departamento de Cardiología. Hospital Pasteur. ASSE.
Correspondencia: Verónica Ventura. Larravide s/n esquina Cabrera. Hospital Pasteur.
Resumen: Arch Med Interna 37(3):
Desde su introducción como entidad clínica por los hermanos Brugada en la década del 90, el Síndrome de Brugada ha generado gran interés debido a su asociación con un alto riesgo de arritmias ventriculares y muerte súbita, en pacientes jóvenes con corazón estructuralmente normal. Se trata de una enfermedad genética, de transmisión autosómica dominante que determina alteraciones a nivel de canales iónicos en el tejido miocárdico.
Tiene una presentación electrocardiográfica característica, siendo sus manifestaciones clínicas principales el síncope y la muerte súbita cardíaca. La presencia únicamente del patrón electrocardiográfico, en ausencia manifestaciones clínicas, no debe considerarse como un Síndrome de Brugada sino como un Patrón Brugada.
El único tratamiento disponible y efectivo es la implantación de un cardiodesfibrilador automático definitivo.
Es nuestro interés realizar una actualización del tema en función de 2 casos clínicos que asistimos.
Palabras claves: síndrome de Brugada. Síncope. Muerte súbita cardíaca
Abstract
Since its introduction as a clinical entity by the Brugada brothers in the 90s, the Brugada syndrome has generated great interest due to their association with an increased risk of ventricular arrhythmias and sudden death in young patients with structurally normal heart. This is a dominant genetic disease, autosomal that determines abnormalities in ion channels in myocardial tissue.
ECG has a characteristic presentation, its main clinical manifestations syncope and sudden cardiac death. The presence of electrocardiographic pattern only in clinical manifestations absence should not be considered as a Brugada syndrome but as a Brugada pattern.
The only available and effective treatment is the implantation of a permanent cardioverter defibrillator.
Our interest is an upgrade of the issue based on two clinical cases that we attended.
Keywords: Brugada syndrome. Syncope. Sudden cardiac death
INTRODUCCIÓN
Es un síndrome clínico-electrocardiográfico descrito por Pedro y Josep Brugada en 1992, que se caracteriza por una elevación persistente del segmento ST en las precordiales derechas, con la morfología de un pseudobloqueo de rama derecha. Se asocia a una alta incidencia de arritmias ventriculares y muerte súbita en hombres jóvenes sin cardiopatía estructural evidente, principalmente en situaciones en las que aumenta el tono vagal, como el sueño y el reposo.1-55
La presencia del patrón electrocardiográfico, en ausencia manifestaciones clínicas, no debe considerarse como un Síndrome de Brugada (SB) sino como un Patrón Brugada 6
Su prevalencia se desconoce, pero se estima de 1 a 5 casos cada 10.000 habitantes a nivel mundial. Es más frecuente en pacientes de sexo masculino (8 o 9: 1), con una media edad de 40 +/- 22 años, y de raza caucásica y/o asiática 6- 8 Los eventos arrítmicos en el SB pueden ocurrir a cualquier edad. Se cree que es responsable del 4-12% de las muertes súbitas en pacientes jóvenes y hasta un 20% de las muertes súbitas en corazones estructuralmente sanos, con una mortalidad de 10% anual. 7, 9
Es una enfermedad genética, de transmisión autosómica dominante, clásicamente descrita como secundaria a la mutación del gen SCN5A ubicado en el cromosoma 3, que codifica la subunidad alfa del canal de sodio cardíaco. Esta mutación se encuentra presente en aproximadamente 25% de los casos, lo que sugiere que la base genética de esta enfermedad es heterogénea. Hasta el momento se han descripto más de 100 mutaciones del gen, todas ellas generan una pérdida de la función del canal de sodio. Hay también descritos casos esporádicos.
En los últimos años se han reconocido otros cuatro genes relacionados con esta enfermedad, si bien aún se desconoce de qué forma contribuyen a la misma (GPD-1L, CACNA1c, CACNA2b, y KCNE3). 7, 10
Clínicamente se manifiesta por episodios de sincope o muerte súbita dependiendo de si la taquicardia ventricular polimorfa rápida o fibrilación ventricular finaliza espontáneamente o persiste. Aproximadamente 25% de los pacientes con muerte súbita han presentado previamente un sincope.1, 10
Se reconocen tres patrones electrocardiográficos (Figura 1). El patrón tipo I, se caracteriza por una elevación descendente del segmento ST ≥ 2mm (en domo) en más de una derivación precordial derecha, seguido por una onda T negativa. El tipo II, está caracterizado por una elevación del segmento ST ≥ 2 mm en precordiales derechas, con una morfología en silla de montar, seguido por una onda T positiva o bifásica. El tipo III se caracteriza por una elevación del segmento ST, en domo o en silla de montar, menor o igual a 1 mm. 4, 5, 9, 11, 12
Los tres patrones pueden observarse en el SB, incluso en el mismo paciente en momentos distintos, pero sólo el tipo I es diagnóstico. 1, 3
El diagnóstico se realiza cuando el patrón ECG tipo I se asocia a por lo menos uno de los siguientes criterios clínicos: fibrilación ventricular (FV) o taquicardia ventricular polimórfica (TV) documentadas, inducibilidad de arritmias ventriculares durante estudio electrofisiológico (EEF), síncope o respiración agónica nocturna, antecedentes familiares de muerte súbita en menores de 45 años o patrón ECG tipo I en otros miembros de la familia. 1, 2, 3, 4, 6, 11 También se considera diagnóstico cuando un patrón ECG tipo II o tipo III pasa a ser de tipo I luego de la administración de bloqueadores de canales de sodio en presencia de 1 o más de los criterios clínicos previamente descriptos. 1, 12
Las manifestaciones electrocardiográficas en el SB son dinámicas, como ya comentamos pueden presentarse los tres patrones ECG en el mismo paciente en distintos momentos e incluso puede ser normal transitoriamente, por lo que en individuos en los que se sospecha esta enfermedad, se cuenta con pruebas de provocación farmacológica como herramienta diagnóstica. La ajmalina es el fármaco más eficaz para el diagnóstico de síndrome de Brugada, con una sensibilidad de 80% y una especificidad de 94%, la flecainida tiene una sensibilidad de 77% y una especificidad de 80%, siendo la procainamida el menos efectivo. El test de provocación se considera positivo, si aparece o se acentúa un patrón ECG tipo I.1-4
En cuanto a la estratificación de riesgo, existe consenso en que la muerte súbita recuperada presenta alto riesgo de recurrencia, por lo que constituye una indicación indiscutible para la colocación de un cardiodesfibrilador implantable (CDI) para prevención secundaria.
La presencia de síncope previo, un patrón ECG tipo I de forma espontánea y el sexo masculino son marcadores de peor pronóstico. 3, 4 El valor pronóstico de la inducibilidad de TV/FV en el EEF continua siendo motivo de debate. 2, 3, 4, 8, 13
El único tratamiento eficaz en el SB es la colocación de un CDI. 1, 2, 4, 8, 10
Su colocación para la prevención secundaria de pacientes con muerte súbita recuperada, es indiscutible. El debate actual se centra en cuando está indicada la implantación del dispositivo para prevención primaria.8 Se recomienda en a) Pacientes sintomáticos con un patrón ECG tipo I, ya sea espontáneamente o luego de la administración de agentes bloqueadores de canales de sodio, b) Pacientes asintomáticos con un patrón ECG tipo I espontáneo o aquellos con antecedentes familiares de muerte súbita y patrón tipo I luego del test de provocación, que presenten TV/FV en el EEF. 1, 2, 4
Farmacos antiarrítmicos del tipo de la amiodarona o B bloqueantes son inefectivos. 2, 4, 8
CASO CLÍNICO 1
46 años, sexo masculino, sin antecedentes personales a destacar. Sin historia familiar de muerte súbita. Consulta en emergencia del Hospital Pasteur, por sincope precedido por síndrome neurovegetativo, estando en reposo. Sin otra sintomatología. Al examen físico se constató paciente lúcido, hemodinamia estable, con un ritmo regular de 70 cpm, sin soplos ni elementos de falla cardíaca. En el ECG se destacaba una elevación del segmento ST de 2 mm con una morfología en silla de montar en las derivaciones V1 a V3, y un pseudo bloqueo de rama derecha, por lo que se lo interpretó como un patrón de Brugada tipo II. Ecocardiograma transtorácico sin alteraciones. Se realizó el diagnóstico clínico presuntivo de SB realizándose para su confirmación, un test de provocación con flecainida (400 mg v/o única dosis), que resultó positivo al evidenciarse el pasaje del patrón ECG tipo II al tipo I. Dado que la presentación clínica era atípica (sincope con pródromo), se completó la valoración diagnóstica con un estudio electrofisiológico.
El mismo resultó positivo al inducirse una FV con dos extraestímulos. Figura 2. Como tratamiento se procedió a la colocación de un CDI con buena evolución.
CASO CLÍNICO 2
73 años, sexo masculino, con antecedentes personales de hipertensión arterial sin control ni tratamiento, y dos episodios de síncope en los tres años previos.
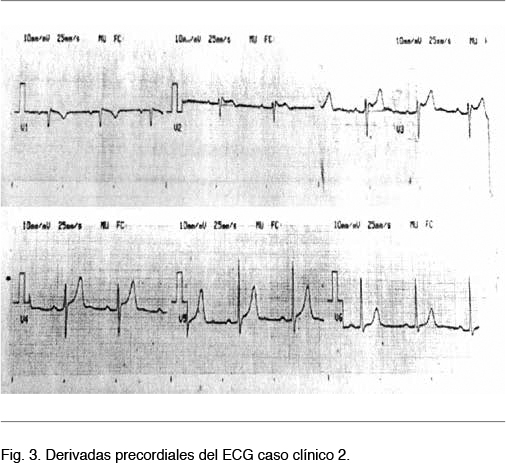
Consultó en emergencia del Hospital Pasteur por un síncope sin pródromos de reposo. Sin otra sintomatología. Al examen físico se constató un paciente lúcido, normotenso, hemodinámicamente estable, con un ritmo regular de 76 cpm, sin soplos ni elementos de falla cardíaca. Se realizó un ECG que evidenció una elevación del segmento ST de menor de 1 mm en domo a nivel de V1, por lo que se interpretó como un patrón de Brugada tipo III. Figura 3. Ecocardograma transtorácico: hipertrofia ventricular izquierda (HVI) sin otras alteraciones.
Para confirmar el diagnóstico se realizó un test de provocación con flecainida (400 mg v/o única dosis), que resultó positivo al constatarse la aparición de un patrón ECG tipo I en V1 y V2.
Como tratamiento se procedió la colocación de un CDI, con buena evolución posterior.
DISCUSIÓN
El SB es una enfermedad poco frecuente y con una alta mortalidad, por lo que es de gran importancia conocerla y sospecharla en pacientes con clínica compatible.
En los casos analizados, el síncope fue la manifestación clínica inicial, pero ambos presentaban características atípicas que podían dificultar el planteo diagnóstico. En el caso 1 el síncope con pródromo puede llevar a interpretar el fenómeno como neuromediado y no cardiogénico, sabemos que si bien no es la forma de presentación habitual, se han descripto casos aislados de sincope con pródromo en pacientes con SB.
En el caso 2 la edad avanzada del paciente puede alejar el planteo clínico de SB ya que el mismo predomina en pacientes con una franja etaria entre 40 y 50 años, aunque es posible que se presente a cualquier edad.
Los patrones electrocardiográficos fueron de tipo II y de tipo III respectivamente, por lo que fue necesario realizar un test de provocación farmacológico que puso en evidencia el patrón de tipo I, y por tanto se arribó al diagnóstico. Nuestros pacientes cumplían claramente con los criterios para la colocación de CDI, por lo que se procedió a su implantación, con buena evolución.
Con el mejor conocimiento de esta patología, el correcto diagnostico y estudio tanto del paciente como de sus familiares, mejoraremos las estrategias de prevención y tratamiento oportuno con la consecuente disminución de la mortalidad.
BIBLIOGRAFIA
1. Begoña B, Brugada J, Brugada R, Brugada P. Sindrome de Brugada. Rev Esp Cardiol. 2009; 62:1297-315.
2. Antzelevitch C. Brugada Syndrome. Pacing Clin Electrophysiol. 2006;29:1130-59.
3. Antzelevitch C, Viskin S. Brugada Syndrome: Cellular Mechanism and Approaces to Thera py. In: Gussak I, Antzelevitch C, editors. Electrical Diseases of the Heart. London: Springer, 2008: 500-535.
4. Antzelevitch C, Brugada P, Borggrefe M, Brugada J, Brugada R, Corrado D, et al. Brugada Syndrome: Report of the Second Consensus Conference: Endorsed by the Heart Rhythm Society and the European Heart Rhythm Association. Circulation 2005;111:659-70.
5. Miyazaki T, Mitamura H, Miyoshi S, Soejima K, Aizawa Y, Ogawa S. Autonomic and antiarrhythmic modulation of ST segment elevation in patients with Brugada syndrome. J Am Coll Cardiol 1996, 27: 1061-1070.
6. Perez Riera A, Fortunato De Cano S, Fleury De Padua Neto L, Schapachnik E. Sindrome de Brugada: Nuevos conceptos y expectativas futuras. Rev. argent. cardiol. 2001;69:652-662.
7. García-Castro M, García C, Reguero J, Miar A, Rubín J, Alvarez V, et al. Espectro mutacional del gen SCN5A en pacientes españoles con síndrome de Brugada. Rev Esp Cardiol. 2010;63:856-9
8. Rossenbacker T, Priori S. The Brugada syndrome. Curr Opin Cardiol. 2007;22:163-170.
9. Gehi A, Duong T, Metz L, Gomez J, Mehta D. Risk Stratification of Individuals with the Brugada Electrocardiogram: A Meta-Analysis. J Cardiovasc Electrophysiol. 2006;17:577-583.
10. Pfahnl AE, Viswanathan PC, Weiss R, Shang LL, Sanyal S, Shusterman V, et al. A sodium channel pore mutation causing Brugada syndrome. Heart Rhythm. 2007;4:46-53.
11. Wilde AAM, Antzelevitch C, Borggrefe M, Brugada J, Brugada R, Brugada P, et al. Proposed diagnostic criteria for the Brugada syndrome. Circulation. 2002;106:2514-2519.
12. Benito B, Brugada J, Brugada R, Brugada P. Brugada syndrome or Brugada electrocardiogram?. Authors’ reply. J Am Coll Cardiol. 2009;53:1569-70.
13. Napolitano C, Priori SG. Brugada syndrome. Orphanet J Rare Dis. 2006,1:35.