Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Archivos de Medicina Interna
versão impressa ISSN 0250-3816versão On-line ISSN 1688-423X
Arch. Med Int vol.37 no. 3 Montevideo nov. 2015
Artículo original
Importancia del examen médico preventivo para el diagnóstico precoz de enfermedad renal en Uruguay.
Programa Nacional de Salud Renal
Importance of preventive medical examination for early diagnosis of renal disease in Uruguay.
The National Renal Health Program
Dr. Pablo Ríos Bruno
Comisión Asesora en Salud Renal. Médico del Estudio Piloto.
Médico del Primer Nivel de Atención. Nefrólogo
Dra. Emma Schwedt
Profesora Agregada de Nefrología. Nefróloga. Internista. Comisión Asesora en Salud Renal. Docente Calificado Honorario. Facultad de Medicina (UDELAR).
Dra. Laura Solá Schnir
Profesora. Adjunta Departamento de Medicina Preventiva y Social. Directora División Epidemiologia. DIGESA-Ministerio Salud Pública. Comisión Asesora en Salud Renal.
ISN Councilor & Latin America Committe Co- Chairman. Coordinadora Comité de Salud Renal. SLANH
Dra. Liliana Gadola
Profesora Agregada de Nefrología - Comisión Asesora en Salud Renal. Docente Facultad de Medicina (UDELAR). Internista. Nefrólogo. Profesora Agregada de Fisiopatología.
Dra. Nancy de Souza
Comisión Asesora en Salud Renal. Nefrólogo. Médico del Primer Nivel de Atención y Enfermedad Renal Crónica avanzada. Hospital Maciel. Delegado Sociedad Uruguaya de Nefrología.
Dra. Verónica Lamadrid
Comisión Asesora en Salud Renal. Internista. Nefróloga. Delegada de Federación Médica del Interior. Médico del Primer Nivel de Atención y Enfermedad renal Crónica Avanzada, Canelones.
Dr. Orlando Canzani
Nefrólogo. Representante de ASSE. Nefrólogo del Primer Nivel de Atención y Enfermedad Renal Crónica Avanzada, Florida.
Académico de Medicina. Nelson Mazzuchi Fratchez
Comisión Asesora en Salud Renal. Profesor Agregado de Nefrología Honorario. Facultad de Medicina. (UDELAR).
Recibido: 10/04/15 Aceptado: 05/10/15
Departamento e Institución responsables: Comisión Asesora de Salud Renal. Ministerio de Salud Pública. Fondo Nacional de Recursos. Sociedad Nefrología del Uruguay. Facultad de Medicina. UdelaR.
Autor de contacto: Dr. Pablo Ríos Bruno. San Fructuoso 1220. Montevideo, Uruguay. E-Mail:pablo.rios.78@gmail.com
RESUMEN: Arch Med Interna 37(3):
Introducción: El Programa Nacional de Salud Renal (PNSR) mostró que la enfermedad renal crónica (ERC) puede estabilizarse en la evolución.
Objetivo: evaluar el tamizaje de Enfermedad Renal Crónica presuntiva (ERCp) en población ambulatoria de una Clínica Preventiva con tirilla reactiva para proteinuria (TPu) y determinación de creatinina.
Método. Estudio observacional, descriptivo, de corte transversal, entre 1/1/2008 y 31/12/2012 en 83.912 personas que se realizaron Carné de Salud (edad media =34.4años). Se consideró proteinuria positiva (Pu+) si TPu ≥1+ o ≥ 0.3 g/l. Se realizó TPu a todos y dosificación de creatinina para estimación Filtrado Glomerular (TFGe) en subpoblación con factores de riesgo (FR) como hipertensión o diabetes. Se evaluó proteinuria según edad y presencia o no de FR. En 11.161 individuos con determinación de creatinina se estimó el TFGe por fórmula CKD-EPI, (edad media=44.7años) se estimó prevalencia de ERCp mediante Pu+ TFGe<60 ml/min aisladas o en conjunto según grupos con FR, en base de datos no identificados de la Clínica Preventiva. Se utilizó el software estadístico SPSS 15.0 y regresión logística para análisis multivariado.
Resultados: La prevalencia total de Pu+ fue de 6% (5.5% en grupo sin FR, 6.7% en hipertensión-sin-diabetes, 9.2% en diabetes-sin-hipertensión y 13.6% con ambos FR). Se desconocen falsos positivos. La prevalencia de TFGe<60 ml/min fue de 1.8%, siendo edad e hipertensión FR independientes para TFGe descendido. Considerados en conjunto Pu+ y TFGe<60 ml/min la prevalencia de ERCp alcanza 9.2%. Los FR aumentan la frecuencia de ERCp (p<0.05). Con Pu+ aislada se detecta ERCp entre el 85-90% según tengan o no FR; por grupos etarios la Pu+ aislada detecta el 100% de individuos con ERCp <20 años, es >90% en <50 años y cae a 30% en >70 años, donde cobra importancia la TFGe: 21.9% en con FR.
Conclusiones: La población del Carné de Salud es útil para el tamizaje de ERCp temprana. Este estudio permitió identificar los mejores marcadores de ERCp para segmentos diferentes de población: la Pu+ aislada detecta ERCp en más del 90% de las personas <50 años y la TFGe adquiere importancia en añosos.
Palabras claves: Tamizaje, ERC, Proteinuria, tasa FG, Diabetes, Hipertensión
ABSTRACT: Arch Med Interna 37(3):
Introduction: The National Renal Health Program showed that chronic kidney disease (CKD) can be stabilized in the outcome.
Objective: To assess screening Chronic Kidney Disease presumptive (pCKD) in an outpatient population of a Preventive Clinic with dipstick proteinuria (TPu) and/or eGFR <60 ml/min.
Method: It is an observational, descriptive and cross sectional study. Between 1/1/2008 and 12/31/2012 was performed medical check to 83.912 individual (average age=34.4 years) from a Preventive Clinic with a proteinuria by TPu. In a selective population with predominant hypertension and diabetes (n 11.161 individuals, age 44.7 years odl) was performed determination of creatina and eGFR was estimated by CKD-EPI formula. pCKD prevalence was assessed by Pu + and/or eGFR<60 ml/min/1.73m2 alone or combined. We analyzed the risk factors (RF) for pCKD with SPSS 15.0 statistical software and logistic regression was used for multivariate analysis.
Results: The prevalence of Pu + in total population was 6% (5.5% in the reference group, 6.7% in hypertension-without-diabetes, 9.2% in diabetes-without-hypertension and 13.6% in both RF group); the risk of Pu+ was increased in the previous groups (p < 0.05). Pu + false positives were unknown. The prevalence of eGFR< 60 ml/min was 1.8%, and age and hypertension were independent risk factors. When Pu + and/or eGFR<60 ml/min are considered together, the prevalence of pCKD reaches 9.2%. RF increases the frequency of pCKD (p < 0.05). With isolated Pu +, pCKD is detected between 85-90% according to whether or not they have RF; by age groups the isolated Pu + detects 100% of individuals with pCKD <20 years, is > 90% in those with <50 years and drop to 30% at 70 years or more, where is relevant the eGFR: 21.9% in RF group.
Conclusions: The Preventive Clinic population is a useful place for screening early pCKD. This study identified renal markers of pCKD for different population segments: isolated Pu + detects pCKD in more than 90% of people < 50 years and the eGFR makes it in aged people.
Key words: screening, CKD, Proteinuria, GFR, Diabetes, Hypertension.
INTRODUCCIÓN
La enfermedad renal crónica (ERC) reúne la mayoría de los criterios de tamizaje recomendados por la Organización Mundial de la Salud (OMS). Es un grave problema de salud pública, ya que tiene una fase silenciosa sólo reconocida por exámenes de laboratorio. Los test para el tamizaje son simples, no costosos y ocasionan mínimas molestias. Hay tratamientos eficaces para prevenir sus factores de riesgo (FR), enlentecer la progresión, prevenir complicaciones y eventos cardiovasculares que condicionan la muerte prematura (1-9).
Los marcadores de lesión renal son albuminuria o proteinuria y determinación de creatinina sérica para estimar la tasa de filtrado glomerular (TFGe) (3, 10).
Si bien el cociente albuminuria/creatininuria (A/C) en una muestra de orina es el test más recomendado (11-14) con alta sensibilidad/especificidad, el cociente proteinuria/creatininuria (P/C) y la proteinuria detectada por tiras reactivas (TPu) son predictores de riesgo muy aceptables (15-19).
Se encontró ser costo-efectivo realizar tamizaje ERC en poblaciones de riesgo (2, 20-23) pero el tamizaje en población general asintomática no es aceptado por muchos investigadores (24-28).
En Japón existen programas anuales de tamizaje mediante detección de proteinuria TPu en todos los adultos que trabajan desde 1972 y en niños en edad escolar desde 1973, con el agregado de creatinina sérica en residentes > 40 años de edad desde 1992. Han demostrado que la TPu es buen predictor de insuficiencia renal extrema (IRE) (15, 29 -32). Kondo et al, encontraron que era costo-efectivo realizar tamizaje de ERC usando TPu o creatinina en poblaciones con alta prevalencia de ERC como la japonesa (33).
En Uruguay, existe un cheque médico preventivo (Carné de Salud) para trabajadores y deportistas, obligatorio desde 1937, que se realiza con cada 2 años, a través de una Clínicas Preventiva pública (Clínica Preventiva) de la División de Salud Ocupacional y Ambiental del Ministerio de Salud Pública (34) y a través de otras clínicas privadas autorizadas (35).
El Carné de Salud incluye medida de presión arterial, peso, talla y exámenes paraclínicos: colesterolemia, glicemia, VDRL y examen de orina por PTu entre otros estudios, también detecta cáncer de mama y colon.
Uruguay cuenta desde 2004 con un Programa Nacional de Salud Renal (PNSR) que capta pacientes generalmente añosos (promedio 67 años) y con ERC fundamentalmente en etapa III (36). Por iniciativa del PNSR, en 2008 se realizó un estudio Piloto que agregó determinación de creatininemia para estimar la TFGe en Carné de Salud (37). El estudio demostró que para captar un paciente con TFGe < 60 ml/min/1.73 m2 se deben estudiar 3 veces menos individuos si se realiza a poblaciones de riesgo comparado con el tamizaje del resto de la población (27 individuos versus 79 respectivamente).
Frente a ello, en el año 2009, el Ministerio de Salud Pública (MSP) decretó la obligatoriedad de realizar la determinación de Creatinina sérica para personas con FR en el Carné de Salud de los trabajadores de Uruguay.
En el Consenso Nacional de Proteinuria de 2011 se mantuvo la determinación de proteinuria por TPu para el tamizaje de ERC: si la tirilla es (+) se debe cuantificar cociente proteinuria/creatininuria (P/C), si es negativa se debe hacer el cociente Albuminuria/creatininuria (A/C) solo en diabéticos (38).
El Carné de Salud aún no ha incorporado la determinación de A/C para todos los individuos diabéticos y ni se realiza tampoco en todos los hipertensos.
Objetivos
Los objetivos de este trabajo son describir la prevalencia de proteinuria y/o TFG estimado < 60 ml/min/1.73 m2 y el riesgo de Enfermedad Renal Crónica (positivos ambos marcadores renales) en poblaciones en usuarios del Carné de Salud.
Material y método
El estudio se realizó en usuarios ambulatorios de la Clínica Preventiva que concurrieron a realizar el Carné de Salud entre enero 2008 y diciembre 2012. Se manejaron bases con datos no identificables por razones éticas y de acuerdo a la normativa legal vigente. La metodología de trabajo de la Clínica Preventiva y la obtención de las distintas variables seleccionadas se detalla en trabajo recientemente publicado de rangos referidos de KEEP (39).
Es un estudio observacional, descriptivo y de corte transversal. Un número menor de individuos que cuentan con seguimiento longitudinal.
Definiciones
Hipertensión arterial: los que manifiestan antecedentes de hipertensión o reciben medicación anti- hipertensiva o comprobación de presión arterial (PA) elevada definida por presión arterial sistólica (PAS) ≥130 mmHg o presión arterial diastólica (PAD) ≥ 80 mmHg para las personas con historia de diabetes o posible ERC o PAS ≥ 140 mm Hg o PAD ≥ 90 mm Hg para las personas sin la historia de diabetes o de ERC. (3, 39).
Diabetes Mellitus: individuos que manifiestan antecedentes de diabetes o de recibir medicación anti-diabética o la comprobación de glicemia elevada definida por glucosa en ayuno ≥ 126 mg/dl en el Carné de Salud. (39).
Categorías de índice de masa corporal (IMC) (kg/m2): peso insuficiente: <18.5; peso normal: 18.5-24.9; sobrepeso: 25–29.9: obeso: 30–39.9; y extremadamente obeso u obesidad mórbida: ≥ 40 (39).
Colesterolemia elevada: colesterol con 12 hs de ayuno ≥200 mg/dl. HDL descendido: si es < de 40 mg/dl en el hombre y < 45 mg/dl en la mujer. (39).
Proteinuria positiva: Si TPu era ≥ a 1+ (0,3 g/lt).
TFGe descendido: Si < 60 ml/min/1,73m² estimado con la fórmula CKD-EPI-2009 (40).
Enfermedad renal Crónica: la persistencia de proteinuria > 0.3 g/L y/o TFGe < 60 ml/min/1.73 m2 por un período mayor de tres meses (5).
La TFGe se estimó con la fórmula CKD-EPI 2009 (40) porque es la más segura en población supuestamente sana y tiene la mitad de sesgo que la MDRD (41).
La Clínica Preventiva adhiere al Programa Nacional de Estandarización de la Creatinina, que habilita su uso y es la fórmula adoptada por las recientes Guías de Práctica Clínica (42).
Enfermedad Renal crónica presuntiva (ERCp): La detección de valores alterados en la proteinuria o TFGe en primera ocasión indican probabilidad de ERC, por lo que es un diagnóstico presuntivo (ERCp).
Los test de tamizaje no deben ser obligatoriamente diagnósticos (2), por lo que los individuos con diagnóstico de ERCp, por norma, fueron enviados al médico de familia y debieron traer la certificación médica de estar en estudio para confirmar diagnóstico, pero los resultados de esta reevaluación no están disponibles en todos los usuarios. Un número menor de individuos optaron por repetir los estudios en la misma Clínica Preventiva y pudieron ser analizados longitudinalmente, presentando proteinuria o TFGe persistentes por más de 3 meses (certificación diagnóstica de ERC por definición).
Determinaciones analíticas para tamizaje de enfermedad renal crónica
Determinación de proteinuria se realizó usando la tira reactiva Bayer Multistix 10 SG con el analizador Siemens Clinitek 50. La sensibilidad analítica para las proteínas es 150-300 mg/L. La lectura fue automatizada. Los TPu positivos (≥1+) fueron confirmados y cuantificados por determinación cuantitativa con la técnica de Cloruro de Bencetonio en medio básico (Hitachi 902 Urinary / Protein) en la misma muestra de orina. Se consideró Pu+ (≥ 0.3 g/L) cuando fue corroborada por ambos métodos (se desconoce si esta modalidad disminuye los falsos positivos).
La determinación de la creatinina del suero fue realizada con la técnica cinética de Jaffé compensada (sensibilidad analítica 0.1 mg/dl) con un analizador Hitachi 902 de Roche Diagnostics. Se utilizó un kit de creatinina ajustado a un estándar IDSM (espectrofotometría de masas por dilución de isótopos) (Crea Plus, Roche Diagnostics).
Análisis estadístico
Las variables normalmente distribuidas fueron expresadas como media ± desvío estándar y se compararon por la prueba de “t” o ANOVA. Las variables no paramétricas fueron expresadas como mediana y rango intercuartilo y se compararon por la prueba de Mann-Whitney. Las variables categóricas fueron expresadas como proporciones e intervalo de confianza (IC 95%), y comparadas por la prueba de Chi-cuadrado. Los factores de riesgo de ERCp y ERC se analizaron mediante regresión logística binaria. Todos los valores de p < 0.05, para dos colas, fueron considerados significativos.
RESULTADOS
Características de la población controlada en Carné de Salud
Entre el 1/1/2008 y el 31/12/2012 se realizaron 103.966 Carné de Salud en la Clínica Preventiva a 83.912 personas. Todos cuentan con TPu por estar incluida la orina en el estudio (Tabla 1). La edad promedio fue 34,1 años (rango 15- 89 años), el 95.9% eran < 60 años, sexo femenino 52,2%. El 82.1% de los individuos no tenía FR o enfermedades de riesgo.
La prevalencia de Diabetes fue 3,9%. Declararon ser diabéticos 1,8%, los restantes se diagnosticaron por hallazgo de glicemia elevada en el Carné de Salud (2.0%).
La prevalencia de hipertensión arterial fue 16,5 % (auto-informada en 9,4% y hallazgo de PA elevada en 7,1 %). El 2,3 % de los individuos asociaban ambos FR y 82.1 % de los individuos no presentaba FR o Enfermedades de Riesgo y tanto la hipertensión como la diabetes aumentaron su prevalencia con la presencia de obesidad.
El 28.2% presentaron sobrepeso y 17,6 % obesidad.
La determinación de colesterol fue elevada en 23,7 % de los individuos controlados y el HDL estaba descendido en el 44%.
La prevalencia no ajustada de FR es menor que la encontrada en la Primera Encuesta Nacional de Factores de Riesgo de Enfermedades Crónicas no Trasmisibles realizada en Uruguay en 2006 (43), posiblemente por la diferencia de edad entre las poblaciones (34 años versus 45 años). Fort et al (35) en una muestra similar seleccionada de usuarios del Carné de Salud de la misma clínica (se descartaron los sin datos), encuentran que la prevalencia de los mismos FR ajustados a edad de la población del país, no es tan diferente de la encontrada en encuesta STEPS (34).
Características de la sub-población con determinación de creatininemia
Si bien todos tienen determinación de TPu, existe una sub-población de 11.161 individuos donde se agregó determinación de creatinina sérica por el decreto presidencial. Ello incluye a la población del estudio piloto antes mencionado, donde se realizó PTu y creatininemia a todos los individuos en forma consecutiva durante 2 meses. Posteriormente, según recomendaciones de la CASR, se agregó la determinación de creatininemia a poblaciones con FR reconocidos (diabéticos e hipertensos ya sean conocidos o nuevamente captados).
Esta subpoblación tenía mayor edad (44,7 vs 34,4 años) y presentaba una mayor prevalencia de diabetes (24,3 vs 3,9%), de hipertensión (61,9 vs 16,5 %), de sobrepeso-obesidad (75 vs 45,8 %) y de colesterol elevado (37,5 vs 23,5%) que la población total. Por tanto esta subpoblación no representa a la población total pero permite analizar prevalencia de ERCp en diferentes poblaciones de riesgo.
En ambas poblaciones (total y subtotal con creatinina) se crearon 4 grupos de pacientes: hipertensos sin diabetes (N=5216, 46.7%), diabéticos sin hipertensión (N= 881, 7.9%), con ambos FR (N=1689, 15.1%) y otro grupo sin FR (N=3375, 30.2%) que se utilizó como grupo de referencia para estimar riesgo de ERC en poblaciones de riesgo, a semejanza del estudio NHANES III (10), en el estudio de Hallan (44) y Tonelli (45).
Prevalencia de Proteinuria aislada en tirilla de orina. La prevalencia de Pu+ en la población total fue 6% (n= 4997) (Tabla 2) y en la sub-población con creatinina fue 7.7 % (n= 859). La prevalencia de Pu+ varía en forma importante según presencia de FR. La prevalencia de Pu+ no se modificó sustancialmente con la edad en nuestro estudio. En el análisis mediante regresión logística binaria, tomando como referencia el grupo sin HTA ni diabetes y ajustando para edad y sexo, el riesgo relativo de padecer Pu+ fue 1.58 (IC 95% 1,45 -1,72) en el grupo de Hipertensos sin diabetes, de 2.11 (IC 95% 1,76 -2,53) en diabéticos sin hipertensión y de 4.34 (IC 95% 3,75 - 5,04) en diabéticos con hipertensión. Así mismo el riesgo es mayor para el sexo femenino: 1.19, (IC 95% 1,12-1,25) en relación al masculino.
Prevalencia de Filtrado Glomerular descendido (< 60 ml/min/1.73 m2) en sub-población de 11.161 individuos con determinación de creatinina. La prevalencia de TFGe <60 se modifica sustancialmente con la edad en todas los grupos de FR, con un incremento importante a partir de los 60 años (Tabla 3). La prevalencia TFGe < 60 también se modifica según FR (Tabla 4). En el análisis multivariado se asociaron independientemente con TFGe descendido solamente la edad (RR 1,096: IC 95% 1,073 - 1,103) y la hipertensión (RR 1,524: IC 95% 1,017 - 2,285), no así la diabetes aislada.
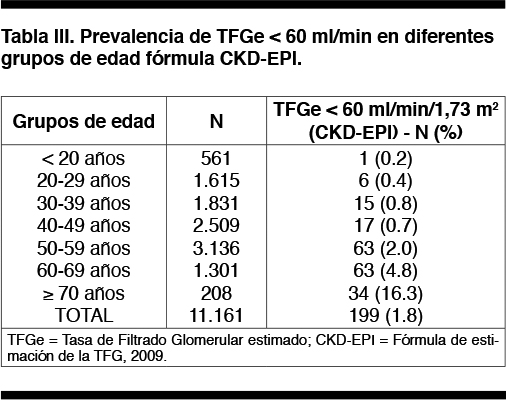
Prevalencia conjunta de ERCp (Proteinuria en tira de orina > 300 mg/L y TFGe < 60 ml/min/1.73 m2); ambos parámetros positivos. Cuando consideramos ERCp según Pu+ y caída de la TFGe la prevalencia alcanza a 9.2 %. Los FR estudiados aumentaron significativamente la frecuencia de ERCp. (Tabla 5). En el análisis multivariado, ajustado para edad, género y FR, la edad (RR 1,006 IC 95% 1,000 - 1,011), la hipertensión (RR 1,55 IC 95% 1,34 - 1,82) y la diabetes (RR 2,03 IC 95% 1,76 - 2,33) presentaron riesgo independiente de ERCp.
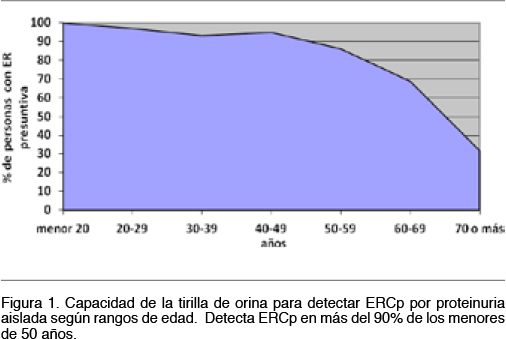
Significado de la primera determinación de proteinuria y creatinina en el tamizaje de Enfermedad Renal presuntiva. Para este análisis se utilizó la sub-población con creatininemia (N= 11.161). Como podemos ver en la Tabla 6, el porcentaje de personas con ERCp que se pueden detectar utilizando solamente la TPu va del 85 al 90% según tengan o no FR. Si lo analizamos por grupos etarios y realizáramos únicamente proteinuria para el tamizaje podríamos detectar el 100% de los pacientes con ERCp en< 20 años. En < 50 años este porcentaje siempre es > 90% y baja al 31.9% en los > 70 años pues en ellos es mas frecuente el diagnóstico de ERC por el hallazgo de TFGe disminuído. En la Figura 1 se puede ver el valor que podría tener la proteinuria cuando se utiliza como único examen para detectar ERCp.
DISCUSION
El valor de la tirilla para detectar proteinuria y la determinación de creatininemia para estimar la TFG, en el diagnóstico de ERCp en el Carné de Salud no había sido analizado en nuestro país según los criterios actuales de diagnóstico de la ERC considerando la positividad de ambos marcadores de lesión y función renal y no c/u por separado.
Analizamos en este estudio una población de 83.947 individuos, que si bien no es representativa de la población nacional, sí representa un número importante de personas laboralmente activas del país (en el año 2010 había 1.400.000 trabajadores activos en Uruguay), pertenecientes mayoritariamente al departamento de Montevideo.
Niveles de Proteinuria aislada.
En el análisis de población total llama la atención la aparición de Pu+ en el 5,5% de los pacientes del grupo sin FR. Esto podría corresponder a falsos positivos, proteinurias transitorias o a personas con glomerulopatías (GP). La tasa de incidencia de GP primarias y secundarias biopsiadas en Uruguay ha ido en aumento. La incidencia de GP primarias y secundarias con biopsia en Uruguay es similar a la comunicada en los registros Español e Italiano (Mazzuchi y col.) (46).
Las GP primarias pasaron de 25.3 pmp en el período 2000-2003 a 44.3 pmp en el período 2010 a 2012. Las GP secundarias pasaron de 14.2 pmp a 16.6 pmp en los mismos períodos (47). También ha aumentado significativamente en Uruguay la incidencia de GP como causa de IRE (48). En el período 1981-1985 la tasa de incidencia de GP fue 13.4 pmp y en el período 2007-2008 fue 18 pmp (CI 95% 14.9-21.6) según reportó el Registro Uruguayo de Diálisis (49). En una comunicación personal los Dres. Hena Caorsi y Pablo Ambrosoni (Uruguay 1991) reportaron una frecuencia de proteinuria de 3% en 31.088 individuos estudiados en un período de 6 meses en la misma Clínica Preventiva. Pero la población era de edad algo menor, la calidad de las tirillas era diferente y prácticamente se detectaron la mitad de personas con proteinuria que las que comunicamos actualmente.
La prevalencia de proteinuria reportada en diferentes estudios varía de acuerdo a las poblaciones seleccionadas (edad, género, hipertensión, diabetes, comorbilidad cardiovascular), al test de tamizaje (albuminuria o proteinuria), al sistema de cuantificación (índice A/C o P/C o tirilla de albuminuria semi-cuantitativa) utilizados y al tipo de muestra de orina (aislada, proteinuria de 24 hs) por lo cual es muy difícil comparar resultados entre estudios (47,50).
En países asiáticos como Japón (n = 53.851) la prevalencia de proteinuria por tirilla ≥1+, similar al método empleado en nuestro estudio, variaba con la edad y fue 1,0% para 40-49 años, 1.4% para 50-59 años, llegando a 5.1% en 80 o más años (29). Nosotros no encontramos una variación etaria.
En China (n= 1999) la prevalencia de proteinuria ≥1+ fue 2,8%, llegando en diabéticos a 4% (51). En Nepal (n=8397) la prevalencia de proteinuria ≥1+ fue 5,4% (51) y en Mongolia (n= 993) 10,3% (51).
En Australia, en el estudio Ausdiab (18) se encontró una prevalencia de proteinuria (índice P/C ≥200 mg/g) de 2,4%. Solo 0.9% de éstos tenían una proteinuria > 400 mg/g. La edad, la diabetes y la hipertensión se asociaron con proteinuria igual a lo que sucede en nuestro estudio.
En el estudio NHANES III, realizado en individuos ambulatorios de entre 20 y 64 años (n= 14.622 personas), se encontró una prevalencia de A/C mayor a 334 mg/g, en una única muestra, de 1%. En diabéticos llegaba a 6,1%, en hipertensos no diabéticos 1,7% y en no hipertensos no diabéticos 0,3% (10).
Es probable que una segunda determinación de proteinuria disminuyan los falsos positivos y este valor se acerque a la prevalencia real de pacientes con proteinuria persistente. En esta misma Clínica Preventiva en 1056 individuos que tuvieron una primera TPu (+) la repitieron (promedio a los 2 años) y solo en 171 (1.1% del total) persistieron positivas. Esto será motivo de otro estudio.
En el estudio NHANES III la repetición de la albuminuria a los dos meses por protocolo y tiempo recomendado para realizarla, mostró la persistencia de la misma en 62% (0.62% del total tuvieron albuminuria persistente).
La albuminuria es más específica que la proteinuria para valorar daño renal persistente y tiene menor frecuencia de falsos positivos. La tirilla de orina que detecta proteinuria tiene un costo de 10 a 15 veces menor que la albuminuria y ha demostrado eficacia en predecir IRE, muerte cardiovascular y de todas las causas (51), por eso fue adoptada por el Consenso de Proteinuria en nuestro país (39) y es la utilizada para tamizaje en la Clinica Preventiva de nuestro estudio. La cuantificación posterior debe acercarse a lo recomendado actualmente.
Significado de la Creatinina aislada en el Tamizaje de ERCp La prevalencia de TFG < 60 ml/min estimado por CKD-EPI, en la subpoblación seleccionada fue 1,8% (siendo 0.6% en los sin FR) y se vinculó fuertemente a la edad. Es menor de 1% en < 50 años y asciende a 16% en > 70 años. Estos datos son parecidos a los reportados en el estudio NHANES que encontraron en <40 años una prevalencia de TFGe < 60 ml/min de 1,5% y > de 70 años de 23,1%.
La presencia de TFGe descendido también se asocia en forma independiente a la hipertensión. Las personas con hipertensión tienen casi 4 veces mayor prevalencia de TFGe < 60 ml/min que las que no la tienen. En nuestro trabajo la TFGe descendido no se asoció a la presencia de diabetes en forma independiente.
De acuerdo a estos datos, la creatininemia cobra relevancia en el tamizaje de ERC en población añosa o con HTA.
En el estudio noruego Hallan (28) con 65.604 individuos, el tamizaje de ERC se realizó mediante TFGe por MDRD. Tenían ERC 3.069 individuos (4.7%). Se necesitaba testear 20.6 personas para identificar 1 caso ERC. Cuando testearon sólo diabéticos e hipertensos era necesario testear 5.9 individuos para captar uno. Al restringir el tamizaje a las personas con FR se pudo identificar el 92.4% de pacientes con ERC y el número de individuos a testear para hallar una persona con ERC sería de 8.7. El 74% de individuos con una determinación inicial de TFGe descendido, tuvieron una segunda determinación, separada al menos tres meses, también descendida, mostrando menores tasas de falsos positivos que la proteinuria determinada por tirilla, aunque el número de pacientes que contaron con dos evaluaciones de TFGe fue bajo.
Proteinuria y Creatininemia conjuntas para detección precoz de ERCp Como se observa en la Figura 1, la proteinuria es relevante para detectar ERCp en < 50 años y la creatininemia en > 70 años. En la franja intermedia ambas formas de tamizaje se complementan.
Se recomienda que el diagnóstico de ERC se base en el descenso del FG y en la presencia de albuminuria (49) porque identifica los individuos con más riego de progresar a IRE. En nuestro estudio vemos que la prevalencia de ERCp aumenta de 6% a 9% cuando además de la TPu utilizamos la creatinina. En el “Multiple, Risk Factor Intervention Trial” (51), una TFG < 60 ml/min/1.73 m2 junto con proteinuria 2+ o más en TPu, tuvo un RR de 33, para progresión a IRE. El valor predictivo de IRE de la TFG <60 ml/min con Pu negativa fue 5.6%, comparado a 26% si Pu (+).
LIMITACIONES
Hay un sesgo de selección porque la población estudiada es una selección de la población general, (joven y laboralmente activa) por lo que nuestros hallazgos no se pueden generalizar a toda la población del país. La subpoblación con creatininemia y TFG es una población aún más selectiva por la presencia predominante de FR. No se confrontaron la TPu y la TFG estimada con otros estudios de mayor precisión para definir adecuadamente el valor predictivo positivo y negativo de los primeros. No se cruzaron la base de datos de los usuarios del Carné de Salud con las de los registros de diálisis y trasplante del PNSR, porque no se manejaron bases identificadas. Por esta causa no se pudo precisar el diagnóstico confirmatorio de ERC y su evolución en todos los individuos estudiados.
CONCLUSIONES
El Carné de Salud en población laboralmente activa permitió:
Diagnosticar nuevos casos de hipertensión en 7.1 % y de diabetes en 2.0 % de la población estudiada, que desconocían padecerlos.
El hallazgo de proteinuria positiva se asoció a la presencia de hipertensión arterial y diabetes, mientras que el eTFG < 60 ml/min a la edad y a la hipertensión arterial
El diagnóstico de ERCp se asoció a la edad, la hipertensión arterial y diabetes
El diagnóstico de ERCp se basó principalmente en la presencia de proteinuria en la población más joven y en el descenso de TFGe en la población de mayor edad, por lo que consideramos que ambas estrategias son complementarias.
La metodología de testeo de ERCp utilizada en el Carné de Salud de la Clínica Preventiva, permite detectar pacientes más jóvenes y ERCp más temprana que los pacientes captados en el PNSR por lo que debería perfeccionarse la forma de confirmación diagnóstica de la ERC y derivación precoz al nefrólogo en las diferentes Clínicas Preventivas para optimizar este recurso.
Hay que hacer estudio de costo-efectividad para ver si es correcto realizar cada 2 años el Carné de Salud con el tamizaje de todos los FR y enfermedades de riesgo renal y CV.
CONFLICTO DE INTERES
Los autores declaran que no existen conflictos de interés.
BIBLIOGRAFIA
1. Wilson JM, Jungner YG. Principles and practice of mass screening for disease. Bol Oficina Sanit Panam. 1968;65(4):281-393
2. Jaar BG, Khatib R, Platinga L, Boulware LE, Powe NR. Principles of screening for chronic kidney disease. Clin J Am Soc Nephrol. 2008; 3: 601-609.
3. National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis. 2002; 39: S1- S266.
4. Perazella MA.Chronic kidney disease: the silent epidemic. Hosp. physician. 2003; 39: 15-17.
5. Go AS, Chertow GM, Fau D, McCulloch CE, Hsu CY. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Eng J Med. 2004; 351: 1296-1305.
6. Schoolwerth AC, Engelgau MM, Hostetter TH, Rufo KH, Chianchiano D, McClellan WM, et al. Chronic kidney disease: a public ealth problem that needs a public health action plan. Prev Chronic Dis. 2006; 3: A57.
7. Levey AS, Atkins R, Coresh J, Cohen EP, Collins AJ, Eckart KU, et al. Chronic kidney disease as a global public health problem: approaches and initiatives – a position statement fron Kidney Disease Improving Global Outcomes. Kidney Int. 2007; 73: 247-259.
8. Levey AS, Stevens LA, Coresh J. Conceptual model of CKD: applications and implications. Am J Kidney Dis 2009; 53: S4 – S16.
9. Perico N, Remuzzi G. Chronic kidney disease: a reaserch and public health priority. Nephrol Dial Transplant. 2012; 27: iii19-26.
10. Garg AX, Kiberd BA, Clark WF, Haynes B, Clase CM. Albuminuria and renal insuficiency prevalence guides population screening: Results from the NHANES III. Kidney Int. 2002; 61: 2165-2175.
11. Houliham CA, Tsalamandris C, Akdeniz A, Jerumes G. Albumin to creatinine ratio. A screenig test with limitation. Am J Kidney Dis. 2002; 39: 1185-1189.
12. de Jong PE, Brenner BM. From secondary to primary prevention of progressive renal disease: the case of screening for albuminuria. Kidney Int. 2004, 66: 2109- 2118.
13. Remuzzi G Weening JJ. Albuminuria as early test for vascuar diseas. Lancet 2005; 365: 556-557.
14. Lambers Heerspink HJ, Gansevoort RT, Brenner BM, Cooper ME, Parving HH, Shahinfar S, et al. Comparison of different measures of urinary protein excretion for prediction of renal events. J Am Soc Nephrol. 2010; 21: 1355-1360.
15. Konta T, Hao Z, Takazaki S, Abiko H, Ishikawa M, Takahashi T, et al. Clinical utility of trace proteinuria for mcroalbuminria screening in the general population. Clin Exp Nephrol 2007; 11: 51-55.
16. Methven S, MacGregor MS, Traynor JP, Hair M, O'Reilly DS, Deighan CJ. Comparison of urinary albumin and urinary total protein as predictors of patiens outcomes in CKD. Am J Kidney Dis. 2011; 57: 21-28.
17. Methven S, Traynor JP, MacGregor MS, Hair D, O’Reilly DS, Deihan CJ. Stratifying risk in chronic kidney disease: an observational study of UK guidelines for measuring total proteinuria and albuminuria. QJM. 2011;104:663-70.
18. White SL, Yu R, Craig JG, Polkinghome KR, Atkins RC, Chadban SJ. Diagnostic accuracy of urine dipsticks for detection of albuminuia in general community. Am J Kidney Dis. 2011; 58: 19-28.
19. Nagai K, Saito C, Watanabe F, Ohkubo R, Sato C, Kawamura T, et al. Annual incidence of persistent proteinuria in the general population from Ibaraki annual urinalysis study. Clin Exp Nephrol. 2013; 17:255-260.
20. Boulware LE, Jaar BG, Taver-Carr ME, Brancati FL, Powe NR. Screening for proteinuria in US adults: a cost-effectiveness analysis. JAMA 2003; 290: 3101-3114.
21. Brown WW, Peters RM, Ohmit SE, , Keane WF, Collins A, Chen SC,et al. Early detection of kidney disease in community settings: the Kidney Early Evaluation Program (KEEP). Am J Kidney Dis. 2003; 42: 22-35.
22. Atthobari J, Asselbergs FW, Boersma C, de Vries R, Hillege HL, van Gilst WH, et al. Cost-effectiveness of screening for albuminuria with subsequent fosinopril treatment to prevent cardiovascular events: A pharmacoeconomic analysis linked to the prevention of renal and vascular endstage disease (PREVEND) study and the prevention of renal and vascular endstage disease intervention trial (PREVEND IT). Clin Ther. 2006; 28: 432-444.
23. Bello AK, Peters J, Wight J, , de Zeeuw D, El Nahas M; European Kidney Institute. A population-based screening for microalbuminuria among relatives of CKD patients: the Kidney Evaluation and Awareness Program in Sheffield (KEAPS). Am J Kidney Dis. 2008; 53: 42: 22-35.
24. McClellan WM, Ramirez SP, Jurkovitz C. Screening for chronic kidney disease: unresolved issues. J Am Soc Nephrol. 2003; 14: S81-S87.
25. Clase CM. Glomerular filtration rate: screening cannot be recommended on the basis of current knowledge. BMJ. 2006; 333:1030-31.
26. Glassock RJ, Winearls C. Screening for CKD with eGFR: doubts and dangers. Clin J Am Soc Nephrol. 2008; 3: 1563-68.
27. Moyer, VA; U.S. Preventive Services Task Force. Screening for Chronic Kidney Disease: U.S. Preventive Services Task Force Recommendtion Statement. Ann Intern Med. 2012; 157: 567-570.
28. Hallan SI, Dahl K, Oien CM, Grootendorst DC, Asberg A, Holmen J, et al. Screening strategies for chronic kidney disease in the general population: follow-up of cross sectional health survey. BMJ. 006; 333: 1047.
29. Yamagata K, Takahashi H, Tomida C, Yamagata J, Koyama A. Prognosis of asymptomatic hematuria and/or proteinuria in men. High prevalence of IgA nephropathy among proteinuric patients found in mass screening. Nephron. 2002; 91: 34-42.
30. Iseki K, Ikemiya Y, Iseki C, Takshita S. Proteinuria and the risk of developing end-stage renal disease. Kidney Int. 2003; 63: 1468-1478.
31. Konta T, Hao Z, Takasaki S, Abiki H, Ishikawa M, Takahashi T, et al. Clinical utility of trace proteinuria for microlbuminuria screening in the general population. Clin Exp Nephrol. 2007; 11: 51-55.
32. Yamagata K, Iseki K, Kousaku N, Imai H, Iino Y, Matsuo S, et al. Chronic kidney disease perspectives in Japan and the importance of urinalysis screening. Clin Exp Nephrol. 2008; 12; 1-8.
33. Kondo M, Yamagata K, Hosh SL, Saito C, SAHI K, et al. Cost-effectiveness of chronic kidney disease mass screening test in Japan. Clin Exp Nephrol. 2012; 16: 279-291.
34. Uruguay. Ministerio de Salud Pública. Marco Normativo. Histórico/Archivo. Ley 9697 de creación del Carné de Salud. Montevideo: MSP 06/10/10 [acceso 37/01/14]. Disponible en http://www.msp.gub.uy/sites/default/files/Ley_9697.pdf
35. Fort Z, Portos A, Castro M, Piñeyro C, Ciganda C, Bermúdez Y, et al. Factores de riesgo cardiovascular en 74.420 solicitantes de carné de salud. Rev Urug Cardiol. 2012; 27: 150-61.
36. Mazzuchi N, Schwedt E, Solá L, González C, Ferreiro A. Risk factors and prevention of end- stage renal disease in Uruguay. Ren Fail 2006; 28: 617-625.
37. Solá L, Ríos P, Schwedt E, Gadola L, Lamadrid V, Ciganda C, et al. Screening of chronic kidney disease at the mandatory health check-up in the working population of Uruguay [en línea]. In: World Congress of Nephrology, ISN Global Outreach award; 8-12 April 2011. Vancouver: International Society of Nephrology, 2011[acceso 27/01/2015]. Disponible en: http://www.theisn.org/latest-isn-news/global-outreach/isn-global-outreach-awards-2011.
38. Schwedt E, Olascoaga A, Sánchez MF, Piana A, Raymondo S, De Souza N, et al. Primer Consenso Nacional sobre Proteinuria en el diagnóstico y la evaluación de la Enfermedad renal Crónica en Adultos. Arch Med Int. 2012; 34: 03-11.
39. KEEP: Kidney Early Evaluation Program. Annual Data Report. Am J of Kidney Dis. November 2003; 42 (suppl):1-60.
40. Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF 3rd, Feldman HI, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009; 150: 604-612.
41. Levey AS, De Jong PE, Coresh J, El Nahas M, Astor BC, Matsushita K, et al. The definition, classification, and prognosis of chronic kidney disease: a KDIGO Controversies Conference report. Kidney Int. 2011; 80; 17-28.
42. Canzani O, De Souza N, Gadola L, Lamadrid V, Ríos P, Schwedt E, et al; Comisión Honoraria de Salud Renal. Guías de Práctica Clínica en el Diagnóstico y Tratamiento de la Enfermedad Renal Crónica : programa de salud renal [en línea]. Montevideo; Fondo Nacional de Recursos, 2013 [acceso: 27/01/2014]. Disponible:http://www.fnr.gub.uy/sites/default/files/publicaciones/FNR_guias_practica_clinica_ERC_2013_tapa.pdf
43. Uruguay. Ministerio de Salud Pública. Dirección Nacional de la Salud. División Epidemiología.1a Encuesta Nacional de Factores de Riesgo de Enfermedades Crónicas No Trasmisibles. Montevideo: MSP, 2006 [acceso el 27/01/2013] . Disponible en: http://www.msp.gub.uy/sites/default/files/archivos_adjuntos/1er_enfrecnt_2006_1.pdf
44. Hallan SI, Ritz E, Lydersen S, Romundstad S, Kvnild K, Orth SR. Combining GFR and albuminuria to classify CKD improves prediction of ESRD. J Am Soc Nephrol. 2009; 20: 1069-1077.
45. Tonelli M, Muntner P, Lloyd A, Manns BJ, James MT, et al; ; Alberta Kidney Disease Network. Using Proteinuria and estimated glomerular filtration rate to classify risk in patients with chronic Kidney Disease. Ann Inter Med. 2011; 154: 12-21.
46. Mazzuchi N, Acosta N, Caorsi H, Schwedt E, Di Martino LA, Mautone M, et al. Frecuencia de diagnóstico y de presentación clínica de las glomerulopatías en el Uruguay. Nefrología. 2005, 25: 113-120.
47. Matsushita K. Mahmoodi B, Woodward M, Emberson JR, Jafar TH, Jee SH, et al. Comparison of risk prediction using the CKD-EPI equation and the MDRD Study equation for estimated glomerular filtration rate. JAMA. 2012; 307: 1941-51.
48. Sociedad Uruguaya de Nefrología. Programa de Prevención y Tratamiento de las Glomerulopatías. Informe 2010-2012. Acceso 15/03/14. [en línea] Disponible en: http://nefrouruguay.com/wp-content/uploads/2014/05/Informe-Incidencia-Glomerulopat%C3%ADas-PPTG-2014.pdf
49. Sociedad Uruguaya de Nefrología. Registro Uruguayo de Diálisis. Informe 2012. Acceso 15/03/14.[en línea] Disponible en: http://nefrouruguay.com/wp-content/uploads/2014/01/informeRUD2012.pdf
50. Ishani A, Grandits GA, Grimm RH, Svendsen KH, Collins AJ, Prineas RJ, et al. Association of single measurements of dipstick proteinuria, estimated glomerular filtration rate, and hematocrit with 25-year incidence of end-stage renal disease in the multiple risk factor intervention trial. J Am Soc Nephrol. 2006; 17: 1444-52.
51. Sharma SK, Zou H, Toqtokh A, Ene-Iordache B, Carminati S, Remuzzi A. Burden of CKD, Proteinuria, and cardiovascular risk among Chinese, Mongolian, and Nepalese participants in the International Society of Nephrology screening programs. Am J Kidney Dis. 2010 Nov; 56 (5): 915-2
 Todo o conteúdo deste periódico, exceto onde está identificado, está licenciado sob uma Licença Creative Commons
Todo o conteúdo deste periódico, exceto onde está identificado, está licenciado sob uma Licença Creative Commons













