Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Archivos de Medicina Interna
versão impressa ISSN 0250-3816versão On-line ISSN 1688-423X
Arch. Med Int vol.37 no. 1 Montevideo mar. 2015
ARCHIVOS DEL INSTITUTO DE NEUROLOGÍA
Hemangiopericitoma intracraneano - Reporte de un caso y revisión del tema
Intracranial Haemangiopericytoma - Case report and literature review
Dr. J. Ignacio Aramburú
Servicio de Neurocirugía, Hospital de Clínicas de Montevideo, UdelaR. Montevideo.
Dra. Verónica Verdier
Servicio de Neurocirugía, Hospital de Clínicas de Montevideo, UdelaR. Montevideo.
Dra. Alejandra Jaume
Servicio de Neurocirugía, Hospital de Clínicas de Montevideo, UdelaR. Montevideo.
Dr. Carlos Aboal
Servicio de Neurocirugía, Hospital de Clínicas de Montevideo, UdelaR. Montevideo.
RESUMEN: Arch Med Interna 37(1): 36-42
INTRODUCCIÓN: el Hemangiopericitoma (HPC) es un tumor hipervascular infrecuente que constituye menos del 1% de todos los tumores del Sistema Nervioso Central (SNC) y aproximadamente el 3% de los tumores vinculados a las meninges. Son tumores agresivos que requieren un tratamiento enérgico mediante cirugía y radioterapia, y a pesar del mismo, generalmente son tumores recidivantes, pudiendo generar metástasis a distancia. OBJETIVOS: comunicar el primer caso en que se hace diagnóstico con un panel inmunohistoquímico completo de HPC en Uruguay, y a partir del mismo, se realiza una revisión bibliográfica. MATERIALES Y MÉTODO: en primer lugar se presenta un caso clínico de un paciente que fue asistido en el Hospital de Clínicas. Mediante estudios de imagen se sospecha probable HPC, es intervenido quirúrgicamente de coordinación y el diagnóstico definitivo se realiza mediante estudio de anatomía patológica que incluye técnica inmunohistoquímica. A partir de este caso clínico ilustrativo se realizó una puesta al día sobre esta patología. DISCUSIÓN: a nivel intracraneano, los HPC tienen una distribución similar a los meningiomas, con una base de implantación dural. Tal es su similitud con los meningiomas, que fueron considerados como una variante meningoblástica o angiomatosas de los mismos. Desde 1993 se los clasifica como un grupo aparte, presentando 2 variantes: clásica, de bajo grado (grado II) y anaplásico (grado III). El estudio histopatológico (morfológico e inmunohistoquimico) es fundamental ya que los diferencia definitivamente a los meningiomas de los HCP. En cuanto a los marcadores, y siguiendo la bibliografía referente, nuestro caso reportado fue negativo para CD 34 pero positivo para factor VIIIa. CONCLUSIONES: los HPC del SNC son tumores poco frecuentes, con un comportamiento agresivo, tendencia a recurrir y dar metástasis a distancia. Por lo que es fundamental tener siempre presente este tipo de lesiones en patología tumoral de meninges. Un diagnóstico rápido con estudio histológico y confirmación immunohistoquímica permite llegar al diagnostico y a un tratamiento oportuno agresivo, ya que el mismo es lo único que está demostrado que mejora el pronóstico.
Palabras clave: Tumor meníngeo, hemangiopericitoma, FVIIIA, CD34.
SUMMARY: Arch Med Interna 37(1): 36-42
INTRODUCTION: the haemangio-pericytoma (HPC) is a rare hypervascular tumor that accounts for less than 1% of all the Central Nervous System (CNS) tumor and approximately 3% of the tumors involving the meninges. They are aggressive tumors that require an energetic therapy including surgery and radiotherapy, despite which the tumors tend to relapse, potentially giving rise to distant metastases. OBJECTIVES: to report the first case where the diagnosis is reached with the comprehensive immuno-histochemistry panel for HPC in
Keywords: Meningeal tumor, haemangiopericytoma, FVIIIA, CD34.
INTRODUCCIÓN
El hemangioperitoma es un tumor hipervascular infrecuente, que se origina de células fusiformes perivasculares denominadas pericitos de Zimmermann.
Los pericitos de Zimmermann se encuentran a nivel pericapilar y vénulas postcapilares. Generalmente asientan en tejidos blandos, con más frecuencia a nivel del retroperitoneo y en extremidades inferiores.
La afección del SNC es poco frecuente1. Sin embargo, todas las localizaciones en cualquier parte de la cuerpo comparten similares características histopatológicas2,3.
INCIDENCIA
Los HPC constituyen menos del 1% de todos los tumores de SNC y aproximadamente el 3% de los tumores vinculados a las meninges2,4. Característicamente presentan un comportamiento agresivo a nivel locorregional, con marcada tendencia a la recurrencia, independientemente de su localización2,3,5,6.
Inicialmente fueron considerados como una variante de los meningiomas (variedad meningioma angioblástico) hipervascularizados, pero desde 1993 la OMS ha cambiado su denominación, desligándolos de los meningiomas2,3,6,7. Y reconociendolos como una entidad propia: Tumores mesenquimaticos no meningoteliales.8
OBJETIVO
El siguiente trabajo se basa en la descripción de un caso clínico, cuya relevancia es ser el primer caso en el país en el cuál se realizó diagnóstico de hemangiopericitoma con un panel de valoración inmunohistoquímico completo.
En base a este caso, se hace una revisión bibliográfica.
Caso Clínico
Paciente de 66 años, con antecedente ser fumador y alcoholista.
Presenta una historia progresiva de 4 meses de evolución de trastornos conductuales, alteración del lenguaje y disminución de fuerzas de hemicuerpo derecho.
El día del ingreso presenta caída de su altura con fractura de cadera, por lo que es trasladado al Servicio de Emergencia del Hospital de Clínicas
Examen clínico al ingreso
El paciente está vigil y cumple órdenes. Presenta una afasia mixta a predominio de la expresión y un déficit motor derecho a predominio braquial M4 en la escala del British Medical Councilie, presenta Babinski e hiperreflexia homolateral.
Con la sospecha clínica de proceso expansivo intracraneano tumoral, se realizó Tomografía de cráneo (TC) como método de screenning y luego Resonancia Nuclear Magnética (IRM).
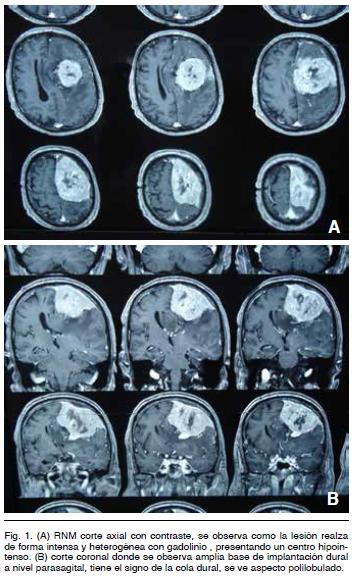
La misma evidenció (Figura 1) un tumor intracraneano extra-axial de la convexidad frontoparietal izquierda, isointenso en la secuencia T1, voluminoso, polilobulado y con extenso contacto dural que llega hasta el seno longitudinal superior y la hoz cerebral. Con la administración de gadolinio hay un realce intenso y heterogéneo del tumor y su base de implantación (signo de la cola dural).
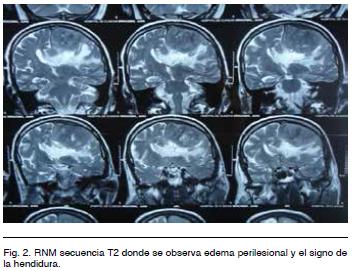
En T2 se observa isointenso, identificándose liquido cefalorraquídeo entre el tumor y el cerebro (signo de la hendidura). Se ve también importante edema perilesional digitiforme (Figura 2).
Por las características imagenológicas en planteo fue de:
• meningioma
• en segundo lugar, hemangiopericitoma.
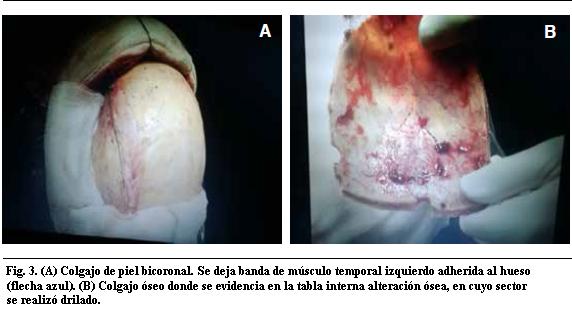
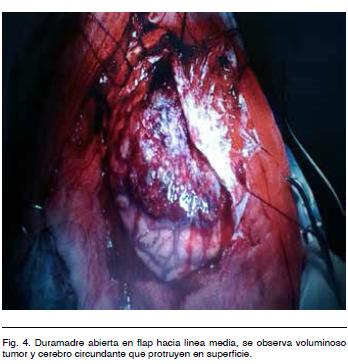
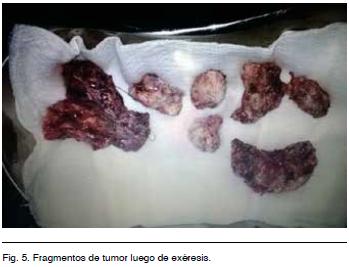
Se realizó tratamiento quirúrgico por abordaje bicoronal con exposición del seno longitudinal superior. Se hizo una exéresis tumoral macroscópicamente completa con plastia de duramadre (Figuras 3, 4 y 5).
Anatomía patológica
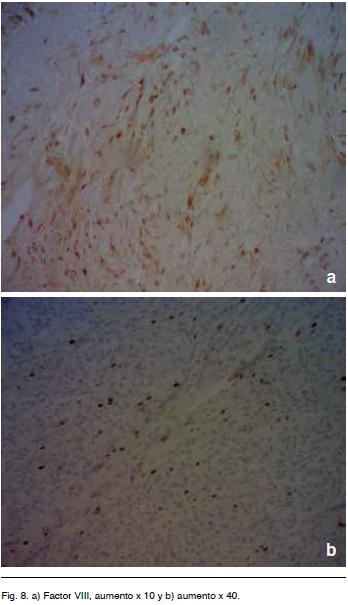
El informe histológico fue compatible con HPC, dada la elevada vascularización, por lo que se solicitó estudio inmunohistoquímico. El mismo fue negativo para CD34 pero positivo para factor VIII (de von Willebrand), presentando un índice de proliferación del 5-10%, por lo que se concluye que corresponde a un HPC grado III (OMS 2007).
El paciente presento buena evolución postoperatoria con mejoría progresiva del déficit motor y afasia. La RNM de control no evidencia complicaciones (Figura 6).
A los 9 meses de la cirugía está asintomático (Glasgow Outcame Scale 5) y está en control clínico e imagenológico. No se realizó tratamiento complementario (radioterapia).
Microscopía
DISCUSIÓN y comentarios
Los hemangiopericitomas (HPC) son tumores hipervasculares poco frecuentes.
Dado que se supone su más probable origen en células situadas en capilares y vénulas postcapilares (pericitos de Zimmermann), pueden verse en cualquier región del organismo. Sus localizaciones más frecuentes son el retroperitoneo, pelvis, miembros inferiores y menos frecuentemente el SNC 2,3,7,9.
Sin importar su localización los HPC presentan características ultraestructurales e inmunohistoquímicas idénticas3,7,9.
A nivel intracraneano, los HPC tienen una distribución similar a los meningiomas, con una base de implantación dural4. La localización a nivel de fosa posterior es de un 15% aproximadamente1,2,10.
Se han reportado raros casos de HPC no durales como en la región pineal, así como también puramente intraparenquimatosos, siendo aún esto mucho más infrecuentes9,10. Entre el 10 y 15% se ubican a nivel espinal, siendo en más de la mitad de los casos cervicales10.
Dentro de todos los tumores del SNC representan menos del 1% y casi el 3% de los vinculados a las meninges2,3,7,9.
Tal es su similitud con los meningiomas, que fueron considerados como una variante meningoblástica angiomatosa o “vasculosa” (Pío del Río Hortega ,1933) de los ellos.
La evolución clínica de éstos pacientes, han llevado a análisis genéticos de éstos casos, demostrándose no tener relación histogenética con los tumores originados en células aracnoideas (meningiomas propiamente dichos).
La clasificación de la World Health Organization (WHO) desde 1993 los clasifica como un grupo aparte. Se los clasifica a su vez en 2 variantes: clásica, de bajo grado (grado II) y anaplásicao (grado III)2,3,6-8.
Por todo esto, es el estudio histopatológico (morfológico e inmunohistoquimico) el que diferencia definitivamente a los meningiomas de los HPC2-5,11.
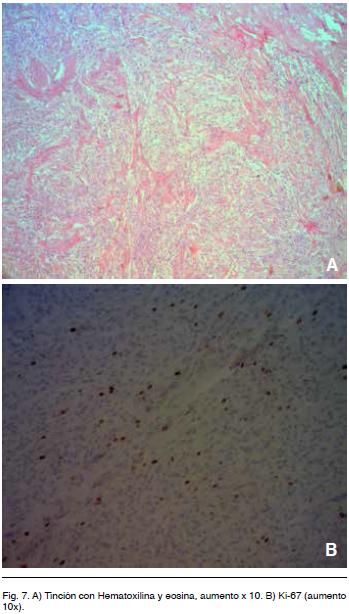
Con respecto a la histología, los HPC son tumores compuestos por abundantes células fusiformes, grandes, con núcleos ovales y escaso citoplasma. Las células se disponen en torno a espacios vasculares de paredes delgadas (capilares y vénulas postcapilares) con un patrón característicos en “asta de ciervo” (Figura 7 A).
La histogenesis de estos tumores es ampliamente debatible. La OMS10, los define dentro del capítulo de los tumores mesenquimaticos, no meningotelial y mas presisamente “un tumor mesenquimal altamente celular y vascularizado exhibiendo una característica monótona … ()….con ramificación vascular ‘cuerno de ciervo’”)12.
Existen HPC de la OMS grado II con 2 a 3 mitosis por 10 campos de alta potencia (HPF) y también se reportan más de 5 por 10 HPF como grado III. En la variante anaplásica (III OMS) también se puede encontrar necrosis, hemorragia y pleomorfismo nuclear4,8.
Immnunohistoquímica
Utilizando técnicas de inmunohistoquímica existen diferentes marcadores que facilitan el diagnóstico de HPC.
Sundaram y col. publicaron un trabajo con 23 pacientes . Los autores concluyen que:
• Los HPC son antígeno epitelial de membrana (EMA) y proteína S-100 negativos, vimentina positivos.
• Los meningiomas son EMA y vimentina positivos, y la respuesta es variable para S-100.
El marcador CD 34 positivo esta solo en 25% de los casos de los HPC. Hay otros marcadores que se mencionan en la literatura entre los que se encuentra el factor VIIIa como ayuda para el diagnostico en los HPC11,13 (Figura 8).
Aunque no hay un solo marcador sensible y especifico, el perfil inmunohistoquímico es suficiente para diferenciar estos tumores de los meningiomas13.
Nuestro caso fue negativo para CD 34 pero positivo para factor VIIIa.
Este hecho concuerda con la definición inicial del HPC y con los resultados de estudios de series de Perry, Arie et al. (1997).
A pesar de la controversia en cuanto a su histogénesis, el HPC meningeo es una entidad clínico patológica bien definida que exhiben altas tasas de recurrencia y metástasis tardías extracraneales. Éste debe distinguirse de varias neoplasias benignas, especialmente:
• Meningioma fibroso (FM)
• tumor fibroso solitario (TFS).
Para determinar el perfil immunohistoquimico se reportan numerosos trabajos donde se comparan diferentes formas de HPC, FM y TFS de las meninges como diagnosticos diferenciales.
Los paneles de anticuerpos para el HPC incluyen vimentina (85% de positividad en algunas series), factor XIIIa (78% ídem), Leu-7 (70% idem), y CD34 (33% ídem). De lo que se desprende el interés real de efectuar factor VIIIa y más aun en tumores CD34 negativos.
En cuanto a otros elementos de la inmunohistoquímica a tener en cuenta, Probst-Cousin y col. (b) encontraron que el grupo de pacientes con Ki-67 de < 5% tienden a sobrevivir más tiempo, sin embargo no predice con exactitud el resultado clínico8. Formalmete la OMS aún no acepta este hecho.
El factor de la coagulación XIIIa se ha demostrado que está presente tanto en células tumorales y en los macrófagos asociados a tumores de diferentes neoplasias tales como la enfermedad de Hodgkin, tumor de células gigantes del hueso, histiocitoma fibroso maligno, tumores de las meninges, y el hemangiopericitoma.
Los Gliomas de alto grado tales como glioblastoma, gliosarcoma, astrocitoma (grado III de la OMS), y ependimoma (III), así como meningiomas y hemangiopericitomas meníngeos consistentemente presentan células factor XIIIa positivas, mientras que los tumores gliales de grado bajo no lo hacen. Con la excepción de hemangiopericitomas, sin embargo, la principal fuente de expresión FXIIIa en todos estos tumores constaba de una subpoblación de macrófagos asociados al tumor, el papel exacto de los cuales sigue siendo poco claro.
CLÍNICA E IMAGENOLOGÍA
Sobre la clínica e imagenología de los HPC hay que destacar algunos puntos.
Estos tumores son ligeramente más frecuentes en hombres y la edad media de presentación es la cuarta década10,12. En cuanto a la forma de presentación, el síntoma más frecuente es la cefalea, luego el déficit focal neurológico, el cuál puede ser variable según la topografía lesional. Las crisis son relativamente poco frecuentes (16% de los tumores supratentoriales)4,10. El sangrado intratumoral es un hecho conocido pero poco frecuente3,4.
Con respecto a los estudios de imagen, es de elección la IRM de cráneo. Como ya se mencionó, estos tumores son imagenologicamente similares a los meningiomas, lo que hace difícil el diagnóstico preoperatorio. Se han descrito algunas características particulares que nos pueden sugerir y orientar hacia un HPC como son: 1) un contorno tumoral polilobulado con base de implantación dural más estrecha, 2) con la administración de contraste hay realce intenso pero heterogéneo, 3) en la secuencia T2 se pueden ver imágenes de vacío de flujo intratumoral, 4) habitualmente no presentan hiperostosis, en cambio producen erosión ósea en mas del 50% de los casos, 5) no tienen calcificaciones intratumorales, 6) la espectroscopia podría diferenciar los HPC de los meningiomas, se ha sugerido que altos valores de mioinositol se pueden encontrar en los primeros4,10.
La arteriografía cerebral es un estudio que debemos tener en cuenta cuando se sospecha un HPC, la presencia de alta cantidad de vasos y un drenaje venoso precoz es más característico de los HPC a diferencia de los meningiomas. A su vez la embolización de los pediculos arteriales nutricios podría formar parte del tratamiento, lo que disminuiría el sangrado intraoperatorio10.
Es de gran importancia tener en cuenta la presencia de estos tumores e intentar diferenciarlos de los meningiomas desde el preoperatorio, ya que los HPC tienen un comportamiento más agresivo y la exéresis completa y amplia es un objetivo fundamental4.
Los HPC característicamente presentan un comportamiento agresivo, con marcada tendencia a recurrir localmente. A 5 y 10 años hay un índice de recidivas de 50 y 70% respectivamente. También pueden extenderse a lo largo de todo el SNC1-3,6. Los HPC grado III presentan mayor tendencia a recurrir más tempranamente que los grado II13. Rutkowski y col. en un trabajo con 40 pacientes, encontraron una relación directa entre el tamaño tumoral y la probabilidad de recurrencia local: los tumores > 6 cm tienen mayor recurrencia a 2 años que los < 6 cm, con una media de 10 años (p < 0,05). Esto se puede deber en parte a que cuanto más grande es el tumor, más dificultosa su exéresis completa y a su vez tienen mayor riesgo de infiltrar sectores el parénquima cerebral, quedando tumor residual4,7. A su vez vieron que los tumores que se localizan en la base de cráneo tienen un mayor tiempo libre de recurrencia18. Esto último podría deberse a la presencia de diferente comportamiento biológico según la localización, por lo que las meninges en diferentes sectores albergan variable potencial neoplásico, al igual que como ocurre con los meningiomas7.
Otra característica diferencial es que pueden dar metástasis extraneurológicas, con más frecuencia en pulmón, hueso e hígado. El rango de aparición de las mismas varía de 2 a 20 años luego del diagnóstico inicial, teniendo a 5 y 15 años un 30 y 70% de probabilidad respectivamente1-3,6. Ningún tratamiento en la actualidad logra prevenir la aparición de metástasis a distancia7.
El tratamiento de los pacientes con HPC es quirúrgico y se debe lograr la resección completa del tumor, la duramadre y el hueso afectado, siempre que la topografía tumoral lo permita7,10. Varios trabajos concluyen que la extensión de la resección, es el factor más importante que determina la probabilidad de recurrencia local y el tiempo de sobrevida, por lo que es fundamental realizar una correcta planificación quirúrgica2,3,5,7.
Una de las mayores dificultades que enfrenta el cirujano es el sangrado intraoperatorio, dado que son lesiones hipervasculares. El sangrado representa la causa más frecuente de muerte intraoperatoria, con un rango de mortalidad que varía de 9 a 25%, a su vez representa uno de los mayores obstáculos para la resección total del tumor7. En los pacientes en que se sospecha un HPC, realizar una arteriografía con embolización preoperatoria se ha sugerido como un método a tener en cuenta para limitar la pérdida de sangre intraoperatoria4,7,10.
La radioterapia postoperatoria, con más de 50 Gy (siendo un tumor dosis dependiente), es considerada beneficiosa dado que prolonga el tiempo de aparición de recurrencia local y la sobrevida global4,7. Esta respuesta favorable se da también en pacientes con resección total del tumor, dado que la radioterapia elimina células tumorales aisladas que puedan quedar luego de la cirugía. La respuesta a este tratamiento oncológico se ve favorecida a su vez por la hipervascularización de estos tumores5,11.
El papel de la radiocirugía Gama Knife también ha sido investigado en los HPC menores de 2-3 cm de diámetro, y parece tener buenos resultados en el control local del tumor4,7. Puede ser considerado en pacientes que tienen tumores primarios o una recidiva menor a 3 cm y no son candidatos a cirugía por ejemplo, por alto riesgo anestésico comorbilidades asociadas10.
Sobre la quimioterapia, Chacko y col. mencionan que la topoisomerasa II alfa se correlaciona con el comportamiento biológico, siendo el riesgo de recurrencia 2,9 veces mayor en pacientes con índice de topoisomerasa > a 5% comparados con los de menor valor. Si bien la quimioterapia en los HPC es inefectiva, podría tener un papel en base a agentes antitopoisomerasas en los que expresan un índice > a 5%, si bien este hecho no está del todo claro15.
Rutkowski y col. en un trabajo retrospectivo con 40 pacientes, evidencian que si bien una exéresis completa del tumor con tratamiento oncológico adyuvante adecuado, tiene tendencia a mejorar el pronóstico global, no ha dado resultados con valores que sean estadísticamente significativos, así como tampoco hay evidencia que este tratamiento pueda prevenir el desarrollo de enfermedad metastásica a distancia16,17. Por lo tanto, no hay demostración clara que deba hacerse quimioterapia en estos tumores.
Gran parte de la literatura publicada deja claro que la enfermedad recurrente y metastásica es algo muy común a pesar de la amplia gama de estrategias terapéuticas que hay hasta el momento actual. La supervivencia promedio es de 7 a 16 años aproximadamente, lo que pone en evidencia la necesidad de monitoreo con un seguimiento a largo plazo de estos pacientes15. Se ha sugerido el empleo de la Tomografía por Emisión de Positrones (PET) para identificar metástasis a distancia, sin embargo hace falta estudios de mayor peso estadístico que respalden esta utilidad4.
CONCLUSIONES
Los hemangiopericitomas del SNC son tumores poco frecuentes, con un comportamiento agresivo, tendencia a recurrir y dar metástasis a distancia. Si bien presentan similares características clínico imagenológicas con los meningiomas hay ciertos elementos que nos permiten su sospecha en el preoperatorio. El estudio anatomopatológico nos permite realizar el diagnóstico definitivo, entendiendo en este caso el estudio immunohistoquimico (Faxtor VIIIa, CD34, Ki-67 entre otros). La cirugía y radioterapia adyuvante es el tratamiento de elección que mejora el pronóstico de estos pacientes, permiten un mayor control local de la enfermedad, si bien no inciden significativamente en la incidencia de metástasis a distancia. Sin embargo a pesar de todas las estrategias terapéuticas sigue siendo una enfermedad recurrente y metastásica, por lo que es de fundamental importancia el seguimiento de estos pacientes a largo plazo.
BIBLIOGRAFÍA
1. Il Seo, Yun Suk Kim, Ho-Sang Kim, Jeong-Ho Kim, Myung-Ki Lee. Hemangiopericytoma of the Posterior Fossa: A case report and review of the literature. Brain tumor Res Treat 2013; 1:95-98
2. R. Gutierrez-Gonzalez, G. R. Boto, A. Perez-Zamarron y M. Rivero-Garvia. Hemangiopericitoma de fosa posterior: a propósito de un caso. Servicio de Neurocirugía, Hospital Clinico San Caros Madrid, España. 2008; 19:446-452.
3. Jun Maruya, Y. Seki, Morita, K. Nishimaki and T. Minkawa. Meningeal Hemangiopericytoma manifesting as massive intracranial hemorrhage – Two Caso Report. Departament of Neurosurgery,
4. Juan Camilo Márquez García, Fernando Rodriguez, Armando Manuel Morales, Alfredo Miguel Fernandez de Castro. Hemangiopericytoma meníngeo anaplásico: presentación de caso. Rev. Colomb. Radiol. 2012;23(2):3510-3.
5. Amol J. Ghia, Eric L. Chang, Pameh K. Allen, Anita Mahajan, Marta Penas-Prado, Ian E. McCutcheon, Paul D. Brown. Intracranial Hemangiopericytoma: Patterns of Failure and the Role Radiation Therapy. Neurosurgery 73: 624-631, 2013.
6. Jason Sheelan, D. Kondzodka, J. Flukinger, L. Dade Lunford. Radiosurgery for treatment of recurrent intracranial Hemangiopericytomas. Neurosurgery Vol. 5. Number 4, 905-91, October 2002.
7. Martin J. Rutkowski, Brian J. Jian, Orin Bloch, Cheng Chen, Michael E. Sughrue, TarikTihan, Igor J. Barani, Mitchel S. Berger, Michael W. McDermott and Andrew T. Parsa. Intracranial Hemangiopericytoma. Clinical experience and treatment. Considerations in a modern series of 40 adult petients. American Cancer Society 2012; 118:1628-36.
8. Louis D, Ohgqki H , Otmar D et al. (1997). WHO Classification of tumours of the Central Nervous System . Lyon
9.
10. Charles S. Cobbs and Barton L. Guthrie. Meningeal hemangiopericytomas. Brain Tumors, second Edition, 2001, Cap 37, pag: 751-759.
11. Nilendu C. Purandare, Sumeet G. Dua, BhratPrekhi, Sneha Shah, Anshu R-Sharma and VenkateshRangarajan. Metastatic recurrence of an intracranial Hemangiopericytoma 8 years after treatment: report of a case with emphasis on the role of PET/CT in follow-up Cancer Imaging (2010) 10, 117-120.
12. Perry, Arie M.D.; Scheithauer, Bernd W. M.D.; Nascimento, Antonio G. M.D. The Immunophenotypic Spectrum of Meningeal Hemangiopericytoma: A Comparison With Fibrous Meningioma and Solitary Fibrous Tumor of Meninges. American Journal of Surgical Pathology. November 1997 - Volume 21 - Issue 11 - pp 1354-1360.
13. Challa Sundaram, Shantveer G. Uppin, Megha S. Uppin, J. SreeRekha, Manas Kumar Panigrahi, A. K. Purohit, S. Rammurti. A clinicopathological and inmunohistochemical study of central nervous system Hemangiopericytoma. Journal of Clinical Neuroscience 17(2010) 469-472.
14. Ari J. Kane, Michael E. Sughrue, Martin J. Rutkowski, GopalShangari, Shanna Frang, Michael W. McDermott, Mitchel S. Berger and Andrew T. Parsa. Anatomic location is a risk for atypical and malignant meningiomas. American Cancer. Volume 117, issue 6, pages 1272-78; march 2011.
15. Chacko G, Rajshekhar V. Intracranial Hemangiopericytomas: correlation of topoisomerase II alpha expression with biologic behavior. Surg. Neurol. 2006;65:11-7.
16. Cristina Prado, Arturo Navarro-Martin, Ana Lucas, Miguel Macia, FerranGuedes. Adyuvant fractionated radiotherapy affter resection of intracranial.
17. Probst-Cousin S1, Rickert CH, Gullotta F. Factor XIIIa-immunoreactivity in tumors of the central nervous system. Clin Neuropathol. 1998 Mar-Apr;17(2):79-84.