Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Archivos de Medicina Interna
versão impressa ISSN 0250-3816versão On-line ISSN 1688-423X
Arch. Med Int vol.34 no.3 Montevideo dez. 2012
Revisión
Tromboprofilaxis y anticoagulación luego del ataque cerebrovascular hemorrágico
Thromboprophylaxis and anticoagulation after hemorrhagic stroke
Dra. Verónica Pérez Papadópulos
Especialista en Medicina Interna. Asistente de Clínica Médica “A”. Facultad de Medicina. UdelaR, Montevideo.
Dra. Laura Llambí
Especialista en Medicina Interna. Profesora Adjunta de Clínica Médica “A”. Facultad de Medicina. UdelaR, Montevideo.
Dr. Mauricio Amaral
Especialista en Medicina Interna. Asistente de Clínica Médica “A”. Facultad de Medicina. UdelaR, Montevideo.
Dr. Rodrigo Andrade
Residente de Clínica Médica “A”. Facultad de Medicina. UdelaR, Montevideo.
Dr. Gonzalo Méndez
Residente de Clínica Médica “A”. Facultad de Medicina. UdelaR, Montevideo.
Dra. Claudia Camejo
Especialista en Neurología. Profesora Adjunta de Neurología. Facultad de Medicina. UdelaR, Montevideo.
Recibido: 21/05/12 - Aceptado: 27/08/12
Centro del Trabajo: Departamento Clínico de Medicina. Hospital de Clínicas.
Correspondencia: Dra. Verónica Pérez Papadópulos. Clínica Médica A, Hospital de Clínicas. Av Italia s/n 11600. Montevideo Uruguay. Correo electrónico: avperez@adinet.com.uy
Resumen: Arch Med Interna 2012 - 34(3):80-87
El ataque cerebrovascular hemorrágico o hemorragia cerebral no traumática es una importante causa de mortalidad y morbilidad a nivel mundial y constituye el efecto adverso más temido de la terapia anticoagulante. Cuando ésta ocurre es significativamente más letal que otras hemorragias constituyendo el 90% de las muertes ocasionadas por sangrados en pacientes que reciben warfarina. La enfermedad tromboembólica es una complicación frecuente en los pacientes que han sufrido un ataque cerebrovascular lo que determina que la profilaxis y tratamiento de eventos tromboembólicos versus el riesgo de recurrencia de sangrado intracraneano constituya un verdadero desafio clínico-terapéutico. El objetivo de esta revisión es analizar la importancia de la enfermedad tromboembólica en los pacientes con hemorragia cerebral, la tromboprofilaxis y el manejo de los pacientes tratados con anticoagulantes orales y la oportunidad de reinicio de los mismos luego de una hemorragia cerebral reciente.
Palabras clave: Ataque cerebrovascular, Hemorragia cerebral, Tromboprofilaxis, Anticoagulantes, Anticoagulantes orales, Enfermedad tromboembólica.
Abstract: Arch Med Interna 2012 - 34(3):80-87
Hemorrhagic stroke or non traumatic cerebral hemorrhage is a significant cause of morbi-mortality globally, and it is the most dreaded adverse effect of anticoagulant therapy. When it does occur, it is significantly more lethal than other hemorrhages, and it accounts for 90% of the deaths that result from bleeding in patients receiving warfarin. Thromboembolic disease is a frequent complication in patients with stroke; therefore, balancing the prophylaxis and therapy of thromboembolic events with the risk of recurrence of intracranial bleeding becomes a true clinical and therapeutic challenge. The objective of this review is to discuss the importance of thromboembolic disease in patients presenting with cerebral hemorrhage, thromboprophylaxis and the management of the patients treated with oral anticoagulants, as well as the timing for resuming the administration of such agents after a recent cerebral hemorrhage.
Keywords: Stroke, Cerebral hemorrhage, Thromboprophylaxis, Anticoagulants, Oral anticoagulants, Thromboembolic disease.
Introducción
El ataque cerebrovascular (ACV) hemorrágico o hemorragia cerebral (HC) no traumática es una importante causa de mortalidad y morbilidad a nivel mundial. También constituye el efecto adverso más temido de la terapia anticoagulante, ya que si bien otros sangrados considerados mayores como el digestivo o urinario pueden determinar muerte o discapacidad, lo hacen en un bajo porcentaje (3%) mientras que la HC causa la muerte o algún grado de discapacidad en las tres cuartas partes de los individuos que la sufren(1-3). El sangrado intracraneano asociado a warfarina no es una entidad frecuente, pero cuando ocurre es significativamente más letal que otras hemorragias constituyendo el 90% de las muertes ocasionadas por sangrados en pacientes que reciben warfarina(3).
Por otra parte la enfermedad tromboembólica es una complicación frecuente en los pacientes que han sufrido un ACV y que permanecen con algún grado de inmovilidad(4).
Esto determina que la profilaxis y tratamiento de eventos tromboembólicos arteriales y venosos en pacientes con una HC constituyen un verdadero desafío clínico-terapéutico, donde la correcta valoración del riesgo tromboembólico versus el riesgo de recurrencia de la HC y el balance de los beneficios y riesgos de la terapia antitrombótica deben sopesarse en un fino y cuidadoso balance, a la luz de la evidencia científica disponible pero en forma individualizada y a medida de cada paciente.
En este artículo se revisan cuatro aspectos del tema:
1. Importancia de la enfermedad tromboembólica venosa en el paciente con ACV.
2. Tromboprofilaxis en el paciente con HC.
3. Manejo de la HC en paciente tratado con anticoagulantes orales.
4. Indicación y oportunidad de reinicio de anticoagulantes en pacientes con HC reciente.
Importancia de la enfermedad tromboembólica venosa en el paciente con ACV
A nivel mundial, la patología cardiovascular constituye la principal causa de morbimortalidad. Uruguay no está ajeno a esa situación, siendo esta patología, responsable de aproximadamente el 30-55% de la defunciones anuales, seguidos de las enfermedades neoplásicas (25%), y enfermedades respiratorias (10%)(5).
Dentro de la patología vascular, las enfermedades cerebrovasculares, donde se incluye al ACV, constituyen la primera causa de muerte en Uruguay en ambos sexos, seguidos por la coronariopatía isquémica, 6 siendo responsable de discapacidad en un alto porcentaje de los pacientes que sobreviven, con un enorme impacto en la calidad de vida individual y familiar, y con la consiguiente repercusión social y económica.
Por otra parte, la enfermedad tromboembólica venosa (ETEV), tanto en su expresión de trombosis venosa profunda (TVP) como en su complicación más temida, el tromboembolismo pulmonar (TEP), constituye un problema sanitario de dimensiones considerables por su impacto en términos de morbimortalidad, costos y consumo de recursos(7). Entre los pacientes hospitalizados, la ETEV constituye una complicación clínica frecuente siendo responsable según las distintas series internacionales de más de 200.000 muertes anuales(8,9). Dada la alta incidencia de la ETEV en los pacientes hospitalizados, la prevención de la misma ha sido ampliamente estudiada en los últimos años y hoy se considera mundialmente una estrategia costo efectiva(10-13).
A pesar de la evidencia científica indiscutible en cuanto al beneficio y eficacia de las mediadas preventivas y el uso de anticoagulantes para la profilaxis de la ETEV, los estudios internacionales continúan mostrando su subutilización(14).
Nuestro país no escapa a esta realidad, lo que se vio reflejado en un estudio realizado en el Hospital de Clínicas en pacientes internados en el periodo 2001-2003, donde se encontró que sólo 22% de los pacientes con indicación de profilaxis de ETEV la recibieron(15).
En referencia a los pacientes con ACV, el riesgo de desarrollar ETEV es muy elevado. En una serie de 1.600 pacientes con ACV, el TEP fue la causa de muerte en 14% de los 580 pacientes que murieron en las primeras tres semanas y en 5% de los 600 pacientes que murieron desde la tercer semana post evento hasta los siete años del mismo(16). Otras series muestran que el riesgo de desarrollar ETEV en pacientes con ACV oscila entre 15 y 60%(17,18).
El ACV hemorrágico o hematoma cerebral por su parte conlleva aun más riesgo de ETEV que el isquémico de acuerdo a algunos autores(19).
Tromboprofilaxis en el paciente con HC
Afortunadamente, la incidencia de ETEV parece haber disminuido en los últimos 10 años, posiblemente debido al uso más frecuente de antiagregantes plaquetarios y anticoagulantes para la prevención del ACV recurrente, y probablemente también debido al uso de profilaxis de ETEV posterior a un ictus. Sin embargo persiste una justificada preocupación en los clínicos por la seguridad, el costo y la conveniencia de los regímenes de tromboprofilaxis.
La prevención de la ETEV puede ser realizada a través de medidas mecánicas o farmacológicas. Con referencia a las primeras, el estudio aleatorizado VICTORIA mostró que la compresión neumática intermitente combinada con medias elásticas es más efectiva en la reducción de la ocurrencia de trombosis venosa asintomática luego de HC (4,7% versus 15,9%) que el uso de medias elásticas únicamente(20). Dennis et al en su estudio publicado en 2009 también concluyen que las medias de compresión graduada utilizadas en forma exclusiva son inefectivas en la prevención de TVP(21).
Por consiguiente, en el análisis y síntesis de la evidencia disponible, la Asociación Americana de Stroke (ASA) y la Asociación Americana del Corazón (AHA) en sus guías de práctica clínica de 2010 recomiendan que los pacientes con ACV reciban compresión neumática intermitente para la prevención de ETEV, además de medias elásticas, siendo ésta una recomendación de clase I, basada en un nivel de evidencia B(1).
Otra de las opciones terapéuticas existentes son las heparinas de bajo peso molecular (HBPM), pero para indicarlas se debe considerar el riesgo de resangrado intracraneano.
Un estudio aleatorizado con un pequeño número de pacientes no encontraron diferencias significativas en la incidencia de TVP y ocurrencia de sangrado, en pacientes que recibieron dosis bajas de heparina subcutánea iniciada al cuarto día luego de una HC frente a los que iniciaron al décimo día(22).
Un estudio clínico aleatorizado que incluyó 68 pacientes mostró que la introducción de heparinas de bajo peso molecular después de los 2 primeros días de una HC redujo de forma significativa las complicaciones trombóticas frente a un inicio más tardío. No encontró un aumento significativo de los resangrado en ninguno de los grupos(23).
Basada en estos estudios la ASA recomienda que después de la documentación del cese del sangrado, dosis bajas de HBPM pueden ser consideradas para la prevención de ETEV en pacientes con déficit motor, luego de 1 a 4 días del inicio del cuadro. (recomendación clase IIb, basado en un nivel de evidencia B)(1).
Las Guías Españolas de Prevención Primaria y Secundaria del Ictus publicadas en 2008 recomienda considerar el uso de HBPM transcurridos 2 días de una hemorragia intracerebral con el objetivo de reducir el riesgo de TVP y TEP(24).
Por último el Manual Diagnóstico y Terapéutico de la unidad de ACV del Hospital de Clínicas, Montevideo Uruguay recomiendan el uso de HBPM o heparina no fraccionada para la prevención de la TVP, a partir del tercer día del evento hemorrágico(25).
Manejo de la HC en paciente tratado con warfarina
Los cumarínicos o antagonistas de la vitamina K han sido los principales anticoagulantes orales (ACO) utilizados desde principios del siglo pasado con el fin de disminuir el riesgo de embolia.
Sus beneficios han sido establecidos en numerosos estudios clínicos para la prevención primaria y secundaria del tromboembolismo venoso, en la prevención del embolismo sistémico para la enfermedad cerebrovascular, entre otros. Sin embargo, vinculado al incremento en el número de indicaciones se asiste al aumento de las complicaciones debido a su uso(26).
Son fármacos con estrecho rango terapéutico, con una variabilidad individual de respuesta y con un sinnúmero de interacciones con otras drogas y con los alimentos. Es por ello que su utilización requiere una monitorización estrecha, clínica y de laboratorio, así como un entrenamiento particular para los pacientes que los reciben.
El sangrado es la complicación mas grave en los pacientes que reciben terapia anticoagulante oral, siendo los sangrados intracraneanos los que tienen mayor morbimortalidad(2,3,27).
La HC espontánea es la forma de ACV con mayor tasa de mortalidad (30-55%), duplicándose en los pacientes que reciben anticoagulantes, hecho vinculado a la perpetuación del sangrado una vez producido el evento hemorrágico. La HC relacionada con ACO representa el 10-12% de todas las HC, estimándose que ocurre con una tasa de 2 a 9 por 100.000 personas/año(28).
El manejo del tratamiento antitrombótico tras una HC en pacientes anticoagulados no está unánimemente definido. Se proponen distintas pautas de manejo según las guías internacionales sin contar con un consenso mundial aceptado.
Aspectos fisiopatológicos
En las HC vinculadas a ACO las causas que se planteanson las mismas que en los pacientes que no los reciben, planteándose que los anticoagulantes actúan como factores exacerbadores. Esto es consistente con el hecho que la topografía de los sangrados con y sin ACO es la misma. Hart et al plantean que los ACO desenmascaran muchas veces sangrados intracraneanos que se comportarían como asintomáticos si los pacientes no recibieran anticoagulación(29). Si bien la mayoría de las HC vinculadas a ACO son con cociente internacional normatizado (INR) en rango de normalidad, el riesgo del evento hemorrágico claramente aumenta con los valores elevados de INR(30).
En los pacientes con HC asociadas a warfarina el riesgo de expansión del hematoma es mayor en las primeras 24 horas por lo que no debería mantenerse la anticoagulación en este período(31,32).
La expansión del hematoma se produce por sangrado persistente o resangrado desde el sitio de ruptura arterial o en el tejido perilesional(33). Si bien la expansión ocurre hasta en 40% de los pacientes en las primeras horas, en los sangrados vinculados a ACO la incidencia es mayor y en un período de tiempo mas prolongado, confiriendo mayor mortalidad.28
Las guías de la Asociacion Americana de Stroke recomiendan que los pacientes que presentan una HC asociada a ACO se debe suspender el uso del anticoagulante, revertir el estado de anticoagulación, reponerse el déficit de factores vitamina K dependientes y corregirse el INR. (Clase I, nivel de evidencia C)(1).
Existen diversas herramientas terapéuticas con el fin de lograr una corrección del estado de anticoagulación, hecho que debe lograrse lo mas rápido posible con el fin de evitar la perpetuación del sangrado y la expansión del hematoma. Es importante recordar que la vida media de la warfarina es de 36 a 42 horas.
La terapéutica disponible incluye: vitamina K, plasma fresco, concentrados de complejo protrombinico y factor VII activado recombinante(34).
La vitamina K es generalmente insuficiente por si sola para normalizar rápidamente el INR, lográndose una respuesta terapéutica en no menos de 2 a 6 horas y a veces hasta 24 horas. Se han reportando casos de anafilaxia o alergia con su uso, si bien su incidencia es baja en la población general.
El plasma fresco contiene todos los factores de la coagulación en una forma no concentrada, por lo que para lograr una corrección de la hemostasia se requieren grandes volúmenes. Esto puede llevar a complicaciones por sobrecarga hídrica en los pacientes agregando morbilidad, además de las complicaciones potenciales relacionadas con las transfusiones tales como alergia e infecciones, entre otras(35).
El complejo protrombínico puede ser administrado sin realizarse previamente test de compatibilidad. Tiene altas concentraciones de factores de coagulación en poco volumen con facilidad en su administración. Diversos estudios han mostrado la rápida corrección obtenida del INR con su uso(36). Sin embargo un estudio retrospectivo con 151 pacientes sugiere que no existe diferencia en las tasas de mortalidad a 90 días, con las diferentes estrategias utilizadas(37). Por otra parte, existe riesgo de inducción de trombosis y coagulación intravascular diseminada con su uso.
Por último el factor VIIa recombinante, ha sido planteado como un candidato promisorio para el tratamiento de estos pacientes por su rápido inicio de acción, buen perfil de seguridad y por requerirse poco volumen para su administración. Sin embargo, no repone todos los factores vitamina K dependientes y por tanto no restaura la generación de trombina en general, como el complejo protrombínico(38).
Si bien existen trabajos que muestran aumento de riesgo de trombosis y eventos embólicos luego de su administración, es importante destacar sin embargo, que y no todos los ensayos fueron realizados en HC por ACO y se trató de estudios pequeños(39,40).
En base a esta evidencia el Comité Británico de estándares en Hematología recomienda administrar 5 mg de vitamina K y 25-50 U/kg de complejo protrombínico (Clase IB) o 15 ml/kg de plasma fresco si no hay disponible complejo protrombínico (clase IC). El factor VIIa recombinante no está recomendado en forma sistemática (clase IB)(41).
El Colegio Americano de Médicos del Torax recomienda el uso de 10 mg de vitamina K y 25-50 U/kg de protrombina o 150-300 ml de plasma fresco(4).
Por su parte las guías de la American Heart Association/American Stroke Association recomiendan: vitamina K i/v (clase I nivel de evidencia C). Considerar complejo protrombínico como alternativa al plasma fresco por sus menores complicaciones a pesar de que no se ha demostrado mejores resultados (Clase IIa nivel de evidencia B), y no recomienda como agente único la administración de factor VIIa recombinante (clase III nivel de evidencia C)(1).
Indicación y oportunidad de inicio /reinicio de tratamiento anticoagulante, luego de una HC reciente
El riesgo de recurrencia de la HC en los pacientes que posteriormente se les indica tratamiento anticoagulante no está claro aún, y no hay estudios poblacionales al respecto. El riesgo de recurrencia de la población general es de 2 a 4% por año, y esto varia en función de la causa del evento(42).Es improbable que se realicen estudios clínicos aleatorizados para dilucidar el dilema del reinicio de los ACO luego de una HC, ya que la aleatorización de pacientes a recomenzar o no el tratamiento enfrentaría el cuestionamiento ético de someter a algunos de ellos a un riesgo predecible alto de recurrencia del sangrado y muerte.
El riesgo de mayor sangrado en los anticoagulados es mayor en el primer mes luego de la HC, y es aún mayor en los añosos, en los pacientes con INR mayor a 4, y luego de los hematomas de topografía lobar(4,22).
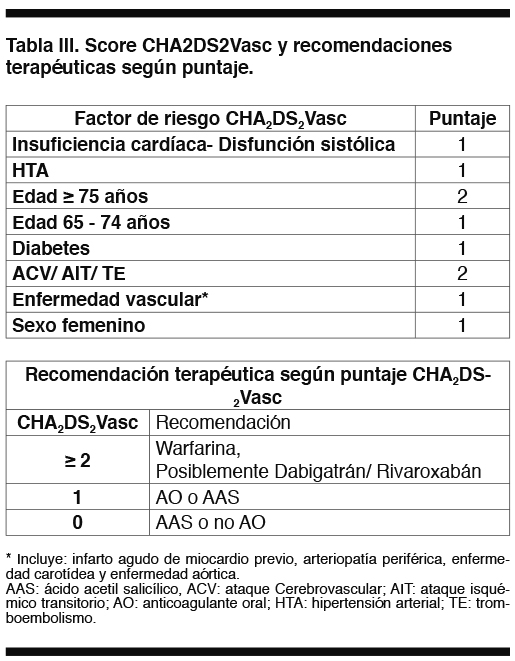
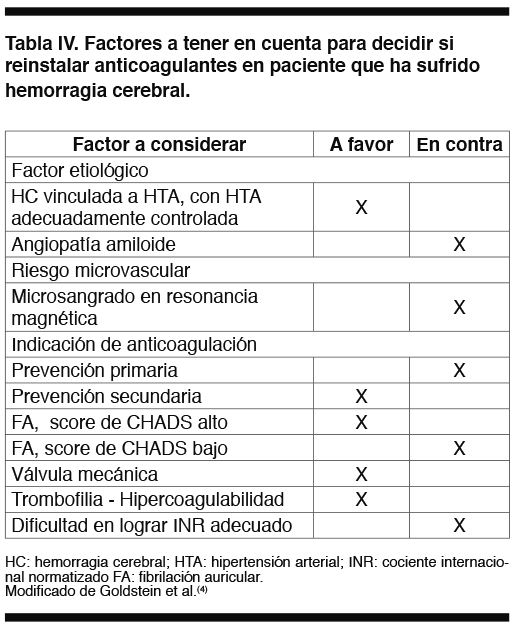
Se plantea que la decisión de iniciar o reiniciar ACO en estos pacientes debe individualizarse en función del riesgo de embolia, del riesgo de resangrado, de la causa del sangrado y de la indicación de anticoagulación. Michota et al(26)plantea valorar el riesgo de tromboembolismo si la ACO no se reinicia versus el riesgo de recurrencia de la HC si la ACO se retoma; las variables tomadas en cuenta para sopesar dichos riesgos se resumen en las Tablas I y II(26). Para categorizar el riesgo embólico de la fibrilación auricular (FA) utiliza el score de CHADS (ver más adelante).
Classen et al realizaron en 2008 un estudio retrospectivo que tenía como end points primarios la recurrencia de HC y los eventos tromboembólicos en pacientes en los que se había recomenzado la warfarina luego de una HC y en pacientes en que no se había reiniciado dicha terapia. Cuando se analizó la sobrevida libre de alguno de los eventos (HC o evento trombótico) en ambos grupos, no se hallaron diferencias estadísticamente significativas(43). En este estudio, existía un número significativamente mayor de pacientes portadores de válvulas mecánicas en el grupo en que se recomenzó la warfarina, y la edad era más avanzada en el grupo que no se retomó la terapia anticoagulante.
Si bien existen diversas condiciones clínicas que constituyen indicación de anticoagulación oral, el riesgo tromboembólico que implican cada una de ellas es heterogéneo. En forma global, la fibrilación auricular incrementa 5 veces el riesgo de ACV,(44) sin embargo ese incremento del riesgo no es igual en todos los pacientes con FA, y es afectado por otras variables con las que se han confeccionado scores que predicen el riesgo embólico del paciente con FA. Uno de los más utilizados es el score de CHADS cuya sigla significa C: insuficiencia cardíaca; Hipertensión; A: edad > 75 años, Diabetes y Stroke o ataque isquémico transitorio (AIT) previo. Este score ha sufrido algunas modificaciones a su versión inicial, existiendo ahora el score CHA2DS2Vasc que agrega la variable de enfermedad vascular, e incrementa el puntaje de la edad y el antecedente de ACV previo(45) (Tabla III). La evaluación del riesgo embólico de la FA no valvular entonces podría contribuir a la toma de decisiones a favor de re-iniciar la ACO o proscribirla indefinidamente de acuerdo al riesgo embólico inherente a esa FA en cada paciente. Un puntaje de CHADS igual a 0 confiere un riesgo anual de ACV de 1,9%, mientras que un puntaje de 6 otorga un riesgo anual de 18,2%
Otra condición fuertemente asociada al riesgo de cardioembolia son las prótesis valvulares cardíacas, mecánicas y los estados de hipercoagulabilidad o trombofilias, y ambos confieren un riesgo que es permanente y sostenido, diferente al que confiere por ejemplo una TVP, que requiere anticoagulación por un período de tiempo limitado.
El poseer una válvula mecánica acarrea un riesgo de infarto cerebral cercano al 4% por año. Existe evidencia que las válvulas mecánicas en posición mitral confieren mayor riesgo que en posición aórtica, lo que también varía de acuerdo al modelo de prótesis utilizada siendo la Starr Edwards indicación de anticoagulación a INR más alto (2,5-3,5), aún en posición aórtica(46). Los primeros meses luego de colocada son los de mayor riesgo embólico, hasta que produce la endotelización de la prótesis valvular.
Otro factor que inclinaría la balanza a favor de reiniciar la terapia anticoagulante es la indicación de la misma en un contexto de profilaxis secundaria de un evento tromboembólico, es decir cuando ya ha ocurrido uno al menos, que en prevención primaria(2,43).
La topografía de una HC, lo que está a su vez relacionada con la etiología del sangrado también confiere distinto riesgo de recurrencia, siendo el hematoma gangliobasal asociado a hipertensión arterial menos recurrente que el hematoma lobar asociado a angiopatía amiloide.
La posibilidad de lograr una buena adherencia al tratamiento anticoagulante con rango adecuado de INR también es una variable a tener en cuenta, ya que el riesgo de HC se incrementa considerablemente con INR > 4, si bien en el estudio de Fang et al. la mediana de INR de los pacientes que presentaron sangrado intracraneano fue de 2,7, con rango intercuartílico 2,3 a 4.3
Del balance de las variables analizadas y otras Goldstein et al. resumen qué factores abogarían a favor y en contra de reiniciar terapia anticoagulante en pacientes que han tenido una HC.2 Tabla IV.
¿Cuándo empezar?
El lapso de tiempo en que la warfarina puede iniciarse o reiniciarse también varía de acuerdo a los autores. La iniciativa europea de stroke (European Stroke Initiative) recomienda de ser necesario el inicio de la ACO , realizarlo a los 10 a 14 días luego del evento(47). Por su parte la American Heart Association/American Stroke Association sugiere reiniciar la warfarina de 7 a 10 días post HC(1).
Nuevas drogas anticoagulantes
Tanto las revisiones como los estudios retrospectivos sobre el inicio o reinicio de la ACO en los pacientes que han presentado una HC se realizaron en pacientes que recibieron warfarina. En el último tiempo, se han incorporado nuevas drogas anticoagulantes orales como el Dabigatrán etexilato y el Rivaroxabán. El dabigatrán es un inhibidor de la trombina libre y unida al trombo mientras que el rivaroxabán es un inhibidor específico del Factor Xa. Inicialmente su uso fue aprobado para la tromboprofilaxis en cirugía ortopédica de cadera y rodilla, y más recientemente se han realizado ensayos clínicos aleatorizados que contemplan otras indicaciones. A partir del estudio RE-LY, el dabigatrán fue aprobado por la Food and Drug Administration de los EE.UU. para prevención de la cardioembolia en pacientes con FA, mientras que el reciente publicado estudio ROCKET con rivaroxabán también estudia la utilidad del mismo en la prevención del ACV en pacientes con FA. En el estudio RE-LY, dabigatrán mostró una eficacia similar a la warfarina pero con menor tasa de sangrado a la dosis de 110 mg dos veces al día y una efectividad mayor en la prevención de eventos tromboembólicos a dosis de 150 mg dos veces al día(48).
En el estudio ROCKET-AF se compara la efectividad de Rivaroxabán frente a Warfarina en la prevención de ACV en pacientes con FA no valvular. Se concluye que rivaroxabán no es inferior a warfarina para la prevención de embolia sistémica y si bien las tasas de hemorragia fueron similares en ambos grupos, la frecuencia de hemorragia intracraneal y fatal fue inferior en el grupo de rivaroxabán(49). Tanto el dabigatrán como el rivaroxabán fueron aprobados en noviembre de 2011 para prevención de ACV en pacientes con fibrilación auricular.
De la evidencia derivada de estos ensayos clínicos aleatorizados parece desprenderse que los nuevos anticoagulantes podrían ser más seguros que la warfarina respecto a la ocurrencia de sangrados, aparte de otras ventajas como la no necesidad de monitorización estrecha de laboratorio, dada su estabilidad. No obstante se deberá esperar a su uso masivo, en otras indicaciones (válvulas mecánicas, trombofilias,etc.) y mayor evaluación para conocer si su utilización en el escenario del paciente de alto riesgo tromboembólico que ha tenido HC es más segura que la warfarina. Aún están pendientes los resultados con epixabán.
El manejo de la sobredosis de estos nuevos fármacos se encuentra en etapa de investigación y no hay consenso sobre manejo definitivo de los sangrados graves planteándose como opciones la administración de factor VII recombinante o concentrado de protrombina incluyéndose también hemodiálisis y ultrafiltración como otras alternativas(50).
Alternativas a la ACO
Los filtros de vena cava (FVC) han sido evaluados en un estudio clínico aleatorizado- PREPIC, y en series de casos y estudios retrospectivos. Streiff et al realizaron una revisión extensa de los evidencia disponible sobre estos dispositivos, concluyendo que el uso de los mismos solo debe restringirse a las situaciones en que la anticoagulación está estrictamente contraindicada, como en la HC. Si bien estos dispositivos disminuyen la ocurrencia de TEP, existe cierta evidencia de que pueden aumentar la frecuencia de TVP y el síndrome post-flebítico(51). Tampoco existe una evidencia clara a favor de los filtros transitorios versus los permanentes o sobre el modelo de dispositivo, ya que no ha habido estudios con diseño apropiado para evaluar esos aspectos.
La Asociación Americana de Médicos del Tórax en su 8ª Guía de Terapia Antitrombótica realiza recomendaciones precisas sobre el uso de dispositivos FVC inferior como alternativa cuando la terapia anticoagulante implica un riesgo inadmisible, recomendando su uso con nivel de evidencia grado 1, C en los pacientes con TVP aguda proximal o TEP agudo en los que la anticoagulación no es posible por el riesgo de sangrado(4). También agregan que en los pacientes con TVP aguda proximal o TEP agudo en los que se colocó un FVC como alternativa a la anticoagulación debido a riesgo de sangrado se recomienda la indicación de tratamiento anticoagulante en forma adicional, si se resuelve el riesgo de sangrado.
CONCLUSIONES
El ataque cerebrovascular hemorrágico o hemorragia cerebral no traumática es una importante causa de mortalidad y morbilidad a nivel mundial.
La enfermedad tromboembólica es una complicación frecuente en estos pacientes siendo necesaria su profilaxis para evitar mayor morbimortalidad.
La prevención de la ETEV puede ser realizada a través de medidas mecánicas o farmacológicas.
Se recomienda que los pacientes con ACV reciban compresión neumática intermitente para la prevención de ETEV, además de medias elásticas
Otra de las opciones terapéuticas existentes son las heparinas de bajo peso molecular, pero para indicarlas se debe considerar el riesgo de resangrado intracraneano.
Se recomienda el uso de HBPM o heparina no fraccionada para la prevención de la TVP, a partir del segundo o tercer día del evento hemorrágico, segun las diferentes guias analizadas.
La complicación más temida del uso de anticoagulantes es el sangrado y, dentro de ellos, el sangrado intracraneano es el que confiere más morbimortalidad
La hemorragia cerebral representa 90% de las muertes causadas por sangrado vinculadas a la warfarina.
La reversión del estado de anticoagulación es la primera medida a tener en cuenta frente a un paciente que se presenta con una HC y que recibe anticoagulantes
Existen diferentes pautas terapéuticas para lograr corregir la coagulación planteándose como opciones: la vitamina K, el plasma fresco, los concentrados de protrombina y el factor VII activado recombinante.
El reinicio de la terapia anticoagulante luego de una hemorragia cerebral es una muy difícil decisión, que deberá individualizarse teniendo en cuenta las caracteristicas y el contexto clinico del paciente, valorando riesgo beneficio del tratamiento que se va a administrar o suspender.
No existe consenso sobre la oportunidad de inicio de la anticoagulación, si ésta estuviera indicada, pero debe diferirse desde el evento agudo en no menos de 7 días
No existen estudios aún con respecto a los nuevos ACO, tanto en la producción de HC como en el inicio de tratamiento luego de ella.
BibliografÍa
1. Morgenstern L, Hemphill III J. C, Anderson C, Becker K, Broderick J, Connolly ES Jr et al. Guidelines for the Management of Spontaneous Intracerebral Hemorrhage: A Guideline for Healthcare Professionals From the American Heart Association/ American Stroke Association. Stroke 2010,41:2108-29
2. Goldstein J, Greenberg S. Should Anticoagulation Be Resumed After Intracerebral Hemorrhage? Cleveland Clinic Journal of Medicine 2010;77: 791-99
3. Fang MC, Go AS, Chang Y, Hylek EM, Henault LE, Jensvold NG, et al. Death and disability from warfarin-associated intracranial and extracranial hemorrhages. Am J Med 2007; 120:700-705
4. Kearon C, Kahn S, Agnelli G, Goldhaber S, Raskob G, Comerota A. American College of Chest Physicians Evidence-Based Antithrombotic Therapy for Venous Thromboembolic Disease Clinical Practice Guidelines 8th Edition Chest 2008;133:454-545
5. Ministerio de Salud Pública del Uruguay. Dirección General de la Salud. Unidad de Información Nacional en Salud. Defunciones ocurridas y Registradas según Causa de muerte y sexo. 2008.
6. Comisión Honoraria para la Salud Cardiovascular. Área Epidemiología y Estadística. 2008. Mortalidad por enfermedades cardiovasculares en el Uruguay. Curto S, Prats O, Martinez L. Disponible en: http://www.cardiosalud.org
7. Otero Candelera R, Grau Segura R, Jiménez Castro D, Uresandi Romero F, López Villalobos JL, Calderón Sandubete E, et al. Profilaxis de la enfermedad tromboembólica venosa. Arch. Bronconeumol. 2008;44(3):160-9.
8. Anderson FA, Wheeler HB, Goldberg RJ, Hosmer DW, Patwardhan NA, Jovanovic B, et al. A population based perspective of the hospital incidence and case-fatality rates of deep vein thrombosis and pulmonary embolism. The Worcester DVT Study. Arch Intern Med. 1991;151:933-38.
9. HirshJ, Bates S. Clinical trials that have influenced the treatment of venous thromboembolism: A historical perspective. Ann Intern Med 2001; 134: 409-17.
10. Pérez G, Alonso J, Estévez M, Martínez R. Trabajo multicéntrico sobre profilaxis de la Enfermedad Tromboembólica Venosa (ETEV) en los pacientes hospitalizados. Arch Med Int 2007; XXIX (2-3): 46-51
11. Samama MM, Cohen AT, Darmon JY, Desjardins L, Eldor A, Janbon C, et al. A comparison of enoxaparin with placebo for the prevention of venous thromboembolism in acutely ill medical patients. Prophylaxis in Medical Patients with Enoxaparin Study Group. N Engl J Med. 1999;341:793-800.
12. Leizorovicz A, Cohen AT, Turpie AG, Olsson CG, Vaitkus PT, Goldhaber SZ. Randomized, placebo-controlled trial of dalteparin for the prevention of venous thromboembolism in acutely ill medical patients. Circulation 2004;110:874-79
13. Cohen AT, Davidson BL, Gallus AS,Lassen MR, Prins MH, Tomkowski W et al. Efficacy and safety of fondaparinux for the prevention of venous thromboembolism in older acute medical patients: randomised placebo controlled trial. BMJ 2006;332:325-29.
14. Keane MG, Ingenito EP, Goldhaber SZ. Utilization of venous thromboembolism prophylaxis in the medical intensive care unit. Chest 1994; 106:13-14.
15. Márquez M, Zeballos M, Bazzino I. Profilaxis de le enfermedad tromboembólica venosa: indicación y realización en pacientes internados en el Hospital de Clínicas. En: Belloso A, Martinez R. Enfemedad Tromboembólica Venosa. Arena Ed. 2005:69-76.
16. Hamilton. M, Hull R, Pineo. G. Venous Thromboembolism in Neurosurgery and Neurology Patients: A Review. Neurosurgery 1994, 34(2): 280-310.
17. Andre C, de Freitas GR, Fukujima MM. Prevention of deep venous thrombosis and pulmonary embolism following stroke: a systematic review of published articles. European Journal of Neurology 2007, 14(1):21-32.
18. Cohen AT, Alikhan R, Arcelus JI, Bergmann JF, Haas S, Merli GJ et al. Assessment of venous thromboembolism risk and the benefits of thromboprophylaxis in medical patients. Thrombosis and Haemostasis 2005, 94(4):750-9.
19. Gregory PC, Kuhlemeier KV. Prevalence of venous thromboembolism in acute hemorrhagic and thromboembolic stroke. American Journal of Physical Medicine and Rehabilitation 2003, 82(5):364-9.
20. Lacut K, Bressollette L, Le Gal G, Etienne E, De Tinteniac A, Renault A et al. VICTORIAh. (Venous Intermittent Compression and Thrombosis Occurrence Related to Intra-cerebral Acute hemorrhage) Investigators. Prevention of venous thrombosis in patients with acute intracerebral hemorrhage. Neurology. 2005;65:865- 9.
21. CLOTS Trials Collaboration, Dennis M, Sandercock PA, Reid J, Graham C, Murray G, Venables G, Rudd A, et al. Effectiveness of thigh-length graduated compression stockings to reduce the risk of deep vein thrombosis after stroke (CLOTS trial 1): a multicentre, randomized controlled trial. Lancet. 2009;373:1958 -65.
22. Dickmann U, Voth E, Schicha H, Henze T, Prange H, Emrich D.Heparin therapy, deep-vein thrombosis and pulmonary embolism after intracerebral hemorrhage. Klin Wochenschr. 1988;66:1182-3
23. Boeer A, Voth E, Henze T, Prange HW. Early heparin therapy in patients with spontaneous intracerebral haemorrhage. J Neurol Neurosurg Psychiatry. 1991;54:466-7
24. Grupo de trabajo de la Guía de prevención del ictus. Centro Cochrane Iberoamericano, coordinador. Guía de práctica clínica sobre la prevención primaria y secundaria del ictus. Madrid: Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad y Consumo. Agència d’Avaluació de Tecnologia i Recerca Mèdiques; 2008
25. Instituto de Neurología. Hospital de Clínicas. Facultad de Medicina. Universidad de la República. Uruguay. Manual diagnostico y terapéutico de la Unidad de ACV. Montevideo. 2010
26. Michota F. Intracerebral hemorrhage: Pick your poison. Cleve Clin J Med 2010; 77:743-746
27. Hutter HB, Schellinger PD, Hartmann M, Kohrmann M, Juettler E, Wikner J, et al. Hematoma growth and outcome in treated neurocritical care patients with intracerebral hemorrhage related to oral anticoagulant therapy: comparison of acute treatment strategies using vitamin K, fresh frozen plasma, and prothrombin complex concentrates. Stroke 2006;37(6):1465-70.
28. Steiner T, Rosand J, Diringer M. Intracerebral Hemorrhage Associated with Oral Anticoagulant Therapy. Stroke 2006; 37:256-62
29. Hart RG. What causes intracerebral hemorrhage during warfarin therapy? Neurology. 2000; 55:907-8
30. Rosand J, Eckmand MH, Kknuden KA. The effect of warfarin and intensity of anticoagulation on outcome of intracerebral hemorrhage. Arch Intern Med 2004;164:880-4
31. Davis SM, Broderick J, Hennerici M, Brun NC, Diringer MN, Mayer SA, et al. Hematoma growth is a determinant of mortality and poor outcome after intracerebral hemorrhage. Neurology 2006; 66(8):1175-81
32. Sousa L, Zorrilla JP, Latini MF, Alvarez Abut P, Ayala M, Romano LM, et al. ¿Es el cociente normalizado internacional un factor pronóstico de mortalidad en hemorragias intracerebrales? Neurologia 2011;26:528-32
33. Mayer SA. Ultra-early hemostatic therapy for intracerebral hemorrhage. Stroke 2003; 34:224-9
34. National Collaborating Centre for Chronic Conditions. Stroke: national clinical guideline for diagnosis and initial management of acute stroke and transient ischaemic attack (TIA). London: Royal College of Physicians, 2008. Disponible en http://www.rcplondon.ac.uk/
35. Hemphill J. Treating Warfarin-Related Intracerebral Hemorrhage. Is Fresh Frozen Plasma Enough? Stroke 2006;37:6-7
36. Leissinger CA, Blatt PM, Hoots WK, Ewenstein B. Role of prothrombin complex concentrates in reversing warfarin anticoagulation: a review of the literature. Am J Hematol. 2008;83:137-43.
37. Sjöblom L, Hårdemark HG, Lindgren A, Norrving B, Fahlén M, Samuelsson M, et al. Management and prognostic features of intracerebral hemorrhage during anticoagulation therapy: a Swedish multicenter study. Stroke. 2001;32:2567-74
38. Tanaka KA, Szlam F, Dickneite G, Levy JH. Effects of prothrombin complex concentrate and recombinant activated factor VII on vitamin K antagonist induced anticoagulation. Thromb Res. 2008;122:117-23.
39. Robinson MT, Rabinstein AA, Meschia JF, Freeman WD. Safety of recombinant activated factor VII in patients with warfarin-associated hemorrhages of the central nervous system. Stroke.2010; 41 (7):1459-63.
40. Mayer SA, Brun NC, Begtrup K, Broderick J, Davis S, Diringer MN, et al. Recombinant activated factor VII for acute intracerebral hemorrhage. N Engl J Med. 2005;352(8):777-85.
41. Keeling D, Baglin T, Tait C, Watson H, Perry D, Baglin C, et al. Guidelines on oral anticoagulation with warfarin - fourth edition. . Br J Haematology 2011 Aug;154(3):311-24
42. Bailey RD, Hart RG, Benavente O. Recurrent brain hemorrhage is more frequent than ischemic stroke after intracranial hemorrhage. Neurology 2001;56:773-77
43. Claasen D, Kazemi N, Zubkov A, Wijdicks EF, Rabinstein AA. Restartin Anticoagulation Therapy After Warfarin - Associates intracerebral Hemorrhage. Arch Neurol 2008;65(10):1313-18
44. Wolf PA, Abott RD, Kannel WB. Atrial fibrillation as an independent risk for stroke: the Framingham Study. Stroke 1991;22:983-8
45. Gregory Y. Anticoagulation therapy and the risk of stroke in patients with atrial fibrillation al moderate risk: simplyfing stroke risk assessment and thromboprophylaxis in real- life clinical practice. Thromb Haenost 2010;103: 683-85
46. Bonow R, Carabello B, Chatterjee K, de Leon A, Faxon D, Freed M, et al. 2008 Focused Update IncorporatedelInto the ACC/AHA 2006 Guidelines for the Management of Patients With Valvular Heart Disease. Circulation 2008;118:e523-e661.
47.Steiner T, Kaste M, Forsting M, Mendelow D, Kwiecinski H, Szikora I, et al. Recommendations for the management of intracranial haemorrhage - part I: spontaneous intracerebral haemorrhage. The European Stroke Initiative Writing Committee and the Writing Committee for the EUSI Executive Committee. Cerebrovasc Dis 2006; 22:294-316
48. Connolly S, Ezekowitz M, Phil D, Yusuf S. Dabigatran versus Warfarin in Patients with Atrial FibrillationN Engl J Med 2009; 361:1139-1151
49. Patel M, Mahaffey K, Garg J, Pan G, Singer D, Hacke W et al. Rivaroxaban versus Warfarin in Nonvalvular Atrial Fibrillation. N Engl J Med 2011.paginas.
50. Van Ryn J, Stangier J, Haertter S, Liessenfeld KH, Wienen W, Feuring M, et al. Dabigatran etexilate - a novel, reversible, oral direvt thrombin inhibitor: Interpretation of coagulation assays and reversal of anticoagulant activity. Thromb Haemost 2010;103:1116-27.
51. Streiff MB. Vena caval filters: a comprehensive review. Blood 2000; 95:3669-77.