Introducción
La infección a citomegalovirus (CMV) es la infección congénita más frecuente en la actualidad, reportándose una prevalencia entre 5 a 20 cada 1.000 nacimientos1. De éstos, hasta el 85%-90%2 no presentarán sintomatología al nacer. Luego de la infección por CMV, el ser humano se mantiene como portador de la infección viral, pudiendo observarse reactivaciones asociadas a situaciones que modifican la inmunidad del huésped. La transmisión materna fetal de infección por CMV puede producirse por reactivación o debido a una reinfección materna por un serotipo viral diferente, dada la gran variabilidad de serotipos existentes.
La infección primaria es la que conlleva mayor riesgo de transmisión vertical y explica la tercera parte de las infecciones congénitas a CMV. Aunque el riesgo de transmisión vertical debido a infección no primaria es de 1,1% a 1,7%, es la causa de las dos terceras partes de infección congénita por CMV, debido a su alta prevalencia en la población3-5.
El riesgo de secuelas neurológicas es elevado, compromete tanto a infecciones congénitas por CMV sintomáticas o asintomáticas. Es la causa más frecuente de sordera neurosensorial no genética, con una incidencia de 13% de los pacientes asintomáticos al nacer1,2,6.
Se están desarrollando múltiples estrategias preventivas para disminuir la carga de esta enfermedad. Ensayos clínicos en etapas avanzadas están en desarrollo para realizar una vacuna contra el CMV en madres no inmunizadas, basado en la premisa de que la inmunidad previa, tanto natural como inducida, disminuye la tasa de transmisión. No obstante, la vacuna solo genera una protección parcial y mantiene sin resolver el problema de las madres previamente infectadas7,8.
Las estrategias educacionales para la prevención de la infección congénita de citomegalovirus sobre el manejo de las secreciones de los niños han demostrado efectividad y son las únicas hasta el momento recomendadas. El screening universal de la infección congénita como prevención secundaria ha demostrado costo efectividad9,10.
En Uruguay, no se cuenta con datos sobre el perfil epidemiológico de esta enfermedad. Datos regionales, como los reportados por la Sociedad Chilena de Infectología11, muestran altas prevalencias maternas, con una diferencia marcada entre mujeres embarazadas de nivel socioeconómico bajo (hasta el 90%) y en niveles socioeconómico altos (50%).
Este estudio tiene el objetivo de caracterizar el perfil epidemiológico de la población de recién nacidos afectados de forma sintomática por esta infección en el centro de referencia neonatal de Uruguay.
Material y método
Se realiza un estudio retrospectivo, descriptivo, observacional, transversal. Se define la población como todos los pacientes ingresados en el Servicio de Recién Nacidos del Centro Hospitalario Pereira Rossell de Montevideo en el período comprendido entre el 1º de enero de 2010 y el 31 de diciembre de 2018 que cumplían con los criterios de inclusión. Se recabaron datos del sistema de historia clínica electrónica del centro.
Se considera como criterio de inclusión en el estudio presentar una PCR en orina, sangre o saliva en las primeras tres semanas de vida y al menos una alteración clínica o paraclínica. Se excluyen dos recién nacidos con diagnóstico de citomegalovirosis congénita cuya historia no definía el momento de diagnóstico.
Se define como variables a estudiar la incidencia del CMV congénito (número de casos cada 1.000 nacidos vivos), la mortalidad (porcentaje de niños fallecidos del total de la muestra), hallazgos ecográficos prenatales, búsqueda de citomegalovirus materno en el embarazo, datos antropométricos al nacer, método de estudio para diagnóstico de CMV congénita, muestra biológica en que se realizó, alteraciones clínicas y paraclínicas presentadas en la evolución perinatal, realización de tratamiento, fármaco usado y duración de éste, presencia de efectos adversos y resultado de anatomía patológica de placenta. Se define pequeño para la edad gestacional como menor al percentil 10 para la edad gestacional y microcefalia como perímetro craneano menor al percentil 3 para la edad gestacional. Para los cálculos antropométricos se utilizan las curvas modificadas de Usher y Mc Lean.
Las variables clínicas y extensión lesional se agrupan por tipo de manifestación presentada y se calcula su prevalencia.
En el análisis descriptivo las variables categóricas se expresan en valor absoluto y las variables continuas en medidas de resumen central.
El estudio fue presentado y aprobado por el Comité de Ética del Centro Hospitalario Pereira Rossell.
Resultados
Se identifican 19 recién nacidos en el período que cumplían con los criterios de inclusión. Las edades gestacionales de la muestra oscilan entre 26 y 42 semanas, con una media de 36 semanas. En cuanto a las medidas antropométricas, siete recién nacidos tuvieron peso adecuado para su edad gestacional y 12 fueron pequeños para la edad gestacional.
Fallecieron dos pacientes de los 19 que cumplían con los criterios de inclusión.
De la paraclínica sanguínea materna, 12 madres no cuentan con búsqueda del estado serológico materno. Una mujer presenta durante la gestación PCR en sangre positivo para CMV sin estudio serológico, una con resultado de PCR en líquido amniótico con serología de inmunización previa, cinco presentan patrón de inmunización previa sin otro estudio. En ningún caso se realiza test de avidez de inmunoglobulina G.
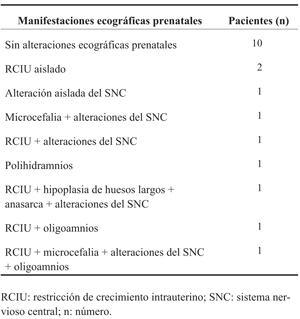
Los hallazgos de la valoración prenatal se representan en la (Tabla 1). Diez mujeres durante la gestación tienen ecografías prenatales normales.
Se realizó el estudio anatomopatológico de la placenta en siete de 19 casos. En cinco casos se obtienen elementos de infección placentaria por citomegalovirus, en dos casos se consignaron hallazgos inespecíficos, como vellositis crónica, microangiomas o trombosis compatibles con infección.
En cuanto al diagnóstico posnatal todos los pacientes son diagnosticados mediante técnica de PCR. En siete, se toman exclusivamente muestras sanguíneas; en cinco, muestras de orina, siete pacientes usan simultáneamente muestras en sangre y orina para el diagnóstico. Los resultados en aquellos que tienen dos muestras coinciden como positivos en todos los casos. En ocho de los casos donde se realiza PCR, el estudio fue cuantitativo (carga viral), en el resto fueron cualitativos (cinco pacientes).
Las manifestaciones clínicas por paciente se encuentran resumidas en la (Tabla 2), estando las manifestaciones paraclínicas resumidas también por paciente en la (Tabla 3).
En cuanto al tratamiento utilizado, 16 de 19 pacientes reciben tratamiento. En tres casos no se realiza tratamiento por presentar manifestaciones clínicas leves o moderadas.
El inicio de tratamiento es en todos con ganciclovir intravenoso. La media de uso de ganciclovir es de 28 días, con un rango de entre 6 y 45 días.
De los 16 pacientes tratados, ocho realizan tratamiento exclusivamente con ganciclovir y nueve continúan tratamiento con valganciclovir. La media de uso de valganciclovir es de 21 días, con un rango de entre 5 y 40 días.
En cuanto a las reacciones adversas, nueve toleran bien el tratamiento, siete presentan reacciones adversas. De las reacciones adversas, dos pacientes presentan neutropenia aislada, un paciente plaquetopenia aislada y cuatro pacientes presentan ambas complicaciones. Estos últimos, dada la severidad de éstas, obligan a la suspensión del tratamiento.
Discusión
La incidencia de infección connatal por citomegalovirus con presentación sintomática o con expresión clínica en el Servicio de Recién Nacidos del Centro Hospitalario Pereira Rossell entre el 1º de enero de 2010 al 31 de diciembre de 2018 fue de 0,2/1.000 nacidos vivos. Esta incidencia es menor a la reportada a nivel internacional, comprendida entre 0,15% y 2%6. Inagaki y colaboradores reportan una incidencia de 0,4% a 0,6%12. Los resultados en el presente estudio pueden deberse a una baja sospecha diagnóstica y subdiagnóstico.
Con respecto al estudio realizado a las pacientes durante la gestación se realiza serología IgG e IgM para infección citomegálica. No se realiza test de avidez en ningún caso. El test de avidez es el método más confiable actualmente para diferenciar las pacientes con primoinfección con una especificidad de 100% y sensibilidad de 100% si se realiza a las 16 y 18 semanas de gestación y sensibilidad; 62,5% luego de las 20 semanas. Dado que se ha encontrado de 3% a 10% de pacientes con IgM negativo e IgG con afinidad baja se propone este estudio de forma general13-15.
Solamente en un caso se realiza amniocentesis para confirmar la infección a través de una PCR en líquido amniótico, único método que confirma la infección.
La incidencia de alteraciones en el ultrasonido durante la gestación es de nueve de 19 pacientes (47%), resultados similares a los reportados por Johnson y colaboradores.
Un elemento interesante y poco destacado en la bibliografía internacional está vinculado a la anatomía patológica de la placenta. En siete de 10 pacientes en las cuales se realiza anatomía patológica, presentaron hallazgos patológicos compatibles con infección específica a citomegalovirus, mientras que dos orientaban una infección, resultando en este caso una herramienta útil para la orientación diagnóstica.
En cuanto a la valoración etiológica del recién nacido, se destaca que en 14 de 19 casos se realiza PCR en muestras sanguíneas, siete de ellos fueron estudiados también con PCR en orina.
A 12 pacientes se les realiza PCR en orina, siete de ellos son valorados concomitantemente con PCR en orina y sangre y solamente cinco de 19 son valorados con PCR en muestras de orina de forma exclusiva, siendo la muestra de orina la recomendada actualmente por su baja invasividad, sensibilidad de 100% y especificidad de 99%1.
No se utilizó en ningún caso la saliva como muestra biológica para la realización de PCR en tiempo real. El estudio en saliva en las primeras tres semanas de vida es un método de análisis de fácil acceso que se recomienda actualmente para realizar el diagnóstico de infección congénita por CMV como alternativa a la urinaria. Una de las dificultades a tener en cuenta con la muestra en saliva es que puede contaminarse con leche materna, resultando en un falso positivo1,16-20.
En ningún caso se realiza el diagnóstico retrospectivo mediante la muestra de sangre de talón de la pesquisa neonatal obligatoria. Este estudio se vuelve particularmente importante una vez transcurridas las tres primeras semanas de vida21, presentando una especificidad de 99% y una sensibilidad de 84%.
En cuanto a la valoración de extensión lesional, la presentación clínica y paraclínica de nuestros pacientes no difiere de lo descripto en la bibliografía consultada. Tanto la valoración clínica como paraclínica reflejaron el amplio espectro de repercusión que presenta la infección connatal por CMV1,2,16.
Debido al alcance de nuestro estudio y a que la valoración auditiva y visual se realizara para lograr un mayor poder diagnóstico y pronóstico entre los tres y seis meses, no se sacaron conclusiones sobre dichos elementos.
El tratamiento realizado en los 19 recién nacidos se inicia con ganciclovir con una duración media de 27,2 días (5-45 días), ocho de los cuales cumplieron seis semanas de tratamiento con ganciclovir y posteriormente continuaron su tratamiento con valganciclovir por vía oral, con una duración media de 28,2 días (5-42). La alta variabilidad de duraciones se propone asociado a la disponibilidad del fármaco, presencia de efectos adversos y diferencias de criterio clínico, dado que no se contaba con un protocolo establecido de tratamiento.
La recomendación actual es iniciar el tratamiento con valganciclovir vía oral y continuar el tratamiento durante seis meses siempre y cuando el paciente tolere adecuadamente el tratamiento, existiendo fuerte evidencia para sostener esta afirmación1,22-26. El inicio con ganciclovir por seis semanas y posteriormente continuar con valganciclovir hasta completar los seis meses, se propone como segunda alternativa1,16,27. Los efectos adversos vinculados a la medicación fueron coincidentes con los descriptos en la bibliografía1,22,28, siete de 19 pacientes presentaron neutropenia, plaquetopenia y sangrado activo. En cuatro casos la severidad de las complicaciones llevó a la supresión del tratamiento.
En Uruguay no se realiza cribado prenatal ni posnatal de infección por CMV y se desconocen reportes sobre prevalencia de sordera neurosensorial y neurodesarrollo a largo plazo. Al momento actual se conoce que los pacientes sintomáticos son el 10%-15%2 de los infectados, que hasta el 13% de los pacientes asintomáticos pueden desarrollar sordera neurosensorial y peor desarrollo neurológico, y que el tratamiento con ganciclovir/valganciclovir demostró mejorar dicho pronóstico1,22. Estos resultados deben conducir a considerar el cribado posnatal sistemático como una medida costo-efectiva10,18,28.
Conclusiones
Durante el período estudiado obtuvimos 19 pacientes que cumplieron con los criterios de inclusión para nuestro trabajo, esto nos permite especular que diez veces más pacientes presentaron una citomegalovirosis asintomática y que de ellos, 13% serán los que presentarán secuelas auditivas y del neurodesarrollo a largo plazo.
Se observó gran diversidad de métodos diagnósticos y de protocolos de tratamiento, por lo cual se considera de fundamental importancia la creación de un protocolo de manejo del paciente con infección por citomegalovirosis connatal sintomática.
Se deberá realizar un estudio con PCR a nivel poblacional y un adecuado seguimiento de los pacientes positivos para conocer el alcance de esta patología a nivel de nuestro país.