Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Archivos de Pediatría del Uruguay
versão impressa ISSN 0004-0584versão On-line ISSN 1688-1249
Arch. Pediatr. Urug. vol.87 no.3 Montevideo set. 2016
Chagas congénito de segunda generación en Uruguay. Primer caso sintomático descrito en el país
Second generation congenital Chagas disease in Uruguay
First symptomatic case described in the country
1. Diplomatura Infectología Pediátrica. Asistente Clínica Pediátrica. Facultad de Medicina. UDELAR. Hospital de Paysandú.
2. Médico Pediatra. Ex Residente Pediatría. Hospital de Paysandú.
Hospital de Paysandú. ASSE.
Declaramos no tener conflictos de intereses.
Trabajo inédito. Se declara que el trabajo no ha sido sometido antes o después a consideración de otras publicaciones.
Fecha recibido: 18 de setiembre de 2015
Fecha aprobado: 26 de febrero de 2016
Resumen
El Chagas congénito se produce cuando la embarazada infectada trasmite el parásito al feto, situación que puede suceder en cualquier estadio de la enfermedad y momento del embarazo. Es el único mecanismo de trasmisión presente actualmente en Uruguay, con una incidencia cercana al 4%. La mayoría de los neonatos infectados nacen asintomáticos y un 10% al 40% presentan síntomas que son indistinguibles de otras infecciones de trasmisión vertical. La prematurez, el bajo peso, la hepatoesplenomegalia y las alteraciones hematológicas son los síntomas más frecuentes. El diagnóstico representa un desafío en aquellos lugares del país en donde, si bien la enfermedad era considerada endémica, no se realiza actualmente el screening obligatorio de la embarazada.
Se describe un lactante procedente de Paysandú, de medio socioeconómico deficitario, que fue pretérmino severo y que presentó al nacer alteraciones hematológicas de las tres series y hepatoesplenomegalia, lo cual motivó múltiples estudios. Sin embargo, no se sospechó la enfermedad hasta los 5 meses de vida, cuando volvió a ingresar por otra patología. Se confirmó la infección a los 9 meses mediante tres técnicas serológicas diferentes. Se indicó tratamiento con nifurtimox por 2 meses y a los 26 y 36 meses de vida presentó serología negativa. Consideramos importante tener alto índice de sospecha de la enfermedad en neonatos con signos de infección congénita y sin serología materna que la descarte. Es importante saber que el tratamiento antes del primer año de vida tiene una excelente respuesta y evita secuelas crónicas que pueden ser invalidantes en etapa adulta.
Palabras clave: ENFERMEDAD DE CHAGAS
TRASMISIÓN VERTICAL
DE ENFERMEDAD INFECCIOSA
RECIÉN NACIDO
Summary
Congenital Chagas disease occurs when an infected pregnant woman transmits the parasite to the fetus, a situation that can happen at any stage of disease and time of pregnancy. It is the only transmission mechanism currently present in Uruguay, with an incidence close to 4%. Most infected infants are born asymptomatic and 10 to 40% have symptoms that are indistinguishable from other infections’ vertical transmission. Prematurity, low birth weight, hepatosplenomegaly and hematological disorders are the most common symptoms. Diagnosis is a challenge in those areas where there is no current compulsory screening for pregnant women in spite of the disease being considered endemic. The study presents the case of an infant from Paysandú, coming from a low socio-economic environment, which was a severe preterm, and presented hematologic disorders of the three series at birth and hepatosplenomegaly, which caused many studies. However, there was no suspicion of the disease until the infant was five months old when re-entering by other pathology. Infection at nine months is confirmed by three different serological techniques. Nifurtimox therapy is indicated for two months and at twenty six and thirty six months of life the patient presents negative serology. A high level of suspicion is needed in order to diagnose the disease in infants with signs of congenital infection without maternal serology. It is important to know that treatment before the first year of life has excellent response and prevents chronic sequelae that can be disabling in adulthood.
Key words: CHAGAS DISEASE
VERTICAL INFECTIOUS
DISEASE TRANSMISSION
NEWBORN
Introducción
La enfermedad de Chagas es una infección parasitaria que mata silenciosamente. Se estima que 14.000 personas mueren por año y muchas de ellas sin saber que sufrían la enfermedad. En países de América del Sur y América central, donde la enfermedad es endémica, existen actualmente 8 a 15 millones de personas infectadas. Según la OMS en el año 2010 existían 5.742.167 personas infectadas con Trypanozoma cruzi en 21 países de América Latina, de los cuales 62,4% (3.581.423 personas) eran de países del Cono Sur. Argentina, Brasil y México fueron los tres países con el número más alto estimado de personas infectadas, seguido de Bolivia. La mejora en las condiciones de vivienda, la prevención y el control vectorial y de la transfusión muestran una reducción significativa de los casos humanos de la enfermedad. Aun así, sigue siendo una de las enfermedades parasitarias más importante del continente y a la que menos recursos se le adjudican para su estudio y tratamiento. La infección no es un problema de salud exclusivo de América Latina(1-3). La globalización, con la creciente migración de millones de individuos, ha determinado que ésta afecte a más de 10 millones de personas en todo el mundo, y ha obligado a países europeos y asiáticos a reconsiderar esta enfermedad olvidada y tenerla presente como otra causa de infección neonatal(4). La enfermedad fue diagnosticada hace más de 100 años por el brasilero Carlos Chagas. Es causada por un protozoario flagelado denominado Trypanozoma cruzi trasmitida al hombre y a diversos animales por insectos triatominos denominados en nuestro continente de muy diversas formas, y en Uruguay y el Cono Sur como vinchuca. Es una de las pocas enfermedades en que se pudo conocer el agente causal antes que la enfermedad(5). Se describen tres vías principales de infección: la vectorial, la transfusional, sanguínea y la vía transplacentaria o congénita.
En nuestro país, la primera descripción de la enfermedad por trasmisión vectorial fue realizada en una niña del Departamento de Paysandú en el año 1937 por los Dres. Talice, De Medina y Rial. A partir de ahí se comienzan a comunicar más casos de la enfermedad, a perfeccionar las técnicas de laboratorio, aplicar la profilaxis de la enfermedad con insecticidas y comenzar con el tratamiento específico (5).
En 1984 se describió en nuestro país el primer caso de Chagas congénito diagnosticado por xenodiagnóstico. Al año siguiente, el Ministerio de Salud Pública (MSP) decretó la obligatoriedad del tamizaje serológico en los bancos de sangre, lográndose así el control de la infección por este mecanismo, y diez años después decretó la obligatoriedad del screening a las embarazadas en departamentos endémicos (figura 1), incluyendo a la maternidad del Centro Hospitalario Pereira Rossell (CHPR). En 1997 un grupo de expertos de la OPS/OMS declararon al Uruguay libre de transmisión vectorial mediante la interrupción de la misma(5-7).
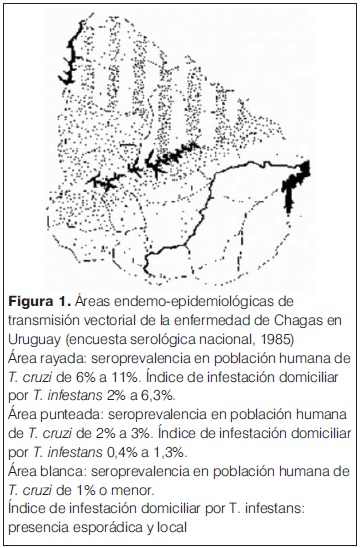
La última encuesta realizada en Uruguay en el año 1985 mostraba una prevalencia general de la infección del 3.4%. En ese momento se estimaba que existían 40.000 individuos afectados en forma crónica donde el 70% se encontraban en etapa asintomática y el 30% en etapa crónica sintomática. La forma crónica más frecuente es la miocardiopatía, seguido por el megacolon adquirido, el megaesófago y las alteraciones de la vejiga(5-7).
Sin embargo, en el año 2010 un reporte de la OMS estimaba un número mucho menor de la enfermedad en nuestro país donde existían 7.852 individuos infectados por T. cruzi, de las cuales 1.858 eran mujeres entre 15 y 44 años. La infección congénita se estimó en 20 casos por año, y la incidencia de trasmisión cada 100 recién nacidos vivos era de 0,040(3).
La infección congénita es el único mecanismo de transmisión presente en Uruguay. Un neonato se considera infectado cuando nace de una madre con serología positiva o parásitos que circulan en la sangre, cuando los parásitos son identificados al nacer, o cuando se detectan anticuerpos específicos luego de los 9 meses de vida habiéndose descartado la adquisición del mismo mediante transfusiones sanguíneas(8). La mayoría (60%-90%) de los recién nacidos afectados son asintomáticos. Sólo un pequeño porcentaje presenta signos que pueden evidenciar la infección. En los casos graves la clínica es indistinguible de la producida por otros agentes que causan infección vertical en el recién nacido. El bajo peso, la prematurez y la hepatoesplenomegalia son las manifestaciones más frecuentes; pero también se describe sepsis, ictericia, anemia, hepatitis, erupciones cutáneas, compromiso del sistema nervioso central y del miocardio (8-12). Lo más importante para establecer el diagnóstico de Chagas congénito es conocer y suponer su existencia, porque solo si se piensa en esta posibilidad se llegará al diagnóstico de los niños infectados cuando son asintomáticos y cuando el tratamiento es más eficaz.
El objetivo de esta comunicación es presentar el primer caso sintomático de Chagas congénito de segunda generación descrito en Uruguay.
Observación clínica
Lactante de 5 meses (FN 24/4/13), sexo masculino, procedente de Paysandú, de medio socioeconómico deficitario. Hijo de madre de 16 años, sana, producto de una primera gestación, y embarazo bien tolerado hasta las 30 semanas. El VDRL y HIV fueron no reactivos, la IgG para toxoplasma reactiva. Parto vaginal a las 30 semanas, Apgar 7/9, peso de 1.314 g, talla 37 cm y perímetro craneano de 27,5 cm, adecuado para la edad gestacional. Instala síndrome de dificultad respiratoria temprano (SDR) e íngresa a CTI.
Evolución y paraclínica en CTI, primera internación
Se diagnostica enfermedad de membrana hialina. Requiere asistencia ventilatoria mecánica por 12 h. Recibe oxígeno hasta los 19 días de vida y aminofilina hasta las 36 semanas por la presencia de apneas. Presenta ictericia tardía no isoinmune que requiere fototerapia por 2 días. Funcional hepático: GOT 62, GPT 11, GGT 224, FA 1.514, BT 1,50, BI 1,10. Calcemia, fosfatemia y hormonas tiroideas normales.
Presenta anemia desde el primer día de vida, la cual se mantiene y se agrava a los 25 días de vida cuando recibe transfusión de glóbulos rojos a pesar de estar recibiendo eritropoyetina y hierro (tabla 1).Recibe antibióticos por 3 días hasta lograr resultados de cultivos estériles. VDRL (cordón) y serología para hepatitis B fueron no reactivas. El ecocardiograma informó foramen oval permeable. Se destaca irritabilidad en los primeros días, por lo cual se solicitan drogas en orina que fueron negativas. Las ecografías transfontanelares fueron normales y la ecografía abdominal evidenció hepatoesplenomegalia, sin lesiones ni dilatación de vía biliar.
A los 30 días de vida pasa a sala de neonatología del Hospital de Paysandú. Continúa con SDR leve, pero sin necesidad de oxígeno. Persiste con la hepatoesplenomegalia y con las alteraciones hematológicas (tabla 1).
Con la sospecha de infección congénita se realizan serologías para: toxoplasma, citomegalovirus (CMV), rubeola, VIH, parvovirus, hepatitis C y reacción en cadena de polimerasa (PCR) para CMV en sangre, que resultaron ser no reactivas.
Al mes y 13 días (36 semanas) agrava su SDR habitual y reingresa a CTI con diagnóstico de Insuficiencia respiratoria tipo 1 y sospecha de infección respiratoria baja. Madre cursando una infección respiratoria. Se realiza hemograma (tabla 1), proteína C reactiva negativa, virus respiratorios negativos, urocultivo y hemocultivo sin desarrollo. Se suspende oxígeno a las 24 hs. Se reinicia la eritropoyetina.
A los 52 días de vida (37 semanas y 3 días) sigue con SDR leve y agrava su anemia, por lo que se transfunde. En ese momento se decide su traslado al Centro Hospitalario Pereira Rossell (CHPR) con el diagnóstico de pancitopenia y hepatoesplenomegalia, para completar estudios. En ese nosocomio se descartan enfermedades metabólicas lisosomales y hematooncológicas .Se estudian inmunodeficiencias y patología infecciosa y se le plantea a la madre del niño realizar una biopsia hepática, que queda pendiente.
A los 3 meses y 16 días (7/8/13) reingresa al Hospital de Paysandú con diagnóstico de bronquiolitis grave por VRS con atelectasia en LSD que requiere nuevo ingreso a CTI.
A los 5 meses y 10 días (7/10/13) reingresa al Hospital de Paysandú cursando bronquiolitis moderada y durante la internación se constata persistencia de la hepatoesplenomegalia y estrabismo convergente de ojo derecho. El hemograma, funcional y enzimograma hepático eran normales.
Se reevalúa en ese momento el paciente y dada la persistencia de la hepatoesplenomegalia y de las alteraciones hematológicas que había presentado los primeros días de vida, se sospecha que pueda tratarse de una causa infecciosa no diagnosticada. Dado la clínica y que se habían descartado todas las infecciones de trasmisión vertical excepto la enfermedad de Chagas, se decide solicitar a la madre serología específica. El resultado mostró hemaglutinación indirecta (HAI) con títulos de 1/8.112, ELISA e inmunofluoresencia indirecta (IFI) reactivos. Se solicita también al niño y se informan títulos por quimioluminiscencia de 6,37 U/ml.
Es dado de alta y controlado en Policlínica de Infectología donde presenta un buen crecimiento y desarrollo, manteniendo la hepatoesplenomegalia.
A los 9 meses (14/2/14) se reitera la serología en Montevideo que informa: HAI 1/256, IFI y ELISA reactivos. Se solicita ecocardiograma, hemograma, función hepática y renal que fueron normales. Se inicia en ese momento nifurtimox a dosis de 10 mg/kg/día por 2 meses. La abuela del niño mostraba una serología reactiva con títulos por quimioluminiscencia de 1/8.000. Una de las tías del paciente, de 12 años, también reveló serología reactiva y se le indicó tratamiento.
A los 18 meses de vida la serología informó HAI e IFI negativos y ELISA reactivo (anticuerpos totales). A los 26 y 36 meses de edad se repite la serología con las mismas técnicas, resultando no reactiva. Si bien fue valorado por oftalmólogo, aún persiste con el estrabismo unilateral y sin diagnóstico.
Discusión
La enfermedad de Chagas congénita se detecta principalmente mediante el screening serológico en la mujer embarazada.
En países como el nuestro, en donde existe aún un importante número de individuos con infección en etapa crónica, sigue existiendo el riesgo de transmisión vertical de la enfermedad.
Desde hace 21 años existe el decreto obligatorio de realizar serología para Chagas en las embarazadas en todos los departamentos endémicos (figura 1). Sin embargo, en este caso no se había realizado la serología, porque no se estaba solicitando de rutina en nuestro departamento.
A pesar de que en este niño no se pudo detectar el parásito, la presencia de serología reactiva a los 9 meses de vida mediante dos técnicas diferentes confirma definitivamente la infección congénita, debido a que los anticuerpos maternos presentes en la sangre del niño desaparecen entre los seis y los nueve meses(8,10-13).
Si bien el recién nacido había recibido dos transfusiones sanguíneas (una de ellas a las 25 días de vida) no pensamos que esta vía haya sido la causa de la infección ya presentaba los síntomas y signos de la enfermedad antes de recibir la misma, y además porque desde hace muchos años en nuestro país se realiza el screening para detectar la infección en los bancos de sangre.
La infección neonatal se produce como consecuencia de la presencia de parasitemia materna. El porcentaje de trasmisión madre-hijo es variable según el país, y puede ir desde 0,13% a 17%(10). El riesgo está presente durante cualquier etapa de la infección materna, y el parásito puede infectar al feto existiendo o no compromiso placentario, pudiendo ocurrir también en sucesivos embarazos como se observó en esta familia donde en dos de sus hijas se pudo confirmar la infección(11,13,14).
La variación en el porcentaje de transmisión se puede deber a: el grado de endemicidad de la región estudiada, las características de la población y del tipo de cepas de los parásitos. Esto sería determinante para explicar porque no todos los hijos de madre chagásica adquieren la infección(11).
Actualmente en el país, la transmisión congénita excede el área de transmisión endémica vectorial por lo que se debe pensar siempre en la enfermedad en un recién nacido de cualquier localidad del país que presente clínica de infección y cuya madre no tenga realizada la serología correspondiente.
En este paciente se pensó en la enfermedad tardíamente, cuando a los 5 meses estando internado en sala se constata que persistía con hepatoesplenomegalia. El hecho de haber nacido en un área endémica, pretérmino y con alteraciones hematológicas y hepatoesplenomegalia (luego de haber descartado las demás infecciones de transmisión vertical) obligó en ese momento a sospechar esta enfermedad. En algunos países, la mayoría de los niños infectados (60%-90%) nacen asintomáticos(15). Esta infección puede manifestarse tempranamente y aparecer en los primeros 30 días de vida, como ocurrió con este paciente, o tardíamente (9,11,16). No hay un cuadro clínico patognomónico, pero las formas más graves no difieren de las infecciones provocadas por el grupo TORCH. El bajo peso al nacer, la prematurez, el edema generalizado, la hepatoesplenomegalia y el distrés respiratorio son los síntomas más frecuentes. También se describen miocarditis, petequias, meningoencefalitis y algunos casos graves de hidrops fetalis y muerte(9-12,16,17).
En lo que se refiere a la asociación con prematurez, existen controversias según los autores. La hepatoesplenomegalia y las alteraciones hematológicas al nacer en este paciente fueron el hilo conductor que llevó al diagnóstico. El primer signo se encuentra entre los más comúnmente reportados en los casos congénitos, y el más importante. Tiende a ir desapareciendo en los casos no tratados entre los seis y doce meses de edad(10), como ocurrió en este paciente.
El distrés respiratorio que presentó al nacer se catalogó como enfermedad de membrana hialina. Sin embargo, llama la atención que en el paciente la sintomatología persistió más de 50 días, con exacerbaciones que no pudieron vincularse a otras causas. Se ha observado que en la gran mayoría de los casos de infección congénita puede aparecer distrés respiratorio grave y la radiografía de tórax no presentar alteraciones(10,11).
En algunos casos aislados se presenta compromiso cardíaco, siendo la taquicardia persistente un síntoma de miocarditis chagásica(10). Estas alteraciones fueron descartadas en este paciente mediante un ecocardiograma, que fue normal. El compromiso neurológico es un componente importante de la infección aguda congénita, siendo difícil de establecer el grado de afectación y la localización de las lesiones solamente por medio de la clínica(10). Se describe en la historia del CTI que presentaba una irritabilidad que llamaba la atención. No sabemos si esta irritabilidad pudo o no vincularse a alguna afectación del sistema nervioso central (SNC), dado que no se realizó punción lumbar para estudio del líquido cefalorraquídeo (LCR), la cual se recomienda para descartar la meningoencefalitis(15).
Se han descrito calcificaciones cerebrales en el 30% de los infectados, así como microcefalia y otras alteraciones del SNC(11), que no se pudieron comprobar en este paciente clínicamente ni ecográficamente. En cuanto al estrabismo que presentaba el paciente, no se había objetivado en ninguna internación anterior y se objetivó, a los 5 meses de vida, lo que hace dudar si era una manifestación de la infección o si se debía a otra causa. Si bien la patología ocular no es frecuente de ver en esta infección, se ha descrito en algunos niños estrabismo y compromiso del segmento posterior, presentándose también alteraciones de la papila, la coroides, la retina, el humor vítreo y coriorretinitis, entre otras(11).
Las alteraciones hematológicas como la anemia microcítica e hipocrómica, trombocitopenia y leucocitosis han sido descritas por varios autores y se ha observado principalmente en animales de experimentación.
Se ha observado que durante la infección se liberan citoquinas que interfieren en la eritro, trombo y mielopoyesis (10,18-23). El grado y la duración de estas alteraciones estarían vinculados a los niveles de parasitemia y a la cepa del parásito. Como sabemos, los valores normales de hemoglobina varían en función de la edad gestacional y cronológica del neonato. Para la edad gestacional que presentaba este paciente, valores menores a 13,5 g/dl de hemoglobina (Hb) en la primera semana de vida se considera anemia. Normalmente en el pretérmino mayor de 1.200 g, el nivel de Hb va disminuyendo con los días hasta llegar a la cifra más baja alrededor de la décima semana, pudiendo alcanzar valores de hasta 9,8 g/dl(22,23). En este caso las cifras se mantuvieron siempre por debajo de lo esperado y fue agravándose hacia el mes de vida, cuando además se evidenciaron cifras disminuidas de reticulocitos, expresando hiporregeneración medular.
En cuanto a la etiología de la anemia, es importante conocer en qué momento se manifiesta. Si ocurre en las primeras horas de vida se puede explicar por sangrados que sabemos pueden producirse antes o después del parto, y en segundo lugar por isoinmunización Rh, ABO o de grupos menores, que se descartaron en este caso. También se descartó la anemia hemolítica, otra causa de anemia en el recién nacido. Hay que tener presente que en el caso de neonatos pretérminos como este puede producirse además anemia iatrogénica por exceso de extracciones sanguíneas. Otra causa de anemia en el recién nacido en la cual debemos pensar siempre es la que suele observarse en el curso de infecciones congénitas, como pensamos que fue la que presentó este paciente. Se evidencia en los primeros días de vida y pueden prolongarse hasta el primer mes(22,23). La trombocitopenia neonatal, definida por cifras de plaquetas menores a 150.000 elementos/mm3, y que en este paciente se mantuvo por debajo de esas cifras alcanzando los valores más bajos al mes de vida, no produjo graves problemas y pensamos que se debió también a la infección. La neutropenia grave que requirió estimulante de las colonias granulocíticas también pensamos que se debió a la enfermedad. La hiperbilirrubinemia, de hallazgo frecuente en el período neonatal, ha sido documentada en pacientes infectados.
El diagnóstico de la enfermedad se realiza mediante la visualización del parásito en la sangre, que puede detectarse por varias técnicas que difieren en sensiblidad y complejidad(15). El microhematocrito tiene varias ventajas: requiere escasa cantidad de sangre (0,3 ml), es una técnica rápida y tiene una sensibilidad entre 80% y 90%. Este método actualmente ha sido modificado, obteniéndose mejores condiciones de bioseguridad, y es la técnica de elección en los recién nacidos pero no se realiza en nuestro país. La gota gruesa es otra técnica directa, pero tiene menor sensibilidad.
La técnica de Strout tiene el inconveniente que requiere entre 5 y 10 ml de sangre y sirve para evaluar la parasitemia en sangre del cordón. El xenodiagnóstico es un método indirecto antiguo y es el que se usa en nuestro país. Utiliza el vector, que se alimenta de sangre del paciente y reproduce el ciclo del parásito. Es de alta sensibilidad pero requiere entre 15 a 60 días para obtener los resultados. En el paciente podría haberse realizado a pesar de la edad avanzada del diagnóstico. La reacción en cadena de la polimerasa (PCR) es una de los últimos avances para el diagnóstico y control del tratamiento. Por esta técnica es posible demostrar la presencia de un parásito cada 20 ml de sangre. Se utiliza de rutina en otros países conjuntamente con el microhematocrito o con la serología. La sensibilidad de este método es mayor en menores de seis meses y la especificidad es del 100%(15,16,24).
Algunos pregonan la superioridad de esta técnica sobre la microscopía que requiere de ojos expertos(16,17,25). Sin embargo, la técnica requiere de un proceso de estandarización y validación de los laboratorios de cada país. Una consideración a tener en cuenta es que el ADN del T. cruzi puede ser transferido de forma transplacentaria, pudiendo circular durante un tiempo en el recién nacido sin que signifique infección y se sugiere que la prueba se realice luego de los 3 meses de edad para evitar falsos positivos(16).
Las técnicas serológicas no son recomendables en etapa neonatal, dado que las técnicas convencionales detectan IgG y no pueden diferenciar los anticuerpos propios del niño de los trasmitidos por su madre a través de la placenta, que se encuentran hasta los 6 meses según algunos autores o hasta los 9 meses para otros. La detección de IgM específica en el recién nacido no es una técnica válida y se ha observado que un 11% de los infectados presentan serología negativa al momento del diagnóstico. Existe un antígeno denominado Shed Acute Phase Antigen (SAPA) que se expresa en la fase aguda de la enfermedad y que podría ser útil en los primeros 3 meses de edad(16). La IgG se debe realizar al menos por dos técnicas diferentes, siendo las más usadas la HAI, IFI o ELISA.
Una vez que se confirma el diagnóstico, se debe comenzar el tratamiento dado que está demostrado que cuanto más temprano se administre, mejor será la eficacia, alcanzando cifras de casi 100% en el primer año de vida(9-11,13-15). Existen por ahora en el mundo dos fármacos clásicos de probada eficacia en el Chagas congénito: el nifurtimox y el beznidazol.
El nifurtimox, cuyo nombre comercial es Lampit y es producido por el laboratorio Bayer, actúa sobre las formas amastigota y tripamastigota del T. cruzi. Tiene una eficacia de 76% administrado en la etapa aguda, y variable en las etapas crónicas. La dosis es de 8-10 mg/kg/día por 60 días, fraccionado cada 8 a 12 horas.
El benznidazol es producido por el laboratorio Elea y su nombre comercial es Abarax; también es un fármaco tripanomicida, efectivo en todas las etapas de la enfermedad y la dosis es de 5-7 mg/kg/día por 60 días, recomendándose en ambos que sean administrados luego de las comidas. Los efectos adversos que se pueden observar son: trastornos digestivos, alteraciones del sueño, inapetencia, leucopenia, plaquetopenia y erupciones cutáneas. En los más pequeños puede empezarse con la mitad de la dosis y si a los 4 días el control hematológico no evidencia alteraciones se instala la dosis definitiva(15,25).
Se recomienda realizar el control hematológico antes de comenzar la terapia, a los 20 días y al finalizar el mismo junto a una función hepática y renal. En este caso se debió solicitar la medicación al MSP, dado que no es un fármaco que esté disponible en la farmacia de todos los hospitales del país. El criterio de curación en la etapa aguda es la negativización de la serología en los controles postratamiento, como sucedió en este paciente. Sin embargo se debe solicitar nueva serología cada 6 meses hasta obtener dos resultados consecutivos negativos, sabiendo que a mayor edad de comenzado el tratamiento, más tiempo demora la serología en negativizarse.
Algunos autores recomiendan, además, realizar pruebas parasitológicas y moleculares luego de finalizado el tratamiento(15,24). Se recomienda ofrecer tratamiento etiológico a mujeres jóvenes en edad fértil, como se realizó en la madre del paciente. No solo eliminaría la infección y reduciría la carga parasitaria sino que existe creciente evidencia del beneficio en la transmisión congénita de futuros embarazos. Se debe tener en cuenta que el mismo está contraindicado durante el embarazo por su potencial teratogénico y por lo tanto se recomienda realizar anticoncepción durante su administración.
Conclusiones
La transmisión congénita del Chagas supone un desafío para el control de la enfermedad parasitaria en nuestro país, pues no solo involucra a los departamentos endémicos, como el nuestro, sino a los no endémicos en donde, como consecuencia de los desplazamientos de la población, viven mujeres en edad fértil portadoras de la infección. El pediatra tendrá que estar atento a estos síntomas y signos descritos, pensar en la enfermedad y actuar en consecuencia. La atención integral de esta enfermedad incluye no solo la detección temprana y el tratamiento del recién nacido o lactante, porque curar a un niño es evitar la morbimortalidad en la etapa adulta y curar a una niña evita que cuando se embarace genere a su vez un hijo con Chagas. En Paysandú se logró que nuevamente se solicitara de rutina la serología a toda embarazada tanto del ámbito de salud pública como mutual. Estudios costo/beneficio en diferentes países, demuestran que por cada dólar invertido en prevención, se ahorrarían entre 11 y 17 dólares en el manejo y tratamiento de estos pacientes(25). Este neonato estuvo casi 3 meses internado realizándose múltiples estudios y tratamientos antes de llegar al diagnóstico. El conocimiento de la enfermedad por parte de los pediatras y neonatólogos y el cumplimiento de las normas podrían disminuir no solo los costos en salud sino los días de pérdida productiva laboral y aumentaría la expectativa de vida de las personas afectadas.
No estalla como las bombas, ni suena como los tiros.
Como el hambre, mata callando.
Como el hambre mata a los callados, a los que viven condenados al silencio y mueren condenados al olvido.
El mal de Chagas no es negocio que atraiga a la industria farmacéutica, ni es tema que interese a los políticos ni a los periodistas.
Elige a sus víctimas en el pobrerío, las muerde y lentamente, poquito a poco va acabando con ellas.
Sus víctimas no tienen derecho, ni dinero para comprar los derechos que no tienen. Ni siquiera tienen el derecho de saber de qué mueren.
Eduardo Galeano (2005)
Agradecimientos
A la Dra. Yester Basmadjián, médica parasitóloga de la Sección Parasitología del MSP por su consejo de publicar este caso clínico y sus aportes, siempre muy valiosos, realizados en el Hospital de Paysandú durante una charla que realizó sobre el tema.
Referencias bibliográficas
1. Briceño-León R, Dias J. La enfermedad de Chagas en una historia de vida: conocer la enfermedad, cambiar el mundo: entrevista a João Carlos Pinto Dias. Cad Saúde Pública 2009; 25(Supl 1):S179-86.
2. Tarleton R, Curran J. Is Chagas disease really the “new HIV/AIDS of the Americas”? PLoS Negl Trop Dis 2012; 6(10):e1861.
3. World Health Organization. Chagas disease in Latin America: an epidemiological update based on 2010 estimates. Wkly Epidemiol Rec 2015; 90(6):33-43.
4. Imai K, Maeda T, Sayama Y, Mikita K, Fujikura Y, Misawa K, et al. Mother-to-child transmission of congenital Chagas disease, Japan. Emerg Infect Dis 2014; 20(1):146-8.
5. Conti I. A propósito del centenario del descubrimiento de la enfermedad de Chagas: análisis cronológico de los principales hitos en la evolución de su conocimiento y control con particular énfasis en las contribuciones científicas uruguayas. Rev Med Urug 2010; 26(2):108-16.
6. Basmadjián Y. Enfermedad de Chagas. Montevideo: MSP, 2012. Disponible en: http://www.msp.gub.uy/sites/default/files/archivos_adjuntos/CHAGAS-MSP_%5BModo_de_compatibilidad%5D.pdf. [Consulta: 8 mayo 2015].
7. Rosa R, Basmadjián Y, González M, González M, Salvatella R. Actualización clínico-epidemiológica y terapéutica de la enfermedad de Chagas en Uruguay. Rev Med Urug 2001; 17(2):125-32.
8. Carlier Y, Torrico F, Sosa-Estani S, Russomando G, Luquetti A, Freilij H, et al. Congenital Chagas disease: recommendations for diagnosis, treatment and control of newborns, siblings and pregnant women. PLoS Negl Trop Dis 2011; 5(10):e1250.
9. Carrilero B, Quesada J, Alfayate S, Segovia M. Enfermedad de Chagas congénita en recién nacido de madre de origen boliviano. Enferm Infecc Microbiol Clin 2009; 27(8):483-490.
10. Freilij H, Altcheh J. Congenital Chagas’ disease: diagnostic and clinical aspects. Clin Infect Dis 1995; 21(3):551-5.
11. Berberián G, Rosanova MT, Kaldzieski C, Paulin P, Castro G, Galina L. Compromiso ocular en la enfermedad de Chagas congénita. Arch Argent Pediatr 2013; 111(3):e78-81.
12. Mansilla M, Rocha M, Sarubbi M. Chagas Congénito: presentación de un caso clínico y revisión bibliográfica. Rev Hosp Mat Inf Ramón Sardá 1999; 18(1):29-34.
13. Contreras S, Fernández MR, Agüero F, Desse J, Orduna T, Martino O. Enfermedad de Chagas-Mazza congénita en Salta. Rev Soc Bras Med Trop 1999; 32(6):633-6.
14. Altcheh J. La enfermedad de Chagas a 100 años de su descubrimiento. Arch Argent Pediatr 2010; 108(1):4-7.
15. Merino F, Martínez R, Olabarrieta I, Merino P, García S, Gastañaga T, et al. Control de la infección por Trypanosoma cruzi/Enfermedad de Chagas en gestantes latinoamericanas y sus hijos. Rev Esp Quimioter 2013; 26(3):253-60.
16. Fundación Sociedad Argentina de Pediatría. Infecciones perinatales: guía para neonatólogos y pediatras. Prevención, diagnóstico y tratamiento. 2 ed. Buenos Aires: FUNDASAP, 2009.
17. Cucunubá Z, Valencia-Hernández C, Puerta C, Sosa-Estani S, Torrico F, Cortés J, et al. Primer consenso colombiano sobre Chagas congénito y orientación clínica a mujeres en edad fértil con diagnóstico de Chagas. Infectio 2014; 18(2):50-65.
18. Blasco L, Núñez V, Cruceyra M, Magdaleno F, García S. Enfermedad de Chagas y embarazo. Rev Chil Obstet Ginecol 2011; 76(3):162-8.
19. Guedes P, Veloso V, Mineo T, Santiago-Silva J, Crepalde G, Caldas I, et al. Hematological alterations during experimental canine infection by Trypanosoma cruzi. Rev Bras Parasitol Vet 2012; 21(2):151-6.
20. da Silva R, Malvezi A, Augusto S, Kian D, Tatakihara V, Yamauchi L, et al. Oral exposure to Phytomonas serpens attenuates thrombocytopenia and leukopenia during acute infection with Trypanosoma cruzi. PLoS One 2013; 8(7):e68299.
21. Tribulatti MV, Mucci J, Van N, Leguizamón MS, Campetella O. The trans-sialidase from Trypanosoma cruzi induces thrombocytopenia during acute Chagas’ disease by reducing the platelet sialic acid contents. Infect Immun 2005; 73(1):201-7.
22. Arca G, Carbonell-Estrany X. Anemia neonatal. En: Asociación Española de Pediatría. Protocolos de la AEP: Neonatología. Barcelona: AEP, 2008. Disponible en: http://www.aeped.es/documentos/protocolos-neonatologia. [Consulta: 25 abril 2015].
23. Christou H, Rowitch D. Anemia. En: Cloherty JP, Stark AR. Manual de cuidados intensivos neonatales. 4 ed. Barcelona: Masson, 2005: 531-9.
24. González-Granado L, Guillen-Fiel G, Rojo-Conejo P. In nonendemic areas, is microscopy better than polymerase chain reaction for diagnosis of congenital chagas disease? Clin Infect Dis 2010; 50(2):279-80. Disponible en: http://cid.oxfordjournals.org/content/50/2/279.long. [Consulta: 19 febrero 2014].
Correspondencia: Dra. Belen Amorin.
Correo electrónico: belena@paysandu.com














