Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Archivos de Pediatría del Uruguay
versão impressa ISSN 0004-0584versão On-line ISSN 1688-1249
Arch. Pediatr. Urug. vol.87 no.1 Montevideo mar. 2016
Clinicopathologic correlation and evolution of lupus nephritis in children and adolescents
Marina Caggiani1, Margarita Halty2, Laura Delfino3
1. Nefróloga Pediatra, Prof. Adj. Pediatría. Facultad de Medicina. UDELAR.
2. Nefróloga Pediatra, Prof. Adj. Pediatría, Pediatra Intensivista. Facultad de Medicina. UDELAR.
3. Nefróloga, Anátomopatóloga. Departamento Patología. CHPR.
Facultad de Medicina. UDELAR
Trabajo inédito.
Declaramos no tener conflictos de intereses.
Fecha recibido: 8 de abril 2015.
Fecha aprobado: 3 de diciembre 2015.
El lupus eritematoso sistémico (LES) tiene una prevalencia baja en la población general y es menor en la edad pediátrica. La nefropatía lúpica (NL) es más frecuente y de mayor severidad que en adultos, condicionando la morbimortalidad de la enfermedad. Se realizó un estudio descriptivo prospectivo de 20 niños y adolescentes con NL controlados en la Policlínica de Colagenopatías del Centro Hospitalario Pereira Rossell en el período desde octubre de 2003 hasta setiembre de 2013 con el objetivo de describir las características clínico-serológicas y evolutivas de pacientes con NL y correlacionarlas con los hallazgos anátomopatológicos.
La NL se observó en el 52,6% de los casos con LES. El 70% fueron de sexo femenino, relación femenino/masculino de 2,3/1, 85% de raza blanca, la mediana del diagnóstico fue de 12 años. Las formas de presentación fueron: alteraciones urinarias menores (AUM) en 14 pacientes (0,7), en cuatro casos síndrome nefrótico (SN), con o sin insuficiencia renal (IR) y/o hipertensión arterial. Un paciente se manifestó con síndrome nefrítico. Un paciente tenía un examen de orina normal. Las formas histopatológicas proliferativas graves se presentaron en 18 (0,9); los casos con AUM presentaban NL grado III-IV en 13 (0,93); todos los casos con SN con o sin IR tenían NL III-IV. No hubo casos de NL aislada como forma de comienzo.
En el momento del diagnóstico, los anticuerpos antinucleares fueron positivos en 19 (0,95) y los anti DNA doble cadena en 16 (0,8); C3 y C4 estuvieron descendidos en 19 (0,95) y en 15 (0,75) respectivamente. El seguimiento promedio fue 4,2 años. Al final del seguimiento estaban en remisión 16 pacientes (0,8), cuatro en remisión parcial, todos con función renal normal, excepto un caso que presentó IR extrema, fue trasplantado y tuvo una excelente evolución. Un paciente falleció con hemorragia pulmonar. La sobrevida de la función renal y la de los pacientes fue 0,95 respectivamente. El tratamiento se realizó en base a corticoides, hidroxicloroquina asociados a azatioprina o micofenolato mofetilo. En ocho pacientes con cuadros graves se usó la ciclofosfamida I/V. Esta serie constituye la primera serie nacional de nefropatía lúpica en niños y adolescentes.
Conclusión: predominó la presentación clínica con AUM y formas histopatológicas severas, clases III y IV, evidenciando una disociación clínico anatomopatológica. A pesar del elevado porcentaje de NL severas, el manejo adecuado y oportuno y la adherencia al tratamiento y a los controles médicos fueron fundamentales para la evolución favorable de la NL.
Palabras clave:
NEFRITIS LúPICA
GLOMERULONEFRITIS
LUPUS ERITEMATOSO SISTÉMICO
NIÑO
Systemic lupus erythematosus (SLE) has a low prevalence in the overall general population and this is lower in children. Child lupus nephropathy (LN) is more frequent and severe than in SLE adult patients, with greater disease morbidity and mortality. A prospective descriptive study of 20 children and adolescents with LN monitored in the Collagen Diseases Office of the Pereira Rossell Hospital between October, 2003 and September, 2013 was performed. The objective of this study was to describe clinical-serological features and the evolution of these patients and to correlate them with its anatomopathological findings.
LN was diagnosed in 52,6% of the SLE patients, 70% were female with a female/male correlation of 2,3/1; 85% were Caucasian; median age at diagnosis was 12 years old. The clinical presentations were minor urinary findings (MUF) in 14 patients (0,7) and nephrotic syndrome (NS) in 4 (0,2), and another one nephritic syndrome. One patient presented no symptoms and had normal urinalysis. Severe proliferative classes predominated in18 patients (0.9); 13 (0.93) patients with MUF and all the patients with NS had LN classes III or IV. Isolated LN was not seen in the initial presentation. At the time of diagnosis antinuclear antibodies were positive in 19 patients (0.95); and anti DNA double stranded in 16 (0.8). Low C3 was found in 19 (0.95) and C4 in 15 (0.75), respectively. Average follow-up time was 4.2 years. At the end of follow-up 16 (0.8) were in remission, 4 of them in partial remission; all patients presented normal renal function except for one who evidenced severe renal failure and required hemodialysis and transplantation and had an excellent evolution. One patient died with pulmonary hemorrhage. The renal and patient survivals were 0.95 respectively. Treatment consisted in corticosteroids and hydroxychloroquine associated with azathioprine or mycophenolate mofetil. Cyclophosphamide was administered to 8 patients with severe illness. This is the first national report of LN in children and adolescents.
Conclusions: the predominant clinical presentation of LN was MUF with severe anatomopathological findings, classes III and IV, showing a clinical-pathological dissociation. Despite the high percentage of severe LN, early and adequate treatment, as well as a good compliance to it with periodic medical follow-up, were essential to achieve a favorable outcome of LN.
Key words:
LUPUS NEPHRITIS
GLOMERULONEPHRITIS
LUPUS ERYTHEMATOSUS, SYSTEMIC
CHILDREN
Introducción
El lupus eritematoso sistémico (LES) es una enfermedad multisistémica inflamatoria autoinmune, de evolución crónica, con un curso clínico y pronóstico variables, con períodos de remisión y exacerbaciones. Puede comprometer cualquier órgano o sistema en diferentes combinaciones. Está causada por la producción de anticuerpos y depósitos de complejos inmunes fijadores del complemento en vasos sanguíneos y tejido conectivo que resultan en afectación variable de piel, articulaciones, riñones, corazón y pulmones entre otros. Factores genéticos, inmunológicos, hormonales y ambientales están vinculados a su patogenia(1-3).
La prevalencia en la población general depende de la etnia, el sexo y la región geográfica, siendo la media 23,8 casos por 100.000 habitantes(4).
Solo el 20% se presentan en la edad pediátrica con un compromiso más frecuente y severo de órganos nobles que en adultos, con una incidencia de 0,3 a 0,9 por 100.000 niños y una prevalencia de 3,3 a 8,8 por 100.000. La edad media de presentación es de 11-12 años; es rara en menores de 5 años(5,6). La relación femenino/masculino de es de 4,5/1, a diferencia de lo que ocurre en adultos, en que la relación es de 8-13/1(7).
Los nuevos criterios diagnósticos del LES de SLICC (Systemic Lupus International Collaborating Clinics) representan un esfuerzo de revisión y de análisis estadísticos para lograr un consenso con los criterios de la American College of Rheumatology. Para el diagnóstico se requiere que se cumplan cuatro criterios al inicio o en la evolución, incluyendo al menos uno clínico y uno inmunológico; o el paciente debe tener nefritis compatible con lupus por biopsia y anticuerpos antinucleares o anti ADN de doble cadena(8).
La frecuencia de las manifestaciones atípicas dificultan el diagnóstico de LES(9). El 12% de los pacientes con LES tienen manifestaciones clínico serológicas incompletas al momento de su presentación y de éstos un tercio tienen nefropatía(10).
Aunque los síntomas y signos de la esfera renal pueden estar presentes en 60-80% de los niños al debut de la enfermedad, éstos raramente son dominantes en la presentación clínica(6,7,11). En 90% de los pacientes la nefritis se manifiesta en el primer año del diagnóstico de la enfermedad(5,12). Es inhabitual luego de los 2 años de su inicio aunque hay casos de aparición tardía(6). Es más frecuente y de mayor severidad que en adultos(7,13).
Los signos de nefropatía lúpica (NL) en general son poco ostensibles como microhematuria y proteinuria(7,11). Otras veces pueden debutar con síndrome nefrótico (SN), hipertensión arterial (HA) o insuficiencia renal (IR)(7). La confirmación diagnóstica del compromiso renal la brinda el estudio de biopsia renal (PBR) demostrando una glomerulonefritis mediada por complejos inmunes compatible con NL(14). Las clases histopatológicas de la NL son: nefritis lúpica mesangial mínima (clase I), nefritis lúpica proliferativa mesangial (clase II), nefritis lúpica focal (clase III) y difusa (clase IV), nefritis membranosa (clase V) y nefritis lúpica esclerosante avanzada (clase VI)(15,16). Las lesiones histológicas más frecuentes son las clases III-IV, estas oscilan entre 50 y 80% (6,7,10,11,17) las clases I, II: 22%, V: 11%; 6% no clasificables(18).
Los objetivos del estudio fueron: 1) describir las características clínico-serológicas y evolutivas de pacientes con nefropatía lúpica diagnosticada con biopsia renal (PBR) y 2) vincular los hallazgos anátomopatológicos a la presentación clinicoserológica.
Material y método
Es un estudio prospectivo descriptivo de los pacientes controlados en la Policlínica de Colagenopatías del Hospital Pereira Rossell en el período octubre de 2003 - setiembre de 2013, se incluyeron niños y adolescentes de hasta 14 años al ingreso. Desde el inicio se llenó un formato de historia clínica de los pacientes con LES y diagnóstico de NL por punción biópsica renal (PBR). Se incluyeron los siguientes datos: edad, sexo, presentación clínica, serología, forma histológica, correlación clinicoanatomopatológica, tratamiento y evolución.
La evaluación final se realizó teniendo en cuenta la última consulta en policlínica en ese período. Algunos pacientes fueron referidos a policlínica de adultos por lo que se consideró la última consulta previa a su derivación que se realizó entre los 15 y 21 años.
El diagnóstico de LES se realizó hasta el año 2012 según los criterios de la American College of Rheumathology y a partir de esa fecha según los criterios diagnósticos de SLICC(8,20).
La PBR estuvo indicada en todo paciente con alteraciones urinarias menores (AUM): proteinuria menor de 1 g/l y/o microhematuria), síndrome nefrótico o nefrítico con o sin insuficiencia renal (IR).
Se define síndrome nefrótico la presencia de proteinuria mayor a 50 mg/kg/día o índice proteinuria/ creatininuria mayor a 2 e hipoalbuminemia menor de 2,5 g/dl(21). Síndrome nefrítico se define por la presencia de edemas, hipertensión arterial, micro o macrohematuria y grados variables de proteinuria(22).
Se consideraron portadores de insuficiencia renal (IR) los pacientes con clearence de creatinina calculado por fórmula de Schwartz(23) menor a 90 ml/min/1,73 m2 superficie corporal; IR leve clearence de creatinina entre 60 y 90 ml/min(24).
Se define glomerulonefritis rápidamente progresiva la pérdida de más del 50% del filtrado glomerular en un período de días a semanas, con un patrón histopatológico de semilunas en más del 50% de los glomérulos(25).
La PBR se realizó con consentimiento informado, ecoguiada en tiempo real. A partir del 2011, se incluyó el diagnóstico de satisfacción de material, intraprocedimiento con microscopio estereoscópico y selección de las muestras. La biopsia se estudió con microscopía óptica e inmunofluorescencia y en algunos casos, cuando se pudo disponer de ella, con microscopía electrónica.
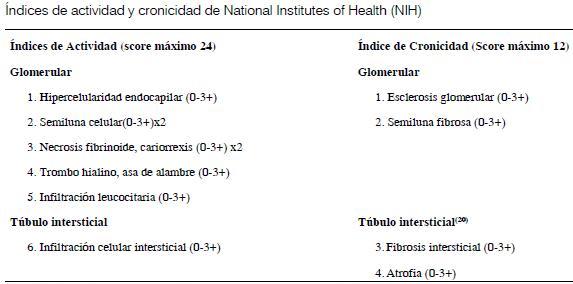
Se revisaron los diagnósticos aplicando la clasificación de la Sociedad Internacional de Nefrología y la Sociedad de Patología Renal (ISN/RPS 2004) (15,16) así como los nuevos aportes a la clasificación de las lesiones túbulointersticiales (26) y vasculares(27) (véase anexo).
Se evaluó el grado de compromiso glomerular, túbulointersticial, (índices de actividad y cronicidad) y el compromiso vascular.
Se definió como empuje renal la existencia de sedimento patológico con o sin hipertensión con o sin IR asociado a serología positiva. Se consideró remisión total a la regresión clínica, con orina, función renal y marcadores inmunológicos normales, y remisión parcial cuando había mejoría sin llegar a la normalidad: pacientes asintomáticos, alteraciones menores en el examen de orina, marcadores inmunológicos con alteraciones leves: disminución de C3 o aumento de anti ADN doble cadena (ADNds).
El método de dosificación de las fracciones del complemento C3 y C4 fue la nefelometría y la detección de anticuerpos antinucleares (AAN) y ADNds fue la inmunofluorescencia.
Se analizaron los datos obteniendo frecuencias absolutas y relativas, promedios, medianas y rangos. Se analizó la existencia de empujes de la NL, sobrevida de la función renal y de los pacientes.
Resultados
La NL se presentó en 20/38 pacientes con LES: 52,6% de los casos. Otros 3 pacientes tenían indicación de realizarse PBR pero no pudo practicarse por contraindicaciones al procedimiento (plaquetopenia, anticoagulación) o por abandono del seguimiento.
El 85% fueron de raza blanca; 20% tenían antecedentes familiares de LES.
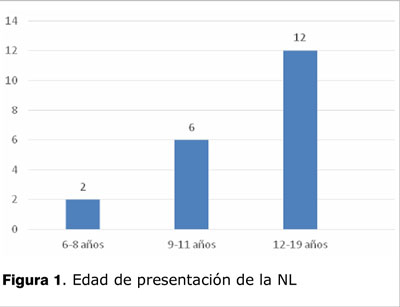
La mediana de edad al diagnóstico de NL fue de 12 años con un rango de 6,5-19 años. Doce pacientes procedían del interior del país y 8 de Montevideo. El tiempo transcurrido entre el inicio de los síntomas y el diagnóstico de LES tuvo una mediana de 5, rango 1-14 meses. La PBR se realizó dentro del primer mes del diagnóstico de LES en 14 casos, en un paciente a los 2 meses, en dos a los 3 meses. En los otros tres casos el diagnóstico de la NL fue a los 12, 17 y 60 meses respectivamente de la confirmación del LES, cuando aparecieron elementos sugestivos de NL. El último caso era un paciente con diagnóstico de LES a los 14 años, que estando en seguimiento presentó NL a los 19 años (figura 1).
Un caso con examen de orina normal se biopsió previo a concurrir a nuestra Policlínica.
En relación a la forma de presentación de la nefropatía la mayoría lo hizo como AUM: 14/20 (FR 0,7). Estas alteraciones urinarias fueron: proteinuria con un rango de 0,1-0,97 g/l, mediana y promedio fueron 0,43 y 0,51 g/l respectivamente. El síndrome nefrótico (SN) se observó en 4/20 (0,20), el síndrome nefrítico en un caso, la insuficiencia renal (IR) en 4/20 (0,20) uno de ellos con insuficiencia renal rápidamente progresiva, la hipertensión arterial (HTA) al inicio en 2/20 casos. Un caso tuvo examen de orina normal.
En la evolución dos pacientes agregaron IR y cinco HTA.
Como antecedentes al LES hubo dos casos de síndrome de Sjögren (1 y 7 años previos), un caso de encefalomielitis (1 año previo) y un caso de diarrea disenteriforme reiterada con colitis eosinofílica.
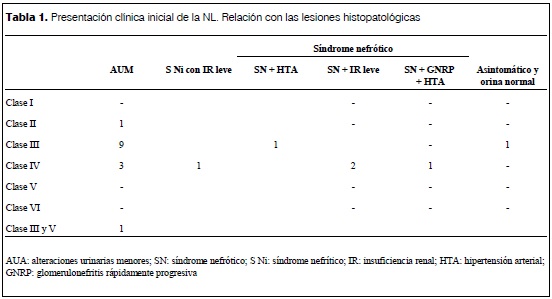
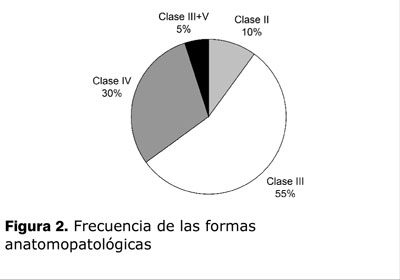
Como se ve en la tabla 1 y la figura 2, las formas histológicas graves se presentaron en 18 casos (0,9): 0,6 NL clase III y 0,3 NL clase IV. Hubo 1 caso de clase III con componente de clase V. Los casos con clase II fueron 2 (0,1). Todos tuvieron lesiones activas y en nueve lesiones de cronicidad. En cinco pacientes se detectaron semilunas: en tres se presentaron en menos del 50% de los glomérulos; en tres eran fibrocelulares, en uno eran fibrosas y en otro eran celulares. Un paciente con glomerulonefritis rápidamente progresiva presentaba semilunas fibrosas en más del 80% de los glomérulos evolucionando a la IR crónica extrema.
AUA: alteraciones urinarias menores; SN: síndrome nefrótico; S Ni: síndrome nefrítico; IR: insuficiencia renal; HTA: hipertensión arterial; GNRP: glomerulonefritis rápidamente progresiva.Con respecto al compromiso tubulointersticial, en 13 biopsias (0,65) había infiltrado inflamatorio con células mononucleares. En dos pacientes se encontró hialinosis vascular y en uno microangiopatía trombótica. De los 14 pacientes con AUM, 13 (0,93) presentaban NL tipo III-IV; todos los casos con SN con o sin IR tenían NL III-IV.
El caso con examen de orina normal tenía una NL tipo III.
No se observaron casos con NL aislada como forma de comienzo. Todos tuvieron manifestaciones extrarrenales. Dentro de éstas se destacaron las cutáneas (0,75) y las articulares (0,65). Con mucha menor frecuencia las hematológicas (0,5), pulmonares (0,3), cardiovasculares (0,3), neurológicas (0,25) y otras.
Del punto de vista serológico los anticuerpos antinucleares (AAN) fueron positivos en 19 (0,95), los anticuerpos anti DNA doble cadena en 16 (0,8).
La fracción 3 del complemento (C3) estuvo disminuida en 19 (0,95) y la fracción 4 (C4) en 15 (0,75).
El tratamiento fue individualizado. Se administraron corticoides en todos los casos, prednisona por vía oral (v/o) o metilprednisolona intravenosa (i/v). Todos recibieron hidroxicloroquina y enalapril.
Dada la gravedad de las lesiones en la mayoría de los casos estos pacientes requirieron la asociación de otros inmunosupresores como azatioprina o micofenolato mofetilo. se usó azathioprina en 12/20 pacientes; en 7 de ellos se cambió por micofenolato por respuesta insuficiente. El micofenolato se utilizó en 15/20; en siete de ellos como inducción, en el resto de mantenimiento.
La ciclofosfamida obtuvo buenos resultados excepto en un paciente con lesiones de cronicidad muy severas. El rituximab fue ineficaz en el único paciente en que se administró.
Dos pacientes que recibieron inmunoglobulina intravenosa presentaron una situación de gravedad extrema con compromiso multisistémico y diagnóstico de probable sepsis/empuje lúpico severo, asociando corticoides i/v y una amplia cobertura antibiótica; el tercero lo recibió por ineficacia de múltiples inmunosupresores con respuesta favorable luego de múltiples dosis.
La mediana del seguimiento fue de 47 meses con un rango de 8–120 meses. Durante el seguimiento tres pacientes tuvieron empuje de su NL; uno de ellos en dos oportunidades. Los empujes fueron con síndrome nefrótico en dos e IR en leve y AUM en uno.
Al final del seguimiento estaban en remisión 16 pacientes, cuatro de ellos en remisión parcial. Los que se encontraban en remisión parcial o total tenían función renal normal, excepto un caso con IR extrema que se trasplantó luego de 18 meses en hemodiálisis desde el inicio de la enfermedad. Esta paciente presentaba una GN rápidamente progresiva con 80% de semilunas fibrosas y fibrosis intersticial. Un paciente falleció por un empuje lúpico incontrolable, con hemorragia pulmonar y probable sepsis, con IR severa. Los otros tres pacientes estaban en empuje, por abandono o mala adherencia al tratamiento, uno de ellos con IR leve. La sobrevida de la función renal y la de los pacientes fue en FR 0,95 respectivamente.
La tabla 2 muestra la presentación clínica, histología, tiempo de seguimiento y situación clínica de los pacientes al finalizar el seguimiento.
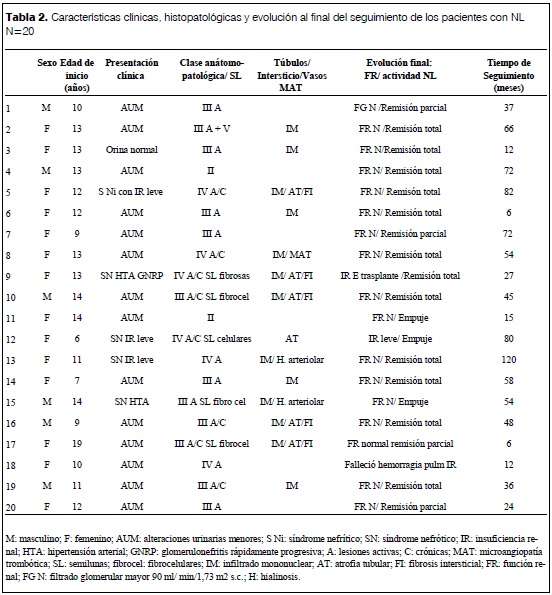
M: masculino; F: femenino; AUM: alteraciones urinarias menores; S Ni: síndrome nefrítico; SN: síndrome nefrótico; IR: insuficiencia renal; HTA: hipertensión arterial; GNRP: glomerulonefritis rápidamente progresiva; A: lesiones activas; C: crónicas; MAT: microangiopatía trombótica; SL: semilunas; fibrocel: fibrocelulares; IM: infiltrado mononuclear; AT: atrofia tubular; FI: fibrosis intersticial; FR: función renal; FG N: filtrado glomerular mayor 90 ml/ min/1,73 m2 s.c.; H: hialinosis.
Discusión
Destacamos que este trabajo es la primera comunicación nacional de nefropatía lúpica en niños y adolescentes. Como ya fue mencionado, el LES es una enfermedad de baja prevalencia. En la policlínica de colagenopatías del Hospital Pediátrico del Centro Hospitalario Pereira Rossell se controlaron 38 pacientes en 10 años.
La edad de presentación en esta serie coincide con lo señalado en la literatura(5,12,28-30). La relación femenino/ masculino fue menor que en otros estudios 2,3/1 versus 4/1 (5,10,16,28). Pero en este estudio solo se consideraron los casos de LES con NL, la relación sería diferente si se consideraran todos los pacientes con LES, ya que el 100% de los varones tuvieron NL.
Benseler y colaboradores encontraron un lapso entre el inicio de los síntomas y el diagnóstico de la enfermedad de 1 mes-3,3 años con una mediana 4 meses(12); en nuestra serie la mediana fue similar pero con un rango menor, 1-14 meses.
La NL se ve entre 50%-86% de los casos de LES(5,6,11,27,31,32); esta serie entra dentro de este porcentaje. En otra serie analizada en nuestro país pero que incluía pacientes atendidos en una policlínica nefrológica la incidencia fue de 89%, con 75% NL clase III-IV(33).
En cuanto al momento de presentación de la NL prácticamente en todos los casos se manifestó desde el debut del LES, solo en un caso que evolucionó luego a un síndrome de superposición con una dermatomiositis la nefropatía apareció luego de 5 años. Está señalado que la nefritis aparece habitualmente en los 2 primeros años de la enfermedad pero también puede presentarse en forma más tardía(5,11).
En esta serie, las clases III y IV tuvieron una frecuencia de 0,9, algo mayor a la descrita en la bibliografía, siendo menor en clases II, V (solo un caso clase III combinada con V), no hubo casos de clase V pura y no clasificables. Otros trabajos muestran una frecuencia de 70-80% en clases III y IV(7,11,29), pero describen clases II y V en mayor porcentaje. La clase V se encontró entre 6 y 16% de los pacientes(17,30). En 24% la clase V se asocia a otras clases de NL (29).
Debe destacarse la franca disociación clínico – anatomopatológica; pacientes con AUM presentaron nefropatía clase III-IV en 93% de los casos. Aunque puede ser sencillo predecir la clase histológica en pacientes que se presentan con síndrome nefrótico o nefrítico con o sin IR, en casos menos graves es difícil predecirla en base a parámetros clínicos y de laboratorio(12).
Hay bibliografía en que se señala la existencia de nefropatía severa aun con examen de orina normal(5,32,34,35). La mayoría de los autores opina que la PBR debería realizarse al menos con AUM(12,36). Otros justifican la realización de PBR a todos los pacientes con LES dadas las discrepancias clínico–anatomopatológicas que pueden condicionar la conducta terapéutica(37).
El significado de la NL silente es incierto y la decisión de PBR es controversial. Algunas series han reportado un pronóstico benigno y por lo tanto perdería jerarquía su detección; para estos autores si el examen de orina y el clearence de creatinina son normales la PBR podría diferirse(32,36). Otros opinan que la PBR en la NL silente está justificada y realizan un tratamiento de acuerdo a la lesión histológica, lo que contribuiría a una mejor sobrevida del paciente (94% de sobrevida a los 8,2 años)(37).
En esta serie en ningún caso la NL se presentó en forma aislada; siempre hubo compromiso de otros parénquimas como refiere la literatura(6,7,11,32). La piel, los sistemas músculo-esquelético y renal son los órganos más frecuentemente afectados en el LES pediátrico(12).
La bibliografía refiere la presencia de AAN positivos en 95-97% de los casos y los anticuerpos anti ADN positivos en 85%-93%. Los datos de este estudio son similares(5,18).
Están descritos valores descendidos de C3: 77% y de C4: 78%(18). La disminución de C3 y el mayor título de anticuerpos anti ADN son más frecuentes en niños que en adultos(28,33).
En lo que respecta al tratamiento el diagnóstico temprano y la introducción de un tratamiento inmunosupresor agresivo conducen a un mejor pronóstico. Decisiones terapéuticas importantes están basadas principalmente en el compromiso de órganos mayores, incluyendo nefritis, enfermedad neurológica y hematológica severa(12). Todos los pacientes recibieron corticoides e hidroxicloroquina como está estipulado en esta afección.
En los casos de nefropatía severa debieron utilizarse inmunosupresores más enérgicos como la ciclofosfamida o el micofenolato mofetilo. Con este último se han visto resultados similares a los de la ciclofosfamida por lo que puede usarse para la inducción de la remisión(32,38).
El rituximab se utilizó en un caso de lupus refractario. Está referido 80% de respuestas positivas al rituximab(32) mientras otros refieren resultados desalentadores(39) por lo cual sería un tratamiento de rescate a intentar en caso de enfermedad refractaria.
En ningún caso se suspendió la inmunosupresión, se logró descender a dosis bajas los corticoides y en ocasiones bajar la dosis del inmunosupresor de mantenimiento. Como señala la literatura la duración del tratamiento es prolongada durante varios años a determinar según la evolución. La posibilidad de empujes persiste aun luego de varios años de remisión por lo que se requiere terapia prolongada aun en ausencia de enfermedad activa(5,32).
Esta serie estudiada es pequeña y el seguimiento corto para extraer conclusiones definitivas en relación al pronóstico de la NL. La evolución de las nefropatías graves III-IV depende del diagnóstico temprano y tratamiento adecuado así como la adherencia al tratamiento que puede verse comprometida sobre todo en la pubertad. La falta de cumplimiento de la medicación es causa frecuente de recaídas como se vio en algún caso de esta serie(6,19).
En la serie de Bogdanovic y colaboradores, el pronóstico depende de la clase histopatológica. La sobrevida renal y de los pacientes a los 5 años fue 88,6% y 98% respectivamente en los pacientes con NL clase IV(40).
La tasa de mortalidad se redujo en las últimas 2 décadas; con una sobrevida mayor al 85% a 10-15 años(5) y de 97% a 9 años(18,29). Algunos autores encontraron en las NL una mortalidad de 6% y evolución a la IRCE de 9% a 11 años(16). La sobrevida global de los pacientes con LES es aproximadamente 95% a los 5 años y 92% a los 10 años, con NL la sobrevida disminuye a 88% a los 10 años, siendo menor en afroamericanos(14,30).
Agravan el pronóstico de la NL: presentación en niños y adolescentes, varones, etnia afroamericana o hispana, síndrome nefrótico, creatinina sérica inicial elevada, severidad histológica, retardo en el inicio del tratamiento, ausencia de respuesta durante el primer año y empujes de NL(12,17,23,29,40,41).
Señalamos que en esta serie dos de los casos más graves eran uno afroamericano: síndrome renopulmonar con síndrome nefrótico y otro indoamericano con glomerulonefritis rápidamente progresiva que requirió sustitución de la función renal.
En conclusión: la NL se presentó mayoritariamente como AUM; en estos casos, se observó una discordancia entre la forma de presentación y la anatomía patológica, con un alto porcentaje de NL severa clases III-IV. Estas clases predominaron en el conjunto de la serie. A pesar del elevado porcentaje de NL severa, el manejo oportuno y adecuado con buena adherencia al tratamiento y a los controles clínico-serológicos constituyeron factores fundamentales para la evolución favorable de la NL.
Referencias bibliográficas
1. American College of Rheumatology Ad Hoc Committee on Systemic Lupus Erythematosus Guidelines. Guidelines for referral and management of systemic lupus erythematosus in adults. Arthritis Rheum 1999; 42(9):1785-96.
2. Zuhre NT, Kenneth CK. The definition and classification. En: Wallace DJ, Hahn B. Dubois’ lupus erythematosus. 7 ed. Philadelphia: Lippincott Williams and Wilkins, 2007:16-9.
3. Rees L, Brogan PA, Bockenhauer D, Webb NJA. Systemic lupus erythematosus. En: Oxford Specialist Handbooks of Pediatrics. Pediatric nephrology. Oxford, UK: Oxford University Press, 2012:226-47.
4. Rus V, Maury EE, Hochberg MC. The epidemiology of systemic lupus erythematosus. En: Wallace DJ, Hahn B. Dubois’ lupus erythematosus. 7 ed. Philadelphia: Lippincott Williams and Wilkins, 2007:34-44.
5. Levy DM, Kamphuis S. Systemic lupus erythematosus in children and adolescents. Pediatr Clin North Am 2012; 59(2):345-64.
6. Marks SD, Tullus K. Lupus Nephritis. En: Geary DF, Schaefer F. Comprehensive Pediatric Nephrology. Philadelphia: Mosby-Elsevier, 2008:329-42.
7. Cameron JS. Lupus nephritis in childhood and adolescence. Pediatr Nephrol 1994; 8(2):230-49.
8. Petri M, Orbai AM, Alarcón GS, Gordon C, Merrill JT, Fortin PR, et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum 2012; 64(8):2677-86.
9. Cervera R, Khamashta MA, Font J, Sebastiani GD, Gil A, Lavilla P, et al; European Working Party on Systemic Lupus Erythematosus. Morbidity and mortality in systemic lupus erythematosus during a 10-year period: a comparison of early and late manifestations in a cohort of 1,000 patients. Medicine (Baltimore) 2003; 82(5):299-308.
10. Zappitelli M, Duffy C, Bernard C, Scuccimarri R, Watanabe Duffy K, Kagan R, et al. Clinicopathological study of the WHO classification in childhood lupus nephritis. Pediatr Nephrol 2004; 19(5):503-10.
11. Lehman TJ. Systemic lupus erythematosus in childhood and adolescence. En: Wallace DJ, Hahn B. Dubois’ lupus erythematosus. 7 ed. Philadelphia: Lippincott Williams and Wilkins, 2007:848-69.
12. Benseler SM, Silverman ED. Systemic lupus erythematosus. Pediatr Clin North Am 2005; 52(2):443-67.
13. Tucker LB, Menon S, Schaller JG, Isenberg DA. Adult- and childhood-onset systemic lupus erythematosus: a comparison of onset, clinical features, serology, and outcome. Br J Rheumatol 1995; 34(9):866-72.
14. Hahn BH, McMahon MA, Wilkinson A, Wallace WD, Daikh DI, Fitzgerald JD, et al; American College of Rheumatology. American College of Rheumatology guidelines for screening, treatment, and management of lupus nephritis. Arthritis Care Res (Hoboken) 2012; 64(6):797-808.
15. Weening JJ, D’Agati VD, Schwartz MM, Seshan SV, Alpers CE, Appel GB, et al. The classification of glomerulonephritis in systemic lupus erythematosus revisited. J Am Soc Nephrol 2004; 15(2):241-50.
16. Markowitz GS, D’Agati VD. Classification of lupus nephritis. Curr Opin Nephrol Hypertens 2009; 18(3):220-5.
17. Hagelberg S, Lee Y, Bargman J, Mah G, Schneider R, Laskin C, et al. Longterm followup of childhood lupus nephritis. J Rheumatol 2002; 29(12):2635-42.
18. Bader-Meunier B, Armengaud JB, Haddad E, Salomon R, Deschênes G, Koné-Paut I, et al. Initial presentation of childhood-onset systemic lupus erythematosus: a French multicenter study. J Pediatr 2005; 146(5):648-53.
19. Marks SD, Hiraki L, Hagelberg S, Silverman ED, Herbert D. Age related renal prognosis in childhood onset SLE. Pediatr Nephrol 2002; 17(9):C107.
20. Tan EM, Cohen AS, Fries JF, Masi AT, McShane DJ, Rothfield NF, et al. The 1982 revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1982; 25(11):1271-7.
21. Niaudet P, Boyer O. Idiopathic Nephrotic Syndrome in Children: Clinical Aspects. En: Avner ED, Harmon WE, Niaudet P, Yoshikawa N, eds. Pediatric nephrology. Berlin: Springer-Verlag, 2009:667-702.
22. Niaudet P. Nephritic Syndrome. En: Geary DF, Schaefer F. Comprehensive pediatric nephrology. Philadelphia: Mosby-Elsevier, 2008:195-203.
23. Van De Voorde RG, Warawdy BA. Management of chronic kidney disease. En: Avner ED, Harmon WE, Niaudet P, Yoshikawa N, eds. Pediatric nephrology. Berlin: Springer-Verlag, 2009:1661-92.
24. National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis 2002; 39(2 Suppl 1):S1-266.
25. Bagga A, Menon S. Rapidly progressive glomerulonephritis. En: Geary DF, Schaefer F. Comprehensive pediatric nephrology. Philadelphia: Mosby-Elsevier, 2008:319-27.
26. Yu F, Wu LH, Tan Y, Li LH, Wang CL, Wang WK, et al. Tubulointerstitial lesions of patients with lupus nephritis classified by the 2003 International Society of Nephrology and Renal Pathology Society system. Kidney Int 2010; 77(9):820-9.
27. Wu LH, Yu F, Tan Y, Qu Z, Chen MH, Wang SX, et al. Inclusion of renal vascular lesions in the 2003 ISN/RPS system for classifying lupus nephritis improves renal outcome predictions. Kidney Int 2013; 83(4):715-23.
28. Hiraki LT, Benseler SM, Tyrrell PN, Hebert D, Harvey E, Silverman ED. Clinical and laboratory characteristics and long-term outcome of pediatric systemic lupus erythematosus: a longitudinal study. J Pediatr 2008; 152(4):550-6.
30. Lee BS, Cho HY, Kim EJ, Kang HG, Ha IS, Cheong HI, et al. Clinical outcomes of childhood lupus nephritis: a single center’s experience. Pediatr Nephrol 2007; 22(2):222-31.
31. Petty RE, Cassidy J. Systemic lupus erythematosus. En: Cassidy J, Petty RE. Textbook of pediatric rheumatology. 4 ed. Philadelphia: Saunders, 2001:396-449.
32. Niaudet N, Salomon R. Systemic Lupus Erythematosus. En: Avner ED, Harmon WE, Niaudet P, Yoshikawa N, eds. Pediatric nephrology. Berlin: Springer-Verlag, 2009:1127-53.
33. Caggiani M, Gazzara G. Lupus eritematoso sistémico en niños y adolescentes: características clínicas, inmunológicas y evolutivas. Análisis y consideraciones terapéuticas. Arch Pediatr Urug 2003; 74(4):237-44.
34. Woolf A, Croker B, Osofsky SG, Kredich DW. Nephritis in children and young adults with systemic lupus erythematosus and normal urinary sediment. Pediatrics 1979; 64(5):678-85.
35. Ahmadian YS, Given GZ, Mendoza SA. Normal urine and positive immunofluorescence reaction in lupus nephritis. Am J Dis Child 1972; 123(2):121-5.
36. Font J, Torras A, Cervera R, Darnell A, Revert L, Ingelmo M. Silent renal disease in systemic lupus erythematosus. Clin Nephrol 1987; 27(6):283-8.
37. Stamenkovic I, Favre H, Donath A, Assimacopoulos A, Chatelanat F. Renal biopsy in SLE irrespective of clinical findings: long-term follow-up. Clin Nephrol 1986; 26(3):109-15.
38. Kazyra I, Pilkington C, Marks SD, Tullus K. Mycophenolate mofetil treatment in children and adolescents with lupus. Arch Dis Child 2010; 95(12):1059-61.
39. Punaro MG. The treatment of systemic lupus proliferative nephritis. Pediatr Nephrol 2013; 28(11):2069-78.
40. Bogdanoviæ R, Nikoliæ V, Pasiæ S, Dimitrijeviæ J, Lipkovska-Markoviæ J, Eriæ-Marinkoviæ J, et al. Lupus nephritis in childhood: a review of 53 patients followed at a single center. Pediatr Nephrol 2004; 19(1):36-44.
41. Cameron JS. Lupus nephritis. J Am Soc Nephrol 1999; 10(2):413-24.
Correo electrónico: marinacaggiani@yahoo.com
Anexo