Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Archivos de Pediatría del Uruguay
versão On-line ISSN 1688-1249
Arch. Pediatr. Urug. vol.84 no.3 Montevideo 2013
CASO CLÍNICO
Síndrome de Mauriac.
A propósito de un caso clínico
Dras. Karina Machado1, María del Luján Pérez2, Alicia Montano3
1. Profesora Adjunta de Pediatría. Departamento de Pediatría y Especialidades. Hospital Pereira Rossell. Udelar
2. Posgrado de Pediatría. Departamento de Pediatría y Especialidades. Hospital Pereira Rossell. Udelar
3. Profesora de Pediatría. Departamento de Pediatría y Especialidades. Hospital Pereira Rossell. Udelar
Departamento de Pediatría y Especialidades. Hospital Pereira Rossell. Facultad de Medicina. Udelar
Fecha recibido: 9 de abril de 2013.
Fecha aprobado: 22 de octubre de 2013.
Resumen
La diabetes mellitus tipo 1 (DM1) es la enfermedad crónica endocrinológica mas frecuente en pediatría y probablemente la de mayor repercusión sanitaria por la gravedad de sus complicaciones. El tratamiento, basado en insulinoterapia, alimentación y ejercicio, tiene como objetivo el control glucémico, garantizando la prevención de complicaciones y mejor calidad de vida. La educación es la piedra angular en la atención del paciente diabético y la clave para un tratamiento exitoso.
La máxima expresión de la DM1 mal controlada es el síndrome de Mauriac, integrado por talla baja, retraso puberal, hepatomegalia, fenotipo cushingoide y dislipidemia. Este síndrome constituye la causa más frecuente de disfunción hepática en niños y adolescentes con DM1 y puede revertir al optimizar el tratamiento.
Se presenta el caso clínico de una adolescente de 14 años, portadora de DM1 de 8 años de evolución. Tenía mal control metabólico, con fallas en todos los pilares de su tratamiento diabetológico. Presentaba falla del crecimiento y del desarrollo puberal, hepatomegalia, hábito cushingoide y dislipemia, lo que configuraba un síndrome de Mauriac en su completa expresión. Estos signos se deben a hiperglucemia mantenida, déficit de insulina y activación de hormonas contrarreguladoras. El diagnóstico de este síndrome es clínico. El tratamiento se basa en el adecuado manejo diabetológico, que lleva al buen control metabólico. Todos los síntomas y signos revierten al lograr el control glucémico. Si este objetivo no se logra, se condiciona el pronóstico a mediano y largo plazo.
Palabras clave:
SÍNDROME DE MAURIAC
DIABETES MELLITUS TIPO 1
Summary
Type 1 diabetes mellitus (T1DM) is the most common chronic endocrinology disease in pediatric and probably the greatest health impact by the severity of its complications. The treatment, based on insulin, food and exercise, search the glycemic control, ensuring the prevention of complications and better quality of life. Education is the cornerstone in the care of diabetic patients and the key to successful treatment.
The ultimate expression of poorly controlled T1DM is the Mauriac syndrome, integrated by short stature, delayed puberty, hepatomegaly, dyslipidemia and cushingoid phenotype. This syndrome is the most common cause of liver dysfunction in children and adolescents with T1DM and may revert optimizing treatment.
We present a case of adolescent 14 years old with 8 years of evolution of T1DM. She had poor metabolic control, with failures in all pillars of diabetologic treatment. She showed failure of growth and pubertal development, hepatomegaly, cushingoid habit and dyslipidemia, which configured Mauriac syndrome in its full expression. These signs are due to sustained hyperglycemia, insulin deficiency and activation of counterregulatory hormones. The diagnosis of this syndrome is clinical. The treatment is based on adequate diabetológic treatment, which leads to good metabolic control. All symptoms and signs reverted achieving glycemic control. If this goal is not achieved, the prognosis depends on the medium and long term complications.
Key words:
MAURIAC SYNDROME
DIABETES MELLITUS, TYPE 1
Introducción
La diabetes mellitus es la enfermedad crónica endocrinológica más frecuente en pediatría y probablemente la de mayor repercusión sanitaria por la importancia y gravedad de sus complicaciones(1). La diabetes mellitus tipo I (DM1) es una enfermedad pancreática determinada por el déficit absoluto de insulina y es la forma de diabetes más frecuente en niños (95% de los casos). Se caracteriza por un estado de hiperglucemia crónica, acompañada de alteraciones en el metabolismo de carbohidratos, lípidos y proteínas(2). La incidencia de DM1 aumentó a nivel mundial en los últimos años, particularmente en menores de 5 años. Se estima que actualmente es de 10-12/100.000 en menores de 15 años(1).
El tratamiento de la DM1, basado en insulinoterapia, alimentación y ejercicio, tiene como objetivo el control glucémico lo más próximo a la normalidad, garantizando mejor calidad de vida(2). La educación es la piedra angular en la atención del paciente diabético y la clave para un tratamiento exitoso. Debe ser personalizada y adaptada a la edad del niño, orientada a él y su familia, impartida por un equipo multidisciplinario con formación especializada en educación en diabetes y métodos educativos, debe ser un proceso continuo y repetitivo(2,3). La familia, como en toda enfermedad crónica, juega un papel muy importante y el apoyo que pueda brindar influirá sobre el buen pronóstico a corto y largo plazo.
La DM1 tiene numerosas complicaciones, que comienzan en la edad pediátrica y se manifiestan principalmente en la edad adulta y determinan la morbilidad de la enfermedad. Muchas complicaciones guardan relación con el mal control y la hiperglucemia crónica, otras no, aunque pueden determinar dificultades en el control. Entre las primeras se encuentran la microangiopatía, determinante de nefropatía, neuropatía y retinopatía y la macroangiopatía, con afectación coronaria, cerebrovascular y vascular periférica. Entre las segundas se encuentran enfermedades psicológicas y psiquiátricas y trastornos autoinmunes. El buen control metabólico se asocia a clara disminución de la frecuencia y el grado de complicaciones microvasculares, tanto en prevención primaria como secundaria. El control glucémico intensivo no mostró reducción importante de eventos macrovasculares, pero al combinarlo con el control de otros factores de riesgo de enfermedad cardiovascular asociados se observa reducción y prevención de estas complicaciones.
Otras complicaciones que pueden desarrollar estos pacientes en estrecha relación con el control metabólico sostenido en el tiempo son: patología articular, caries dental, déficit de crecimiento, sobrepeso y retraso puberal(4). En estos pacientes, además, es frecuente la coexistencia de otros factores de riesgo de enfermedad cardiovascular: hipertensión arterial, dislipidemias, sobrepeso/obesidad, sedentarismo y tabaquismo(5). Algunos de estos factores tienen relación directa con la calidad del control(6). Los programas de tratamiento y educación diabetológica deben prevenir y tratar estos factores de riesgo(7).
Debe buscarse la asociación con otras enfermedades autoinmunes, como hipotiroidismo y enfermedad celíaca.
La máxima expresión de la DM1 mal controlada constituye el síndrome de Mauriac. Éste fue descrito por primera vez en 1930 por Paul Mauriac y, a pesar de ser una entidad antigua, aún se describen casos, sobre todo en adolescentes de sexo femenino. Se caracteriza por talla baja, pubertad retrasada, hepatomegalia y fenotipo cushingoide. Algunos autores incluyen la dislipidemia en el diagnóstico(5,6). Mauriac advierte que el síndrome puede expresarse en grado variable, desde una forma completa hasta formas frustras con menor expresividad clínica(8).
En las últimas décadas la introducción de automonitoreo y técnicas de vigilancia como la hemoglobina glicosilada (HbA1c), y el advenimiento de nuevas insulinas han convertido este síndrome en una rareza, habiendo sólo comunicaciones esporádicas en la literatura(8). La importancia de este síndrome radica en que constituye la causa más frecuente de disfunción hepática en niños y adolescentes con DM1 y en su reversibilidad al optimizar el tratamiento(9).
Objetivo
Presentar el caso clínico de una paciente portadora de DM1 con una evolución propia del síndrome de Mauriac, entidad que si bien es cada vez más rara, aún sigue estando presente en pacientes con mala adhesión al tratamiento.
Caso clínico
Sexo femenino, 14 años y 10 meses, medio social, económico y cultural deficitario. Convivía con madre, abuela materna y hermano menor; padre ausente. No escolarizada. Diagnóstico de DM1 a los 8 años, debut en cetoacidosis. Buen control metabólico hasta los 12 años. A partir de entonces presentó múltiples hospitalizaciones por episodios de cetoacidosis leves a severos, dos de las cuales requirieron ingreso a centro de cuidados intensivos, desencadenados en su mayoría por descontroles dietéticos. Durante las internaciones permanecía acompañada por su madre o su abuela, en forma irregular. No concurría con cuaderno de automonitoreo. Refería cifras habituales de hiperglicemia. No realizaba ejercicio. A los 11 años se diagnosticó hipotiroidismo: comenzó tratamiento sustitutivo, con controles posteriores normales. Último fondo de ojo, realizado un año antes, sin alteraciones. Cifras de microalbuminuria de 33 mg/24 horas en un control realizado un año antes. Recibió psicoterapia irregularmente por alteraciones del humor en menos. No presentaba controles periódicos con pediatra ni con endocrinólogo pediátrico. No logró culminar el programa de educación por no concurrir a los controles. Tratamiento al momento del ingreso: insulina NPH 1 UI/kg/día en tres dosis diarias y ajustes con insulina regular.
Ingresó al hospital por cetoacidosis moderada en el curso de infección respiratoria. Se inició el tratamiento, con buena evolución.
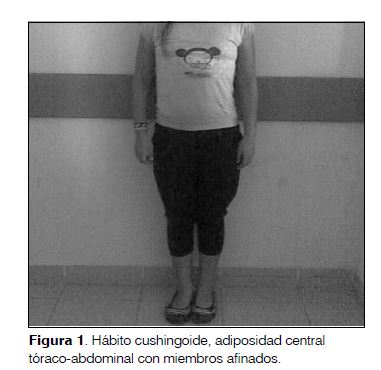
Examen físico durante la hospitalización: hábito cushingoide con cara de luna llena, adiposidad de distribución central, aumento del panículo adiposo a nivel abdominal y miembros afinados (figura 1). Piel y mucosas bien coloreadas, zonas de lipohipertrofia en cara anterior de muslos, pies sin lesiones. Examen cardiovascular: punta en línea de referencia, tonos normofonéticos, sin soplos, frecuencia cardíaca 90 por minuto. Presión arterial 100/60 mmHg. Examen pleuropulmonar normal. Abdomen globuloso, hepatomegalia a 4 cm del reborde costal, de consistencia firme-elástica, borde regular, levemente dolorosa. Examen osteoarticular: retracción con limitación en la motilidad de articulaciones interfalángicas proximales y metacarpofalángicas de tercero, cuarto y quinto dedo de ambas manos. Limitación en la extensión de ambos puños (figura 2). No presentaba alteraciones en otras articulaciones. El examen neurológico era normal. Estadio de TANNER II. Peso 39.900 g, talla 1,43 m. Índice talla para la edad (T/E) con puntaje Z de -3,1; índice de masa corporal (IMC) para la edad 19,5, con puntaje Z de 0,03.
La HbA1c era de 16,1%; la cifra de colesterol fue de 265 mg/dl, y triglicéridos de 450 mg/dl. El funcional hepático fue normal excepto una leve microalbuminuria.
La ecografía abdominal evidenció hígado aumentado de tamaño, de contornos regulares, con leve aumento de la ecogenicidad en forma global. El examen de orina fue normal.
Discusión
La DM1 es una enfermedad crónica que determina importantes modificaciones a nivel físico y emocional. Los pacientes afectos sufren grandes alteraciones en su estilo de vida, deben inyectarse insulina a diario, controlar su glicemia y cuidar su ingesta. La morbilidad y mortalidad tienen relación directa con los desajustes metabólicos agudos y las complicaciones crónicas. Los progresos en el tratamiento de la diabetes han logrado una mejoría notable en el pronóstico a corto, mediano y largo plazo. Los niños portadores de esta enfermedad no mueren por descompensaciones, en su mayoría puede tener una buena calidad de vida, con escolaridad normal y buen nivel psicofísico(10).
El tratamiento adecuado de la DM1 incluye insulinoterapia, dieta, ejercicio y autocontrol. Es indispensable una educación diabetológica intensa, continua, reiterada e impartida por personal entrenado, destinada al paciente, su familia y su entorno. Uno de los objetivos de la educación es transferir en forma gradual las responsabilidades en el cuidado de la diabetes al paciente y su familia(1,10). En esta paciente no se optimizaron estos pilares del tratamiento, lo que determinó que evolucionara con graves complicaciones.
La adhesión al tratamiento requiere la motivación del paciente y su familia(10). El rol de la familia es fundamental. Es recomendable que ambos progenitores y/u otros integrantes del núcleo familiar concurran a los controles y participen en la educación, lo que no se pudo llevar a cabo en este caso(10). Esto seguramente influyó negativamente en su tratamiento. Se ha reportado que en las familias disfuncionales puede haber dificultades desde el momento del diagnóstico, con conflictos para aceptar la condición de patología crónica, así como durante la evolución, para lograr una correcta adhesión al tratamiento y un buen grado de control(1). Estas familias requieren atención psicológica especializada, lo que no fue posible en este caso.
Son predictores de mala adhesión al tratamiento: la existencia de un solo progenitor, la ausencia permanente de uno de los progenitores a las instancias de instrucción, problemas psiquiátricos en la casa, familia que necesita inicialmente asistencia social(10). Muchos de estos factores estaban presentes en esta paciente, lo que debió haber sido abordado y tratado en forma óptima por el equipo de salud, pudiendo quizás haber prevenido la mala evolución posterior.
Esta paciente presentaba múltiples fallas en la adherencia a todos los pilares del tratamiento. Incumplía la dieta, con frecuentes transgresiones. Presentaba evidencias de fallas en la técnica de administración de insulina, como las zonas de lipohipertrofia, debidas a la elección de la misma zona para aplicar la insulina, sin rotar los sitios de punción; que determinan además una absorción errática y enlentecida(11). No realizaba actividad física, una de las estrategias fundamentales en el tratamiento de la enfermedad, que influye positivamente en el control metabólico y corrige factores de riesgo de enfermedad cardiovascular como sobrepeso y sedentarismo. El ejercicio, además, contribuye al bienestar psicológico(10,12). Además, en los siete años de evolución de la enfermedad no recibió un programa de educación diabetológica completo.
Otro factor que pudo haber incidido negativamente en la evolución de la enfermedad y su escasa adherencia al tratamiento fue el trastorno del humor en menos, con rasgos depresivos, incorrectamente tratado. Varios estudios internacionales comprobaron que niños y adolescentes con DM1 presentan mayor prevalencia de depresión en comparación con la población general, así como niveles más bajos de autoestima(13). La terapia conductual mejora estos trastornos y favorece la adherencia al tratamiento(12,14).
Todas estas fallas determinaron, por un lado, múltiples descompensaciones, algunas de ellas con riesgo de vida, y por otro lado, muchas complicaciones crónicas, que condicionan el pronóstico a mediano y largo plazo. La falla en la adherencia al tratamiento determinó el mal control de la enfermedad en su expresión máxima: el síndrome de Mauriac, que esta paciente presentaba en forma completa, con falla del crecimiento, retraso puberal, hepatomegalia, hábito cushingoide y dislipemia. Mauriac hacía alusión a que los pacientes pasibles de desarrollar este síndrome eran aquellos con escasa adherencia al tratamiento, lo que fue reafirmado en 1950 por la doctora Saldún de Rodríguez(8). Ambos destacaron su reversibilidad, en forma total o parcial, con buen control metabólico.
La falla de crecimiento se evidenciaba por una talla baja severa con un score Z -3,1 de T/E. Su origen es probablemente multifactorial, derivado de factores nutricionales y endocrinológicos. A través de varios mecanismos, la hiperglucemia mantenida y el déficit de insulina contribuyen al deterioro del crecimiento provocando alteraciones metabólicas y hormonales, con afectación de todas las hormonas adenohipofisarias. Tanto al inicio de la enfermedad como en la evolución, los niveles de ghrelina, potente estimulante de la secreción de hormona de crecimiento (GH), permanecen disminuidos. El aumento de las cifras de glucosa produce disminución en la secreción basal de GH. Por otra parte la insulina regula la actividad de la somatomedina (IGF-I), importante factor de crecimiento tisular. Aún son necesarios más estudios para dilucidar si existen otros mecanismos fisiopatológicos del retraso de crecimiento. Los conocimientos acerca de la relación entre el control de la diabetes, el crecimiento lineal y la actividad de la somatomedina se basan en datos de niños en quienes, mejorando el control metabólico, se logró el regreso a la normal actividad de IGF-I y la recuperación parcial del crecimiento(15-17).
La pubertad normal es un período crítico en el que se necesita la confluencia de factores alimentarios, endocrinológicos, metabólicos y psicoemocionales. En niñas sanas, la pubertad se inicia a los 11 ± 2 años y la menarca tiene lugar 2 años más tarde(18). Los púberes portadores de DM1 requieren un control preciso en su tratamiento nutricional e insulínico. Estudios internacionales demostraron un retraso en el inicio de la pubertad en niñas con DM1, en las que la menarca se presentó a una edad promedio de 15 años. Este retraso tuvo relación inversa con la duración de la enfermedad. Los distintos autores advierten que podrían existir otros factores en la patogenia del retraso puberal(16,19). Esta paciente presentaba un retraso en su desarrollo puberal, relacionado seguramente al mal control metabólico y la mala adhesión al tratamiento.
El hábito cushingoide se caracteriza por distribución particular de la grasa corporal con acumulación en cara, dando a la misma forma redondeada (luna llena), adiposidad en cuello (giba de búfalo), adiposidad en tronco y centroabdominal con emaciación en miembros. Su patogenia se atribuye al hipercortisolismo endógeno, generado por aumento en la secreción de corticoesteroides, mediante la estimulación adrenal que puede ocurrir tanto en los episodios de hipoglicemia como en los episodios de cetosis(20). La insulinización insuficiente promueve la lipólisis con producción de cuerpos cetónicos. La cetosis activa la síntesis del cortisol, retroalimentando así la liberación de ácidos grasos y la hiperglucemia(9).
La hepatomegalia es un signo presente en la mayoría de los pacientes con mala adhesión al tratamiento, aunque no es patognomónica del síndrome de Mauriac. Se debe a sobrecarga glucogénica(1,9). La hiperglucemia estimula el depósito de glucógeno en los hepatocitos. La deficiencia de insulina y el consecuente aumento de la glucemia sanguínea impiden el feedback necesario para inhibir la gluconeogénesis hepática. El hígado produce una cantidad mayor de glucosa, que se convierte en glucógeno y se almacena en este órgano. La ecografía es un método sensible para el diagnóstico de glucogenosis hepática. La biopsia está indicada solamente en casos graves o cuando existan dudas diagnósticas(21,22). La glucogenosis hepática es reversible con insulinización adecuada y normalización glucémica(9).
La hipercolesterolemia se debe a absorción aumentada de colesterol(23). Esto se conoce a partir de estudios sobre el metabolismo del colesterol en estos pacientes. Fármacos como las estatinas no tendrían beneficios, ya que no inhiben la absorción de colesterol(24,25).
Como complicación relacionada a toxicidad de la hiperglicemia crónica y la glucosilación de los tejidos, esta paciente presentaba limitación en la movilidad de las articulaciones interfalángicas, metacarpofalángicas y de ambos puños. Esta situación se asocia a complicaciones microvasculares(7).
Como complicaciones microvasculares, propias de la enfermedad crónica mal controlada, la microalbuminuria incipiente es la primera manifestación clínica de nefropatía diabética. No se encontraron evidencias de otras complicaciones microangiopáticas retinianas ni neurológicas.
El diagnóstico del síndrome de Mauriac es eminentemente clínico. En muchos casos se requiere descartar algunos diagnósticos diferenciales. La medición de HbA1c es un parámetro importante para demostrar el mal control metabólico cuando se encuentra por encima de 7,5%(21). En esta paciente la cifra extremadamente elevada lo demuestra. El tratamiento del síndrome de Mauriac se basa en un buen control metabólico, para lo cual es imprescindible una correcta adherencia al tratamiento diabetológico. Está demostrado que una vez logrado y mantenido el buen control glucémico desaparece la signosintomatología del síndrome(8,22).
Si bien el síndrome de Mauriac es poco frecuente, es importante la sospecha clínica en niños con mal control metabólico, lo que posibilitará un diagnóstico temprano, adecuación del tratamiento y reducción de los riesgos de complicaciones, mejorando la calidad de vida(22).
Referencias bibliográficas
1. Oyarzábal Irigoyen M, Rodríguez Rigual M, López García MJ. Educación diabetológica. En: Pombo Arias M. Tratado de endocrinología pediátrica, 4 ed. Madrid: McGraw-Hill, 2009:796-803.
2. Barreiro Conde J, Cabanas Rodriguez P, Castro Fijoo L, Pombo Arias M. Diabetes mellitus infantil: clasificación, diagnóstico, epidemiología y etiología. En: Pombo Arias M, Tratado de endocrinología pediátrica. 4 ed. Madrid: McGraw-Hill, 2009:748-75.
3. Swift PG. Diabetes education in children and adolescents. Pediatr Diabetes 2009; 10 Suppl 12:51-7.
4. Molina Font JA, Fernández García JM. Complicaciones de la diabetes mellitus. En: Pombo Arias M. Tratado de endocrinología pediátrica. 4 ed. Madrid: McGraw-Hill, 2009:770-80.
5. Abregú AV, Carrizo T del R, Prado MM, Velarde MS, Díaz EI, Pérez Aguilar RC, et al. Factores de riesgo cardiovascular en niños con diabetes tipo 1 y su relación con el control de la glucemia. Medicina (B. Aires) 2005; 65(5): 385-89.
6. Moreno Téllez E, Barbán Mesa V, Acosta Valdés MA, Alonso Rodríguez D, Medina Ali FE. Monitorización de lípidos séricos en niños diabéticos tipo I según control metabólico. Arch Méd Camaguey 2004; 8(1): s/p. Disponible en: http://www.redalyc.org/articulo.oa?id=211117824003. [Consulta: octubre 2013].
7. Rubio Cabezas O, Argente Oliver J. Diabetes Mellitus en niños y adolescentes: complicaciones crónicas y enfermedades asociadas. An Pediatr (Barc) 2009; 66(3):282-9.
8. Tonietti M, Raizman H, Trifone L. Síndrome de Mauriac: regreso a la historia de la diabetes. Rev Hosp Niños B Aires 2007; 49(222): 86-92.
9. Flotats Bastardas M, Miserachs Barba M, Ricart Cumeras M, Clemente León M, Gussinyer Canadell M, Yeste Fernández D et al. Hepatomegalia por depósito de glucógeno hepático y diabetes mellitus tipo 1. An Pediatr (Barc) 2007; 67(2):157-60.
10. López García MJ, Oyarzábal Irigoyen M, Rodríguez Rigual M. Tratamiento de la diabetes mellitus en la infancia y adolescencia. En: Pombo Arias M. Tratado de endocrinología pediátrica. 4 ed. Madrid: McGraw-Hill, 2009::756-769.
11. Morelli JG. Enfermedades del tejido celular subcutáneo. En: Kliegman RM, Jenson HB, Behrman RE, Stanton BF. Nelson Tratado de Pediatría. 18 ed. Barcelona: Elsevier, 2009: 2721-4.
12. García Gómez JR. Diabetes y depresión en niños, preadolescentes, adolescentes y adultos que padecen diabetes mellitus tipo 1. Qurriculum 2006; 19:267-81.
13. Gil Roales Nieto J, Vilchez Joya R. Diabetes: intervención Psicológica. Madrid: Eudema psicología, 1993.
14. Gil Roales Nieto J. Programas de educación en diabetes. En: Polaino Lorente A, Gil Roales Nieto J. La diabetes. Barcelona: Martínez-Roca, 1994:162-200.
15. Winter RJ, Phillips LS, Green OC, Traisman HS. Somatomedin activity in the Mauriac syndrome. J Pediatr 1980; 97(4):598-600.
16. Lechuga Sancho AM, Blanca JA, Lechuga Campoy JL. Hipocrecimiento de origen nutricional y por enfermedades crónicas En: Pombo Arias M, Tratado de endocrinología pediátrica. 4 ed. Madrid: McGraw-Hill, 2009: 188-99.
17. Timoteo C, Castanhinha S, Constant C, Robalo B, Pereira C, Sampaio L. Crescimento e puberdade na diabetes mellitus tipo 1. Acta Med Port 2012; 25(4):213-8.
18. Muñoz Calvo MT, Pozo Román J. Pubertad normal y sus variantes. Pediatr Integral 2011; 15(6):507-18.
19. Elamin A, Hussein O, Tuvemo T. Growth, puberty, and final height in children with Type 1 diabetes. J Diabetes Complications 2006; 20(4):252-6.
20. Clarke W, Jones T, Rewers A, Dunger D, Klingensmith GJ. Assessment and management of hypoglycemia in children and adolescents with diabetes. Pediatr Diabetes 2009; 10(Suppl 12):134-45.
21. Brink S. Complicaciones micro y macrovasculares en niños y adolescentes con Diabetes Mellitus Tipo 1. Rev Asoc Latinoam Diabetes 2008; 16(4): 124-6.
22. Maia F, Araújo L. Síndrome de Mauriac: forma rara do Diabetes Mellitus Tipo I. Arq Bras Endocrinol Metab 2002; 46(3): 310-15.
23. Mandell F, Berenberg W. The Mauriac syndrome. Am J Dis Child 1974; 127(6):900-2.
24. Constantino C, Neves JF, Marta R, Pereira G, Barata D, Lopes L. Síndrome de Mauriac: uma apresentação rara de uma doença mais comum. Nascer e Crescer 2010; 19(4): 278-81.
25. Kidambi S. Effect of diabetes mellitus on cholesterol absortion, sintesis and statin efficacy. ClinicalTrials.gov 2013, Identifier: NCT00879710. Disponible en: http://clinicaltrials.gov/ct2/show/NCT00879710?recr=Open&cond=%221%22&lup_s=09%2F22%2F2012&lup_d=30 [Consulta: octubre 2013].
Correspondencia: Dra. Karina Machado.
Correo electrónico: kmachado@adinet.com.uy