Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Archivos de Pediatría del Uruguay
versão impressa ISSN 0004-0584versão On-line ISSN 1688-1249
Arch. Pediatr. Urug. vol.82 no.3 Montevideo 2011
ARTÍCULO ORIGINAL
Arch Pediatr Urug 2011; 82(3)
Neuroprotección mediante hipotermia moderada en recién nacidos con encefalopatía hipóxico-isquémica
Dres. Claudia Martínez 1, Carlos Pouso 1, Daniel Borbonet 2, Margarita Bidegain 3, Ronald Goldberg 4
1. Pediatra. Asistente de Neonatología.
2. Profesor Director del Dep. de Neonatologia del CHPR.Facultad de medicina, Udelar.
3. Profesor Asistente de Pediatría de la División de Neonatología en Duke University Medical Center.
4. Profesor Director del Dep de Neonatología en Duke University Medical Center.
Fecha recibido: 28 febrero de 2011.
Fecha aprobado: 1º de noviembre de 2011.
Resumen
En la mayoría de los países desarrollados el tratamiento con la hipotermia se ha convertido en un pilar fundamental para la neuroprotección del recién nacido con encefalopatía hipóxico-isquémica (EHI). En la unidad de cuidados intensivos neonatales de la universidad de Duke, la hipotermia moderada se aplica desde el 2005. El tratamiento con hipotermia es muy limitado en otros países porque en adición a un equipamiento especializado, requiere de manejo detallado de las disfunciones multiorgánicas, documentación meticulosa de la información clínica con cuidados y control del paciente en forma protocolizada. Como punto de partida, y para facilitar la introducción de la hipotermia en las unidades de cuidados intensivos neonatales en Uruguay, se presenta la evolución de cinco pacientes internados en la unidad de cuidados intensivos del centro hospitalario de Duke (Carolina del Norte, EE.UU.), evaluando la respuesta al tratamiento con hipotermia moderada y su evolución clínica.
Palabras clave:
HIPOTERMIA INDUCIDA
HIPOXIA-ISQUEMIA ENCEFÁLICA
RECIÉN NACIDO
Summary
In most developed countries hypothermia treatment has become a fundamental pillar for the neuro-protection of the newborn with hypoxic ischaemic encephalopathy. In the neonatal intensive care unit at Duke University, moderate hypothermia has been applied since 2005. Hypothermia therapy is very limited in other countries because in addition to specialized equipment, it requires detailed management of the multiorganic dysfunctions, meticulous documentation of clinical information with patient care and control in following protocols. As a starting point and in order to facilitate the introduction of hypothermia in neonatal intensive care in uruguayan units, the evolution of 5 patients in the intensive care unit of the Centre Hospitalier of Duke (North Carolina, USA) is presented, assessing response to treatment with moderate hypothermia and its clinical evolution.
Key words:
HYPOTHERMIA, INDUCED
HYPOXIA-ISCHEMIA, BRAIN
INFANT, NEWBORN
Introducción
La agresión asfíctica alrededor del nacimiento y su correlato clínico, la encefalopatía hipoxia isquémica (EHI), moderada o grave ocurre aproximadamente en 6 por 1.000 recién nacidos a término en países desarrollados y se asocia a una importante morbimortalidad neonatal y neurológica a largo plazo. Aproximadamente 10% de los recién nacidos afectados muere en el período posnatal y 30% queda con discapacidad neurológica durante la infancia (1,2).
Las anormalidades encontradas en el examen neurológico a los pocos días del nacimiento es uno de los más útiles predictores en la infancia de que la injuria ocurrió en el período neonatal.
Los criterios esenciales sugeridos como requisitos previos para el diagnóstico de injuria hipóxico-isquémica resultando en moderada o severa encefalopatía en el recién nacido de término incluyen: acidosis metabólica con pH menor o igual de 7 o déficit de base mayor de -12 mmol/l; comienzo temprano de encefalopatía; disfunción orgánica multisistémica; exclusión de otras causas como trauma, alteraciones de la coagulación, alteraciones metabólicas, causas genéticas (3).
Hasta el presente el manejo de la EHI ha consistido en cuidados de soporte general y el tratamiento de las crisis convulsivas.
En la última década el mejor conocimiento de los acontecimientos que se producen tras la agresión hipóxico-isquémica ha dado lugar a una intensa investigación sobre nuevas estrategias terapéuticas neuroprotectoras. Además se ha demostrado que tras la agresión hipóxico-isquémica existe un período de tiempo durante el cual las intervenciones terapéuticas pueden aminorar la lesión cerebral (1,2).
A partir de los trabajos que demostraron la eficacia del tratamiento con hipotermia como neuroprotector en recién nacidos de término o casi a término con EHI para mejorar los resultados de morbimortalidad y de sobrevida sin morbilidad neurológica, se ha instaurado esta terapia como tratamiento de rutina en los recién nacidos con sufrimiento hipóxico-isquémico perinatal (4).
El acceso a esta terapia en los países latinoamericanos es posible con adiestramiento del personal de enfermería para el manejo y control estricto de estos pacientes durante el período de hipotermia y recalentamiento.
Propósito del estudio
Apoyar la introducción del tratamiento de hipotermia moderada como neuroprotección en los recién nacidos con EHI en los países de Latinoamérica.
Material y métodos
Se realizó un estudio descriptivo, retrospectivo, de revisión de casos clínicos en recién nacidos tratados con hipotermia debido a encefalopatía hipóxico-isquémica en la unidad de cuidados intensivos neonatales de Duke en el período comprendido entre julio de 2010 y setiembre de 2010. En este período asistimos como neonatólogos visitantes a la unidad de cuidados intensivos de Duke, con el apoyo de la Sociedad Iberoamericana de Neonatología (SIBEN). Esta unidad tiene 800 ingresos anuales, 40 de los cuales requieren tratamiento con hipotermia.
Se describieron los signos vitales, neurológicos, cardiovasculares, respiratorios, renales, hematológicos y metabólicos durante el período de hipotermia de 72 horas. Los datos fueron obtenidos de los registros médicos que se encuentran en formato electrónico, antes, durante y posteriormente al tratamiento con hipotermia. Los datos descriptivos incluyen: examen físico, signos vitales, notas de evolución, resultado del laboratorio, tratamientos e interconsulta. Se obtuvieron registros sobre las interconsultas luego del alta del paciente evaluando el neurodesarrollo y paraclínica evolutiva.
Riesgos/beneficios de la evaluación
El estudio fue aprobado por el Duke Institutional Review Board. El único riesgo involucrado en este estudio es la pérdida de confidencialidad. Los datos obtenidos de los registros médicos no incluyen ninguna forma de identificación de pacientes. Los registros se mantendrán protegidos electrónicamente con la contraseña de los principales investigadores o en otras computadoras protegidas por las redes electrónicas de Duke.
Resultados
La media de la edad materna fue 27,8 años, 60% eran de raza afroamericana, fumadoras, con hipertensión arterial crónica. En uno de los casos se constató consumo de drogas ilícitas (heroína). Cuatro de los embarazos fueron bien controlados, con más de cinco controles.
En cuanto a eventos perinatales agudos se observaron: corioamnionitis clínica, desprendimiento prematuro de placenta normoinserta, rotura de vasos uterinos.
Como elementos de hipoxia fetal intraparto se evidenció monitorización fetal patológica y presencia de liquido amniótico meconial espeso.
La vía del parto fue vaginal en cuatro de los cinco casos, con evolución espontánea sin inducción farmacológica.
Los recién nacidos en esta serie, fueron de sexo masculino 80%, con edades gestacionales comprendidas entre las 35 y las 39 semanas. El Apgar al minuto fue de 0 en 60% y 1 en 40%, a los 5 minutos fue 0 en 20%, 2 en el 40% y 3 en el 40%. El pH de cordón fue menor o igual a 7 en todos los pacientes, con BE mayor de -14 en todos los casos. Todos los recién nacidos requirieron reanimación completa utilizándose como medicación principal epinefrina por vía intratraqueal e intravenosa. A los 10 minutos el Apgar fue mayor de 7 en 80%. En todos los casos se realizó intubación orotraqueal, en 80% se mantenía al inicio del enfriamiento.
Decisión de iniciar tratamiento con hipotermia
Los recién nacidos fueron evaluados en dos escalones:
A) Evaluación clínica y criterios paraclínicos.
B) Seguimiento con examen neurológico.
A) Para considerar tratamiento con hipotermia se deben cumplir los siguientes requisitos:
1. Edad gestacional mayor o igual a 34 semanas.
2. Historia clínica de evento perinatal agudo (por ejemplo desprendimiento prematuro de placenta (DPPNI), prolapso de cordón, monitorización fetal alterada, etcétera).
3. Apgar menor o igual a 5 a los 10 minutos de vida.
4. PH de cordón o en gasometría en sangre antes de la hora de vida menor o igual a 7.
5. Déficit de base de cordón umbilical o antes de la hora de vida mayor o igual a -16 mEq/l.
6. Necesidad de ventilación continua más allá de los 10 minutos de vida.
Cuando el recién nacido cumple con los criterios A1 o A2 (tabla 1), se procede al examen neurológico.
B) Presencia de encefalopatía moderada a severa, definida como convulsiones o presencia de uno o más signos en tres de las seis de las categorías (nivel de conciencia, actividad espontánea, postura, tono, reflejos primitivos, sistema autonómico) (tabla 2).
El examen neurológico fue realizado por el médico a cargo del recién nacido. Si el recién nacido se encuentra en los criterios A1 o A2 y criterio B y no tenía criterios de exclusión, el recién nacido era elegido para el enfriamiento corporal total.
Todos los recién nacidos comenzaron en enfriamiento corporal total dentro de las primeras seis horas de vida en la unidad de cuidados intensivos neonatales de Duke (figura 1). Tres de ellos fueron transportados desde hospitales externos a la unidad de cuidados intensivos neonatales de Duke, el transporte se realizó con incubadoras apagadas con el objetivo de realizar un enfriamiento pasivo y evitar hipertermia.
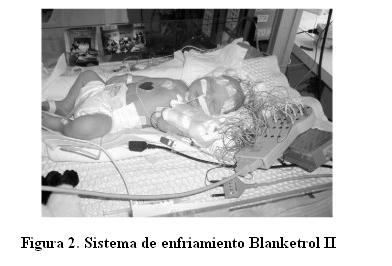
El sistema de enfriamiento corporal utilizado fue el de hipotermia corporal total que utiliza las mantas de hipotermia/hipertermia Blanketrol II (figura 2), más un termómetro de control de temperatura esofágica que se coloca en el tercio inferior del esófago por vía intranasal comprobándose la posición correcta de la misma mediante radiografía de tórax. El recién nacido se ubica en una termocuna apagada, una de las mantas (de 64 cm por 83 cm) se coloca debajo del paciente y otra de tamaño adulto se coloca suspendida a un lado de la cama. Esta manta funciona como un buffer de temperatura para incrementar la circulación del volumen de agua y evitar cambios rápidos de temperatura durante el enfriamiento y el período de recalentamiento. La temperatura elegida para comenzar el enfriamiento es de 33,5ºC. La temperatura de las mantas, axilar y de la sonda intraesofágica se monitorea cada 15 minutos durante las primeras 4 horas, y luego horariamente durante las primeras 12 horas y luego cada 4 horas hasta comenzar el recalentamiento a las 72 horas. Durante este período los pacientes son sometidos a incrementos graduales de temperatura a razón de 0,5ºC por hora hasta alcanzar una temperatura de 36,5ºC durante un lapso de seis horas. Para lograr este objetivo se realiza un reajuste en la temperatura del Blanketrol II de 0,5ºC por hora, y la temperatura se monitorea cada 30 minutos durante el período de recalentamiento (protocolo adjunto, apéndice A) (figura 3).
Durante las 72 horas de enfriamiento se realizó monitorización:
Metabólica: ionograma, creatinina, cada 24, 48 y 72 horas. Respiratoria: gasometría cada 24, 48 y 72 horas. Cardiovascular: frecuencia cardíaca, presión sanguínea, agentes inotrópicos administrados con registro horario. Renal: diuresis horaria. Hematológica: hemograma, recuento plaquetario, crasis a las 24 horas del enfriamiento y luego según la clínica. Cutánea: valoración del estado de la piel una vez por turno.
Al ingreso 80% tenía encefalopatía moderada según el examen físico (tabla 1). Presentaron convulsiones 80% de los recién nacidos. Tres de los pacientes presentaron convulsiones antes del inicio del enfriamiento y uno durante el período de recalentamiento. No se constataron convulsiones durante el período de hipotermia. Todos fueron tratados con fenobarbital. Ningún paciente contaba con electroencefalograma previo al enfriamiento. Durante el período de hipotermia se realizó a todos EEG prolongados. De forma paralela se evaluó la evolución clínica neurológica.
También fueron evaluados con imagenología, ecografía transfontanelar y resonancia nuclear magnética cerebral (RNM). Las RNM mostraron resultados patológicos en todos los pacientes con imágenes compatibles con eventos hipóxico-isquémicos, como encefalomalacia multiquística, hemorragia y zonas hiperdensas. Las ecografías transfontanelares se realizaron dentro de las 12 a 24 horas de vida, tres fueron normales y dos mostraron resultados patológicos con evidencia de edema cerebral y hemorragia grado 1 (tabla 3).
Con respecto a la evolución neurológica de los pacientes, al momento del alta uno de ellos mantenía elementos patológicos al examen físico neurológico, con tendencia a la mejoría durante su seguimiento.
En el seguimiento ambulatorio se constató que 80% tuvieron buena evolución clínica con respecto al examen neurológico al ingreso. El 80% evidenció examen clínico neurológico normal al mes de vida.
En cuanto a la valoración de la electroencefalografía, los registros fueron realizados dentro de los primeros tres días de vida siendo patológicos en 80%, con patrones compatibles con encefalopatía difusa, disfunción cerebral leve y excesiva irritabilidad cortical. En 60% se realizó control evolutivo con EEG, mostrando mejoría con registros normales.
En uno de los pacientes se diagnosticó síndrome aspirativo de líquido meconial. En dos pacientes se diagnosticó hipertensión pulmonar persistente evidenciada por la clínica y el ecocardiograma.
Al inicio del tratamiento de hipotermia un paciente se encontraba ventilando espontáneamente al aire, dos se encontraban en asistencia ventilatoria mecánica con ventiladores ciclados por tiempo y limitados por presión, el sistema utilizado fue el Babylon, con parámetros fijados por el terapeuta respiratorio.
En dos pacientes se utilizo ventilación jet de alta frecuencia, utilizando el sistema Bunnel. En ellos se realizó diagnóstico de hipertensión pulmonar persistente dada por signos directos ecocardiográficos de medición de presión arterial pulmonar y/o signos indirectos de hipertensión pulmonar persistente tales como insuficiencia tricuspídea, flujo de sangre a través del ductus arterioso permeable o foramen oval de derecha a izquierda, rectificación del septum interventricular e hipertrofia del ventrículo derecho, y elementos clínicos como cianosis generalizada corroborada con saturación menor a 85% que no mejoraba con el aporte de oxígeno al 100%, gradiente pre y posductal mayor a 5%. Sin evidencia ecocardiográfica de cardiopatía estructural. El tiempo de ventilación jet para cada uno de estos pacientes fue de 72 horas y de 12 días respectivamente. Se suministró óxido nítrico inhalado a través de un dispositivo colocado inmediatamente a la salida del respirador, realizándose controles permanentes de la dosis de óxido nítrico y de la cantidad de dióxido de nitrógeno generado durante un período de 36 horas y 12 días respectivamente. El tratamiento de sostén hemodinámico fue de acuerdo a la situación hemodinámica particular de cada paciente, utilizándose dopamina, epinefrina e hidrocortisona. En ningún caso se utilizó dobutamina ni milrinona. Durante el inicio del óxido nítrico se observó en estos pacientes mejoría de la saturación de oxígeno que se mantuvo entre 90% y 100% con FIO2 y presión media en vía aérea en descenso.
Como se muestra en la figura 4, cuatro de los recién nacidos mostraron períodos de frecuencias cardíacas entre 80 y 100 cpm durante el enfriamiento.
Las presiones arteriales medias se mantuvieron dentro del rango normal esperable para la edad gestacional. No se evidenció aumento de la necesidad de apoyo inotrópico vinculado a la hipotermia.
Características gasométricas, hematológicas y metabólicas de los pacientes que reciben hipotermia corporal total durante 72 horas
Se realizaron controles gasométricos seriados, observándose valores de pH que estuvieron en un rango de 7,25 a 7,44, con una media de 7,32.
El hematocrito durante el enfriamiento estuvo en un rango de 34%–50%, con un promedio de 42%. Uno de los pacientes requirió transfusión de glóbulos rojos secundaria a desprendimiento de placenta normoinserta.
El recuento de glóbulos blancos se mantuvo por encima de 7.000 elementos/mm3 en todos los recién nacidos durante el período de hipotermia.
80% tenían recuentos plaquetarios normales al inicio de la hipotermia. Uno de los recién nacidos tenia plaquetopenia de 106.000 antes del inicio del enfriamiento.
De los pacientes con recuentos plaquetarios normales al inicio del enfriamiento, 100% desarrolló plaquetopenia (se definió plaquetopenia < 150.000) durante dicho período. El rango observado fue de 63.000 a 208.000.
Uno de los pacientes presentó hemorragia ventricular grado 1 no progresiva (tablas 4, 5 y 6).
En cuanto al medio interno uno de los pacientes presentó hipocalcemia que requirió corrección.
No se observaron episodios de hipoglicemia.
En cuanto a la crasis, en todos los pacientes se observó aumento del tiempo de protrombina y KPTT con tendencia a la hipocoagulabilidad.
Todos los pacientes sobrevivieron. El alta se otorgó tempranamente de la unidad de cuidados intensivos con períodos de internación que fueron de 9 a 30 días.
Discusión
La fisiopatología de la injuria cerebral debida a la hipoxia-isquemia ha sido bien estudiada: está asociada con dos fases de eventos patológicos que culminan en la injuria cerebral (5) (tabla 7).
Etapas fisiopatológicas de la lesión cerebral hipoxia isquémica
Inicialmente, de forma inmediata tras la agresión, tiene lugar un edema citotóxico grave debido a la despolarización celular hipóxica, generada por una falla primaria de energía que es consecuencia de una reducción del flujo sanguíneo cerebral y del suministro de oxígeno, generando una disminución en la concentración de los componentes de alta energía como el ATP y la fosfocreatina, determinando una falla en las bombas de sodio-potasio ATPasa.
El descenso en la concentración de ATP conduce a una despolarización de membrana y a una disrupción de los canales iónicos voltaje dependiente lo que permite una excesiva entrada de calcio al citosol iniciándose la salida de glutamato y activando los receptores N-metil-D-aspartato (NMDA). El incremento en expresión y activación en los receptores NMDA lleva a un mayor influjo de calcio intracelular.
Cuando el influjo de calcio no está regulado se produce la activación de fosfolipasas, proteasas, endonucleasas que producen la disrupción de membranas celulares de organelos y el núcleo (5,6).
Esta falla primaria de energía es un prerrequisito esencial para todos los eventos deletéreos que siguen (pérdida de homeostasis iónica transmembrana; acumulación de sodio, cloro y agua intracelular; déficit de la osmorregulación; liberación o bloqueo de la recepción de neurotransmisores excitatorios; inhibición de la síntesis proteica).
Tras la reperfusión, el edema citotóxico puede resolverse transitoriamente y se produce una recuperación parcial del metabolismo oxidativo del cerebro, lo que se conoce como fase latente, que corresponde a la “ventana terapéutica”, es decir un período de tiempo durante el cual el inicio de una intervención terapéutica puede aminorar la lesión cerebral, y transcurrido éste ninguna intervención logrará reducir el daño. No se conoce la duración de esta ventana terapéutica tras la reanimación en recién nacidos humanos. Probablemente depende de numerosos factores, entre ellos la gravedad de la agresión (1,2,4). Los estudios en modelos animales y los realizados en humanos indican que su duración no es mayor de 6 a 8 horas (5,6).
Tras la fase latente tiene lugar una fase de deterioro del metabolismo oxidativo, que puede extenderse varios días y que comienza aproximadamente 6 a 15 horas después de la agresión.
Durante esta fase, denominada secundaria o tardía, tienen lugar una serie de procesos fisiopatológicos que incluyen: acumulación de neurotransmisores excitatorios, injuria oxidativa, apoptosis, inflamación y alteraciones de los factores de crecimiento y de la síntesis proteica (6-10).
Hipotermia como neuroprotección
Durante las últimas dos décadas, numerosos estudios experimentales han mostrado que la temperatura cerebral es una variable biológica importante durante y después de la agresión hipóxico-isquémica. Mientras que la hipertermia incrementa el deterioro neurológico temprano, así como la mortalidad y morbilidad neurológica (11-13); una reducción de la temperatura corporal de 3-4ºC después de la agresión, la fase de reperfusión o la fase latente tiene un claro efecto neuroprotector y previene o aminora la lesión cerebral (14,15).
Los mecanismos de neuroprotección de la hipotermia han sido bien documentados, e incluyen un descenso de la utilización de energía cerebral documentada por resonancia espectroscópica, reducción del tamaño del infarto, disminución de la pérdida de neuronas, conservación de la función sensorio motora, preservación de las estructuras del hipocampo y recuperación de la actividad electroencefalográfica (16-21) (tabla 8).
Evidencia sobre eficacia
Una revisión sistemática de 10 ensayos clínicos controlados y randomizados (Edwars, incluye el NICHD, CoolCap y TOBY), en 1.320 recién nacidos en total, reportaron un menor riesgo de muerte en niños con enfriamiento corporal total o de la cabeza en los primeros 18 meses en comparación con los que reciben tratamiento estándar (riesgo relativo (RR) de 0.78, IC 95% 0.66 – 0.93). (4,22-24)
En 3 de estos ensayos hubo seguimiento hasta los 18 meses, con un total de 767 recién nacidos, con riesgo combinado de muerte y discapacidad severa que fue significativamente más bajo en los recién nacidos con enfriamiento comparado con los recién nacidos que recibieron cuidados estándar (riesgo relativo de 0,81, IC 95% 0,71-0,93). Se mostró además que el enfriamiento incrementa la sobrevida con desarrollo neurológico normal comparado con aquellos niños que recibieron cuidados estándar (RR 1,53, IC 95% 1,22–1,93) a los 18 meses de seguimiento.
Cada uno de estos tres ensayos mostró una reducción del riesgo de muerte y discapacidad neurológica en el recién nacido que recibió hipotermia terapéutica pero se encontró significancia estadística solo en el estudio de NICHD (tabla 7). El metaanálisis de estos tres ensayos muestra que la hipotermia terapéutica reduce significativamente el riesgo de muerte o discapacidad a los 18 meses de vida. (RR 0,81, IC 95%, 0,71-0,93 con una p 0,002, con una diferencia del riesgo -0,11, IC 95%, -0,18- -0,04), con un número necesario a tratar de nueve (IC 95%, 5-25).Este nuevo metaanálisis de los datos existentes sobre el tema, incluidos los resultados del estudio TOBY, proporciona el más alto nivel de evidencia de que la hipotermia moderada es eficaz en niños con encefalopatía hipóxico-isquémica.
Uno de los ensayos de 325 recién nacidos tratados con enfriamiento corporal total o cuidado estándar reportaron la supervivencia sin anormalidades neurológicas en 44% (71/163) y 28% (45/162) respectivamente hasta los 18 meses de seguimiento (RR 1,57, IC 95% 1,16–2,12) entre los recién nacidos supervivientes hubo más bajo porcentaje de parálisis cerebral en los tratados con enfriamiento (28% (33/120) versus 41% (48/117) RR 0,67 , IC 95% 0,47-0,96) (22).
Un ensayo de 234 infantes tratados con enfriamiento cefálico o cuidados estándar reportaron muerte o discapacidad neurológica a los 18 meses de tratamiento de 55% (59/108) y 66% (73/110), respectivamente (odds ratio 0,61, IC 95% 0,34–1,09). En la revisión sistemática de tres ensayos con un total de 767 recién nacidos reportaron que el porcentaje de discapacidad severa y parálisis cerebral en los recién nacidos sobrevivientes fue significativamente más baja en los infantes tratados con enfriamiento que en los tratados con cuidados estándares a los 18 meses de tratamiento (RR 0,71, IC 95% 0,56–091 y riesgo relativo de 0,69 IC 65% 0,54-0,89 respectivamente) (23).
Los asesores especialistas enumeraron claves de eficacia y resultados como mejora en la sobrevida sin impedimentos neurológicos, reducción de las discapacidades severas, mejoramiento en el desarrollo sicomotor y reducción de parálisis cerebral. Una cuestión importante planteada por los médicos a cargo del cuidado de los recién nacidos con encefalopatía hipóxico-isquémica es, si es posible definir un grupo de pacientes que están demasiado afectados para beneficiarse del tratamiento con hipotermia, como lo sugiere el CoolCap estudio. Para arrojar luz sobre esta cuestión se llevó a cabo un análisis de subgrupos para examinar la interacción entre la gravedad de la enfermedad y el efecto del tratamiento. En los resultados primarios de muerte o discapacidad a los 18 meses, se observó una reducción en los recién nacidos moderadamente afectados pero no en los afectados severamente (4,22-25).
Otra área de preocupación con respecto a la difusión de la hipotermia es el transporte, dado que esta terapia es más efectiva cuanto más tempranamente se inicia, se debe facilitar su comienzo fuera de los centros de tercer nivel y durante el transporte. Los métodos aplicados en los ensayos clínicos ya descriptos son dos, en el TOBY se incluyó refrigeración pasiva (eliminación de fuentes de calor externas) y en otros ensayos se utilizaron compresas frías de gel y/o paquetes fríos de hielo envueltos en paños estériles.
Evidencia sobre seguridad
Un ensayo de 208 recién nacidos (26) reportó incidencia más alta de hipocalcemia en recién nacidos bajo enfriamiento en relación a aquellos con tratamiento y cuidados estándar (27%, 28/102 y 19%, 20/106 respectivamente, valores de p no fueron reportados).
En un ensayo de 234 recién nacidos (25), un recién nacido bajo enfriamiento (quien muere por otras causas) tenía la piel erosionada y hemorragias locales bajo la capa de enfriamiento. Otro caso reportado describió fascitis necrotizante en un recién nacido tratado con enfriamiento corporal total aplicando los paquetes de hielo sobre la piel. A los 9 meses el recién nacido tenia nódulos firmes sin calcificación. En otro caso reportado un recién nacido enfriado con colchón de agua desarrolló esclerodermia sobre el área de contacto que desapareció en 3 meses.
Los asesores especialistas consideraron teóricos o anecdóticos los eventos adversos, que incluyeron disturbios metabólicos, síndrome de hiperviscosidad sanguínea, incrementos de infecciones y convulsiones durante el recalentamiento si es realizado rápidamente (25).
Conclusiones
Se presentaron cinco recién nacidos con encefalopatía hipóxico-isquémica moderada a severa, con altas probabilidades de secuelas neurológicas, tratados con hipotermia corporal total, con buena evolución neurológica valorada a través de la evolución clínica y electroencefalográfica al alta, con 100% de sobrevida al alta.
Los efectos secundarios más obvios observados durante las 72 horas del período de hipotermia fueron a nivel cardiovascular bradicardia y a nivel hematológico plaquetopenia, prolongación del tiempo de protrombina y KPTT . No tuvieron manifestaciones clínicas evidentes, que llevaran a realizar un tratamiento específico como transfusión de plasma o factores de la coagulación, o llegaron a poner en riesgo la vida del paciente. Por lo tanto, en concordancia con la evidencia sobre seguridad, es un procedimiento seguro (22,24).
Con esta serie de casos y basados en la evidencia actual experimental y clínica podemos inferir que la hipotermia moderada es actualmente el tratamiento de elección para el recién nacido con encefalopatía hipóxico-isquémica. El procedimiento se puede aplicar si se cuenta con los elementos necesarios: equipamiento (que es accesible), entrenamiento del personal en forma intensiva dado que requiere de estrictos controles clínicos y paraclínicos (hemodinámicos, hematológicos, metabólicos). Se debe utilizar un estricto criterio de selección, intentándolo en aquellos recién nacidos que potencialmente se pueden beneficiar con protocolos adecuados, a fin de que la hipotermia moderada sea aplicada en forma precisa y segura para lograr los máximos resultados.
Agradecimiento
Especial agradecimiento a la Sociedad Iberoamericana de Neonatología mediante la cual fue posible la realización de este trabajo.
Referencias bibliográficas
1. Seetha Shankaran. Neonatal Encepalophaty: treatment with hypothermia. Neo Reviews 2010; 11: e85-e 92.
2. García A, Martínez M. Neuroprotección mediante hipotermia moderada en el recién nacido con encefalopatía hipóxico-isquémica. An Pediatr Contin 2005; 3(6): 357-60.
3. The American Congress of Obstetricians and Gynecologists. Neonatal encephalopathy and cerebral palsy: defining the pathogenesis and pathophysiology. Washington: ACOG, 2003.
4. Edwards AD, Brocklehurst P, Gunn AJ, Halliday H, Juszczak E, Levene M, et al. Neurological outcomes at 18 months of age after moderate hypothermia for perinatal hypoxic ischaemic encephalopathy: synthesis and meta-analysis of trial data. BMJ 2010; 340: c363. Obtenido de: http://www.ncbi.nlm.nih.gov/pubmed/20144981 [consulta: 20 set.2010].
5. Volpe JJ. Hypoxic-ichemic encephalopathy: clinical aspect. En: Neurology of the newborn. 3a ed. Philadelphia: WB Saunders, 1995: 314-69.
6. Roth SC, Baudin J, Cady E, Johal K, Townsend JP, Wyatt JS, et al. Relation of deranged neonatal cerebral oxidative metabolism with neurodevelopmental outcome and head circumference at 4 years. Dev Med Child Neurol 1997; 39: 718-25.
7. Fellman V, Raivio KO. Reperfusion injury as the mechanism of brain damage after perinatal asphyxia. Pediatr Res 1997; 41: 599–606.
8. Liu XH, Kwon D, Schielke GP, Yang GY, Silverstein FS, Barks JD. Mice deficient in interleukin-1 converting enzyme are resistant to neonatal hypoxic-ischemic brain damage. J Cereb Blood Flow Metab 1999; 19: 1099-108.
9. Mehmet H, Yue X, Squier MV, Lorek A, Cady C, Penrice J, et al. Increased apoptosis in the cingulate sulcus of newborn piglets following transient hypoxia-ischaemia is related to the degree of high energy phosphate depletion during the insult. Neurosci Lett 1994; 181: 121-5.
10. Tan WK, Williams CE, During MJ, Mallard CE, Gunning ML, Gunn AJ, et al. Accumulation of cytotoxins during the development of seizures and edema after hypoxic-ischemic injury in late gestation fetal sheep. Pediatr Res 1996; 39: 791–7.
11. Gluckman PD, Guan J, Williams C, Scheepens A, Zhang R, Bennet L, et al. Asphyxial brain injury—the role of the IGF system. Mol Cell Endocrinol 1998; 140: 95-9.
12. Kim Y, Busto R, Dietrich WD, Kraydieh S, Ginsberg MD. Delayed postischemic hyperthermia in awake rats worsens the histopathological outcome of transient focal cerebral ischemia. Stroke 1996; 27: 2274-80.
13. Castillo J, Dávalos A, Marrugat J, Noya M. Timing for fever-related brain damage in acute ischemic stroke. Stroke 1998; 29: 2455-60.
14. Shum-Tim D, Nagashima M, Shinoka T, Bucerius J, Nollert G, Lidov HG, et al. Postischemic hyperthermia exacerbates neurologic injury after deep hypothermic circulatory arrest. J Thorac Cardiovasc Surg 1998; 116: 780-92.
15. Wagner CL, Eicher DJ, Katikaneni LD, Barbosa E, Holden KR. The use of hypothermia: a role in the treatment of neonatal asphyxia? Pediatr Neurol 1999; 21: 429-43.
16. Thoresen M, Wyatt JS. Keeping a cool head, posthypoxic hypothermia. An old idea revisited. Acta Paediatr 1997; 86: 1019-33.
17. Gunn AJ, Gunn TR, Gunning MI, Williams CE, Gluckman PD. Neuroprotection with prolonged head cooling started before postischemic seizures in fetal sheep. Pediatrics 1998; 102: 1098-106.
18. Bona E, Hagberg H, Løberg EM, Bågenholm R, Thoresen M. Protective effect of moderate hypothermia after neonatal hypoxia ischemia: short and long term outcome. Pediatr Res 1998; 43: 738-45.
19. Busto R, Dietrich WD, Globus MYT, Valdes I, Scheinberg P, Ginsberg MD. Small differences in intraischemic brain temperature critically determine the extent of ischemic neuronal injury. J CerebBlood Flow Metab 1987; 7: 729-38.
20. Carroll M, Beek O. Protection against hippocampal CA cell loss by post-ischemic hypothermia is dependent of delay of initiation and duration. Metab Brain Dis 1992; 7: 45-50.
21. Colbourne F, Corbett D. Delayed and prolonged postischemic hypothermia is neuroprotective in the gerbil. Brain Res 1994; 656: 265-72.
22. Azzopardi DV, Strohm B, Edwards AD, Dyet L, Halliday HL, Juszczak E, et al. Moderate hypothermia to treat perinatal asphyxial encephalopathy. N Engl J Med 2009; 361: 1349-58.
23. Gunn AJ, Hoehn T, Hansmann G, Buhrer C, Simbruner G, Yager J, et al. Hypothermia: an evolving treatment for neonatal hypoxic ischemic encephalopathy. Pediatrics 2008; 121: 648-9.
24. Shankaran S, Pappas A, Laptook A, Mc Donald SA, Ehrenkranz RA, Tyson JE, et al. Outcomes of safety and effectiveness in a multicenter randomised controlled trial of whole-body hypothermia for neonatal hypoxic-ischemic encephalopathy. Pediatrics 2008; 122: e791–8. Obtenido de: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2819143/ pdf/nihms170776.pdf [consulta: 20 set. 2010].
25. National Institute for Health and Clinical Excellence. Therapeutic hypothermia with intracorporeal temperature monitoring for hypoxic perinatal brain injury. London: NHS, 2010. Obtenido de: http://www.nice.org.uk/IPG347 [consulta: 20 set.2010].
26. Pfister RH, Soll RF. Hypotermia for the treatment of infants with hypoxic-ischemic encephalopathy. J Perinatol 2010: 30: S82-S87.
Correspondencia: Dra. Claudia Martinez.
Correo electrónico: claumar286@gmail.com















