Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Archivos de Pediatría del Uruguay
versão On-line ISSN 1688-1249
Arch. Pediatr. Urug. vol.78 no.4 Montevideo dez. 2007
ARTÍCULO ORIGINAL
Arch Pediatr Urug 2007; 78(4)
Hipertensión pulmonar e hipoxemia grave en recién nacidos
Dres. Fernando Silvera 1,2,3, Alicia Mele 1,2, Mariela Costas 1,2, Mariela Viña 1,2,
Magdalena Hermida 2, Enrique Di Lucci 1,2, Ruth Keshishian 1,2, Eduardo Mayans 1,2, Gonzalo Giambruno 4
2. Neonatólogo.
3. Asistente Área Básica del departamento de Neonatología del Hospital de Clínicas. Facultad de Medicina.
4. Prof. Adjunto de Neonatología. Supervisor neonatal de AESPM.
Asociación Española Primera de Socorros Mutuos (AESPM).
Fecha recibido: 2 de abril de 2007.
Fecha aprobado: 18 de diciembre de 2007.
Resumen
El óxido nítrico inhalado (ONi), mediante vasodilatación pulmonar directa y carencia de efectos sistémicos, constituye el tratamiento ideal para la hipertensión pulmonar del recién nacido (HTPP). Para evaluar la respuesta a dicho tratamiento se presenta la evolución de 16 pacientes internados en una unidad de cuidados intensivos neonatales valorada por cambios en la saturación de O2 (SO2), presión media en la vía aérea (PMVA) y fracción inspirada de O2 (Fio2).
Se analizaron dos grupos: 1) bajo tratamiento con ONi en las primeras 72 horas de vida (n=13) –su diagnóstico más frecuente fue aspiración de líquido meconial (SALAM)-; y 2) recién nacidos con insuficiencia respiratoria grave (n=3), refractaria al tratamiento, en los que se inició ONi luego de 14 días de vida.
En el grupo 1 se constató un aumento significativo de la SO2 a partir de las primeras 6 horas del tratamiento con ONi. El descenso de Fio2 y de PMVA fue más tardío, con una mortalidad de 23% (2/13).
En el grupo 2 se elevó la SO2, permitiendo disminuir el soporte ventilatorio en las primeras 72 horas de la terapia en un caso.
Las dosis de ONi utilizadas fueron menores a las 20 ppm en 8/13 pacientes, no se observaron alteraciones plaquetarias, sangrados, metahemoglobinemia ni se observó efecto rebote al suspender el ONi desde dosis mínimas (2 ppm).
En esta unidad, la inclusión de ONi en el tratamiento de la HTPP o insuficiencia respiratoria se asoció con mejoría de la SO2 y a descenso del soporte ventilatorio, sin efectos adversos, con beneficios sobre la terapia global instituida.
Palabras clave:
HIPERTENSIÓN PULMONAR
ÓXIDO NÍTRICO
ANOXEMIA
RECIÉN NACIDO
Summary
Inhaled nitric oxide (iNO) through direct pulmonary vasodilator action and without sistemyc effects, is the gold standard treatment for pulmonary hypertension of the newborn (HTPP). This work was designed with the aim of evaluating the response to this treatment in 16 newborn patients in an intensive care unit, by changes in oxygen saturation (SO2), medium airway pressure (MAP) and inspirited fraction of O2 (FiO2).
Two groups were anaylized: 1) under iNO treatment during the first 72 hs of life, where the most frequent diagnosis was meconium aspiration syndrom,e and 2) newborns with severe respiratory failure (n=3), refractary to treatment, in which iNO was begun after 14 days of life.
Among patients of group 1 it was evident an increase in SO2 after the first 6 hs of treatment with iNO. The decrease FiO2 and MAP occurred later. The mortality rate was 23% (2/13) in this group.
In group 2 the SO2 increased, leading to a decrease in ventilatory support in the first 72 hours of treatment in one case.
iNO doses were lesser than 20 ppm in 8/13 patients, there were neither platelet impairment, nor bleeding or metahemoglobinemia. There was no rebound effect after finishing iNO therapy from minimum doses (2 ppm).
In this unit the inclusion of iNO treatment in HTPP or respiratory failure was associated with improvement in SO2 and a decrease in ventilatory support, without adverse effects resulting in a benefit over the globally support therapy.
Key words:
HYPERTENSION, PULMONARY
NITRIC OXIDE
ANOXEMIA
INFANT, NEWBORN
Introducción
La HTPP y la hipoxemia refractaria alcanzan una incidencia en recién nacidos de término o casi término (mayores de 35 semanas) que varía de acuerdo a las series entre 0,43 y 6,8 cada 1.000 nacidos vivos (1). Continúa siendo una de las situaciones clínicas de mayor gravedad en la etapa neonatal; a pesar de los avances en la terapia, con nuevas estrategias, nuevos modos de ventilación y la adecuación de la monitorización, mantiene una mortalidad entre el 10 al 20%, con una altísima morbilidad (2).
Los pilares terapéuticos antes de la introducción del ONi eran: a) la hiperventilación buscando la alcalosis respiratoria como estrategia de dilatación de las arterias pulmonares, lo cual ha demostrado el descenso en los requerimientos de oxigenación por membrana extracorpórea (ECMO) sin aumento de la morbilidad pulmonar (1); b) apoyados ocasionalmente en el aporte de suero bicarbonatado (alcalinoterapia) para lograr pH alcalinos (> 7,5), aunque el efecto benéfico de esta estrategia no ha sido demostrado y se ha visto un aumento del riesgo de necesidad de ECMO, así como la prolongación de la oxígeno-dependencia (1); c) apoyo inotrópico asociando sedación, analgesia y relajantes musculares para lograr una adecuada ventilación (1).
Desde los trabajos de Wung y colaboradores se ha puesto énfasis en el manejo conservador de la ventilación, con buenos resultados y menor riesgo de injuria pulmonar (3), adoptándose una postura diferente frente a la HTPP.
A partir de trabajos que demostraron la eficacia del ONi (4-8) en recién nacidos de término o casi término para lograr vasodilatación pulmonar selectiva, con mejoría de la oxigenación y sin afectación de la presión arterial sistémica, se han abierto nuevas opciones en el tratamiento de la HTPP del recién nacido. En la actualidad la discusión está dirigida a la posibilidad de ampliar las indicaciones para la realización de ONi en pretérminos como tratamiento electivo en patologías como enfermedad de membrana hialina (EMH) y broncodisplasia pulmonar (BDP) (9).
El acceso a esta terapia tiene como limitante fundamental su costo, por lo que no está disponible en la mayoría de los centros de asistencia neonatal y determina el traslado de pacientes en situación de gravedad e inestabilidad extremas.
La HTPP es un fenómeno hemodinámico cuyos ejes centrales son elevación de la PAP y su relación con la PAS, un modelo experimental animal en el que se registraron directamente estas variables, valorando además el efecto del ONi (10,11) permitió ilustrar la fisiopatología de esta entidad nosológica.
Objetivos
1) Evaluar el tratamiento global de la HTPP.
2) Evaluar la respuesta, tolerancia y aparición de posibles efectos secundarios a la terapia con ONi en pacientes con HTPP.
Material y métodos
Estudio descriptivo y retrospectivo que analiza a 16 pacientes de la Asociación Española Primera de Socorros Mutuos que en el período entre enero de 2003 y diciembre de 2005 recibieron ONi.
Se analizan dos grupos:
1) Recién nacidos en los que se inició el ONi en las primeras 72 horas de vida y cumplieron con, al menos, uno de los siguientes criterios de inclusión:
a) Diagnóstico clínico de HTPP: cianosis generalizada corroborada por saturación menor a 85% que no mejora con aporte de O2 al 100%. Gradiente pre y posductal de saturación mayor al 5%. Sin evidencia ecocardiográfica de cardiopatía congénita estructural.
b) Diagnóstico ecocardiográfico de hipertensión pulmonar dado por signos directos de medición de la PAP y/o signos indirectos de HTPP tales como insuficiencia tricúspidea, flujo de sangre a través del ductus arterioso permeable (DAP) o foramen oval de derecha a izquierda, rectificación del septum interventricular, hipertrofia del ventrículo derecho (VD), que configuren al criterio del ecocardiografista una HTPP significativa.
2) Recién nacidos con insuficiencia respiratoria en situación de gravedad extrema con altos requerimientos ventilatorios, a los que se agregó ONi después de 14 días de vida como terapia compasiva. No se requiere de confirmación ecográfica de HTPP.
Todos los pacientes se encontraban en asistencia ventilatoria mecánica (AVM) y el sistema de administración utilizado fue el Innovent ® (aprobado por MSP). Se suministró ON a través de dispositivo colocado inmediatamente a la salida del respirador, en forma continua, realizando una toma de muestra de la mezcla de gas próximo a la entrada de la sonda endotraqueal con control permanente de la dosis de ONi y de dióxido de nitrógeno generado.
La dosis de inicio, mantenimiento y supresión fue determinada por el equipo médico tratante de acuerdo a la situación clínica de cada paciente. Ningún paciente recibió sildenafil como fármaco coadyuvante del tratamiento vasodilatador pulmonar o como preventivo del rebote al suprimir el ONi.
Se realizaron controles gasométricos seriados para ajustar y optimizar el tratamiento, así como radiografías de tórax para ajustar el soporte de AVM. Se realizó recuento plaquetario antes y luego de iniciado el ONi de manera seriada así como ecografía transfontanelar para valorar la presencia de hemorragia intraventricular.
La AVM se llevó a cabo con ventiladores ciclados por tiempo y limitados por presión con parámetros fijados por el médico tratante, no se utilizó ventilación de alta frecuencia. La modificación de los parámetros ventilatorios y de la dosificación de óxido nítrico se realizaron de manera independiente.
El tratamiento de sostén con inotrópicos se realizó de acuerdo a la situación hemodinámica particular de cada paciente con dopamina, dobutamina y adrenalina, en ningún caso se utilizó milrinona.
Los cuidados del paciente que recibe ONi se basaron en la monitorización de su medio interno (pH, pCO2, pO2 y BE), monitorización electrocardiográfica, de la saturación de O2 y presión arterial invasiva continua así como control periódico de la temperatura y humidificación del sistema ventilatorio. Se complementó con control del ambiente térmico y mínima manipulación posible, evitando maniobras dolorosas que puedan exacerbar la hiperreactividad vascular pulmonar, con aspiración de la vía aérea con sistema de cerrado para evitar caídas de la concentración de gas así como pérdidas del soporte de presión.
Se presenta, además, un modelo experimental animal desarrollado en el Área Básica del departamento de Neonatología del Hospital de Clínicas en el que se produjo HTPP mediante acidosis metabólica mostrándose la respuesta al tratamiento con ONi.
En cerdo recién nacido, anestesiado y traqueostomizado, en asistencia ventilatoria mecánica, se cateterizó arteria femoral, pulmonar y vena yugular.
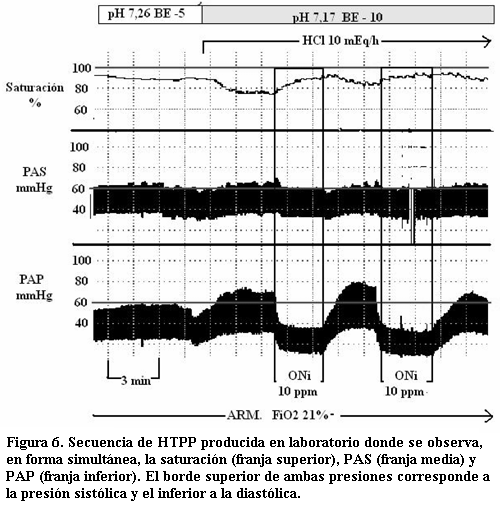
Se administró HCl 1 M a razón de 10 mEq/hora comprobándose mediante gasometría un pH 7,17 con EB -10. Se monitorizó en forma continua PAP, PAS, FC y saturación. Se observó aumento de PAP por sobre los valores básales, en esta situación se administró ONi a 10 ppm evaluándose la respuesta a esta terapia (figura 6).
Resultados
Pacientes que reciben oxido nítrico en las primeras 72 horas (N=13) (tabla 1)
En esta serie, 8/13 (61%) son pacientes con edad gestacional mayor a las 37 semanas y 5/13 (38%) menor a las 35 semanas. El SALAM fue el diagnóstico inicial más frecuente (46%) tomando en cuenta la totalidad de los pacientes y en 6/8 (75%) recién nacidos de término, seguido por la infección connatal y el déficit de surfactante (2/13) respectivamente. La indicación fue el diagnóstico de HTPP en 11/13 (84%) y en dos pacientes pretérminos se utilizó el ONi como rescate. La confirmación de HTPP previo al inicio del tratamiento se realizó en la mitad de los casos. Se utilizó surfactante de rescate previo al inicio de ONi en 4/13 (30%) pacientes.
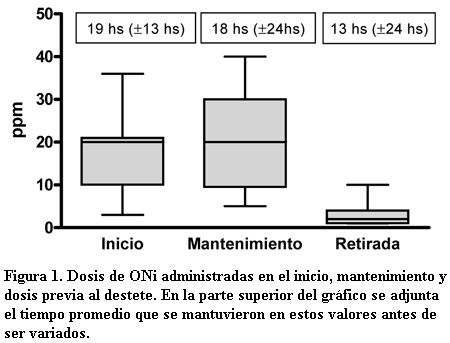
La mediana de los valores iniciales y mantenimiento (cuando se logró la estabilidad del paciente) alcanzan valores de 19 ppm (± 11 ppm) y 18 ppm (± 9 ppm) respectivamente (con dosis máxima de 40 ppm), 8/13 pacientes se mantienen durante todo el tratamiento con dosis de ONi menores a 20 ppm. La totalidad de los pacientes se destetaron desde dosis muy bajas de ONi (promedio 2 ppm ± 2 ppm) con el objetivo de evitar el efecto “rebote” de los requerimientos, en ningún caso fue necesario reinstalar el ONi una vez retirado (figura 1).
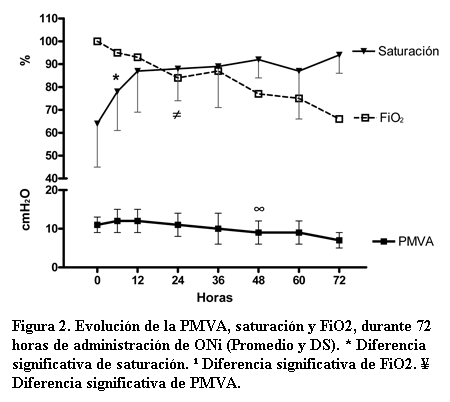
Se evaluó la respuesta a la terapia con ONi de acuerdo al cambio de la saturación luego del inicio de la misma. A las 6 horas de iniciado el ONi se constató un aumento significativo (pre ONi 64 ± 19 versus post ONi 78 ± 17, p< 0,05) (figura 2). Excepto en 4/13 casos (30%), en todos se observó aumento de la saturación a las 6 horas de inicio del ONi, sólo 1/13 no continúa aumentando a las 12 horas.
10/13 (76%) tenían una saturación menor a 80% antes de iniciar la terapia con ONi en este grupo, que descendió a 5/13 (39%) a las 6 horas de inicio y a 3/13 (23%) a las 12 horas.
La PMVA no descendió hasta las 48 horas de iniciado el ONi (PMVA pre ONi 11 cm H2O ± 2 versus PMVA 48 hs post ONi 9 cm H2O ± 3, p=0,03) y la FiO2 recién presentó un descenso significativo a las 24 horas de iniciada esta terapia (FiO2 pre ONi 1± 0 vs. FiO2 24 horas post ONi 0,84 ± 21, p=0,01).
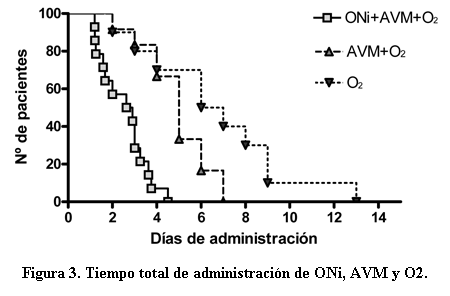
El promedio del total de días de administración de ONi alcanzó 2,5 días (± 1 día), recibiendo 4,9 días de AVM (± 1,5 día) y 6,7 días de O2 (± 3,4) (figura 3).
En este grupo de pacientes analizados, todos recibieron dobutamina y 12/13 dopamina como inotrópicos. En 2/13 pacientes se administró adrenalina como tratamiento vasopresor y 3/13 requirieron administración de carga de volumen (suero fisiológico a 10 a 20 ml/kg/dosis) para el tratamiento de la hipotensión concomitante.
La adaptación a la asistencia ventilatoria mecánica requirió de la administración de fármacos para la sedación y analgesia, morfina en 5/13 y fentanil en 6/13 pacientes. Además 7/13 pacientes recibieron curarización (en esta unidad Atracurio ® a dosis habituales para la relajación muscular (figura 4). Un dato destacable es que 4/13 pacientes no requirieron de sedación o analgesia para su tratamiento.
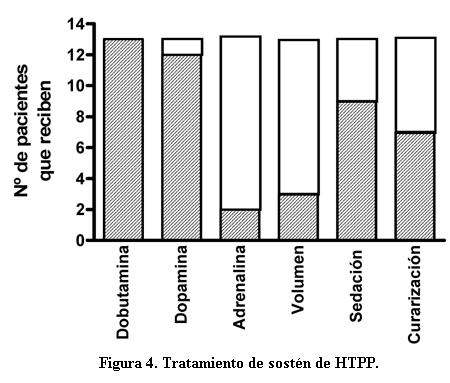
Los controles realizados muestran una tendencia no significativa al aumento de la frecuencia cardíaca y al descenso de la PAM hacia las 4 a 6 horas de iniciado el tratamiento con ONi (cuando comparamos los promedios del tiempo 0 con los promedios en esos períodos de tiempo).
En la evaluación de las posibles complicaciones de la administración de ONi se destaca el monitoreo permanente de la producción de NO2 como gas asociado, no se constataron valores por encima de 2 ppm en ningún caso, aun en aquellos en los que se administraron dosis elevadas (mayores de 20 ppm). Tampoco valores de metahemoglobina mayores a 5% de Hb en ningún paciente.
Los estudios de la coagulación realizados fueron normales, el recuento plaquetario, antes y después del inicio de ONi, mostró un descenso no significativo (plaquetas pre ONi 165.000 elementos/mm3, DS 56.000 elementos/mm3 versus plaquetas luego del inicio de ONi 125.000 elementos/mm3 DS 42.000 elementos/mm3, p= 0,16) y no se constataron sangrados durante o luego la administración de ONi.
Se realizaron ecografías transfontanelares seriadas a todos los pacientes siendo normales, excepto en un paciente pretérmino de 31 semanas (PN 1.570 g) en quien se constató hemorragia intraventricular grado 1 luego del inicio de ONi, que no progresó; y en otro paciente pretérmino de 26 semanas (PN 740 g) en quien se constató leucomalacia periventricular. Dentro de las complicaciones que presentaron los pacientes destacamos que 2/13 pacientes presentaron convulsiones tónico-clónicas durante su internación. Fallecieron 3/13 pacientes (23%).
Pacientes que reciben óxido nítrico luego de las 72 horas de vida (tabla 2)
Se trata de tres pacientes, prematuros de muy bajo peso al nacer, que desarrollaron una broncodisplasia pulmonar grave de difícil manejo. La indicación de administración de ONi se basó en su gravedad extrema, la hipoxemia mantenida y refractaria a las estrategias ventilatorias utilizadas. Por tanto, todos reciben ONi en modalidad de rescate como tratamiento compasivo. Todos los pacientes se encontraban internados en la unidad desde el nacimiento.Las dosis de inicio y mantenimiento son menores a 20 ppm, realizándose la retirada desde dosis promedio de 4 ppm (± 1 ppm), sin efecto rebote secundario.
La evolución de la saturación, como evaluadora de la respuesta a la terapia, muestra un aumento sustantivo en los casos analizados evidenciándose en dos pacientes una saturación por encima de 80% a las 6 horas del inicio del tratamiento (figura 5).
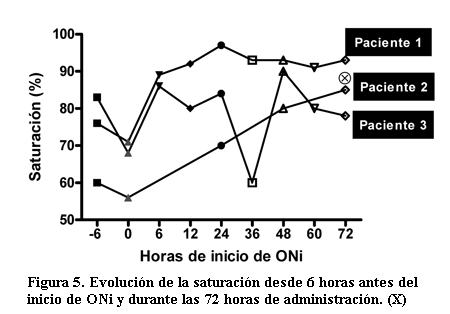
El apoyo respiratorio (PMVA y FiO2) en uno de los tres pacientes se constató un descenso de la FiO2 hacia las 24 horas de iniciada la terapia, coincidiendo con el descenso de la PMVA. En los otros dos pacientes no hubo variaciones asociadas, falleciendo uno de ellos producto de la evolución de su enfermedad de base.
Los valores de NO2 se mantuvieron por debajo de 1 ppm, sin trastornos de la crasis sanguínea y con valores de metahemoglobinemia menor a 5% de Hb. No se observaron trastornos plaquetarios ni sangrado intraventricular.
Modelo animal
La situación de acidosis metabólica determina un aumento de la PAP (PAP sistólica antes de inicio de acidosis 53 mmHg versus PAP sistólica a los 3 minutos de inicio de ácido 73 mmHg) que se vuelve suprasistémica (PAS sistólica 61 mmHg) con una disminución en “espejo” de la saturación. Esta situación se revierte cuando se administra ONi (a 10 ppm), con un descenso de la PAP a valores por debajo de los basales (PAP sistólica 57 mmHg) y aumento de la saturación, sin determinar cambios en la PAS. La supresión de ONi se acompaña de un nuevo aumento de la PAP (figura 6).
Discusión
Por tratarse de un trabajo descriptivo se agrupan pacientes con características de peso y edad gestacional disímiles.
El SALAM es la principal causa de ingreso de pacientes a la terapia de ONi en esta serie, lo cual está de acuerdo con la literatura (2).
El uso de ONi en recién nacidos con edad gestacional mayor a las 35 semanas ha sido aprobado por la Academia Americana de Pediatría, pero en niños con menor edad gestacional aún es motivo de revisión, teniendo en cuenta los potenciales riesgos de sangrado intraventricular secundario a alteraciones de la coagulación y la posibilidad de lesión pulmonar por estrés oxidativo además de la formación de peroxinitritos en una población susceptible. En esta serie se agregó ONi a pacientes menores de 35 semanas (4/13) con diagnóstico de HTPP o en situación de rescate (ante gravedad extrema) como último recurso terapéutico. La indicación está basada en estudios que muestran que la alteración en la coagulación puede revertir con la suspensión de ONi, además de que a dosis bajas (< 5ppm) no se observaron signos de estrés oxidativo y que su utilización puede realizarse con seguridad (12).
Hipertensión pulmonar e indicación
de óxido nítrico
La sospecha clínica de HTPP en un paciente grave conduce al inicio del tratamiento de sostén, pero la instalación de los signos clínicos no siempre son espectaculares, muchas veces se pone de manifiesto únicamente por un progresivo aumento de los requerimientos de oxígeno y del trabajo respiratorio. Horas después el paciente ha pasado por todas las formas de aplicar O2 desde las menos invasivas hasta llegar a la aplicación de presión positiva no invasiva (CPAP) o presión positiva intermitente (AVM), extremadamente lábil y con fallo hemodinámico evidente. Es por esta razón que en el 50% de los casos de esta serie no se esperó la confirmación ecocardiográfica para iniciar ONi estando la indicación basada en los signos clínicos clásicos de HTPP o en circunstancias de gravedad extrema como terapia compasiva.
De acuerdo con estos datos parece prudente, en un paciente con diagnóstico de SALAM que aumenta sus requerimientos de O2, descartar la HTPP incipiente e iniciar las estrategias de vasodilatación pulmonar tempranamente. Entendiendo como inicio temprano con índice de oxigenación (IO) de 15 como mínimo (13,14).
Previo a la administración de ONi, y como tratamiento coadyuvante al soporte ventilatorio, se ha realizado surfactante intratraqueal de rescate en el 30% de los casos, basados en estudios multicéntricos (15) que demuestran que la administración de surfactante temprano en recién nacidos mayores de 36 semanas con SALAM, neumonía o HTPP y con falla respiratoria severa disminuye la necesidad de ECMO. En el caso de SALAM y neumonía la base fisiopatológica es la inactivación y cambios en la estructura que sufre el surfactante endógeno. En caso de hernia diafragmática se plantea el déficit en la producción de surfactante endógeno (16).
Administración de óxido nítrico
Las dosis de ONi utilizadas en esta serie en el 61% de los casos se mantienen por debajo de las 20 ppm durante todo el tratamiento y la exposición a dosis de 40 ppm fueron durante breve período de tiempo. El equipo tratante tiene claro que el objetivo del tratamiento es lograr vasodilatación pulmonar con la menor dosis posible, teniendo en cuenta que la mejor respuesta se puede alcanzar aun con dosis muy bajas de ONi (6,17).
Con dosis elevadas (80 ppm) no se han comprobado mejores
y aumenta la posibilidad de presentar efectos secundarios, sobre todo los vinculados a metahemoglobinemia y trastornos de la coagulación, así como la posibilidad de incremento de peroxinitritos. El rango de 10 a 20 ppm parece ofrecer seguridad en este sentido . La HTPP es un fenómeno multifactorial en la que la vasodilatación pulmonar es uno de los hechos fundamentales pero no el único en juego, por tanto si el paciente no presenta una mejoría en la oxigenación con dosis de 20 ppm, es poco probable que mejore con dosis mayores y requiere de ajustes en la terapéutica de los otros factores involucrados, sobre todo hemodinámicos y/o metabólicos, que perpetúan la gravedad.
Se ha reportado que la retirada de ONi en forma brusca, desde dosis de aplicación clínica (aproximadamente 20 ppm) puede resultar en un “rebote” de vasoespasmo pulmonar severo (con un incremento de la PAP en un 20%). Lo cual estaría vinculado a disminución de la actividad de la ON sintasa con menor producción de ON endógeno por las células endoteliales en presencia de ONi. Para prevenir o evitar este fenómeno en la literatura se cita el uso de sildenafil antes de suprimir definitivamente el ONi (19).
En esta serie, la estrategia seguida para evitar el efecto rebote (20) ha sido realizar la retirada desde dosis muy bajas mantenidas. La recomendación es que en los pacientes en que el tratamiento ha sido efectivo, retirar el ONi con seguridad una vez que se ha logrado un descenso en el IO por debajo de 10 y luego de permanecer al menos 30 minutos con dosis mínimas de 1 ppm sin necesidad de aumentar la FiO2 (21), o desde 5 ppm pero con un aumento de la FiO2 a 0,40 evitando la hipoxemia que pueda aparecer (22).
Respuesta al óxido nítrico
En este trabajo se ha utilizado la saturometría de pulso como criterio para evaluar la respuesta al tratamiento, pese a las limitaciones que este dato pueda tener por estar influenciado por múltiples factores, es indudable que en la práctica clínica es un signo trascendente.
Los resultados muestran una mejoría significativa de la saturación a partir de las 6 horas de administración de ONi (figura 2 A), a su vez un dato muy interesante es el descenso del porcentaje de pacientes con saturación menor a 80% en las horas siguientes al inicio de la terapia (sólo el 23% de los pacientes presentaron saturaciones menores de 80% a las 12 horas de iniciado, comparado con el 76% de pacientes antes del tratamiento).
De todas maneras hasta un 30% de los pacientes pueden no responder al tratamiento con ONi, este es el criterio básico para la búsqueda de terapias vasodilatadoras pulmonares alternativas o coadyuvante. El uso de sildenafil, un inhibidor de la fosfodiesterasa 5 cuyo efecto es aumentar la cantidad de GMPc disponible (1,23,24); o prostaciclinas que logran vasodilatación por la vía del estímulo de la adenilatociclasa con aumento del AMPc (25,26) deben ser tenidos en cuenta por el equipo médico tratante.
En el modelo experimental (figura 6) se observa que en situación de HTPP suprasistémica la administración de ONi determina un rápido descenso de la PAP, en pocos segundos se alcanzan valores basales lo cual es un echo trascendente, así como también que dicha respuesta es en acidosis metabólica. No menos importante es constatar que el efecto del ONi en este modelo se obtiene con concentraciones muy bajas (de 10 ppm) y que el mismo se limita exclusivamente al tiempo en que se administra, con un efecto “rebote” de la PAP a valores nuevamente suprasistémicos al suprimirlo.
La utilización racional de esta terapia requiere de protocolos que establezcan los criterios de destete del ONi para aquellos pacientes no respondedores, es muy difícil que el médico tratante suspenda tratamientos posiblemente benéficos ante un paciente con gravedad extrema, como se observa en esta serie donde no se consideraron criterios de mala o ninguna respuesta y la retirada se determinó por mejoría o fallecimiento del paciente.
Lograr una adecuada ventilación es un criterio básico en el tratamiento de la HTPP, además el ONi requiere de alvéolos ventilados para que la droga pueda acceder al torrente vascular pulmonar y sobre ésta ejercer su efecto dilatador. La PMVA, dado su vínculo con la oxigenación, es un indicador de los requerimientos de asistencia respiratoria mecánica. La terapia con ONi no se acompaña de rápidos descensos de la PMVA seguramente por influencia de la patología de base. El descenso de la FiO2 logrado es un dato importante si tenemos en cuenta conocimientos actuales sobre lesión oxidativa sobre los diferentes órganos (27) y que, a pesar de que se trata de recién nacidos de término, debemos cuidar el aporte de O2, no está probado que la hiperoxia mejore con mayor celeridad la HTPP y nuestro objetivo sigue siendo mantenerlo en normoxemia.
En esta serie de pacientes llama la atención favorablemente el breve tiempo de requerimientos de ONi, de AVM y de requerimiento de O2 teniendo en cuenta la situación crítica inicial.
Hipertensión pulmonar y hemodinamia
La HTPP en el recién nacido es un fenómeno hemodinámico, es tan importante el valor absoluto de la PAP como la relación entre la PAP (sistólica) y la PAS (sistólica). Por tanto el tratamiento debe incluir medidas para descender la PAP pero además para mantener o elevar la PAS buscando revertir o limitar el shunt de derecha izquierda. En el modelo experimental animal (figura 6) se observan estas variables hemodinámicas en juego. Es muy importante que dentro de las medidas adoptadas se asegure la PAS, esto teniendo en cuenta que hay drogas utilizadas sobre todo para sedación y analgesia que tiene dentro de sus efectos secundarios producir hipotensión sistémica.
Este concepto queda de manifiesto en el soporte de drogas inotrópicas requeridas. Se destaca la utilización de dobutamina en el 100% de los casos, lo cual se explica por la acción directa de esta droga sobre el miocardio y con efectos vasodilatadores sistémicos y pulmonares (28). Dopamina a dosis entre 4 a 12 mcg/kg/minuto cuyo efecto sobre los receptores betaadrenérgicos miocárdicos aumentan la contractilidad y el gasto cardíaco es utilizada en el 92% de esta serie, dosis mayores pueden requerirse para mantener la PAS sabiendo que inducen activación de receptores alfaadrenérgicos y serotoninérgicos con aumento de las resistencias vasculares sistémicas; el incremento de las resistencias vasculares pulmonares puede observarse con dosis mayores a las 15 a 20 mcg/kg/min, aun así no hay evidencia clínica consistente que aumente el shunt de derecha a izquierda (29). El uso de adrenalina es infrecuente en neonatología debido a la vasoconstricción periférica que produce, especialmente a nivel de la vasculatura renal. Pero en aquellos pacientes que no mejoran con dobutamina o dopamina pueden responder a la infusión continua de adrenalina, sobre todo cuando las condiciones del paciente se asocian a vasodilatación periférica (30). Se aconseja titular la menor dosis efectiva para evitar dicho efectos secundarios logrando una adecuada perfusión tisular.
El otro pilar sobre la que se basa la hemodinamia es el volumen intravascular, es imperioso lograr un buen relleno vascular por lo que el aporte de volumen en forma controlada debe considerarse siempre en el tratamiento de la HTPP, en esta serie se utilizó en el 23% de los casos. El clínico es conciente de esta situación pero se le presenta la disyuntiva de si la bomba cardíaca en situación precaria tolerará una sobrecarga de volumen o si su decisión terminará en un aumento del edema pulmonar que presenta el paciente. En recién nacidos la monitorización no incluye, por lo general, la presión venosa central, por lo que el manejo del volumen es por datos indirectos y aproximados, observando la respuesta al aporte extra realizado.
Hipertensión pulmonar, sedación, analgesia
y curarización
Las utilización de sedoanalgesia se basa en la necesidad de minimizar estímulos que incrementan la PAP y adaptarlo al soporte de asistencia ventilatoria mecánica permitiendo la utilización de parámetros más bajos y disminuyendo el riesgo de baro y volo trauma. Como contrapartida las drogas utilizadas tienen efectos secundarios que deben ser tenidos en cuenta: morfina que puede producir hipotensión, liberación de histamina y depresión respiratoria; fentanilo que produce cambios mínimos en la hemodinamia pulmonar y cardíaca, podría mejorar el resultado en hernias diafragmáticas pero su administración en bolo puede producir rigidez de la pared torácica; midazolam produce sedación rápida pero no analgesia, se han reportado alteraciones neurológicas a largo plazo asociadas a su uso (31). Es necesario contar con una monitorización estricta y evitar la administración en bolo o “push” rápido.
Algo similar ocurre con la utilización de relajantes musculares, no se recomienda su utilización sin tener claro los riesgos y beneficios, dentro de las ventajas se incluyen mejoría de la oxigenación, mayor distensibilidad pulmonar y menor consumo de O2. Los efectos secundarios dependen de la droga utilizada, en el caso de Atracurio puede producir cambios severos en los parámetros hemodinámicos (disminución de la FC y de la PAS) vinculados a la liberación de histamina cuando se administra en forma rápida (32).
Un dato que interesa destacar es que en el 50% de los casos no se utilizaron relajantes musculares, lo cual podría considerarse un signo positivo al evitar drogas potencialmente nocivas.
Efectos adversos del tratamiento
con óxido nítrico
Al utilizar ONi como terapia vasodilatadora pulmonar, clásicamente se citan los trastornos en la agregabilidad plaquetaria, en el recuento plaquetario así como la aparición de metahemoglobinemia o la toxicidad directa sobre las células epiteliales pulmonares del NO2 como los factores adversos a controlar (20). En esta serie de pacientes no se constataron efectos adversos.
Es necesario citar la posibilidad de la injuria celular pulmonar producida por la asociación de O2 en altas concentraciones y ON a través de la producción de peroxinitritos que llevan a la lesión oxidativa de las células pulmonares y a la inactivación de proteínas y enzimas lo cual en definitiva puede llevar a la falla del tratamiento vasodilatador y a secuelas pulmonares a largo plazo (33).
Los efectos adversos a largo plazo de la terapia con ONi aún no están del todo aclarados, sobre todo cuando el tratamiento se prolonga, y tampoco hay establecido un seguimiento adecuado de estos pacientes.
La mortalidad fue de 23% de los pacientes incluidos, uno de los pacientes que fallece es portador de una hernia diafragmática , patología que cursa con hipoplasia pulmonar, y que dentro de las causas de HTPP clásicamente responden menos a la terapia con ONi (8); aun en los pacientes con desenlace fatal es posible observar un aumento inicial de las saturación.
Óxido nítrico en la enfermedad pulmonar crónica
Un capítulo aparte lo constituye la administración de ONi a recién nacidos evolucionados con gravedad extrema como parte de tratamiento compasivo. Los recién nacidos con pulmones inmaduros que requieren AVM prolongada sufren lesiones mecánicas (por presión o volumen), inflamatorias y oxidativas que determinan una alta morbimortalidad. La presencia de hipertensión pulmonar en este grupo de pacientes está determinada por la vasoconstricción arterial pulmonar hipóxica aguda y, a largo plazo, por alteraciones en el crecimiento y desarrollo del pulmón. Se ha mostrado que la administración de ONi en bajas dosis puede mejorar la oxigenación y determinar un descenso de los parámetros ventilatorios sin evidencia de efectos adversos (34,35). Desde el punto de vista fisiopatológico lo que se busca es la optimización de la relación ventilación perfusión, con disminución del shunt intrapulmonar.
En este pequeño grupo de pacientes la administración de ONi se asoció con una mejoría de la saturación en dos pacientes lográndose, incluso, el descenso de los parámetros ventilatorios en uno de ellos, y continuar el tratamiento contribuyendo a evitar la muerte.
Conclusiones
El tratamiento de pacientes con diagnóstico de HTPP y/o de hipoxemia refractaria con ONi permite un aumento significativo y mantenido de la saturación a las primeras 6 horas de su administración, utilizándose en la mayoría de los pacientes dosis menores a las 20 ppm, sin efectos adversos y con hemodinamia conservada. La retirada de ONi se realizó sin efectos adversos.
Concomitantemente en las horas siguientes es posible lograr un descenso del soporte respiratorio hasta lograr su retirada y del aporte de O2. A pesar de esto la mortalidad alcanza un 23% de los pacientes y no hay establecido un seguimiento a largo plazo para evaluar posibles secuelas. En este contexto de paciente con gravedad extrema, como queda de manifiesto por el soporte hemodinámico y respiratorio requerido, llama la atención la brevedad del tiempo total de uso de ONi, AVM y así como de O2.
El agregar ONi al tratamiento de pacientes con insuficiencia ventilorrespiratoria y gravedad extrema como terapia compasiva se asoció con mejoría de la saturación, sin efectos adversos, contribuyendo al mantenimiento de la terapia global instituida lográndose la sobrevida en 2/3 pacientes.
El modelo experimental expuesto pone de manifiesto la rapidez de acción del ONi aun en situación de acidosis metabólica.
Se considera necesario la protocolización de la administración de ONi y su retirada para realizar un uso racional del mismo, tomando en cuenta el aumento del costo que esta terapia implica en el gasto global del manejo del paciente crítico en una unidad de cuidado intensivo así como también establecer un seguimiento a largo plazo al tratarse de un grupo de riesgo con potenciales secuelas pulmonares y neurológicas.
Agradecimientos
Al Prof. Dr. Miguel Martell por su participación en la concreción y corrección de este trabajo.
A la Dra. Fernanda Blasina y la Bioq. Lucía Vaamonde por su colaboración en la corrección.
Al Área Básica del departamento de Neonatología del Hospital de Clínicas por su aporte en el modelo animal.
Al equipo de enfermería de la unidad neonatal de AESPM.
Referencias bibliográficas
1. Baquero H, Soliz A, Neira F, Venegas ME, Sola A. Oral sildenafil in infants with persistent pulmonary hypertension of the newborn: a pilot randomized blinded study. Pediatrics 2006; 117(4): 1077-83.
2. Walsh-Sukys MC, Tyson JE, Wright LL, Bauer CR, Korones SB, Stevenson DK, et al. Persistent pulmonary hypertension of the newborn in the era before nitric oxide: practice variation and outcomes. Pediatrics 2000; 105(1 Pt 1): 14-20.
3. Wung JT, James LS, Kilchevsky E, James E. Management of infants with severe respiratory failure and persistence of the fetal circulation, without hyperventilation. Pediatrics 1985; 76(4): 488-94.
4. Inhaled nitric oxide in full-term and nearly full-term infants with hypoxic respiratory failure. The Neonatal Inhaled Nitric Oxide Study Group. N Engl J Med 1997; 336(9): 597-604.
5. Roberts JD Jr, Fineman JR, Morin FC, Shaul PW, Rimar S, Schreiber MD, et al. Inhaled nitric oxide and persistent pulmonary hypertension of the newborn. The Inhaled Nitric Oxide Study Group. N Engl J Med 1997;336(9):605-10.
6. Clark RH, Kueser TJ, Walker MW, Southgate WM, Huckaby JL, Perez JA, et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. Clinical Inhaled Nitric Oxide Research Group. N Engl J Med 2000; 342(7): 469-74.
7. Kinsella JP, Truog WE, Walsh WF, Goldberg RN, Bancalari E, Mayock DE, et al. Randomized, multicenter trial of inhaled nitric oxide and high-frequency oscillatory ventilation in severe, persistent pulmonary hypertension of the newborn. J Pediatr 1997; 131(1 Pt 1): 55-62.
8. Finer NN, Barrington KJ. Nitric oxide for respiratory failure in infants born at or near term. Cochrane Database Syst Rev 2006(4): CD000399.
9. Kinsella JP. Inhaled nitric oxide therapy in premature newborn. Curr Opin Pediatr 2006; 18: 107-11.
10. Etches PC, Barrington KJ, Graham AJ, Chan WK. Nitric oxide reverses acute hypoxic pulmonary hyperthension in the newborn piglet. Pediatr Res 1994; 35(1): 15-9.
11. Silvera F, Tellechea S, Godoy C, Mañana G, Bernachin J, Pascale A, et al. Modelos en suinos para el estudio de hipertensión pulmonar en el recién nacido. Poster. Procedente del 25º Congreso Uruguayo de Pediatría; 2005, oct. 30-nov.1, Montevideo, Uruguay.
12. Hascoet JM, Fresson J, Claris O, Hamon I, Lombet J, Liska A, et al. The safety and efficacy of nitric oxide therapy in premature infants. J Pediatr 2005; 146(3): 318-23.
13. Konduri GG, Solimano A, Sokol GM, Singer J, Ehrenkranz RA, Singhal N, et al. A randomized trial of early versus standard inhaled nitric oxide therapy in term and near-term newborn infants with hypoxic respiratory failure. Pediatrics 2004; 113(3 Pt 1): 559-64.
14. Early compared with delayed inhaled nitric oxide in moderately hypoxaemic neonates with respiratory failure: a randomised controlled trial. The Franco-Belgium Collaborative NO Trial Group. Lancet 1999; 354(9184): 1066-71.
15. Lotze A, Mitchell BR, Bulas DI, Zola EM, Shalwitz RA, Gunkel JH. Multicenter study of surfactant (beractant) use in the treatment of term infants with severe respiratory failure. Survanta in Term Infants Study Group. J Pediatr 1998; 132(1): 40-7.
16. Finer NN. Surfactant use for neonatal lung injury: beyond respiratory distress syndrome. Paediatr Respir Rev 2004; 5 Suppl A: S289-97.
17. Finer NN, Sun JW, Rich W, Knodel E, Barrington KJ. Randomized, prospective study of low-dose versus high-dose inhaled nitric oxide in the neonate with hypoxic respiratory failure. Pediatrics 2001; 108(4): 949-55.
18. Guthrie SO, Walsh WF, Auten K, Clark RH. Initial dosing of inhaled nitric oxide in infants with hypoxic respiratory failure. J Perinatol 2004; 24(5): 290-4.
19. Namachivayam P, Butt WW, Cooper SM, Penny DJ, Shekerdemian LS. Sildenafil prevents rebound pulmonary hypertension after withdrawal of nitric oxide in children. Am J Respir Crit Care Med 2006; 174(9): 1042-7.
20. Weinberger B, Laskin DL, Heck DE, Laskin JD. The toxicology of inhaled nitric oxide. Toxicol Sci 2001; 59(1): 5-16.
21. Davidson D, Barefield ES, Kattwinkel J, Dudell G, Damask M, Straube R, et al. Safety of withdrawing inhaled nitric oxide therapy in persistent pulmonary hypertension of the newborn. Pediatrics 1999; 104(2 Pt 1): 231-6.
22. Aly H, Sahni R, Wung JT. Weaning strategy with inhaled nitric oxide treatment in persistent pulmonary hypertension of the newborn. Arch Dis Child Fetal Neonatal Ed 1997; 76(2): F118-22.
23. Martell M, Blasina F, Silvera F, Tellechea S, Godoy C, Vaamonde L, et al. Intratracheal sildenafil in the newborn with pulmonary hypertension. Pediatrics 2007; 119: 215-6.
24. Bonino A, Moraes M, Martinotti M, Bustos R. Sildenafil: ¿una alternativa para el tratamiento de la hipertensión pulmonar persistente? Arch Pediatr Urug 2006; 72(2): 130-4.
25. Rodríguez G, Ferrari A, Pérez R, Martell M, Burgueño M. Prostaciclinas inhalatorias en la hipertensión pulmonar persistente del recién nacido. Arch Pediatr Urug 2006; 77(3): 267-72.
26. Kelly LK, Porta NF, Goodman DM, Carroll CL, Steinhorn RH. Inhaled prostacyclin for term infants with persistent pulmonary hypertension refractory to inhaled nitric oxide. J Pediatr 2002; 141(6): 830-2.
27. Davis JM. Role of oxidant injury in the pathogenesis of neonatal lung disease. Acta Paediatr Suppl 2002; 91(437): 23-5.
28. Noori S, Friedlich PH, Seri I. The use of dobutamine in the treatment of neonatal cardiovascular compromise. NeoReviews 2004; 5(1): 22-6.
29. Noori S, Friedlich PH, Seri I. Developmentally regulated cardiovascular, renal, and neuroendocrine effects of dopamine. NeoReviews 2003; 4(10): 283-8.
30. Engle W, LeFlore J. Hypotension in the neonate. NeoReviews 2002; 3(8): 157-62.
31. Alexander SM, Todres ID. The use of sedation and muscle relaxation in the ventilated infant. Clin Perinatol 1998; 25(1): 63-78.
32. Piotrowski A. Comparison of atracurium and pancuronium in mechanically ventilated neonates. Intensive Care Med 1993; 19(7): 401-5.
33. Davidson D, Barefield ES, Kattwinkel J, Dudell G, Damask M, Straube R, et al. Inhaled nitric oxide for the early treatment of persistent pulmonary hypertension of the term newborn: a randomized, double-masked, placebo-controlled, dose-response, multicenter study. The I-NO/PPHN Study Group. Pediatrics 1998; 101(3 Pt 1): 325-34.
34. Banks BA, Seri I, Ischiropoulos H, Merrill J, Rychik J, Ballard RA. Changes in oxygenation with inhaled nitric oxide in severe bronchopulmonary dysplasia. Pediatrics 1999; 103(3): 610-8.
35. Abman SH, Griebel JL, Parker DK, Schmidt JM, Swanton D, Kinsella JP. Acute effects of inhaled nitric oxide in children with severe hypoxemic respiratory failure. J Pediatr 1994; 124(6): 881-8.
Correspondencia: Dr. Fernando Silvera.
Avenida Rivera 2810 Apto. 501. Montevideo, Uruguay
Correo electrónico: julsil@adinet.com.uy