Introducción
La resonancia magnética (RM) es una técnica de imagen diagnóstica indicada cada vez con más frecuencia en el estudio de un amplio espectro de patologías1. A su vez, el número de pacientes con dispositivos cardíacos implantables, tanto marcapasos (MP) como cardiodesfibriladores (CDI), se encuentra en aumento2,3. La presencia de un dispositivo cardíaco implantable ha sido históricamente considerada una contraindicación absoluta para la realización de una RM. El desarrollo de la ingeniería aplicada a estos dispositivos en los últimos años ha permitido su utilización en forma segura en RM. Además, como detallaremos, la publicación de varios trabajos retrospectivos y prospectivos avalan la utilización de MP y CDI, tanto condicionales como no condicionales en determinadas condiciones4.
En el 2017, la Heart Rhythm Society (HRS) publicó un consenso apoyado por numerosas asociaciones internacionales de cardiología e imagen al respecto5, también está contemplado en un apartado de las últimas guías de estimulación de la Sociedad Europea de Cardiología (ESC) del año 20212.
El propósito de esta revisión es resumir la evidencia existente sobre el tema, conocer los potenciales riesgos implicados y las mejores estrategias para sobrellevarlos.
Proponemos, asimismo, un protocolo esquemático y puntos adaptados de los sugeridos por las sociedades científicas para el manejo de los pacientes.
Mecanismos de los potenciales efectos adversos
La adquisición de imágenes por RM se basa en las propiedades físicas atómico-nucleares del hidrógeno de absorber y emitir pulsos de energía de radiofrecuencia cuando se expone a un campo magnético (cuya fuerza se mide en Tesla)1,5.
Los factores que pueden determinar efectos adversos están vinculados a las características del paciente, del resonador y del dispositivo. El resonador genera un campo magnético estático que lo caracteriza. Los resonadores más usados, tanto en los ensayos clínicos como en nuestro medio, son de 1,5 Tesla, existe a la fecha un solo resonador de 3 Tesla en nuestro país ubicado en el Centro Uruguayo de Imagenología Médica (CUDIM). Se trata de campos magnéticos permanentes de una intensidad 30 a 60 mil veces superior al campo magnético ejercido por la Tierra. Los materiales con componentes ferromagnéticos están sujetos a las fuerzas de atracción, pudiendo generar un “efecto misil” y de rotación, cuya magnitud depende de su masa y la distancia de la entrada del magneto5.
Durante la realización de los estudios se aplican pulsos de energía de radiofrecuencia (RF) a través de las bobinas utilizadas en la zona de estudio del paciente, que se suman al campo magnético estático; son imprescindibles para generar las imágenes.
El cuerpo absorbe parte de la energía de RF y aumenta su temperatura, habitualmente en cifras inferiores a 1 grado centígrado. El término dosimétrico utilizado para caracterizar la energía de RF es la tasa de absorción específica (SAR, medida en watios por kilogramo).
Los campos magnéticos variables o gradiente son campos magnéticos pequeños, que se activan y desactivan con rapidez durante el estudio. Pueden generar corrientes eléctricas y estimular los nervios periféricos, aunque no llegan a niveles suficientes para estimular directamente al miocardio6,7.
Potencialmente estos campos generados por el resonador actuando de forma aislada o combinada podrían interactuar con algunos objetos metálicos, así como dañar la performance de componentes electrónicos sensibles por los siguientes mecanismos que analizaremos:
a) Movimiento de algún componente
La fuerza inducida por el campo magnético sobre los componentes ferromagnéticos del dispositivo podría generar movimiento y, por lo tanto, dislocación7,8. Esto es extremadamente raro, dado el confinado espacio en el que se encuentran alojados8,9. El avance técnico en la fabricación de dispositivos implantables con la intención de hacerlos compatibles con el uso de RM ha llevado a la disminución de los componentes ferromagnéticos en los dispositivos actuales a una expresión mínima, manteniéndose, sobre todo, necesario a nivel de la batería y transformadores del capacitor del CDI.
A raíz de estudios realizados in vitro e in vivo, se estima que la fuerza inducida por el resonador sobre el dispositivo es equiparable a la generada por los movimientos gravitacionales fisiológicos, los cuales son insuficientes para moverlos, sobre todo teniendo en cuenta los tejidos que los sostienen. Las puntas de los electrodos utilizados en la práctica actual no contienen elementos ferromagnéticos, por lo que la posibilidad de que generen falla de captura por desplazamiento es nula7-10.
Si bien la dislocación de electrodos es una complicación de baja incidencia, es el principal motivo de reintervención tras un implante, ocurre predominantemente en los primeros días a semanas posteriores al procedimiento. Los estudios más importantes que analizan la seguridad en el uso de RM en portadores de dispositivos tienen como criterio de exclusión a implantes recientes (menores a 6 semanas) por el riesgo teórico de aumentar la tasa de dislocación en este período vulnerable2-5. Sin embargo, las guías admiten la realización de RM en las 6 semanas del posimplante si es estrictamente necesario, pero con un menor nivel de evidencia. Esto se ha analizado en pequeñas series y casos publicados y se observó que aún en estas circunstancias el riesgo es bajo y sin complicaciones mayores reportadas(2, 10-12). Es probable que estas recomendaciones cambien en un futuro no lejano cuando se disponga de mayor evidencia acerca de la inocuidad de realizar una resonancia en la cercanía del posimplante.
b) Calentamiento de los cables
A través de los campos de radiofrecuencia se deposita energía en forma de calor predominantemente en las puntas de los cables, pudiendo lesionar la interfaz cable-tejido, lo que conllevaría a un aumento en el umbral de estimulación y teórica pérdida de captura o inclusive generar sustrato para arritmias. El rediseñado de la geometría de los cables modernos ha llevado a transmitir menos radiofrecuencia. Los cambios máximos de temperatura registrados en estudios fueron de 1 ºC in vitro y < 0,2 ºC in vivo12,13, los cuales no tienen implicancias clínicas y son aceptados por la Food Drug Administration (FDA)13,14. En humanos con dispositivos implantados se han comparado los niveles de troponinas previo y posterior a la RM, lo que sugirió que el mínimo calentamiento inducido es insuficiente para generar daño tisular y liberación de biomarcadores14,15.
Los cables abandonados, fracturados o epicárdicos son presumiblemente más susceptibles al calentamiento, por lo que han sido excluidos de la mayoría de los estudios clínicos15-18. El generador absorbe parte de la energía inducida y esta se disipa en su superficie. Se ha sugerido en estudios in vitro que cables abandonados exhiben mayor calentamiento en las puntas comparado con los cables conectados porque no disipan la energía, ya que no están conectados a un generador5.
Un estudio reciente incluyó una cohorte de 139 pacientes con dispositivos y por lo menos 1 cable abandonado. Se realizaron 200 RM en distintas regiones anatómicas incluyendo el tórax, sin observarse signos vitales anormales, arritmias ventriculares sostenidas, alteraciones en la batería, power-on reset ni cambios en la estimulación. Dentro de los parámetros estudiados de los dispositivos, 4 pacientes tuvieron disminución en el sensado auricular y uno solo disminución del sensado ventricular; estos eventos fueron transitorios. Un paciente con fijación quirúrgica del esternón refirió ardor esternal, lo que provocó el cese del estudio sin mayores implicancias clínicas18,19.
Se ha observado en modelos in vitro un mayor calentamiento de los cables epicárdicos (posiblemente vinculado a la ausencia de flujo sanguíneo a dicho nivel); existe poca evidencia de este subgrupo de pacientes, dado que estos han sido excluidos de la mayoría de estudios. Los cables temporales epicárdicos poscirugía cardíaca que han sido parcialmente removidos no se consideran contraindicación para RM5.
c) Inducción de corriente
Los campos de gradiente magnético y de radiofrecuencia pueden acoplarse electromagnéticamente con los cables del dispositivo a través del denominado “efecto antena” e inducir una corriente (sobre todo en dispositivos antiguos)19-25.
Estas corrientes pueden alterar la programación del dispositivo, generar interferencia (“ruido”) en el electrograma con eventual ausencia de estimulación por inhibición en el MP o ser interpretado de manera errónea como arritmia ventricular e iniciar terapias inapropiadas por el CDI5 (figura 1). Este efecto también es responsable de la interferencia observada en el monitor, lo que obliga a monitorizar por otros métodos (por ejemplo, onda de pulso del saturómetro).
d) Otros efectos adversos posibles
Existe la posibilidad de activación del “efecto de imán” sobre los dispositivos, es decir, activar el modo asincrónico del MP o la inhibición de terapias del CDI. En dispositivos antiguos esto sucede por la activación de un interruptor (reed switch) por la fuerza magnética del resonador. Los nuevos dispositivos han solucionado este problema modificando la forma de activar esta función cambiando el interruptor por tecnología (“efecto Hall”) que se comporta de forma más adecuada en ambientes de RM.
La interferencia electromagnética generada por la RM puede ser reconocida como interferencia no fisiológica por el dispositivo y determinar el cambio hacia un modo de respaldo con programación que varía según la marca y el tipo de dispositivo, habitualmente modo a demanda VVI, llamado en inglés power-on reset. Esto puede cambiar la polaridad de la estimulación a unipolar, cambiar la salida por debajo del umbral de captura, aumentar la sensibilidad y sensar la interferencia generada por la RM o determinar la activación de terapias antitaquicardia por un CDI. Los dispositivos actuales han incorporado carcasas con filtros que limitan la transmisión de frecuencias altas y disipan mejor la energía para amortiguar este problema5.
El estado de la batería puede verse afectado, sobre todo, en dispositivos cercanos al ERI (período de recambio electivo). En CDI esto es teóricamente más factible, ya que las descargas no son posibles dentro del resonador. El campo magnético estático satura el condensador, lo que impide su adecuada carga. La interferencia electromagnética podría ser sensada por el CDI y desencadenar terapias inapropiadas que a su vez no logren cargarse adecuadamente. Cabe destacar que muchas veces la depleción de la batería es transitoria26,27.
Otro efecto adverso para destacar, más esperable, es la presencia de artefactos en la imagen debido a la composición metálica de los dispositivos, sobre todo en CDI. Se observan como distorsión de la imagen o pérdida de la señal entre planos. No se pueden predecir por adelantado debido a las múltiples variables implicadas5. Este problema es especialmente importante en las RM torácicas y cardíacas donde los artefactos generados en la imagen adquirida pueden interferir con la zona de interés.
Existe menos evidencia sobre los efectos adversos en la RM torácica o cardíaca, puesto que fueron excluidos de muchos trials. Sin embargo, estudios que investigaron específicamente su seguridad han determinado que esta es equivalente a la de las resonancias extratorácicas27-29.
Un estudio prospectivo recientemente publicado incluyó 200 pacientes con dispositivos a los que se les realizó cardiorresonancia29,30. Se implementó un protocolo estandarizado de chequeo, con pre- y posprogramación según cada caso, y se realizó seguimiento a 6 meses pos-RM. A este grupo se lo comparó con una cohorte de pacientes implantados de referencia, sin exposición a RM. No hubo diferencias significativas entre los grupos con respecto a disfunción del dispositivo. Los autores concluyeron que, si se realiza un adecuado protocolo, se puede realizar cardiorresonancia de manera segura.
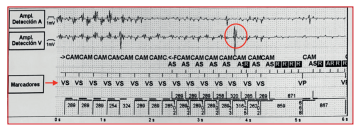
Figura 1 Episodio registrado como “frecuencia ventricular rápida” en paciente portadora de marcapasos bicameral. Estos coinciden con la realización de una RM de cráneo. Se observan señales en electrodos auricular y ventricular, que son ruido producto de la interferencia con el resonador, pero interpretadas como propias (VS). El dispositivo cambia de modo a VVI e inhibe la estimulación mientras la señal de ruido supera el umbral de detección. Luego, al ser menores, no las detecta y estimula (VP). La paciente refirió mareos durante la RM sin síntomas mayores. Se señala un probable escape ventricular propio. No se realizó consulta a cardiología ni evaluación del dispositivo previo a la RM, lo que fácilmente hubiera prevenido la situación programando en modo asincrónico.
Etiquetado
En términos generales, la seguridad de cualquier objeto que se exponga a un ambiente de resonancia se clasifica de la siguiente forma30,47:
a. Sistemas RM seguros: objetos que no presentan ningún riesgo para cualquier ambiente de RM. Debido a los riesgos potenciales de los dispositivos cardíacos implantables, ninguno entra en esta categoría.
b. Sistemas RM no seguros: los riesgos de exponer estos materiales a un resonador son conocidos y se deben evitar.
c. Sistemas RM condicionales: se refiere a aquellos objetos bajo condiciones dadas tanto del objeto como del resonador que no conllevan riesgos conocidos utilizando protocolo preestablecido.
El rediseño y avance en la ingeniería de los dispositivos cardíacos ya mencionados ha llevado a que desde el 2011 existan dispositivos cardíacos con este etiquetado aprobados por la FDA31.
Estos dispositivos tienen la posibilidad de programar con facilidad un “modo resonancia” previo a la exposición al resonador. Este modo incluye chequeos de la integridad del sistema previo a exponerse a resonancia, cambio temporal a modo asincrónico con alto voltaje de salida en pacientes dependientes, desactivación de terapias antitaquicardia y la fácil restauración a la programación previa. Aun así, esto implica el control con programador pre- y posresonancia. Se han desarrollado recientemente dispositivos con la capacidad de detectar por sí solos la presencia de un entorno de resonancia y cambiar de manera automática su programación a una preestablecida para adaptarse a la RM y permitir un control más laxo del dispositivo32. De todas formas, los consensos remarcan la importancia de valorar a estos pacientes dentro de protocolos institucionales establecidos con lista de verificación y programador pre- y posresonancia5.
Las principales marcas disponibles en nuestro medio han incorporado (desde el 2015 aproximadamente) modelos de dispositivos RM condicionales que incluyen capacidad de programación en modo resonancia. Estos modelos son: SureScan de Medtronic33, ProMRI de Biotronik(34), ImageReady de Boston Scientific(35) y MRI Ready de St. Jude Abbott36. Se identifican con un símbolo universal para objetos RM condicionales (figura 2).
Ensayos clínicos randomizados multicéntricos realizados de manera prospectiva y estudios de cohorte37-41) (40-44 han estudiado la seguridad de los dispositivos condicionales al realizar RM con configuración clínica habitual (1,5-3 T y SAR ≤ 2 W/kg). En la mayoría se reportó ausencia de eventos adversos, con escasas variaciones no significativas en los parámetros programados reportados que no tuvieron mayores implicancias clínicas.
d. Sistemas RM no condicionales: son los dispositivos que no tienen el etiquetado de condicional por no haber sido probados en un ambiente RM específico. Se incluyen en este grupo dispositivos de fabricación antigua no diseñados específicamente para exponerse a un resonador y tampoco probados en ese medio, por lo tanto, tampoco puede decirse que no sean seguros. De ahí el concepto de RM no condicional para estos dispositivos.
Son considerados también sistemas RM no condicionales los dispositivos que combinan sus componentes de distintos proveedores o que alguno de sus componentes sea no condicional, aunque otro sí lo sea (por ejemplo, electrodos no condicionales con un generador condicional) o sistemas con cables abandonados, fracturados, extensiones u otros.
Hay evidencia creciente sobre la seguridad de realizar RM en pacientes con estos dispositivos utilizando protocolos específicos, con bajo riesgo de efectos adversos menores y solucionables5.
En un estudio prospectivo no randomizado publicado en The New England Journal of Medicine en 2017 se investigó la seguridad de realizar RM en 1.509 pacientes con MP o CDI no condicionales a quienes se realizaron 2.103 RM torácicas y no torácicas por indicación clínica27. Previo a la RM, se programó el modo de estimulación a asincrónico en dependientes y a demanda en el resto, desactivando las funciones antitaquicardia en portadores de CDI. No se reportaron eventos a largo plazo clínicamente significativos. En 9 pacientes el dispositivo se reseteó a un modo de respaldo (de forma transitoria en 8 de ellos). En un caso, un MP en ERI se reseteó y no pudo ser reprogramado, tuvo que recambiarse. El cambio en los parámetros medidos más frecuente fue un descenso en la amplitud de la onda P, que ocurrió en 1% de los pacientes de forma inmediata y 4% a largo plazo, aumento de captura auricular 4% y ventricular 3%, sin ser clínicamente significativos ni requerir revisión del dispositivo ni reprogramación. El estudio concluyó en que la realización de RM a pacientes con dispositivos no condicionales bajo el protocolo estandarizado utilizado fue seguro.
El multicéntrico MagnaSafe Registry42 fue realizado de forma prospectiva e incluyó 1.000 RM en pacientes con MP y 500 RM en pacientes con CDI no condicionales, todas ellas en regiones no torácicas y utilizando resonadores 1,5 T; 28% de los pacientes con MP eran dependientes. Pacientes con CDI dependientes fueron excluidos. Se utilizó un protocolo de evaluación y programación específico pre- y pos-RM. No se registraron muertes, fallas del generador ni de los electrodos, así como tampoco falla de captura. En un caso, el CDI no pudo ser interrogado pos-RM y requirió el recambio inmediato; no se había cumplido el protocolo preestablecido de manera adecuada. Se observaron bajas tasas de cambios en los parámetros de los dispositivos: descenso de 50% o más de la onda P sensada en menos del 1% y descenso del 25% de la onda R sensada en 3,9% de los MP y 1,6% de los CDI. Un cambio en la impedancia de más de 50 ohms se detectó en cerca de 4% de los dispositivos. Los pacientes que presentaron estos cambios (menores y sin importancia clínica) fueron seguidos a 6 meses y se observó reversión a parámetros previos. También se observaron 6 casos de fibrilación auricular revertida espontáneamente y 6 casos de reset parcial. Concluyeron que en esta población, utilizando un protocolo de evaluación y programación específico, ningún paciente presentó fallas significativas del sistema.
Un estudio con grupo control formado por pacientes con dispositivos que no se sometieron a RM43 observó que existe una variación en los parámetros de los dispositivos, aún sin estar expuestos a campos electromagnéticos, lo cual sugiere que los cambios reportados en otros estudios podrían corresponder a una variación basal normal.
Un metaanálisis publicado en Europace en 2020 con pacientes de 35 estudios (incluyendo a los del MagnaSafe) analizó un total de 7.196 RM en 5.625 pacientes con dispositivos no condicionales. También concluyó que realizar RM bajo protocolos estandarizados es seguro en pacientes con MP y CDI no condicionales44.

Figura 2 Logos para diferenciar los niveles de seguridad de un objeto al exponerse a una RM. Los dispositivos cardíacos implantables son condicionales o no condicionales47.
Manejo de pacientes con dispositivo implantado e indicación de resonancia
Con base en lo expuesto y teniendo especialmente en cuenta el consenso de la HRS publicado en 20175 y las últimas guías de estimulación y resincronización del 2021 de la ESC2, se establecen las siguientes recomendaciones:
1. En la institución donde se realicen estos procedimientos deben participar integrantes de los servicios de radiología y de electrofisiología cardíaca para el desarrollo de un protocolo específico adaptado a las condiciones del servicio y que este sea conocido, difundido, ejecutado y evaluado de forma periódica45.
2. Se deben ponderar los potenciales riesgos y beneficios de realizar una RM y evaluar junto a quien indica el estudio si existen métodos alternativos de imagen que aporten la información deseada.
3. Conocer el ritmo subyacente del paciente y si es dependiente o no del marcapasos. Además, el tipo de dispositivo implantado y si tiene status de RM condicional o no, por lo que debe conocerse marca y modelo para consultar las especificaciones del proveedor o sitios de internet, de permanente actualización, útiles en la evaluación de cualquier dispositivo de uso médico (http://www.mrisafety.com/TMDL_list.php).
4. Conocer el estado de la batería, presencia de cables abandonados, fracturados, epicárdicos y presencia de componentes de distintos proveedores.
5. Cualquiera sea la RM que se realizará en pacientes con dispositivos implantados debe coordinarse en resonadores actuando con una fuerza magnética de hasta 1,5 T (esta es una característica intrínseca y no modificable del resonador).
6. Se recomienda usar:
a) Un valor de SAR menor a 1,5 W/kg (este es un parámetro modificable que controla el licenciado radiólogo que realiza la RM).
b) El modo operativo normal de SAR y dB/dt.
c) La bobina de cuerpo para emisión de RF y evitar uso de bobinas de emisión- recepción, como las de cabeza y cuello y las de rodilla, especialmente en proximidad del dispositivo45.
7. Si el dispositivo es condicional y ya ha pasado el tiempo suficiente tras el implante, se puede realizar la RM de forma segura siguiendo protocolos estandarizados con indicación I, nivel de evidencia A (figura 3).
8. En dispositivos no condicionales se deben considerar métodos alternativos de imagen con mayor énfasis. Si es imprescindible la RM, en ausencia de electrodos epicárdicos, fracturados, abandonados, adaptadores o extensores, se puede realizar RM siguiendo un protocolo estandarizado con indicación IIa, nivel de evidencia B (ver figura 3).
9. Si hay cables abandonados o fracturados, no existen métodos alternativos de imagen y los beneficios de la RM superan ampliamente a los riesgos de esta, se puede realizar (indicación IIb, nivel de evidencia C).
10. Se sugiere realizar una lista de verificación (checklist) para comprobar ausencia de contraindicaciones y la programación pre- y pos-RM según sea indicado (figura 4).
11. Si bien la evidencia no es contundente, debe evitarse la realización de una RM en las primeras 6 semanas consecutivas al implante del dispositivo.
12. En la sala de resonancia se recomienda la monitorización electrocardiográfica y saturación de O2 continua durante el estudio. Todo el personal actuante debe estar al tanto de que el paciente es portador de un dispositivo implantado.
13. Se recomienda la presencia de material adecuado y personal con la habilidad de realizar soporte vital avanzado, reconocimiento de arritmias, desfibrilación, estimulación transcutánea o transvenosa (sobre todo en pacientes dependientes de MP y dispositivos RM no condicionales) durante el período en que el paciente se encuentre en la sala de resonancia.
14. Ante la necesidad de utilizar un desfibrilador, programador u otro equipamiento no seguro en torno al resonador, debe trasladarse al paciente fuera de la sala del resonador (de zona 4 a zona 3).
15. Se recomienda personal capacitado rápidamente disponible para reprogramar el dispositivo (es fundamental en los pacientes dependientes del MP y portadores de dispositivos RM no condicionales). Esto implica que el personal pueda solicitar con facilidad la asistencia de un técnico entrenado en programación. A su vez, el personal dedicado al control de dispositivos debe estar en conocimiento de que un paciente con dispositivo implantado se está realizando una RM.
16. Los pacientes con dispositivos (MP o CDI) RM condicionales se deben programar a modo RM previo a la resonancia y volver a su programación inicial una vez finalizado el estudio.
17. Los pacientes con MP no condicionales que sean dependientes se deben programar a modo asincrónico (VOO/DOO) a una frecuencia alta que evite competencia y a una salida alta. Se debe volver a su programación inicial una vez finalizado el estudio.
18. Los pacientes con MP no condicionales que no son dependientes deben programarse a un modo de no estimulación (OVO) o inhibición (VVI) a frecuencias bajas, desactivando modos adaptativos. Finalizado el estudio, se debe chequear el dispositivo y modificar a la programación y modo configuradas previo a la RM.
19. En pacientes portadores de CDI no condicionales se debe desactivar transitoriamente la detección de arritmias. Se debe volver a su programación inicial una vez finalizado el estudio.
20. Por último y a modo de resumen, todo paciente portador de dispositivo implantado al que se le realizará RM debe ser evaluado con el programador antes y después de esta, por personal entrenado del equipo que implantó el dispositivo. Si al interrogar el dispositivo luego de la RM se observa un aumento del umbral mayor a 1V, descenso de P o R mayor a 50% o aumento en la impedancia del electrodo de estimulación mayor a 50 Ω o del electrodo de desfibrilación mayor a 5 Ω, se recomienda un nuevo control en 1 semana. Habitualmente retornan a los valores previos en ese plazo. Si no hay retorno a los valores basales, debe hacerse seguimiento estrecho y eventualmente considerar la intervención para corregir las anomalías detectadas. Como fue referido, este hecho es excepcional.
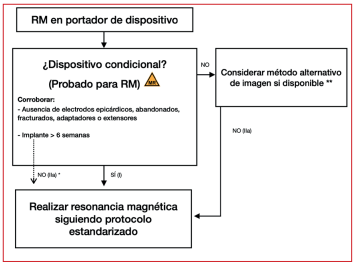
Figura 3 Algoritmo para toma de decisiones (adaptado de 2, 5). * Balance riesgo-beneficio considerando métodos alternativos de imagen, esperar plazos de ser posible. ** Reconsiderar resonancia si no hay métodos alternativos de imagen y el resultado de la prueba tiene impacto significativo para el paciente.
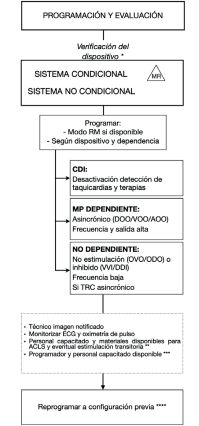
Figura 4 Flujograma sugerido para pacientes con dispositivos cardíacos implantables que se realizarán una RM. * Verificar tipo de dispositivo, dependencia, presencia de elementos que contraindiquen. ** Las eventuales maniobras de resucitación como la desfibrilación deben realizarse fuera de la sala del imán (zona 4). *** Sobre todo, para pacientes dependientes en dispositivos no condicionales. **** Si se encuentra alguno de los siguientes, nuevo control en 1 semana: Aumento umbral de captura >1,0 V - disminución sensado >50% Impedancia estimulación > 50 Ω - impedancia choque > 5 Ω
Conclusión
La RM es una técnica que en la actualidad ocupa un rol central en nuestra práctica médica. Ser portador de un dispositivo magnético implantable no es hoy una contraindicación absoluta para este tipo de estudios. Sin embargo, estos pacientes requieren seguir estrategias y protocolos adecuados que siempre incluyan la evaluación de los dispositivos antes y después del estudio.















