Introducción
El sistema gastrointestinal (GI), además de la absorción, digestión de nutrientes y secreción de gran cantidad de hormonas, es el mayor compartimiento mucoso del sistema inmune y una barrera al paso de antígenos, tóxicos, microorganismos y sus toxinas desde la luz intestinal a la circulación sistémica1. Esta “barrera intestinal” constituye un sistema defensivo compuesto por elementos extracelulares (pH intraluminal; secreciones gástricas, pancreáticas y biliares; peristaltismo; capa de moco, agua y glicocálix que previene la adhesión e invasión por microorganismos y contiene inmunoglobulina A secretora (IgAs) y celulares (epitelio intestinal, tejido linfoide asociado al intestino, microbiota intestinal y el sistema nervioso entérico organizado en una red interconectada de neuronas y células gliales)2.
La microbiota intestinal es un ecosistema diverso que comprende bacterias, arqueas, hongos, virus y bacteriófagos, entre sus funciones se reconocen: metabólicas, tróficas y de protección3. El microbioma se refiere al número total de microorganismos, su material genético y las condiciones ambientales circundantes, mientras que la colección de genes y genomas de una microbiota constituye el metagenoma4.
En el paciente crítico el intestino es protagonista de la respuesta al estrés y todos los elementos de la barrera intestinal son afectados, condicionando alteraciones sistémicas, disminución de la inmunidad, situación proinflamatoria, susceptibilidad a infecciones, sepsis y síndrome de fracaso multiorgánico5. Los síntomas de insuficiencia intestinal en las unidades de cuidados intensivos (UCI) no son específicos y no se incluyen en escalas de gravedad comúnmente usadas, como el Sequential Organ Failure Assessment (SOFA), sin embargo, el 62% de los pacientes críticos presenta síntomas GI al menos una vez al día6. Demostrándose la relación existente entre la aparición de problemas GI y la mortalidad en pacientes críticos (43,7% frente a 5,3% de los pacientes sin alteraciones GI)7.
Fleming y Remington, en 1981, usaron por primera vez el término “fallo intestinal”. Hasta el 2014 habían menos de 1.000 referencias al tema, recientemente la Sociedad Europea de Nutrición Clínica y Metabolismo (ESPEN) ofrece una nueva definición y clasificación del fallo intestinal (FI)8.
Metodología
El objetivo de esta revisión es proporcionar el conocimiento teórico necesario sobre el fallo intestinal como entidad exclusiva, su reconocimiento en el paciente grave, su clasificación y el enfoque multidisciplinario del tratamiento.
Se realizó una revisión cualitativa y sistemática en inglés y español de las bases de datos PubMed/MEDLINE, EMBASE, Scopus y Cochrane Central para identificar la documentación publicada sobre el tema, como artículos de revisión, ensayos clínicos, guías clínicas y estudios observacionales entre el mes de octubre de 2000 hasta noviembre de 2020. Como criterios de búsqueda se incluyeron los siguientes descriptores: “fallo intestinal”, “disfunción intestinal”, “insuficiencia intestinal”, “intestinal insufficiency”, “intestinal failure”, “intestinal dysfunction”. Se revisaron los resúmenes y en casos necesarios los artículos completos, considerándose los que incluían recomendaciones sobre fallo, disfunción o insuficiencia intestinal.
Resultados
En total, se revisaron 97 citas y resúmenes para su inclusión (53 de PubMed/MEDLINE, 16 de EMBASE, 7 de Scopus y 21 de Cochrane Central). De estos fueron seleccionados cuatro guías clínicas, seis ensayos clínicos aleatorizados y 11 estudios observacionales controlados.
Desarrollo y discusión
Los pacientes graves con FI requieren una intervención multidisciplinaria y unidades dedicadas con experiencia. Este enfoque se asocia a menor incidencia de complicaciones y mortalidad8,9.
Definición
La ESPEN8 ha definido el FI como la reducción de la función intestinal bajo el mínimo necesario para la absorción de macronutrientes y/o agua y electrolitos, requiriéndose suplementación intravenosa (IV) para mantener la salud y/o el crecimiento. La reducción de la función intestinal de absorción que no precisa suplementación IV, puede considerarse como disfunción intestinal.
Clasificación y etiología
Según la duración del soporte nutricional y/o de agua y electrolitos IV, algunos pacientes con FI necesitarán soporte por un corto período de tiempo mientras se recupera la función intestinal, como sucede en algunos postoperatorios de cirugía abdominal o con otras patologías (neumonía, traumatismo craneoencefálico, pancreatitis aguda). En otros pacientes más complejos y metabólicamente inestables, el soporte IV puede extenderse por un período mayor de tiempo y requerirán atención multidisciplinaria, generalmente en UCI. Un grupo menor de casos, estables metabólicamente, podrán requerir soporte nutricional IV durante meses o incluso años.
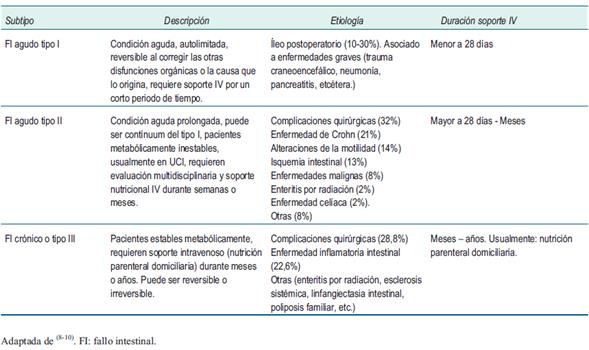
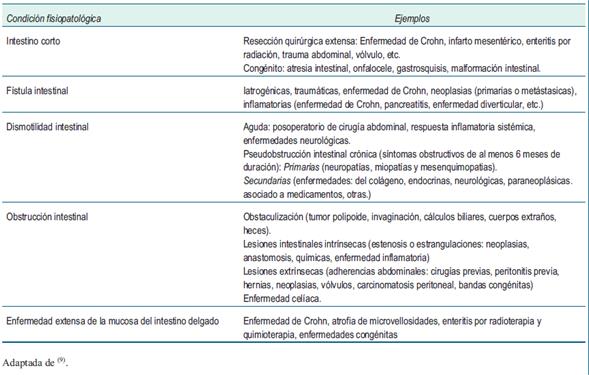
Se identifican tres subtipos funcionales de FI (tabla 1), según el tiempo de duración y las características fisiopatológicas se reconocen cinco condiciones capaces de ocasionarlo (tabla 2).
Esta clasificación de la ESPEN8 fue resultado del trabajo de dos grupos de estudio: uno en 1992, “Grupo de falla intestinal crónica y nutrición artificial en el hogar”, y otro en 2010, “Grupo de falla intestinal aguda”.
En la (tabla 1) se integra la etiología según el estudio británico de Lal y colaboradores10, estas enfermedades se resumen en cinco condiciones fisiopatológicas8(tabla 2) y pueden coincidir más de una en un paciente con FI.
Según la severidad, el grupo de trabajo de problemas abdominales de la Sociedad Europea de Medicina Intensiva (European Society of Intensive Care Medicine, ESICM) propuso la clasificación de las alteraciones gastrointestinales agudas del paciente crítico en cuatro grados11:
- Grado I (riesgo): náuseas posoperatorias o vómitos durante los primeros días poscirugía; ausencia de sonidos intestinales, disminución de motilidad intestinal en la fase precoz del shock.
- Grado II (disfunción GI): gastroparesia, aumento del residuo gástrico, parálisis del tracto GI, diarrea, aumento de la presión intraabdominal (PIA) entre 12-15 mmHg, sangrado digestivo. Existe intolerancia a la nutrición enteral (NE) (cuando a las 72 horas no se han podido aportar 20 kcal/kg).
- Grado III (fallo intestinal agudo): persistencia de la intolerancia a pesar de intervención terapéutica, residuo gástrico aumentado, parálisis GI, distensión intestinal, elevación de la PIA (15-20 mmHg), y presión de perfusión abdominal(PPA) baja (<60 mm Hg).
- Grado IV (fallo intestinal agudo): isquemia intestinal con necrosis, hemorragia GI, shock hemorrágico, síndrome de Ogilvie, síndrome compartimental abdominal (SCA). Riesgo vital inmediato.
Esta clasificación considera parámetros objetivos como la PIA y la presencia de hipertensión abdominal o SCA en el diagnóstico de FIA. La hipertensión abdominal se diagnostica entre el 38%-45% de todos los pacientes adultos en UCI12,13 y la incidencia del SCA varía con la gravedad de la lesión; reportándose entre 10%-35% de los pacientes críticos sin lesión abdominal directa y en 30% después de una cirugía o traumatismo abdominal mayor con una mortalidad aproximada de 50%13.
Ambas clasificaciones no son excluyentes, existiendo concordancia entre el tipo I de la clasificación funcional por la ESPEN8 y el grado I de la ESICM11. Resulta complejo establecer una clasificación basada en la severidad del FI por la falta de marcadores de gravedad e indicadores simples de absorción intestinal y equilibrio metabólico.
Diagnóstico en el paciente grave
Seguidamente al insulto inicial (infección, trauma, cirugía, etcétera) se describen dos fases en la enfermedad crítica14:
1. Fase aguda: comprende un período temprano de la fase aguda (antes llamada EBB) de inestabilidad metabólica con aumento importante del catabolismo y razón de la admisión en UCI. Un período tardío de la fase aguda (antes llamada FLOW) más o menos prolongado (3-7 días) donde aún predomina el catabolismo, pérdida de masa muscular y tendencia a estabilizarse los disturbios metabólicos.
2. Fase crónica: Se caracteriza por anabolismo, convalecencia, rehabilitación y en algunos casos un síndrome inflamatorio y catabólico crónico.
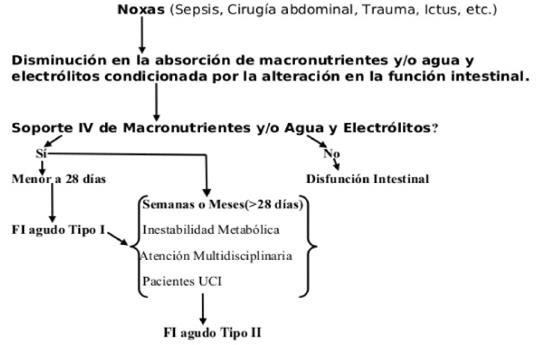
En este complejo escenario el paciente puede presentarse sin disfunción ni FI, con disfunción intestinal solamente o fallo intestinal agudo (FIA) tipo I o II (figura 1).
Los test actuales para la evaluación de la disfunción y FI son de valor limitado, los síntomas y signos son muy variados y en ocasiones carecen de objetividad. La definición propuesta por la ESPEN8 condiciona el diagnóstico de FI a la presencia simultánea de dos criterios:
Consideraciones sobre la disminución en la superficie intestinal funcional15,16
Es necesario documentar la anatomía y función del intestino restante para diseñar la estrategia nutricional según los segmentos afectados15:
1. Yeyuno: el 90% de la absorción de macronutrientes (carbohidratos, lípidos y aminoácidos) ocurre en los primeros 100 a 150 cm de intestino proximal, así como la absorción de agua, calcio, fósforo, hierro, ácido fólico y la mayoría de las vitaminas hidrosolubles.
2. Íleon: absorción de vitamina B12 unida al factor intrínseco en los 50-60 cm de íleon distal, vitaminas(A, D, E y K), sales biliares, agua y electrolitos.
3. Colon: absorbe agua en forma más eficaz (puede reabsorber hasta 6 l/día), electrolitos, ácidos grasos de cadena corta y carbohidratos gracias a la flora colónica.
4. Válvula ileocecal: su pérdida reduce el tiempo de tránsito intestinal, alterando la absorción de nutrientes, y es causa de diarrea. Actúa como barrera al paso de bacterias del colon al íleon terminal, que ocasionarían sobrecrecimiento bacteriano alterando la absorción de vitamina B12, grasas y sales biliares.
Capacidad adaptativa del intestino delgado y colon15,16
Intestino delgado: la adaptación es más probable con íleon que con yeyuno. El íleon puede adaptarse en 1-2 años, aumentando longitud y diámetro, ampliación de pliegues de Kerckring y profundización de criptas. Evidencia que se limita a modelos animales sugiere que la hiperplasia de enterocitos y el aumento en la longitud de las vellosidades pueden ocurrir tan pronto como 48 horas después de la resección, mediada por factores tróficos (péptido 2 similar al glucagón, enteroglucagón, factor de crecimiento epidérmico, glutamina, hormona del crecimiento, colecistoquinina, gastrina, neurotensina, leptina y factor de crecimiento similar a la insulina).
Colon: el colon conservado es importante en la digestión, la ralentización de la motilidad intestinal mediada por hormonas y la estimulación de la adaptación intestinal para la reabsorción de agua y electrolitos. También para la absorción de ácidos grasos de cadena corta producidos por la digestión de carbohidratos mediada por bacterias colónicas y la absorción de ácidos grasos de cadena media solubles en agua.
Biomarcadores en la insuficiencia intestinal: en la mayoría de las fallas orgánicas, los biomarcadores séricos constituyen pilares para el diagnóstico, evolución y pronóstico. La cuantificación de la actividad metabólica de la masa enterocitaria representa hipotéticamente la capacidad absortiva de nutrientes en el intestino. En este sentido, dos biomarcadores muestran resultados prometedores: la citrulina plasmática y la apolipoproteína AIV (Apo AIV)17,18.
1.Citrulina: aminoácido que no se incorpora a proteínas, producido casi exclusivamente por los enterocitos, principalmente del intestino delgado proximal, como parte del metabolismo de la glutamina. Finaliza en los riñones liberando arginina. El valor sérico normal es 40 mcmol/l y no se altera por el efecto del primer paso hepático, la dieta o la inflamación18,19. Crenn y colaboradores20 demostraron que su valor plasmático se correlaciona con la longitud del intestino delgado como un biomarcador potencial de masa de enterocitos en pacientes con enfermedad celíaca. Cuando los niveles plasmáticos alcanzan 20 mcmol/l en el contexto de síndrome de intestino corto (SIC), la insuficiencia intestinal permanente es predecible con una sensibilidad del 92% y especificidad del 90%18,19.
2.Apo AIV: en humanos es sintetizada exclusivamente por enterocitos y representa hasta el 4% de las proteínas sintetizadas por estos. Se expresa en el íleon, estimulando la producción en el yeyuno18. Un valor de corte de 4,6 mg/100 ml es predictivo de rehabilitación intestinal y establece una diferencia entre los pacientes que alcanzan alimentación oral frente a los que permanecen en nutrición parenteral21.
Abordaje multidisciplinario del paciente grave con insuficiencia intestinal
El paciente grave con FI se presenta generalmente con fístula de alto gasto o enterostomía, sepsis y problemas asociados al SIC (deshidratación, desnutrición, alteraciones hidroelectrolíticas) en el contexto de FIA tipo II22.
Dos acrónimos describen la estrategia terapéutica del FIA22,23: SNAPP (Sepsis, Nutrición, Anatomía de la fístula, Protección (piel y herida), Plan quirúrgico) y SOWATS (Sepsis, Optimización nutricional, Cuidado de heridas y estomas, Anatomía intestinal y de la fístula, Tiempo y Planificación quirúrgica). Ambos pueden utilizarse en pacientes con FI sin fístulas22,23.
Resucitación inicial y corrección hidroelectrolítica: los primeros días, hasta uno o dos meses después de la resección intestinal y la formación del estoma/fístula (fase hipersecretora), se caracterizan por importantes pérdidas de líquidos y electrólitos24. Se reconocen cuatro indicaciones para la terapia con fluidos: resucitación, mantenimiento, reemplazo y redistribución24,25.
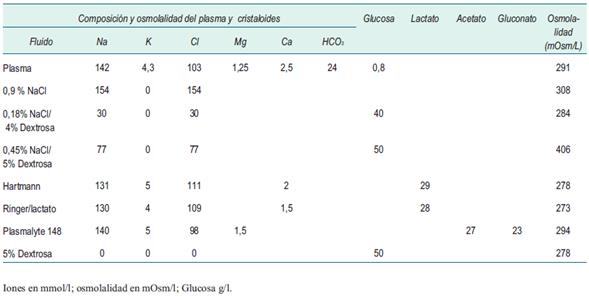
En la (tabla 3) se muestran algunas de las soluciones comúnmente usadas y su composición en relación al plasma.
La resucitación tiene como objetivo restaurar y mantener el volumen intravascular para una perfusión tisular adecuada. Para urgencias se recomienda el uso de cristaloides balanceados isotónicos. Como primera opción, la solución de Hartmann o el ringer lactato son adecuadas. Debe evitarse el uso de dextrosa al 5% como solución para la resucitación.
El cloruro de sodio al 0,9% es una mala elección en estados de shock con acidosis, potencialmente empeorará la situación (causa acidosis hiperclorémica), tiene un contenido de sodio suprafisiológico y no es isotónico.
Los fluidos de mantenimiento deben cubrir las necesidades basales diarias de agua y electrolitos en casos que estos no puedan ser administrados por vía enteral. Los fluidos para el mantenimiento IV en adultos deben incluir:
Los fluidos de reemplazo son diseñados para sustituir pérdidas más específicas: estomas, fístulas, fiebre, heridas abiertas, etcétera. Suelen usarse cristaloides balanceados e isotónicos. Pautas recientes24 recomiendan igualar la cantidad de líquidos y electrolitos tan cerca como sea posible a la del fluido perdido. En el caso de fístulas/enterostomías, los fluidos IV más usados para el reemplazo son la solución de Ringer lactato o Hartmann. Cuando el déficit se debe a una pérdida de cloruro del fluido gástrico se puede elegir solución salina al 0,9%. Es necesario corregir bajas concentraciones séricas de potasio, magnesio y fosfato: asociadas a alteraciones de la motilidad intestinal y desarrollo del síndrome de realimentación.
1. Fases de la fluidoterapia24,25
- Fase de rescate o resucitación (0 - primeras horas). Rescate del paciente mediante un manejo temprano y adecuado de fluidos (early adequate fluid management -EAFM-). Debe personalizarse según predictores dinámicos de la relación precarga/gasto cardíaco o respuesta a bolus de fluidos (3-4 ml/kg en 10-15 min).
- Fase de optimización (24 h-72 h). Sustituir las pérdidas y evitar la sobrecarga de fluidos (que conduce a disfunción orgánica e hipertensión abdominal). El balance acumulado de fluidos constituye un marcador pronóstico durante la primera semana de estadía en UCI y si es mayor a 10% se asocia a aumento de la mortalidad.
- Fase de estabilización (tercer-cuarto día). Evitar la hipovolemia y sobrecarga de fluidos: considerar en casos sobrerresucitados al inicio el manejo conservador tardío de fluidos (late conservative fluid management -LCFM-), definido como dos balances de fluidos negativos consecutivos durante la primera semana.
- Fase de evacuación (semanas): conservar la estabilidad hemodinámica, mientras se resuelve la sobrecarga secundaria a la fluidoterapia inicial, mantener la normovolemia y las necesidades básicas. Considerar en caso de sobrecarga de fluidos la desresucitación (late goal directed fluid removal -LGFR-) mediante el uso de diuréticos o ultrafiltración en algunos casos.
2. Predicción de la respuesta24,25
Consiste en predecir -antes de la administración de líquidos- si ésta será beneficiosa:
- Evitar marcadores estáticos de precarga cardíaca, como la presión venosa central (PVC) o la presión de oclusión de la arteria pulmonar (PAOP).
- Se recomienda evaluación dinámica de la relación precarga/gasto cardíaco. Por ejemplo: variabilidad de presión de pulso (VPP) y del volumen sistólico (VVS), índice de variabilidad pletismográfica (IVP) y de perfusión (IP), elevación pasiva de piernas/aumento del gasto cardíaco medido (PiCCO, volume view, ecocardiograma), índice de colapso de vena cava inferior (VCI) sin ventilación mecánica (VM) o de distensibilidad de VCI con VM.
- Parámetros clínicos: diuresis, presión arterial y presión arterial media (PAM), PIA, llenado capilar, frecuencia cardiaca, balance diario y acumulado de fluidos, peso, auscultación cardiaca y pulmonar, presencia de edemas.
- Laboratorio: lactato, BUN, ionograma, gasometría, creatinina, hematocrito, saturación venosa central de oxigeno (SvcO2), albúmina, osmolalidad sérica.
- Imagen: radiografía de tórax, ecografías (cardiaca, pulmonar, venosa (VCI, yugular interna), abdominal).
- Hemodinámica: PiCCO y PiCCO plus, IVP, IP, entre otros.
Prevención y tratamiento de la sepsis: la sepsis puede originarse en la cavidad abdominal, ocurrir por translocación bacteriana (por ejemplo: casos de distensión intestinal grave, isquemia intestinal subaguda sin perforación), producto de intervenciones y procederes terapéuticos: bacteriemia relacionada al catéter venoso central (BRCVC) o causas extraabdominales (neumonía, infección del tracto urinario), presentándose con un amplio espectro de síntomas y signos, y es la principal causa de muerte en pacientes con FIA26. En pacientes con fístula enterocutánea la sepsis intraabdominal se asocia al 77% de la mortalidad27. En una colección intraabdominal, se recomienda un abordaje mínimamente invasivo, realizándose drenaje percutáneo o de no ser posible, por vía alternativa (por ejemplo transgástrica, transrrectal o transvaginal), convenientemente guiado por tomografía computadorizada (TC) o ecografía, que además permite tomar muestras para estudios microbiológicos y tratamiento antimicrobiano dirigido. La reintervención para el control de foco séptico intraabdominal debe reservarse para situaciones en las que fallan los enfoques mínimamente invasivos26,28.
Nutrición: la NE previene la atrofia de la mucosa, contribuye a preservar la microbiota y a reducir la incidencia de bacteriemia y la mortalidad26. Los esfuerzos para iniciarla deben comenzar una vez que el paciente esté euvolémico, hemodinámica y metabólicamente estable26,28.
La Sociedad de Medicina Crítica (Society of Critical Care Medicine -SCCM-) y la Sociedad Americana para la Nutrición Enteral y Parenteral (American Society for Parenteral and Enteral Nutrition -ASPEN-)29 y la ESPEN14 recomiendan iniciar la NE en forma temprana (primeras 48 h) en pacientes graves cuando la vía oral no es posible.
Según la ESPEN14 no se debe iniciar la NE completa (más del 70% del gasto energético en reposo -GER, pero menos del 100%) en forma temprana en pacientes críticos, y se prescribirá entre el tercero y el séptimo días. Mientras la ASPEN/SCCM29 recomienda evitar la NE completa solamente en pacientes que tengan un riesgo nutricional elevado (Nutritional Risk Screening (NRS-2002) >5 o Nutrition Risk in the Critically Ill (NUTRIC) >5, sin interleucina 6) o gravemente desnutridos, avanzando para proporcionar >80% de la energía y proteínas estimadas en 48-72 horas durante la primera semana de hospitalización.
En pacientes con fístulas o estomas de alto gasto y acceso distal posible debe considerarse la reinfusión de quimo (enteroclisis)14,29,30.
A) ASPEN/SCCM29
- Evaluar riesgo nutricional de los pacientes al ingreso en UCI (por ejemplo NRS-2002, NUTRIC).
- Evitar NP durante los primeros 7 días en UCI en el paciente con bajo riesgo nutricional (por ejemplo NRS 2002 <3 o NUTRIC <5), que no pueda mantener la ingesta voluntaria y la NE no sea factible.
- Iniciar NP exclusiva lo antes posible después de la admisión en la UCI, en el paciente con alto riesgo nutricional (por ejemplo NRS 2002 >5, NUTRIC >5) o con desnutrición grave, cuando la NE no es factible.
Cuándo iniciar la NP como suplemento de la NE
ESPEN, ASPEN/SCCM14,29: la NP no debe iniciarse hasta que todas las estrategias para maximizar la tolerancia de la NE se han intentado.
ESPEN14: pacientes que no toleran la dosis completa de NE durante la primera semana en la UCI, deben evaluarse individualmente en relación a la seguridad y beneficios de iniciar la NP.
ASPEN/SCCM29: independientemente del riesgo nutricional, el uso de NP suplementaria debe considerarse solo después de siete a diez días si la NE no puede satisfacer >60% de las necesidades de energía y proteínas.
El papel de la NP suplementaria queda por definir en términos de tiempo, cantidad y composición. Casaer y colaboradores31 observaron que la NP temprana (complementaria o exclusiva) se asocia con un aumento de la morbilidad, estadía prolongada en UCI, mayor dependencia de la ventilación mecánica, aumento en la tasa de infección y necesidad de terapia de reemplazo renal. Sin embargo, otros estudios que abordan la NP suplementaria32,33 no mostraron hallazgos similares. El estudio EAT-ICU34) sobre asociar la NP suplementaria con la alimentación enteral desde el ingreso en UCI con un objetivo definido por calorimetría, no encontró daño o ventaja en términos de morbilidad, función a largo plazo o mortalidad.
En situaciones de alto gasto (estomas con pérdidas mayores a 1.500 ml/día) los esfuerzos deben centrarse en implementar una dieta con alto contenido calórico y baja en fibra que pase lentamente por el intestino delgado, aumentando la absorción de nutrientes, evitar fluidos hipotónicos vía oral o enteral, restringiendo el volumen de fluidos: 500-1000 ml/24 h28,35. Usar soluciones, como la de rehidratación oral de la OMS o la solución de St Mark’s, para reemplazar las pérdidas de electrólitos. Estas se componen de 3,5 g de cloruro de sodio, 2,5 g de bicarbonato de sodio, 20 g de glucosa en 1 l de agua23. Se puede administrar magnesio oral además de las soluciones de electrólitos cuando sea necesario. Se requiere un cuidadoso balance mientras se titula entre la suplementación oral y parenteral26,28.
Es recomendable probar NE si el gasto de la fístula/estoma es <1,5 l. Las fórmulas semielementales reducen significativamente el gasto de la fístula28. La NE puede estar contraindicada: cuando la longitud intestinal es insuficiente (<75 cm), si existe discontinuidad intestinal, aumento >3.000 ml en la salida de la fístula/estoma con el inicio de NE, intolerancia a NE, cuando el acceso enteral no se puede establecer o mantener28,35.
Farmacoterapia en situaciones de alto gasto
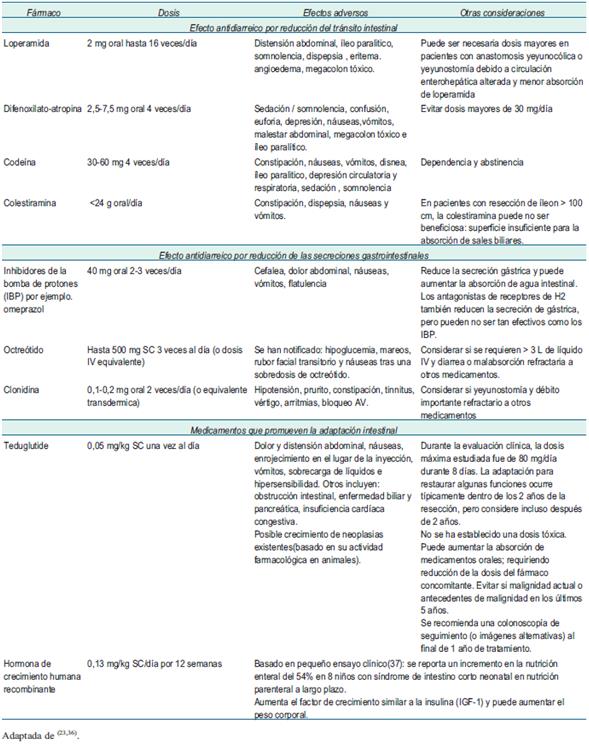
En la fase hipersecretora es común el uso de medicamentos inhibidores de la bomba de protones o antagonistas de los receptores H2 de histamina y antidiarreicos como la loperamida o codeína para disminuir el gasto la de la fístula o estoma35, en un centro de insuficiencia intestinal británico, altas dosis de loperamida (40 mg/día) y codeína (240 mg/día) se utilizaron para controlar el gasto de fístulas refractarias con éxito36.
La evidencia sobre los beneficios de la somatostatina y su análogo sintético octreótido en la enterostomía de alto gasto es controversial, su uso en una unidad dedicada al FI se limita a pruebas de 72 h y en caso de disminuir el débito del estoma o fístula continuaría aplicándose36.
En la (tabla 4) se resumen los fármacos más utilizados, dosis, consideraciones sobre su aplicación y efectos adversos.
Sobre teduglutide
Es un análogo sintético del péptido-2, similar al glucagón, con mayor vida media, y representa el primer abordaje no sintomático del SIC38.
Fue aprobada para el uso en pacientes adultos con SIC en Estados Unidos por la FDA y en la Unión Europea por la EMA en 2012. La aprobación se basó en los resultados de un estudio en fase III de 24 semanas, doble ciego, controlado con placebo (STEPS)39: pacientes con FI por SIC dependientes de NP, recibieron 0,05 mg/kg de teduglutide o placebo 1 vez/día durante 24 semanas. La proporción de pacientes que consiguieron una reducción >20% en el volumen de NP en la semana 20 frente al valor basal y que mantuvieron dicha respuesta en la semana 24 (respondedores) fue significativamente mayor en el grupo de teduglutida que en el de placebo (63% vs. 30%; p = 0,002). La reducción absoluta media frente al valor basal del volumen de NP en la semana 24 fue significativamente mayor (4,4 vs. 2,3 l/semana; p<0,001) y se mantuvo a largo plazo. En la extensión abierta del estudio STEPS (STEPS-2)40, todos los pacientes continuaron el tratamiento con teduglutide o fueron cambiados a él (n = 88), durante 2 años adicionales y 65 (74%) completaron el estudio, 13 pacientes lograron autonomía enteral total y la mayoría de los pacientes alcanzaron o mantuvieron respuestas importantes con la teduglutide con las mayores reducciones en la NP en el subgrupo de mayor exposición a teduglutide.
En la primera serie pediátrica argentina tratada con teduglutide41 de 62 niños con síndrome de intestino corto, 5 recibieron teduglutide 0,05 mg/kg/día SC. El aporte de nutrición parenteral se redujo ± 48%, pudiendo suspenderse en 2 (a las semanas 29 y 24 del tratamiento).
Protección de la piel que rodea la fístula/estoma y cuidado de la herida
El aporte de la enfermera especialista en ostomía es fundamental para la protección y cuidado de la piel perifístula y herida23,28. El contenido procedente de la porción proximal del intestino delgado puede causar excoriación cutánea en menos de 3 h36. Los objetivos en el cuidado de la herida y drenaje de la fístula o estoma son: estabilizar y controlar el drenaje, evitar pérdida de la piel y tejidos circundantes, minimizar el dolor y aislamiento social, contribuir al cierre de la herída o fístula35. Las fístulas de gasto moderado pueden manipularse con bolsa de ostomía y protección adecuada de la piel alrededor en forma de anillo adhesivo, pasta, polvo o apósito hidrofílico28,35. La terapia con presión negativa tópica (TPN) es la aplicación de la presión negativa a través de la herida o fístula para ayudar en su cicatrización y estabilizar el drenaje42, el cierre asistido por vacío (VAC) de KCI Medical, San Antonio, Texas, ha mostrado resultados exitosos en algunas series de casos sin constituir nivel I de evidencia42,43.
Anatomía
El mapeo anatómico ayuda a comprender la ubicación y longitud del intestino restante y predecir resultados posoperatorios, incluida la necesidad de nutrición parenteral a largo plazo. Investigaciones radiológicas, como: TC y resonancia magnética (RM), fluoroscopía, estudios de tubo o drenaje y fístulogramas o sinogramas pueden ser necesarios para delimitar el origen, destino y número de fístulas. La evaluación endoscópica a través de un orificio natural, estoma o fístula también puede ser útil como complemento para la planificación preoperatoria y raramente proporcionar terapia con stent o cierre con clip23,28,35. Estos deben realizarse al menos 7 a 10 días después de la reanimación con líquidos y electrólitos, control de infecciones y tratamiento de heridas28.
Plan y cirugía definitiva
Aproximadamente el 30% de los pacientes experimentarán curación de la fístula entre las 4 y 8 semanas después de la provisión de nutrición, control de sepsis y drenaje de la fístula44. Si la curación no ocurre dentro de este período, deben iniciarse los planes para la cirugía definitiva. La reparación quirúrgica definitiva debe retrasarse durante un mínimo de 6 meses desde la última intervención quirúrgica. Dado que las adherencias tempranas tienden a ser más tenaces 10 días a 3 meses después de la laparotomía, la reintervención quirúrgica temprana (<3 meses desde última cirugía abierta) está asociada con altas tasas de mortalidad, morbilidad y riesgos de recurrencia28, realizándose sólo en situaciones que ponen en peligro la vida, entre éstas23,35:
- Drenaje de focos sépticos cuando esto no puede ser logrado por vía percutánea.
- Extirpación de intestino isquémico.
- Abrir cavidades de abscesos de la pared abdominal.
- Construcción de una estoma de derivación proximal en raras circunstancias.
- Falla anastomótica catastrófica no controlada.
En la (figura 2) se muestra un protocolo aplicado al paciente grave con fallo intestinal y la intervención multidisciplinaria según las etapas.
Las unidades dedicadas
Se trata de unidades especializadas en insuficiencia intestinal. Los principales objetivos son: proporcionar un cuidado experto para un soporte IV seguro y cuidado del catéter para minimizar las tasas de BRCVC, mantener un equilibrio de líquidos preciso, cuidados de estomas y heridas, alimentación distal y atención psicológica. Cuentan con enfermeras especializadas y una gama completa de especialistas disponibles: intensivistas, gastroenterólogos, cirujanos, dietistas, farmacéuticos, psicólogos/psiquiatras y radiólogos intervencionistas. Existe evidencia de que en estas unidades se reducen las tasas de complicaciones y la mortalidad hasta en un 50%22.
Conclusiones
Las alteraciones gastrointestinales son frecuentes en el paciente crítico y un determinante en su mortalidad. Reconocer el fallo y disfunción intestinal permite optimizar el tratamiento, reducir la mortalidad e incidencia de complicaciones, las unidades dedicadas con un staff de experiencia en el manejo del FIA constituyen un aspecto clave en este sentido.