Introducción
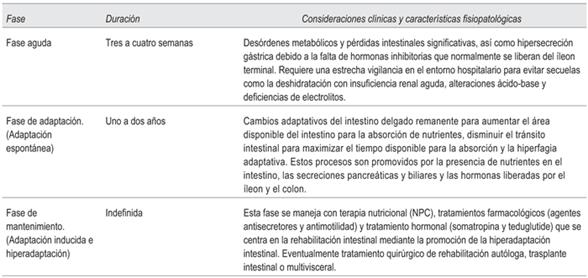
El síndrome del intestino corto severo es una condición rara definida como un intestino delgado remanente con una longitud en continuidad menor de 200 cm. Se caracteriza por la reducción clínicamente significativa de la superficie intestinal capaz de absorber los nutrientes. Es causa importante de falla intestinal crónica o tipo III, donde los cambios estructurales y funcionales favorecen la malabsorción, el riesgo de deficiencias severas de micronutrientes y la inhibición del proceso de desarrollo y crecimiento. La incidencia de síndrome de intestino corto es de aproximadamente 2 casos por millón por año y la prevalencia se sitúa en torno a 20 casos por millón1-4. La falla intestinal crónica se produce cuando fracasa la fase de adaptación del síndrome de intestino corto1. La posibilidad de reversibilidad de la falla intestinal crónica depende de la anatomía (figura 1), fisiopatología del síndrome de intestino corto y de la adaptación intestinal, pero la mayoría de los pacientes requieren terapia de soporte nutricional a largo plazo, generalmente en forma de nutrición parenteral crónica (NPC)1,5. En la (tabla 1) se describen fases fisiopatológicas del síndrome de intestino corto. Anatómicamente, los pacientes con mayor riesgo de falla intestinal crónica y dependencia de NPC son aquellos con una yeyunostomía final y menos de 115 cm de intestino delgado residual funcional; aquellos con anastomosis yeyuno-cólica y menos de 60 cm de intestino delgado residual (ausencia de válvula ileocecal), y aquellos con anastomosis yeyuno-ileal y con menos de 35 cm de intestino delgado residual (pero con presencia de válvula ileocecal y colon). Si bien los pacientes sobreviven, las complicaciones asociadas con la NPC y la falla intestinal crónica son múltiples y graves. Estas incluyen las asociadas con el catéter venoso central (CVC) utilizado para administrar la NPC, la enfermedad hepática asociada a NP y falla intestinal crónica (EHNPFI), las alteraciones óseas y metabólicas, así como el impacto en la calidad de vida6. El tratamiento de soporte del síndrome de intestino corto se caracteriza por modificaciones en la dieta y terapia farmacológica que se basan en la anatomía y fisiología del remanente intestinal. Estos habitualmente no evitan la NPC. En Europa, se estima que la prevalencia de NP domiciliaria (NPD) para falla intestinal crónica oscila entre 5 y 80 por millón de habitantes, con una incidencia que varía entre 7,7 y 15 pacientes con falla intestinal crónica dependiente de NPC/millón de habitantes/año3,6) .
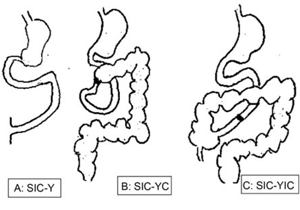
Figura 1: Tipos de intestino corto según la anatomía del intestino remanente.Grupo A. SIC-Y: síndrome de intestino corto con yeyunostomía o ileostomía final sin colon en continuidad. Grupo B. SIC-YC: síndrome de intestino corto con anastomosis yeyuno cólica sin válvula ileocecal y una parte del colon en continuidad. Grupo C. SIC-YIC: síndrome de intestino corto con anastomosis yeyunoileal con la válvula ileocecal y el colon en continuidad.
Las opciones quirúrgicas para el síndrome de intestino corto con falla intestinal crónica, incluido el trasplante intestinal, están disponibles en algunos centros, pero tienen importantes limitaciones7-9.
Las nuevas terapias hormonales dirigidas a la adaptación intestinal que se centran en la rehabilitación intestinal mediante la promoción de la hiperadaptación intestinal son prometedoras, en este sentido, el análogo del péptido similar al glucagón -2 (GLP-2) es actualmente el tratamiento de referencia1.
Caso clínico
Presentamos el caso de un paciente de sexo masculino de 23 años, estudiante universitario, que a los 6 años (31/8/2002) presentó un infarto intestino mesentérico extenso, requiriendo una enterectomía masiva, quedando como remanente intestinal aproximadamente 10 cm (7 cm de yeyuno y 3 cm de íleon con válvula ileocecal preservada). Se realizó el diagnóstico anatomopatológico de panarteritis nodosa, y se completó el tratamiento con glucocorticoides, ciclofosfamida y gammaglobulina.
Con diagnóstico de síndrome de intestino corto anatómico (con reducción significativa de la masa enterocitaria funcionante), requirió internación prolongada en terapia intensiva y múltiples reintervenciones quirúrgicas por peritonitis secundaria hasta la reconstrucción del tránsito digestivo. Luego de ésta, presentó como complicación malabsorción intestinal (alta tasa de diarrea persistente y alteraciones en el crecimiento ponderal), a pesar de la implementación de medidas convencionales de tratamiento (cambios en la dieta oral y enteral, fármacos antisecretores y antimotilidad). Con planteo de falla intestinal tipo II (fase aguda del síndrome de intestino corto), a los 18 días de la primera intervención se colocó catéter venoso central (CVC) para nutrición parenteral total (NPT), se mantuvo nutrición enteral trófica.
Recibió NPC de forma ininterrumpida hasta la actualidad. A los tres años de evolución logró reducción progresiva de las horas diarias de NP y en 2006 se logró el primer día por semana sin NP; evolucionando en los meses siguientes a una falla intestinal tipo III (crónica con dependencia de la NP por síndrome de intestino corto).
Como complicaciones vinculadas a su enfermedad de base y asociadas con la NPC y la falla intestinal tipo III, presentó: a menos de un año del evento (2003) una colecistitis alitiásica, siendo colecistectomizado en esa oportunidad. En 2003, instaló convulsiones tónico-clónicas generalizadas con compromiso encefálico severo que revirtió completamente con ciclofosfamida, gammaglobulina y metilprednisolona. En 2004, presentó hemorragia digestiva alta secundaria a gastritis erosiva por estrés con compromiso hematimétrico y hemodinámico. Entre 2007 y 2009 desarrolló nefrocalcinosis, requiriendo litotricia extracorpórea. Desde los primeros meses, luego del inicio de la NP, desarrolló elementos de enfermedad hepática asociada con NPC y falla intestinal (EHNPFI), entidad que mantiene hasta la actualidad. Presenta punciones biopsias de hígado que confirman el diagnóstico anatomopatológico de EHNPFI, informándose el 7/7/2015 y el 23/2/2017: cambios inflamatorios portales y lobulillares, esteatosis macrovacuolar leve, focos de balonización hepatocitaria y fibrosis portal moderada (METAVIR 2). Se realizaron ajustes en la composición de la NPC y desde 2012 recibe emulsiones lipídicas de alternativa.
Entre 2010 y 2013, el paciente recibió tratamiento con somatotropina. Actualmente continúa en seguimiento por nefrólogo debido a la presencia de hiperoxaluria.
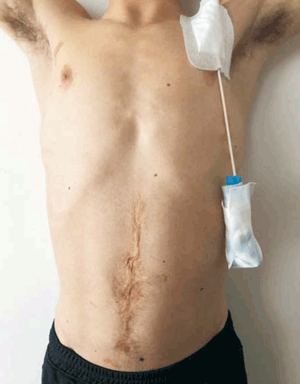
Desde 2017, recibe NPC domiciliaria nocturna con una fórmula nutricionalmente completa con emulsiones lipídicas de alternativa ahorradoras de lípidos omega 6, ricas en omega 3, oligoelementos y vitaminas; se administra en forma cíclica, en infusión de 12 horas diarias, cuatro veces a la semana, por CVC de larga duración. El aporte nutricional semanal actual por vía parenteral es de 5.800 a 6.000 kcal, la dieta oral hipercalórica tolerada es mínima, su peso y talla actuales son 58 k y 176 cm. A pesar del tratamiento recibido y del soporte nutricional prolongado con NP, no ha logrado autonomía intestinal e independencia de la NPC, siendo actualmente una terapia de soporte vital (figura 2).
Durante toda su infancia y adolescencia requirió seguimiento estricto por profesionales especializados en nutrición clínica tanto nacionales (de pediatría y adultos) como internacionales; el tratamiento generó importantes limitaciones en múltiples actividades, con impacto en su calidad de vida.
Discusión y comentarios
La longitud normal del intestino delgado en un adulto, a partir de la flexión duodenoyeyunal, es de 275 a 850 centímetros, a través de los cuales pasan diariamente aproximadamente 9 litros de fluidos (fluidos orales, saliva, secreciones gástricas, biliares y pancreáticas). Entre el 70% y 80% de ese líquido se absorbe en el intestino delgado y 2 litros en el intestino grueso. El intestino grueso y sano absorbe aproximadamente 150 kilocalorías por día, pero puede absorber hasta 1.000 kilocalorías por día en aquellos pacientes con malabsorción. La absorción de la mayoría de los nutrientes ocurre en los primeros 100 centímetros del yeyuno, sin embargo, la vitamina B12 y las sales biliares se absorben en los últimos 100 centímetros del íleon; mientras que el magnesio se absorbe en el íleon terminal y el colon proximal y la absorción de agua y sodio ocurre en todo el intestino10,11. La resección yeyunal limitada suele ser mejor tolerada, ya que la absorción de sales biliares y vitamina B 12 se mantiene normal. La resección ileal se tolera peor, dadas las consecuencias de la pérdida de sales biliares y la limitada capacidad del yeyuno para la hiperplasia adaptativa10-12. El síndrome de intestino corto en adultos se define con menos de 180 a 200 centímetros de intestino delgado remanente, lo que lleva a la necesidad de reposición nutricional y de fluidos6,11. Alrededor del 75% de los casos de síndrome de intestino corto se desarrollan después de una resección única y masiva del intestino, como es el caso que presentamos; mientras que el 25% restante ocurre después de múltiples resecciones6,11. En la (tabla 2) se muestran las causas más frecuentes del síndrome de intestino corto en adultos.
Dos tercios de los pacientes que desarrollan este síndrome sobreviven a su hospitalización inicial, y un número similar sobrevive al primer año luego de desarrollar esta rara entidad. La edad y la enfermedad subyacente muchas veces determinan el resultado a largo plazo de un paciente con síndrome de intestino corto y falla intestinal crónica6,11. La consecuencia del síndrome de intestino corto es la malabsorción, y este es el principal mecanismo fisiopatológico de la falla intestinal secundaria, debido a la pérdida de la superficie de absorción y al tránsito intestinal acelerado; sin embargo, son múltiples los factores que determinan la gravedad de la malabsorción en el síndrome de intestino corto6,11. Cuanto mayor es la longitud del intestino delgado que se extrae o se vuelve no funcional, mayor es el área de superficie de absorción perdida. Los criterios fisiopatológicos también pueden subdividirse en categorías donde el colon está en continuidad y aquellos donde no lo está. Estos subgrupos se diferencian en tres características claves: absorción intestinal de agua y sodio, secreción de hormonas gastrointestinales y absorción de energía a partir de ácidos grasos de cadena corta (AgCC) producidos por el microbiota del colon. Los pacientes sin colon en continuidad a menudo pierden más líquido y sodio que los ingeridos (secretores netos), mientras que al igual que nuestro paciente, los que preservan el colon por lo general tienen suficiente intestino distal para permitir el equilibrio hidroelectrolítico (absorbentes netos) y favorecer la adaptación6,11. Sin embargo, en algunos pacientes la falla intestinal crónica es irreversible y requieren NPC domiciliaria para mantenerse con vida o un trasplante intestinal o multivisceral (hepato-intestinal) si en la evolución aparecen complicaciones potencialmente mortales que surgen como resultado directo de la falla intestinal crónica o secundariamente a la NPC (tabla 3).
Tabla 3: Complicaciones asociadas con el síndrome de intestino corto, la falla intestinal tipo III y la nutrición parenteral crónica.

Las principales complicaciones de la malabsorción son la desnutrición, la pérdida de peso, la esteatorrea, la diarrea y las deficiencias de vitaminas. Otras complicaciones incluyen nefrolitiasis debida a hiperoxaluria, colelitiasis, hipersecreción gástrica transitoria, crecimiento excesivo de bacterias, deshidratación, hiponatremia, hipopotasemia, insuficiencia renal, colestasis secundaria a enfermedad hepática asociada a falla intestinal crónica y acidosis d-láctica6,11. En adultos y niños mayores la esteatosis es más frecuente, mientras que en los niños la colestasis y la progresión rápida a fibrosis hepática es la evolución más común6,11. Hasta el 60% de las muertes en pacientes con NP domiciliaria son secundarias a EHNPFI6,11. Nuestro paciente exhibe hallazgos histopatológicos compatibles que incluyen colestasis, esteatosis, esteatohepatitis, ductopenia y fibrosis perivenular y portal.
La falla intestinal crónica es una enfermedad debilitante con un efecto negativo importante en la vida del paciente y su familia16; es una condición médica compleja que se asocia con altos costos, sobre todo vinculados a la NPD a largo plazo, estos se ven agravados por las admisiones frecuentes secundarias a las complicaciones asociadas. Se desconoce cuáles son las subdivisiones de costos específicos y cómo evolucionan con el tiempo17.
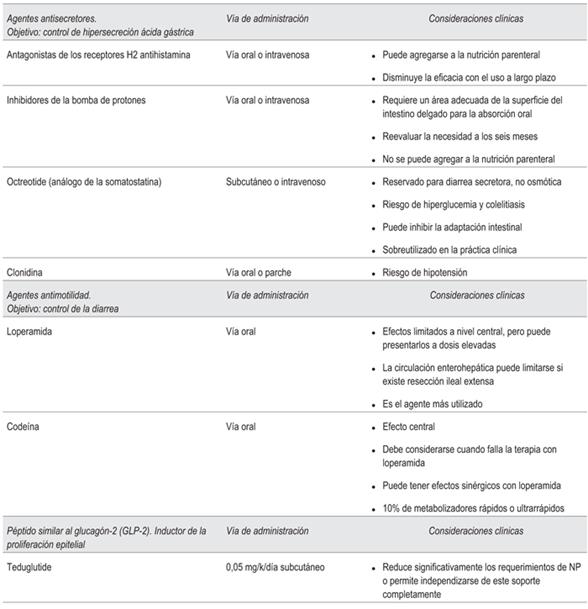
El manejo inicial del síndrome de intestino corto implica mantener un buen estado nutricional y maximizar la superficie de absorción del intestino remanente, para lo cual es necesario NP posoperatoria temprana, así como nutrición enteral tan pronto como sea posible6,13. Esto promueve la adaptación intestinal que mejora la absorción de nutrientes con el tiempo. La EHNPFI y la colestasis hepática se tratan manteniendo cierta alimentación oral o enteral, tratando en forma oportuna las complicaciones infecciosas, optimizando la NP en el hogar, disminuyendo la dependencia de las emulsiones de lípidos a base de soja y cambiándolas a emulsiones a base de aceite de pescado. Los pacientes con síndrome de intestino corto (más frecuentemente aquellos con menos de 180 cm de intestino delgado o una válvula ileocecal ausente) tienen un riesgo aumentado de desarrollar cálculos biliares, habitualmente compuestos de bilirrubinato de calcio; estos pueden prevenirse o revertirse manteniendo la nutrición enteral, limitando los períodos de ayuno oral y restringiendo el uso de opioides y anticolinérgicos10,11,14. Un objetivo primordial cuando se trata a un paciente con falla intestinal crónica por síndrome de intestino corto que requiere NPC es reducir o, cuando sea posible, eliminar su uso. Los medicamentos más utilizados, en particular durante el período de mayor adaptación intestinal, son los antisecretores y los fármacos antimotilidad, necesarios para controlar la hipersecreción gástrica (que se produce de 6 a 12 meses después de la resección de más del 50% del intestino delgado) y la diarrea de alto débito, existiendo escasa evidencia que respalde su uso6,15(tabla 4). Los inhibidores de la bomba de protones en dosis completas pueden reducir las pérdidas de líquido intestinal al disminuir la secreción gástrica. La loperamida y el fosfato de codeína retardan el tránsito intestinal de forma segura6. El octreotide disminuye la secreción y la motilidad gastrointestinal y puede ser útil en algunos pacientes por corto tiempo13.
Tanto la anatomía del circuito intestinal remanente del caso que presentamos así como su longitud y tiempo de evolución hacen actualmente improbable la rehabilitación intestinal completa con el tratamiento presente, dado que mientras la mitad de los adultos con síndrome de intestino corto y falla intestinal tipo III pueden independizarse completamente de la NPC dentro de los cinco años posteriores al diagnóstico, menos del 6% abandonarán la NP utilizando métodos convencionales si no se logra la independencia en los primeros dos años posteriores a la resección18-20. La reconstrucción gastrointestinal autóloga incluye varias técnicas que manipulan el intestino quirúrgicamente para facilitar el proceso de adaptación intestinal y la restauración de la nutrición enteral. En última instancia, el trasplante intestinal puede servir como la última opción para la cura de la falla intestinal cuando se aplica selectivamente21.
Dos factores de crecimiento intestinal (somatropina y teduglutide) están disponibles para su uso en pacientes con síndrome de intestino corto que no pudieron independizarse de la NPC luego del período de máxima adaptación intestinal22; nuestro paciente recibió somatotropina. El objetivo de estos tratamientos es reducir la dependencia a largo plazo del soporte parenteral favoreciendo la hiperadaptación del intestino remanente( 22,23).
Recientemente, el liraglutide (un análogo de GLP-1) se administró por vía subcutánea una vez al día a ocho pacientes con yeyunostomía terminal en el contexto de un estudio piloto de ocho semanas24; se demostró reducción del debito de la ostomía, mejoría en la absorción intestinal y producción de diuresis, con escasos y transitorios efectos adversos gastrointestinales leves. Ninguno de estos eventos llevó a la interrupción del tratamiento con liraglutide.
Numerosos trabajos han evaluado recientemente el efecto de otro análogo de GLP-2, en este sentido, un estudio piloto abierto de fase II evaluó por primera vez en 2005 la seguridad y el efecto de teduglutide en pacientes con síndrome de intestino corto25. El fármaco aumentó significativamente la absorción de masa húmeda absoluta y relativa y disminuyó la masa húmeda fecal y la excreción de energía. También aumentó la altura de las vellosidades, la profundidad de la cripta y el índice mitótico en pacientes con síndrome de intestino corto con yeyunostomía final, cambios que desaparecieron al interrumpir el tratamiento. La aprobación de teduglutide se basó en los resultados de un estudio multicéntrico internacional, en fase III de 24 semanas, doble ciego, controlado con placebo (STEPS-2)25. Pacientes con falla intestinal por síndrome de intestino corto dependientes de NP > 3 veces/semana durante > 12 meses recibieron 0,05 mg/kg de teduglutide (n = 43) o placebo (n = 43) una vez al día26. El número de respondedores fue significativamente mayor en el grupo de teduglutide (27/43, 63%) respecto al grupo placebo (13/43, 30%, p= 0,002). La reducción media en el volumen de NPC fue de 4,4 ± 3,8 litros por semana en el grupo de teduglutide vs 2,3 ± 2,7 litros por semana en el grupo placebo (p <0,001). Estos hallazgos fueron confirmados por estudios de seguimiento27. Según un estudio post hoc que analizó los factores relacionados con la respuesta a teduglutide28, los efectos del fármaco en el volumen absoluto de NPC fueron significativamente mayores en los pacientes con yeyunostomía/ileostomía terminal (reducción de 919 ± 644 ml/d) no solo en comparación con los pacientes que recibieron placebo (reducción de 340 ± 436 ml/d; p = 0,0112), sino también en comparación con los pacientes tratados con teduglutide con > 50% de colon en continuidad sin estoma, como el caso del paciente que presentamos (reducción de 355 ± 306 ml/d; p = 0,0066). En pacientes tratados con otras anatomías u otras características de la enfermedad (con enfermedad intestinal inflamatoria, enfermedades vasculares mesentéricas u otras afecciones) el efecto fue intermedio28. Los eventos adversos informados fueron los mismos en todos los estudios, en su mayoría vinculados al tracto gastrointestinal (náuseas, vómitos, dolor abdominal) o urinario (infecciones)29-31.
Rahim Naimi y colaboradores publicaron los primeros datos sobre un nuevo análogo de GLP-2, el glepaglutide, que tiene una vida media de aproximadamente 50 horas. Luego de tres semanas de administración subcutánea diaria los niveles de citrulina (marcador para la masa total enterocitaria) aumentaron en los grupos de intervención y se determinó un vaciamiento gástrico más lento. La producción fecal se redujo significativamente en los grupos de dosis de 1 mg y 10 mg diarios de glepaglutide32. En la actualidad un estudio controlado con placebo, multicéntrico, fase 3 (NCT03690206; EASE SBS 1), que evalúa las administraciones una y dos veces por semana, está en curso.
Conclusiones
Hemos presentado el caso de un paciente adulto joven portador de un síndrome de intestino corto con el tracto gastrointestinal reconstruido con anatomía tipo grupo C (anastomosis yeyuno-cólica con válvula ileocecal y el colon en continuidad) que es portador de una falla intestinal tipo III que no ha logrado independencia de la NP, siendo actualmente necesaria la NPC para mantenerse con vida. Ha presentado una evolución excepcional en nuestro medio por el debut, por su patología de base y por su larga evolución, en la que el enfoque multidisciplinario y el empoderamiento familiar siguen siendo necesarios y resultan esenciales para su supervivencia.
En este paciente en particular, con 17 años de NP y complicaciones graves asociadas a esta técnica de soporte vital, es obligatorio cambiar la perspectiva del tratamiento y dirigirlo a evitar la falla hepática y la muerte. En el mejor de los escenarios, evitar el trasplante combinado (hepato intestinal), procedimiento que no se encuentra disponible en nuestro país. Si bien se esperan resultados adicionales de seguridad a largo plazo, los datos disponibles sugieren que el teduglutide podría resultar esencial, parece ser seguro y efectivo, se ha demostrado que recupera la absorción intestinal y reduce significativamente la dependencia de la NPC, logrando incluso la independencia en algunos casos, mejorando en forma relevante la calidad de vida de pacientes con falla intestinal crónica que dependen de la NPC para sobrevivir.