Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Revista Médica del Uruguay
versão On-line ISSN 1688-0390
Rev. Méd. Urug. vol.31 no.2 Montevideo jun. 2015
Benzodiazepinas y fractura de cadera: estudio de casos y controles
Dres. Álvaro Danza*, Marcos Rodríguez Branco†, Maynés López Pampín‡, Diego Agorio§, Alfonso Caleri§, Inés Patiño§, Practicante Mariela Casal¶, Dra. Lilián Díaz**
Resumen
Introducción: las benzodiazepinas (BZD) son medicamentos ampliamente usados en la práctica clínica. Son eficaces en el tratamiento sintomático de ansiedad, insomnio a corto plazo, crisis epilépticas, síndrome de abstinencia alcohólica e inducción anestésica. En ancianos pueden tener efectos adversos como incoordinación motora y debilidad muscular que llevan a caídas, aumentando el riesgo de fractura de cadera.
Objetivo: determinar si existe asociación entre el consumo de BZD y el riesgo de fractura de cadera.
Material y método: se diseñó un estudio de casos y controles (1:2) durante seis meses (tres meses en 2013 y tres meses en 2014). Se definió “caso” a los pacientes con fractura traumática de cadera. Se definió “control” a pacientes de igual sexo y edad (± 5 años) que hubieran ingresado en la misma semana por una causa diferente (médica o quirúrgica). Se relevaron datos demográficos y consumo de medicamentos potencialmente involucrados en fracturas de cadera. Se consideró consumo de BZD, haberlas recibido durante cinco días previos a la fractura. Se calcularon odds ratios (OR) e intervalo de confianza 95%.
Resultados: se obtuvieron 29 casos y 60 controles. La media de edad (DE) en el grupo casos fue de 82,8 (6,4) años y 82,1 (5,2) años en el grupo control (p > 0,05). Sexo femenino: 25 (86%) en el grupo casos y 49 (82%) en el grupo control (p > 0,05). Las BZD fueron consumidas por 16/29 (61,5%) casos y 13/60 (21,7%) controles (p < 0,05). Todos los pacientes que consumían BZD en ambos grupos lo hicieron por más de seis semanas. El OR de fractura de cadera en pacientes que consumían BZD fue de 4,5 (IC 95% 1,7-11,6).
Conclusiones: se destaca que las BZD aumentan el riesgo de fractura de cadera y que se consumen por períodos no aconsejables. Deben desarrollarse políticas nacionales orientadas al uso racional de estos medicamentos.
Palabras clave: Benzodiazepinas; Fracturas de cadera
Key words: Benzodiazepines; Hip fractures
* Profesor Adjunto de Clínica Médica. Hospital Pasteur. Administración de los Servicios de Salud del Estado (ASSE). Facultad de Medicina, Universidad de la República. Ex Asistente del Departamento de Farmacología y Terapéutica. Facultad de Medicina, Universidad de la República. Departamento de Medicina Interna de Médica Uruguaya Corporación de Asistencia Médica (MUCAM). Uruguay.
† Residente de Traumatología y Ortopedia del Instituto Nacional de Ortopedia y Traumatología. Administración de los Servicios de Salud del Estado (ASSE). Facultad de Medicina, Universidad de la República. Asistente de Traumatología de Médica Uruguaya Corporación de Asistencia Médica (MUCAM). Uruguay.
‡ Profesora Adjunta del Departamento de Farmacología y Terapéutica. Ex Asistente de Clínica Médica. Facultad de Medicina, Universidad de la República. Uruguay.§ Ayudante del Departamento de Medicina de Médica Uruguaya Corporación de Asistencia Médica (MUCAM). Uruguay.
¶ Practicante del Departamento de Medicina de Médica Uruguaya Corporación de Asistencia Médica (MUCAM). Uruguay.
** Profesora Directora de la Cátedra de Hematología. Hospital de Clínicas. Facultad de Medicina, Universidad de la República. Jefe del Departamento de Medicina Interna de Médica Uruguaya Corporación de Asistencia Médica (MUCAM). Uruguay.
Correspondencia: Dr. Álvaro Danza. Almirón 5082 (Montevideo).
Correo electrónico: alvarodanza@gmail.com
Conflictos de interés: los autores no tienen conflictos de interés para declarar.
Recibido: 9/2/15 Aceptado: 28/4/15
Introducción
Las benzodiazepinas (BZD) son medicamentos ampliamente usados en la práctica clínica. Su eficacia ha sido demostrada en el tratamiento sintomático de la ansiedad y el insomnio a corto plazo y también en el tratamiento de crisis epilépticas, síndrome de abstinencia alcohólica y en la inducción anestésica(1). Desde la década de 1960, sustituyeron a los barbitúricos por presentar un perfil de eficacia y seguridad más favorable. Este hecho ha contribuido a un uso más extendido, constituyendo actualmente el grupo de psicofármacos más prescripto(2).
Se estima que 10% de la población general consume BZD y que esta proporción se incrementa al considerar a las personas mayores de 60 años o a los pacientes institucionalizados(3). En Uruguay, según la quinta encuesta de la Junta Nacional de Drogas, el 20,6% de la población analizada consumió alguna vez cierto “tranquilizante o hipnótico”(4). Otro estudio, realizado en una policlínica comunitaria de Montevideo en 1998, evidenció que 75% de la población encuestada (adultos mayores de 65 años) utilizó psicofármacos en el último año, de los cuales 92% correspondieron a BZD(5).
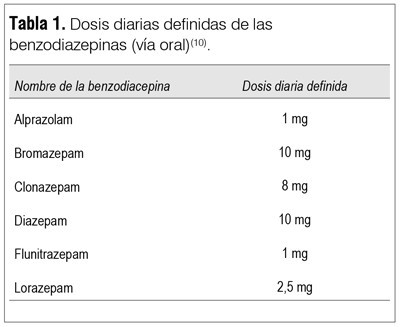
En el mismo sentido, varios trabajos nacionales e internacionales han observado que hipnóticos y sedantes se consume por períodos prolongados, que se utilizan BZD en combinación y que la automedicación es un hecho frecuente, lo cual es discordante con las recomendaciones internacionales(6-9). Datos recientes del Departamento de Farmacología y Terapéutica de la Facultad de Medicina de la Universidad de la República, donde se recabó el consumo de BZD en el 62% de la población del Uruguay entre 2010 y 2012, mostró una dosis diaria definida (DDD) por cada 1.000 habitantes y día (DHD) de 110 DHD. Esto debe interpretarse como si cada día, en cada año considerado, un promedio de 110 de cada 1.000 habitantes han recibido una DDD de BZD (ver tabla 1)(10). Se observó un predominio del consumo de alprazolam, flunitrazepam, clonazepam y diazepam*.
* Datos presentados en forma oral en las 2as Jornadas de Novedades Farmacoterapéuticas, realizadas entre el 3 y 6 de noviembre de 2014, organizadas por el Departamento de Farmacología y Terapéutica, Facultad de Medicina, Universidad de la República.
Todos estos datos ubican a Uruguay en un nivel de consumo preocupante y exigen el desarrollo de políticas tendientes a promover un uso racional de las BZD.
Los efectos adversos más frecuentes de las BZD son dependientes de la dosis y también varían de acuerdo a la potencia, propiedades farmacocinéticas de cada BZD considerada y en función de la duración del tratamiento. Se describen con frecuencia: sedación, somnolencia, debilidad muscular, ataxia, incoordinación motora, deterioro cognitivo y alteraciones de la memoria. El uso de BZD determina tolerancia y dependencia, por lo que es frecuente la aparición de síntomas de discontinuación(1,2).
Las BZD se han asociado con caídas en los ancianos. Este efecto puede deberse a varios factores mencionados, como debilidad muscular, incoordinación motora, retraso en la respuesta a los estímulos o alteraciones en la atención que estos medicamentos determinan(2).
Además, la edad constituye un factor determinante de la respuesta farmacológica. Con el envejecimiento suceden cambios graduales en la farmacocinética y efectos de los medicamentos, con lo cual aumenta la variabilidad interindividual de la respuesta terapéutica. Existen modificaciones en la distribución de los fármacos por disminución de la masa magra corporal, de la albúmina y del agua corporal total así como por el aumento relativo del tejido adiposo. También disminuye la eliminación de los fármacos por descenso del filtrado glomerular y disminución de la función de las enzimas oxidativas del citocromo P450(11).
Los cambios en la farmacodinamia también son factores importantes a considerar en el tratamiento de los ancianos. Los fármacos que deprimen el sistema nervioso central determinan efectos más intensos y mayor frecuencia de efectos paradójicos. Además, los ancianos tienen más enfermedades crónicas y reciben más fármacos, lo que aumenta la posibilidad de interacciones farmacológicas(11).
La fractura de cadera es un problema mayor de salud pública, afectando principalmente a las personas más añosas, asociándose a una elevada morbimortalidad. Se describe hasta 20% de mortalidad en el año posterior a la fractura y se estima que solo un 30% de las personas mayores de 65 años recuperan su nivel previo de movilidad(12,13). Esto es particularmente relevante considerando que en Uruguay la población mayor de 65 años constituye aproximadamente el 13% de toda la población(14).
La asociación del consumo de BZD con las fracturas ha sido controversial y analizada en varios estudios clínicos. Se ha establecido que en la población mayor de 65 años se puede comportar como un factor de riesgo de fractura de cadera. Sin embargo, a los efectos sanitarios, se ha enfatizado en que debe profundizarse en el análisis de esta posible asociación(15).
Específicamente, en nuestro medio no se dispone de estudios que evalúen la relación entre el consumo de BZD y las fracturas de cadera. El objetivo de este trabajo es determinar si existe asociación entre el consumo de BZD y el riesgo de fractura de cadera. De este modo se podrá contribuir a establecer estrategias para mejorar el uso de las BZD, disminuir la frecuencia de efectos adversos y prevenir el desarrollo de una complicación que es en sí misma un problema de salud pública, como lo es la fractura de cadera.
Material y método
Se diseñó un estudio observacional y analítico de tipo casos y controles. Por cada caso se obtuvieron dos controles.
No se obtuvo un dato válido sobre la frecuencia de la fractura traumática de cadera en Uruguay, por lo que debió optarse por un muestreo por conveniencia.
Durante un período de seis meses, tres meses en el 2013 y tres meses en el 2014, se relevaron pacientes que ingresaran por fractura traumática de cadera.
Se consideraron “casos” a todos los pacientes ingresados en el período del estudio por fractura traumática de cadera, definido de acuerdo a la confirmación radiológica y al diagnóstico realizado por un traumatólogo.
Por cada caso se obtuvieron dos “controles” de igual sexo y edad (± 5 años) que hubieran ingresado en la misma semana por una causa diferente (médica o quirúrgica).
A todos los pacientes se les practicó una encuesta idéntica relevando datos demográficos (sexo, edad, procedencia), comorbilidades y los medicamentos que consumían, específicamente aquellos que podrían tener relación con las caídas: BZD, hipnóticos no BZD (“fármacos Z”), antihipertensivos, relajantes musculares, antipsicóticos o antiparkinsonianos, vasodilatadores cerebrales.
Se entendió que un paciente había consumido BZD en caso de recibir una dosis durante al menos cinco días consecutivos previos a la fractura. En caso de identificarse BZD, se identificó el tiempo de consumo estimado por el paciente o familiar (de forma dicotómica, mayor o menor a seis semanas).
Las BZD fueron clasificadas en función de su vida media: corta o intermedia (alprazolam, bromazepam, lorazepam, midazolam y oxacepam) y prolongada (clobazam, clonazepam, diazepam, flunitrazepam)(2). Quienes relevaron los datos fueron entrenados para evitar sesgos y errores en el llenado de los formularios.
El estudio se desarrolló en una institución de asistencia médica colectiva que cuenta con 300.000 afiliados entre adultos y niños. Para la realización del estudio se obtuvo autorización de las autoridades institucionales y el consentimiento de todos los pacientes encuestados. Se contemplaron los principios éticos para la investigación médica en seres humanos, enunciados en la Declaración de Helsinki de la Asociación Médica Mundial(16).
Se presentan variables demográficas (sexo y edad), comorbilidades, BZD y otros medicamentos consumidos relevados. Las variables cualitativas se presentan con proporciones y las cuantitativas se resumen con media y desvío estándar (DE). La asociación entre las variables se analizó mediante el test de chi cuadrado, aplicando la corrección de Fischer en caso de ser necesario. Se utilizó un modelo de regresión logística para identificar factores asociados independientemente con fractura de cadera, de modo de evitar el impacto de posibles variables de confusión. Se presentan los odds ratios (OR) con su correspondiente intervalo de confianza 95%. Se consideró estadísticamente significativo una p < 0,05. Los datos fueron procesados con el programa estadístico SPSS versión 2.1.
Resultados
Se obtuvieron 29 casos y 60 controles. Edad, sexo y comorbilidades más significativas de cada grupo se presentan en la tabla 2. Los medicamentos relevados consumidos por los pacientes encuestados fueron: BZD 16/29 (61,5%) casos y 13/60 (21,7%) controles (p < 0,05); antihipertensivos 6/29 casos (20,7%) y 32/60 controles (53,3 %) (p < 0,05); vasodilatadores cerebrales 0/29 (0%) casos y 3/60 (5%) casos (p = NS). En estos grupos no se constató consumo de “fármacos Z”, relajantes musculares, antipsicóticos ni antiparkinsonianos. El 100% de los pacientes que consumían BZD en ambos grupos lo hizo por períodos superiores a las seis semanas. Dentro de las BZD consumidas en el grupo casos, 7/16 (43,75%) fueron de vida media prolongada y 9/16 (56,25%) de vida media corta o intermedia; en el grupo control, 5/13 (38,5%) fueron de vida media prolongada, intermedia o corta 7/13 (53,8%) y 1/13 (7,7%) consumían dos BZD.
El OR de fractura de cadera en pacientes que consumían BZD fue de 4,5 (IC 95% 1,7 - 11,6). Al discriminar por sexo, en pacientes de sexo masculino el OR fue de 1,44 (IC 95% 1,0 - 2,1) y en pacientes de sexo femenino el OR fue de 6,1 (IC 95% 2,1 - 17,6).
En el modelo de regresión logística, al ajustar por consumo de antihipertensivos la relación entre consumo de BZD y fractura de cadera se mantuvo significativa, OR = 3 (IC 95% 1,0 - 9,5). De igual modo, la relación se mantuvo significativa al considerar BZD de vida media corta o intermedia (OR = 4,7 IC 95%: 1,6 - 15,2) y las de vida media prolongada (OR = 4,3 IC 95% 1,2 - 15,3) (tabla 3).
Discusión
Este estudio sugiere una asociación entre el consumo de BZD y la presencia de fractura traumática de cadera. Los pacientes que consumen BZD tienen más del doble de riesgo de presentarla que quienes no las consumen, riesgo que es clínica, estadística y socialmente significativo. Esto es particularmente significativo en pacientes de sexo femenino donde el riesgo es seis veces mayor que en los pacientes de sexo masculino. En estos últimos, el OR fue de 1,44 y el intervalo de confianza no alcanza la significación estadística. Sin embargo, es necesario tener en cuenta que el número de pacientes de sexo masculino en el grupo “casos” fue pequeño, tan solo cuatro, lo que posiblemente influyera para no encontrar diferencias estadísticamente significativas.
Sin perjuicio de lo anterior, el OR global de 4,5 es especialmente relevante en pacientes añosos, como los incluidos en nuestro estudio –con una media de edad superior a los 80 años–, los que constituyen per se una población de riesgo para fractura traumática de cadera y eventos adversos de los medicamentos.
En el mismo sentido se verifica una asociación estadísticamente significativa al considerar las BZD de vida media corta o intermedia y prolongada. Se destaca un consumo por períodos prolongados, mayor a seis semanas, hecho opuesto a las recomendaciones internacionales en relación al uso racional de las BZD. Es bien conocido que las BZD de vida media corta o intermedia y mayor potencia –típicamente alprazolam, lorazepam– son las que provocan mayor dependencia y tolerancia y, en consecuencia, son las más difíciles de retirar luego de un consumo prolongado por períodos inadecuados(2).
El uso de BZD a largo plazo no se recomienda puesto que no son eficaces, e incluso en algunas de sus indicaciones, como el trastorno de pánico, pueden empeorarlo y aumentar el riesgo de efectos adversos, por lo que solo deberían utilizarse por períodos cortos. Las indicaciones terapéuticas aprobadas por las principales agencias reguladoras de medicamentos para las BZD tienen una duración variable, de acuerdo a la BZD y la indicación, no superando en cualquier caso las 8 a 12 semanas(17-19).
La relación entre fractura de cadera e hipnóticos y sedantes viene siendo estudiada por varios autores. Nuestras observaciones son comparables con las de otros autores que también se han preocupado por esta asociación. En un estudio observacional que incluyó a casi 40.000 pacientes con fractura de cadera se observó que el riesgo de fractura era mayor entre los pacientes expuestos a ansiolíticos e hipnóticos (BZD, “fármacos Z”), RR 1,4 ( IC 95% 1,4-1,5)(20).
Por su parte, en otro estudio descriptivo en el que se comparó 217 pacientes mayores de 65 años con fractura de cadera y 1.214 controles, se encontró una asociación entre el uso de BZD y el riesgo de fractura de cadera, OR 1,7 (IC 95% 1,2-2,5)(21). En una serie de casos de 223 pacientes con fractura de cadera, con una media de edad de 80 años, se detectó BZD en sangre u orina en el 37% de los pacientes y esta frecuencia era mayor al 50% en los pacientes institucionalizados(22).
Nuestros resultados en relación con el riesgo aumentado de fractura de cadera en pacientes que emplean BZD, independientemente de la vida media considerada, también son concordantes con otras observaciones. En un trabajo que evaluó factores de riesgo para fractura de cadera en 192 mujeres mayores de 65 años, el uso de BZD de vida media prolongada se asoció con un aumento del riesgo de fractura de cadera, con un RR 1,6 (IC 95% 1,1-2,4)(23). Otro estudio, conducido por el Grupo Italiano de Farmacovigilancia en el Anciano (GIFA) mostró que las BZD de vida media corta e intermedia incrementaban el riesgo de fractura de cadera, OR 1,8 (IC 95% 1,2-2,8)(24).
El trabajo tiene algunas limitaciones. Dentro de ellas se destaca no haber contado con datos fiables nacionales que permitieran hacer un muestro estadísticamente más representativo de la realidad de nuestro país, lo que obligó a realizar un muestreo por conveniencia. En segundo lugar, la observación de un mayor consumo de medicación antihipertensiva en el grupo control constituye un factor de confusión que fue mitigado con el análisis de regresión logística. Además, carecería de plausibilidad biológica plantear que los medicamentos antihipertensivos pudieran tener un efecto “protector”(25). Dentro de las fortalezas se destaca la observación prospectiva en un período de seis meses en dos años consecutivos y el haber logrado obtener dos controles por cada caso incluido. Por último, las publicaciones basadas en registros procedentes de grandes bases de datos son sumamente útiles, pero deben ser complementadas con investigaciones clínicas realizadas en el lugar donde están los pacientes. De igual modo, los datos internacionales deben ser contrastados con datos obtenidos en nuestro medio, con nuestra población, como los que se presentan.
En línea con lo anterior, estos datos, junto con otros que se están generando en nuestro medio, deben conducir a establecer una pauta de alcance nacional que permita fomentar y regular el uso racional de estos medicamentos en la práctica clínica. Debe ponerse especial énfasis en reducir y de ser posible evitar el consumo de BZD en pacientes añosos, considerando su vulnerabilidad particular, como queda confirmado en el presente trabajo. En tal sentido, debe estudiarse la causa que motivó la prescripción, recurriendo eventualmente a medicamentos más seguros en este grupo etario en función de la patología considerada. Específicamente, algunos antipsicóticos, como haloperidol y los atípicos (risperidona o quetiapina) podrían tener un lugar en el tratamiento sintomático de la confusión mental(26). Por otro lado, el tratamiento del insomnio en el anciano es un problema complejo, su abordaje debe incluir medidas no farmacológicas y una minuciosa revisión de los medicamentos que el paciente recibe, evitando la prescripción de BZD en esta situación(27). En el mismo sentido debe desaconsejarse el consumo por períodos mayores a seis a ocho semanas. Una forma posible de evitar el consumo por plazos superiores podría relacionarse con la cantidad de comprimidos dispensados por receta. No parece razonable que se disponga de presentaciones comerciales de 60 comprimidos para medicamentos que deben emplearse por períodos breves.
En nuestro país, desde diversas entidades académicas, integradas por internistas, farmacólogos, psiquiatras y geriatras, se viene trabajando en promover el uso racional de estos medicamentos, al tiempo que se están desarrollando estudios farmacoepidemiológicos –como el presente– para determinar el consumo y las consecuencias del uso de estos medicamentos.
En conclusión, esta constituye la primera observación nacional en relación con una asociación entre consumo de BZD y un riesgo aumentado de fractura de cadera. Los pacientes expuestos a BZD tienen un riesgo claramente mayor que los no expuestos, independientemente de la vida media de la BZD considerada. Las BZD se utilizan por períodos no aconsejables. Es razonable proponer políticas sanitarias que mejoren el uso de este grupo de medicamentos, especialmente destinadas a la población añosa. Una vez aplicadas habrá que estudiar el impacto en la incidencia de fractura de cadera. Este tipo de estudios aportan datos locales de utilidad para la planificación de las citadas políticas sanitarias.
Agradecimientos
A la Prof. Agda. Dra. Noelia Speranza por facilitarnos los datos obtenidos en la encuesta sobre consumo de benzodiazepinas, comentada en la Introducción de este artículo.
Al Prof. Dr. Gustavo Giacchetto por sus correcciones y aportes al manuscrito.
A la Médica Uruguaya Corporación de Asistencia Médica (MUCAM) por permitir realizar este estudio en esa institución.
Abstract
Introduction: benzodiazepines (BZD) are widely used drugs in the clinical practice. They are effective in the symptomatic treatment of anxiety, short-term insomnia, epileptic seizures, alcohol withdrawal effect and anesthetic induction. In the elderly, they may cause adverse effect such as lack of motor coordination and muscle weakness which can lead to falling, increasing the risk of hip fracture.
Objective: to determine whether the consumption of benzodiazepine may be associated with hip fracture.
Method: a case-control study was designed (1:2) and conducted (three months in 2013 and three months in 2014) . A “case” was defined for patients with a traumatic hip injury. “Control” was defined for patients of same sex and age (± 5 años) who had been admitted in the same week for a different cause (medical or surgical). Demographic data was collected, as well as the consumption of drugs potentially involved in hip fracture. The study considered patients had consumed benzodiazepine when it had been received within five days prior to the fracture. Odd ratios were calculated and confidence intervals were 95%.
Results: 29 cases and 60 controls were obtained. Average age (standard deviation) in the cases group was 82,8 (6.4) years old and 82.1 (5.2) years old in the control group (p > 0.05). Female: 25 (86%) in the cases group and 49 (82%) in the control group (p > 0.05). BZD were consumed by 16/29 (61.5%) cases and 13/60 (21.7%) controls (p < 0.05). All patients who had consumed BZD in both groups had done so for over six weeks. The odd ratio for hip fracture in patients who consumed BZD was 4.5 (confidence interval 95% - 1.7-11.6).
Conclusions: the study points out that BZD increases the risk of hip fracture, and that patients consume it for non-advisable periods of time. National policies should be devised to encourage a rational use of these drugs.
Resumo
Introdução: os benzodiazepínicos (BZD) são medicamentos muito utilizados na prática clínica. São eficazes no tratamento sintomático da ansiedade, insônia em curto prazo, crises epilépticas, síndrome de abstinência alcoólica e indução anestésica. Em pacientes idosos podem ter efeitos adversos como comprometimento da coordenação motora e debilidade muscular que podem causar quedas, aumentando o risco de fratura de quadril.
Objetivo: determinar a existência de uma associação entre o consumo de BZD e o risco de fratura de quadril.
Material e método: um estudo de casos e controles (1:2) foi realizado durante seis meses (três meses em 2013 e três em 2014). Definiu-se como “caso” os pacientes com fratura traumática de quadril. Definiu-se como “controle” os pacientes de mesmo sexo e idade (± 5 anos) que foram admitidos na mesma semana por uma causa diferente (médica ou cirúrgica). Foram coletados dados demográficos e de consumo de medicamentos potencialmente relacionados com fratura de quadril. Considerou-se como consumo de BZD a ingestão durante os cinco dias prévios a fratura. Foram calculados o odds ratio (OR) e o intervalo de confiança 95%.
Resultados: foram estudados 29 casos e 60 controles. A idade média (DE) no grupo casos foi 82,8 (6,4) anos e 82,1 (5,2) anos no grupo controle (p > 0,05). Sexo feminino: 25 (86%) no grupo casos e 49 (82%) no grupo controles (p > 0,05). Os BZD haviam sido consumidos por 16/29 (61,5%) casos e 13/60 (21,7%) controles (p < 0,05). Todos os pacientes, em ambos grupos, haviam consumido BZD por seis semanas. O OR de fratura de quadril em pacientes que consumiam BZD foi de 4,5 (IC 95% 1,7-11,6).
Conclusões: destaca-se que os BZD aumentam o risco de fratura de quadril e que são consumidos por períodos não aconselháveis. Ë necessário desenvolver políticas nacionais buscando o uso racional destes medicamentos.
Bibliografía
1. Charney D, Mihic S, Harris R. Hipnóticos y sedantes. En: Brunton LL, Lazo JS, Parker KL, eds. Goodman & Gilman: las bases farmacológicas de la terapéutica. 11 ed. México: McGraw-Hill, Interamericana, 2007:823-44.
2. Danza Galdo Á, Cristiani Halty F, Tamosiunas Gorski G. Riesgos asociados al uso de benzodiazepinas. Arch Med Interna (
3. Allgulander C. History and current status of sedative-hypnotic drug use and abuse. Acta Psychiatr Scand 1986; 73(5):465-78.
4. Uruguay. Junta Nacional de Drogas. 5ta encuesta nacional en hogares sobre consumo de drogas: informe de investigación mayo 2012. Montevideo: Junta Nacional de Drogas, 2012. Disponible en: http://www.infodrogas.gub.uy/images/stories/pdf/v_enc_hogares_2011.pdf. [Consulta: 12 de diciembre de 2014].
5. García G, Vignolo J, Contera M, Murillo N. Consumo de psicofármacos en el Centro de Salud Sayago: Montevideo, 1998. Rev Méd Urug 2002; 18(2):154-60.
6. Mato M, Toledo M, Olmos I, Frontini M. Estudio de consumo de benzodiazepinas en la Policlínica Psiquiátrica del Hospital Vilardebó. Rev Psiquiatr Urug 2012; 76(1):25-34.
7. García Del Pozo J, de Abajo Iglesias JF, Carvajal García-Pando A, Montero Corominas D, Madurga Sanz M, García del Pozo V. Utilización de ansiolíticos e hipnóticos en España (1995-2002). Rev Esp Salud Pública 2004; 78(3):379-87.
8. Kendall T,
9. Buscemi N, Vandermeer B, Friesen C, Bialy L, Tubman M, Ospina M, et al. The efficacy and safety of drug treatments for chronic insomnia in adults: a meta-analysis of RCTs. J Gen Intern Med 2007; 22(9):1335-50.
10. World Health Organization. Collaborating Centre for Drug Statistics Methodology. Anatomical Therapeutic Chemical (ATC) classification index including Defined Daily Doses (DDDs) for plain substances, Jan 2001.
11. Shi S, Mörike K,
12. Haentjens P, Magaziner J, Colón-Emeric CS, Vanderschueren D, Milisen K, Velkeniers B, et al. Meta-analysis: excess mortality after hip fracture among older women and men. Ann Intern Med 2010; 152(6):380-90.
13. Uruguay. Fondo Nacional de Recursos. Artroplastia de cadera por fractura: normativa de cobertura del Findo Nacional de Recursos. Montevideo: FNR, 2010. Disponible en: http://www.fnr.gub.uy/sites/default/files/normativas/tecnicas/n_prot_cadera_fractura_2010.pdf. [Consulta: 12 de diciembre de 2014].
14. Pellegrino A. Caracterización demográfica del Uruguay. Montevideo: UDELAR. Facultad de Ciencias Sociales. Programa de población, 2003. Disponible en: http://www.anep.edu.uy/historia/clases/clase20/cuadros/15_Pellegrino-Demo.pdf. [Consulta: 18 de enero de 2015].
15. Xing D, Ma XL, Ma JX, Wang J, Yang Y, Chen Y. Association between use of benzodiazepines and risk of fractures: a meta-analysis. Osteoporos Int 2014; 25(1):105-20.
16. Asociación Médica Mundial.64ª Asamblea Médica Mundial. Declaración de Helsinki de la Asociación Médica Mun¬dial: principios éticos para las investigaciones médicas en seres humanos, octubre 2013. Fortaleza, Brasil: AMM, 2013. Disponible en: http://www.wma.net/es/30publications/10policies/b3/. [Consulta: 18 de enero de 2015].
17. Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica: alprazolam. Madrid: AEMPS, 2011. Disponible en: http://www.aemps.gob.es/cima/pdfs/es/ft/64428/FT_64428.pdf. [Consulta: 23 de enero de 2015].
18. Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica o resumen de las características del producto: diazepam. Madrid: AEMPS, 2010. Disponible en: http://www.aemps.gob.es/cima/pdfs/es/ft/39693/FT_ 39693.pdf. [Consulta: 23 de enero de 2015].
19. Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica brompacepam. Madrid: AEMPS, 2011. Disponible en: http://www.aemps.gob.es/cima/pdfs/es/ft/73321/FT_73321.pdf. [Consulta: 23 de enero de 2015].
20. Stordal Bakken M, Engeland A, Engesæter L, Hylen Ranhoff A, Hunskaar S, Ruths S. Risk of hip fracture among older people using anxiolytic and hypnotic drugs: a nationwide prospective cohort study. Eur J Clin Pharmacol 2014; 70(7):873–80.
21. Chang CM, Wu EC, Chang IS, Lin KM. Benzodiazepine and risk of hip fractures in older people: a nested case-control study in
22. Nurmi-Lüthje I, Kaukonen JP, Lüthje P, Naboulsi H, Tanninen S, Kataja M, et al. Use of benzodiazepines and benzodiazepine-related drugs among 223 patients with an acute hip fracture in
23. Cummings SR, Nevitt MC, Browner WS, Stone K, Fox KM, Ensrud KE, et al. Risk factors for hip fracture in white women. Study of Osteoporotic Fractures Research Group. N Engl J Med 1995; 332(12):767-73.
24. Passaro A, Volpato S, Romagnoni F, Manzoli N, Zuliani G, Fellin R. Benzodiazepines with different half-life and falling in a hospitalized population: The GIFA study. Gruppo Italiano di Farmacovigilanza nell’Anziano. J Clin Epidemiol 2000; 53(12):1222-9.
25. López M, Ketzoian C. Metodología científica. Diseños de estudio. Protocolo de investigación. En: Ketzoian C, Aguirrezábal X, Alonso R, Bezano D, Cáceres R, Gil J, et al. Estadística médica: conceptos y aplicaciones al inicio de la formación médica.
26. Young J, Murthy L, Westby M, Akunne A, O’Mahony R; Guideline Development Group. Diagnosis, prevention, and management of delirium: summary of NICE guidance. BMJ 2010; 341:c3704.
27. Bloom HG, Ahmed I,