Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Revista Médica del Uruguay
versão On-line ISSN 1688-0390
Rev. Méd. Urug. vol.31 no.1 Montevideo mar. 2015
Nefropatía IgA en Uruguay: presentación clínica y evolución
Dres. Liliana Gadola*, Jimena Cabrera†, Nelson Acosta Marichal‡, Ana Panuncio§, María Haydé Aunchaina¶, Virginia Coria**, Alicia Petraglia††, Gabriela Ottati‡‡, Silvia Melessi§§, Pablo Ríos Sarro¶¶, Beatriz Gelabert***, Cristina Verdaguer†††, Nelson Dibello‡‡‡Cecilia Burgos§§§, Raquel Arregui¶¶¶, José Santiago****, Federico García Rey††††, Fernanda Varela††††, Sebastián Marton††††, Gabriela Campeas‡‡‡‡, María García Taibo§§§§, Mercedes Chᶶ¶¶, Luis Vilardo*****, Eduardo Rugnitz†††††, Raúl Mizraji‡‡‡‡‡, Alfredo Maino§§§§§, Sylvia Ballardini¶¶¶¶¶, Alejandro Opertti******, Pierina Borggini††††††, Patricia Cuña‡‡‡‡‡‡, Ben Szpinak§§§§§§, Soledad Brovia¶¶¶¶¶¶, Mary Antúnez*******, Graciela Desiderio†††††††, Óscar Noboa‡‡‡‡‡‡‡, Emma Schwedt‡‡‡‡‡‡‡, Hena Caorsi‡‡‡‡‡‡‡, Francisco González-Martínez‡‡‡‡‡‡‡, Carlota González§§§§§§§, Mariela Garau¶¶¶¶¶¶¶
Resumen
La nefropatía IgA es frecuente en Uruguay y su tratamiento conflictivo. Objetivo: analizar la incidencia, presentación clínica, histología, tratamiento y evolución de la nefropatía IgA en Uruguay. Material y método: se realizó un análisis retrospectivo de datos del Registro Uruguayo de Glomerulopatías (RUG) e historias clínicas con estricta confidencialidad; se registró edad, sexo, fecha de biopsia renal, presentación clínica, presión arterial (PA), proteinuria, hematuria y creatininemia (al inicio y en última evolución registrada), histología, tratamientos y evolución. Análisis estadístico uni y multivariado. Aprobado por el Comité de Ética del Hospital de Clínicas. Resultados: se estudiaron 341 pacientes con nefropatía IgA, confirmada por histología, en el período comprendido entre el 1º de enero de 1985 y el 31 de diciembre de 2009; 65% hombres, edad media 31 ± 13 años y mediana de seguimiento de 52 meses (1-271); 14% ingresaron a diálisis y 1,2% fallecieron. La presentación clínica más frecuente fue con alteraciones urinarias asintomáticas (AUA) (42%), (mayor en el período 2000-2009, chi2 p < 0,05). Al inicio, la proteinuria era 1,7 ± 1,9 g/l; creatininemia 1,6 ± 1,8 mg/dl, y 32% tenían PA ≥ 140/90 mmHg. Se observaron semilunas en 48%. Recibieron inhibidores de la enzima convertidora de angiotensina/antagonistas de los receptores de la angiotensina II (IECA/ARAII) 56% e inmunosupresores, 52%. La PA disminuyó significativamente en la evolución. En el análisis univariado, la creatininemia inicial fue ≥ 2,5 mg/dl, proteinuria, semilunas y proliferación endocapilar se asociaron a ingreso a diálisis o fallecimiento, pero en el análisis multivariado (regresión de Cox) solo fue significativo el nivel de creatininemia. Conclusiones: la presentación clínica de nefropatía IgA ha cambiado en la última década, siendo más frecuente las AUA. La creatininemia ≥ 2,5 mg/dl se asocia a peor supervivencia renal, probable “punto de no retorno”.
Palabras clave: GLOMERULONEFRITIS POR IGA URUGUAY
Keywords: GLOMERULONEPHRITIS, IGA URUGUAY
* Prof. Agda. de Nefrología, Facultad de Medicina, Universidad de la República. Uruguay.
† Ex Asistente de Nefrología, Facultad de Medicina, Universidad de la República. Uruguay.
‡ Ex Prof. Adj. de Histopatología Renal, Facultad de Medicina, Universidad de la República. Uruguay.
§ Prof. Agda. de Anatomía Patológica, Facultad de Medicina, Universidad de la República. Uruguay.
¶ Patóloga, Hospital Maciel, ASSE. Uruguay.
** Nefróloga, Laboratorio de Histopatología renal. Uruguay.
†† Ex Prof. Adj. de Nefrología, Facultad de Medicina, Universidad de la República. Uruguay.
‡‡ Prof. Adj. de Nefrología, Facultad de Medicina, Universidad de la República. Uruguay.
§§ Ex Prof. Adj. de Anatomía Patológica, Facultad de Medicina, Universidad de la República. Uruguay.
¶¶ Nefrólogo, Programa Salud Renal, Hospital Maciel, ASSE. Uruguay.
*** Jefe de Nefrología, ASSE, Hospital Maciel. Uruguay.
††† Jefe de Nefrología, Asociación Española. Uruguay.
‡‡‡ Jefe de Nefrología, Hospital Evangélico. Uruguay.
§§§ Jefe de Nefrología, Casa de Galicia. Uruguay.
¶¶¶ Jefe de Nefrología, Hospital Policial. Uruguay.
**** Asistente de Nefrología, Facultad de Medicina, Universidad de la República. Uruguay.
†††† Residente de Nefrología. Facultad de Medicina, Universidad de la República. Uruguay.
‡‡‡‡ Nefróloga, ASSE, Hospital Pasteur. Uruguay.
§§§§ Nefróloga, Cooperativa Médica de Canelones. Uruguay.
¶¶¶¶ Nefróloga, Hospital Militar, Ex Asistente de Nefrología de Facultad de Medicina, Universidad de la República. Uruguay.
***** Ex Asistente de Nefrología, Facultad de Medicina, Universidad de la República. Uruguay.
††††† Prof. Agdo. de Medicina Interna, Facultad de Medicina, Universidad de la República. Uruguay.
‡‡‡‡‡ Prof. Adj. INDOT. Uruguay.
§§§§§ Nefrólogo, ASSE, Hospital de Colonia.Uruguay.
¶¶¶¶¶ Nefróloga, CAAMS, Soriano. Uruguay.
****** Nefrólogo, SUMMUM.Uruguay.
†††††† Nefróloga, CAMDEL, Lavalleja. Uruguay.
‡‡‡‡‡‡ Nefróloga, Asistencial de Maldonado. Uruguay.
§§§§§§ Ex Asistente de Nefrología, Facultad de Medicina, Universidad de la República. Nefrólogo, CRAMI, Las Piedras. Uruguay.
¶¶¶¶¶¶ Nefróloga, Hospital de Rivera, ASSE. Uruguay.
******* Cooperativa Médica de Rivera. Uruguay.
††††††† Nefróloga, Cooperativa Médica de Artigas. Uruguay.
‡‡‡‡‡‡‡ Prof. de Nefrología, Facultad de Medicina, Universidad de la República. Uruguay.
§§§§§§§ Directora del Registro Uruguayo de Diálisis. Uruguay.
¶¶¶¶¶¶¶ Prof. Adj. de Métodos Cuantitativos, Facultad de Medicina, Universidad de la República. Uruguay.
En nombre de nefrólogos que reportan al Programa de Prevención y Tratamiento de las Glomerulopatías (PPTG).
Correspondencia: Dra. Liliana Gadola.
Correo electrónico: lilianagad@gmail.com
Conflicto de interés: los autores declaran no tener conflictos de intereses.
Recibido: 28/7/14 Aceptado: 22/9/14
Introducción
La nefropatía IgA se caracteriza por presentar depósitos glomerulares dominantes o codominantes de inmunoglobulina A (IgA). Es la glomerulopatía primaria más frecuente en el mundo y también en Uruguay(1). Su incidencia es variable, siendo particularmente elevada en el este asiático y baja en África. La presentación clínica y la histopatología renal también tienen una amplia variación, por lo que se plantea que probablemente se trate de una “familia de enfermedades”. Su tratamiento es aún debatido(2). Esta variabilidad clínica e histológica se traduce en las diferentes evoluciones posibles, pudiendo ser asintomática, como lo demuestra el hallazgo casual en autopsias, o en donantes de riñón(3), tener resolución espontánea o evolucionar en forma crónica, en algunos casos hasta enfermedad renal crónica terminal (ERCT), generalmente a los diez a veinte años del diagnóstico. Esta larga, y a veces benigna evolución, ha dificultado los ensayos clínicos terapéuticos, pues los pacientes deben controlarse durante períodos prolongados para poder identificar las formas graves. Los estudios epidemiológicos realizados en diferentes regiones del mundo muestran un riesgo de ingreso a tratamiento sustitutivo renal (TSR) cercano a 20% a los diez años(4). El pronóstico vital de los pacientes también se vería comprometido, como muestra un estudio noruego, en el que la mortalidad de los pacientes con nefropatía IgA fue el doble que en la población general ajustada a edad y sexo(5). Múltiples estudios han tratado de identificar los factores de riesgo de progresión a ERCT, y se han elaborado scores clínicos y/o histológicos para definir el pronóstico y optimizar el tratamiento(6,7).
En Uruguay, el Programa de Prevención y Tratamiento de las Glomerulopatías (PPTG) (declarada enfermedad de denuncia obligatoria por el Ministerio de Salud Pública en el año 2000) lleva adelante el Registro Uruguayo de Glomerulopatías (RUG) (www.nefroprevencion.com.uy), que incluye casi el 100% de las biopsias renales realizadas en el país (aunque en algún período pudo haber subregistro). En el Informe 2010 del PPTG se consignó un aumento significativo de la incidencia de nefropatía IgA, comparando el bienio 1988-1989 (5,6 por millón de población -pmp) y 2008-2009 (12,6 pmp)(8), con una tasa de biopsias renales estable en el período (5 cada 100.000 habitantes/año). Esto llevó a analizar las características de esta enfermedad en nuestro país, su presentación clínica, los factores de riesgo de progresión a la ERC y los tratamientos realizados, con el objetivo de optimizar la asistencia de estos pacientes.
Objetivo
El objetivo general del estudio fue evaluar las características de las nefropatías IgA incluidas en el PPTG en el período comprendido entre el 1º de enero de 1985 y el 31 de diciembre de 2009. Los objetivos específicos fueron: analizar la forma de presentación, los hallazgos histopatológicos, los tratamientos realizados y la respuesta a los mismos en relación con la presencia y severidad de los factores de riesgo.
Material y método
Se realizó un estudio retrospectivo de la cohorte de pacientes con nefropatía IgA confirmada por histología (inmunofluorescencia IgA+), ingresados al RUG entre el 1º de enero de 1985 y el 31 de diciembre de 2009 y seguidos hasta 31 de diciembre de 2011. Se analizó la base de datos del RUG y las historias clínicas individuales (por los médicos tratantes) con estricta confidencialidad. El RUG confirma las evoluciones (ingreso a TSR) con los datos del Registro Uruguayo de Diálisis (RUD). Se registraron variables clínicas, histológicas, tratamientos instituidos (nefroprotección e inmunosupresores) y evolución final (en control, ingreso a diálisis o fallecimiento). Se registró la forma de presentación declarada por el médico tratante al ingreso al RUG de acuerdo a la clasificación establecida en el mismo: AUA, hipertensión arterial aislada, macrohematuria aislada, síndrome nefrótico, síndrome nefrítico, glomerulonefritis rápidamente progresiva (GNRP), insuficiencia renal aguda y crónica.
Se definió hipertensión arterial (HTA) como PA ≥ 140/90 mmHg. Se utilizó la proteinuria expresada en g/l, ya que por ser un estudio nacional retrospectivo, no se disponía de datos expresados en g/día en todos los pacientes. Consideramos el tiempo de evolución desde la biopsia renal hasta el último registro disponible de cada individuo.
La evolución de la nefropatía se definió de acuerdo a los datos del RUG, se calculó el delta de creatininemia anual y del filtrado glomerular (FG) estimado por fórmula de CKD-EPI(9). Los “puntos finales” del estudio fueron el ingreso a tratamiento de sustitución renal (TSR) o el fallecimiento.
Se compararon las características de las subcohortes de pacientes ingresados en los períodos 1985-1999 y 2000-2009.
Análisis estadístico
Los resultados de las variables continuas se expresaron como media ± DE (desvío estándar) o mediana y rango, según corresponda. Las características de la población se compararon mediante test de chi2 para las variables categóricas y análisis de varianza (ANOVA) para las variables continuas. Se realizó el análisis considerando end-point primarios: a) Ingreso a tratamiento de sustitución renal. b) Fallecimiento. Se realizaron curvas de sobrevida de Kaplan-Meyer y se utilizó el test de Breslow para comparar la sobrevida en diferentes subgrupos. Se realizó un análisis univariado con las variables potencialmente confundentes y aquellas significativas se incluyeron en el análisis multivariado. Se utilizó el modelo de riesgo proporcional de Cox para evaluar el riesgo de progresión de la enfermedad renal crónica, censurado por muerte. Se utilizó el paquete estadístico SPSS (Chicago, lllinois). Se consideró significativo un valor de p menor a 0,05.
Aspectos éticos
El proyecto fue aprobado por el Comité de Ética del Hospital de Clínicas. Los investigadores se comprometieron a respetar la ley de hábeas data (Nº 18331) de la legislación nacional.
Resultados
Se estudiaron 341 pacientes con nefropatía IgA (confirmada por histología), diagnosticadas en el período comprendido entre el 1º de enero de 1985 y el 31de diciembre de 2009, con observación hasta el 31 de diciembre de 2011. Las características clínicas fueron similares a las reportadas en la literatura(10,11), con predominio del sexo masculino (65%), jóvenes, con una edad media en la presentación de 31 ± 13 años. La mediana de seguimiento fue de 52 meses (1 a 271 meses). Se dispone de datos completos de la histología en 215 casos (63%), de la evolución detallada en 267 (78%) y del tratamiento inmunosupresor en 227 casos (66%). Al cierre del estudio se encontraban en control 215 pacientes (63%), 48 (14%) habían ingresado a TSR, 4 (1,2%) habían fallecido y 74 (21,7%) estaban perdidos en el seguimiento (más de un año sin control).
Forma clínica de presentación
La forma clínica de presentación (tabla 1) más frecuente (41,8%, 125 casos) fueron las AUA (microhematuria y proteinuria no nefrótica sin HTA ni insuficiencia renal). Es de destacar que esta forma de presentación ha aumentado al comparar los períodos 1985-1999 (34,4%) y 2000-2009 (47%) (chi2 p < 0,05). Se presentaron con macrohematuria 24,7%, síndrome nefrótico 9,7%, y nefrítico 8,7%. A pesar de la noción clásica de la benignidad de esta nefropatía, 3,7% debutaron como glomerulonefritis rápidamente progresiva (GNRP) y el reporte de esta presentación también ha aumentado (en 1985-1999 fue 0,8% y en 2000-2009 fue 5,5%) (chi2 p < 0,005). No se encontraron diferencias significativas en los períodos considerados respecto a: sexo, creatininemia inicial, presencia de HTA, proliferación endocapilar, presencia de semilunas, daño túbulo-intersticial o tratamiento con (IECA/ARAII).
En el período 2000-2009, la proteinuria inicial menor a 1 g/d fue significativamente más frecuente (chi2 p <0,05) (figura 1).
El subgrupo que debutó como AUA incluyó a 125 pacientes, 57,6% hombres, con una edad media de 33 ± 13 años (similar al grupo global) y una creatininemia media inicial de 1,0 ± 0,3 mg/dl (tabla 1).
Un subgrupo de 11 pacientes se presentó como GNRP, siete hombres, con edad media de 33 ± 10 años, creatininemia media inicial de 4,5 ± 5,9 mg/dl, PA sistólica (PAS) inicial media 154 ± 30 mmHg, PA diastólica (PAD) inicial media 89 ± 22 mmHg y proteinuria inicial media 0,9 ± 0,8 g/l.
Histología
Se analizaron los hallazgos histológicos en 215 casos (63%) (tabla 2). La mayoría de ellos debutaron antes de que se formulase la clasificación de Oxford(12,13), por lo tanto se analizó la descripción realizada por el patólogo para evaluar la presencia de factores considerados de valor pronóstico: proliferación endocapilar, presencia de semilunas y valoración semi-cuantitativa de daño túbulo-intersticial (inexistente, leve, moderado, severo)(6,14-19). Se observó proliferación mesangial en todos los casos, endocapilar en 25%, semilunas en 48%, algún grado de daño túbulo-intersticial en 88%, la mayoría leve (64%) y en el 40% de los casos más de 10% de los glomérulos obsoletos (87/215). Solo 9% de los casos presentaban 30% o más semilunas (cuatro casos con más de 50%). No se dispuso de datos detallados de lesiones actualmente consideradas de valor pronóstico, como son la esclerosis segmentaria, las lesiones vasculares y la microangiopatía trombótica.
En el sub grupo biopsiado por AUA también se observaron signos histológicos de mal pronóstico: 42% presentaban semilunas (38/90 casos con datos), 19% (16/85 casos con datos) tenían proliferación endocapilar y 86% (71/83) daño túbulo-intersticial (aunque leve en la mayoría de los casos), como ya fue señalado. Es de destacar que tres pacientes (1,1%) tenían semilunas en 30% o más de los glomérulos.
De los casos ingresados como GNRP se dispone de datos de histología en 8/11 y se observaron semilunas en 30% o más de los glomérulos en 6/8 casos (tres de los cuales tenían semilunas en 50% o más glomérulos). La presencia de semilunas en 30% o más glomérulos fue significativamente más frecuente en esta forma de presentación clínica que en las restantes (chi2 p < 0,05), así como en el grupo con creatininemia inicial ≥ 2,5 mg/dl (chi2 p < 0,05), pero se observan semilunas en todas las formas de presentación.
Tratamiento, evolución y pronóstico
Analizamos el tratamiento recibido según presentación clínica e histología. En un estudio retrospectivo, como el presente, es muy difícil separar la evolución del tratamiento recibido. El PPTG ha publicado y difundido las pautas de tratamiento de las glomerulopatías desde 1990 y la mayoría de los pacientes han sido tratados de acuerdo a las mismas, las que han variado en el tiempo a la luz de la evidencia científica contemporánea. Recibieron tratamiento nefroprotector (IECA/ARAII) en la cohorte global el 56% de los pacientes, sin diferencia significativa según época de inicio (antes del 2000 lo recibieron 52% y 59% en el período 2000-2009, pero es posible que exista un subreporte). El 51,5% recibió algún tipo de tratamiento inmunosupresor (prednisona sola el 16% y el 35% asociado a azatioprina o ciclofosfamida, o ambos). Se observa un porcentaje significativamente mayor de pacientes tratados con inmunosupresores en el último período 2000-2009 (91/152 versus 26/76) (chi2 p < 0,05) (figura 1).
Al comparar los datos del inicio con los del final del seguimiento en la cohorte global se observa una mejoría significativa en el control tensional, PAS (132 ± 22 versus 122 ± 20 mmHg), PAD (80 ± 16 versus 75 ± 12 mmHg) (n = 178) y una disminución de la proteinuria (1,6 ± 1,8 versus 0,5 ± 0,9 g/l, n = 133) (test de t pareado, p < 0,05). La variación de la creatininemia (delta creatinina/tiempo evolución) en la cohorte global fue de 0,003 ± 1 mg/dl/año (estable) y variación del FG estimado de – 2 ± 57 ml/min/1,73 m2/año, similar en la mayoría de los tipos de presentación clínica.
En el subgrupo que debutó con AUA, el 41% presentó proteinuria mayor a 1 g/d en la evolución y 18% HTA. Al final del seguimiento, tres pacientes (2,5%) habían ingresado a TSR; uno (0,8%) falleció, y la mayoría, 102 pacientes (86%), continuaba en seguimiento.
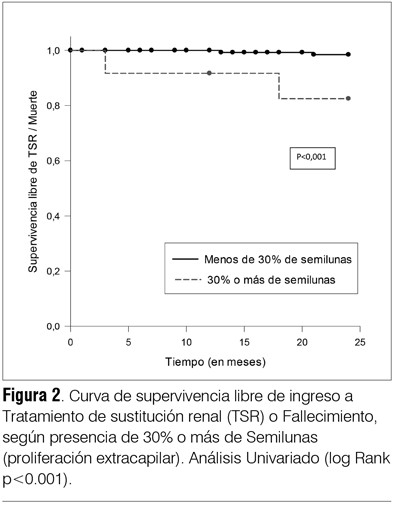
Se dispuso de los datos detallados del tratamiento recibido en el 80% de los pacientes, de los cuales el 32% recibió algún tipo de tratamiento inmunosupresor, ya sea con prednisona sola o asociada a azatioprina o ciclofosfamida, o ambos. La medicación inmunosupresora fue utilizada con mayor frecuencia en quienes desarrollaron proteinuria ≥ 1 g/d y/o presentaban semilunas ≥ 10% (40/50) (chi2 p < 0,05). Al final del seguimiento, el subgrupo tenía una creatininemia media de 1,1 ± 0,4 mg/dl), proteinuria media final (0,5 ± 0,9 g/d), PAS (122 ± 17 mmHg) y PAD (76 ± 12 mmHg), significativamente menores que al ingreso (test de t pareado p < 0,05). La supervivencia a cinco años fue de 98% en este subgrupo con AUA al inicio, en tanto que fue 90% en la cohorte global (figura 2).
En el subgrupo que se presentó como GNRP, todos los casos (8/8) recibieron el protocolo de inmunosupresión estándar (bolos de metilprednisolona y ciclofosfamida intravenosa, seguidos por prednisona y azatioprina vía oral). Al final del seguimiento (tiempo medio 43 ± 34 meses), seis pacientes se encontraban en TSR y dos continuaban en control con un descenso significativo de PAS (final media 127 ± 10 mHg), PAD (final media 80 ± 11 mmHg), proteinuria (final media 0,85 ± 1 g/l), de creatininemia (media inicial 10,7 ± 14 versus media final 1,2 ± 0,2 mg/dl), delta creatinina/tiempo evolución – 2,7 ± 4,5 mg/dl/año y aumento del FG estimado (+ 19 ml/min/1,73 m2/año) (test de t pareado p < 0,05).
Al analizar la relación entre forma histológica y tratamiento en la cohorte global se observa que 68/90 (75%) pacientes que presentaban semilunas recibieron inmunosupresores versus 29/97 (29%) que no las presentaban (chi2 p < 0,000). No se observó relación significativa entre la presencia de proliferación endocapilar o daño túbulo-intersticial con el tratamiento inmunosupresor indicado.
En la cohorte global no se observaron diferencias en la supervivencia renal al comparar los pacientes que recibieron y los que no recibieron tratamiento inmunosupresor, pero los pacientes que lo recibieron tenían una proteinuria inicial significativamente mayor (2,4 ± 1,9 g/l versus 1,4 ± 2 g/l) (test de t p < 0,05) y mayor lesión histológica (presencia de semilunas en 68/90 pacientes tratados con inmunosupresores, chi2 p < 0,05). No se observó diferencia en la creatininemia inicial (1,6 ± 2 mg/dl en quienes recibieron inmunosupresores versus 1,4 ± 1,5 mg/dl en quienes no los recibieron). La presencia de 30% o más de semilunas (aún sin disponer de datos precisos del tipo de semilunas encontradas) se correlacionó con una peor sobrevida en análisis univariado (log rank < 0,0001) (figura 2). La supervivencia renal global (ingreso a TSR o fallecimiento) fue de 90% a los cinco años y de 75% a los diez años (figura 3). No hay diferencia estadísticamente significativa en la supervivencia renal entre los pacientes que debutaron antes y después del año 2000. La supervivencia renal es mejor en los pacientes que debutan solo con HTA o AUA, pero en el análisis multivariado la única variable independiente de progresión a la insuficiencia renal extrema (ingreso a TSR o fallecimiento) fue la creatininemia inicial de 2,5 mg/dl o mayor (tabla 3 ).
Discusión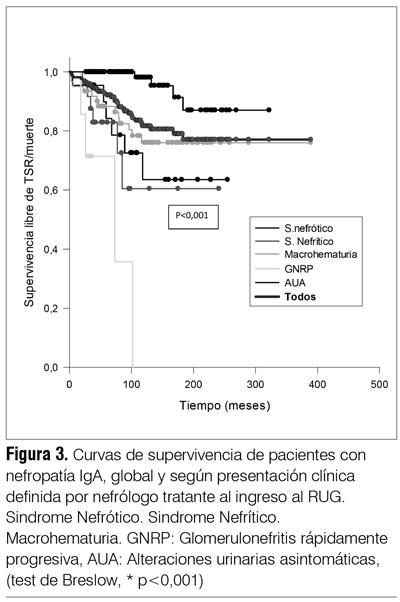
Hemos analizado la incidencia, la presentación clínica, los hallazgos histológicos, la evolución y los tratamientos realizados de los pacientes con nefropatía IgA en Uruguay en los últimos 25 años.
Presentación clínica
Las características clínicas en la presentación son similares a las reportadas en la literatura(10,11). En el período estudiado se detectó, además, un aumento de la incidencia de la forma de presentación como AUA, sin aumento de la tasa de biopsias anuales(8), lo cual puede traducir un diagnóstico más precoz vinculado a hallazgos de alteraciones urinarias en estudios preventivos (carné de salud). Asimismo aumentó significativamente el grupo que debuta como IRRP/GNRP, según definición del nefrólogo tratante a la inclusión (11 casos, 3,7%) que tuvieron muy mal pronóstico en nuestra serie (6/8 ingresaron a TSR). Shimizu y colaboradores(20) encuentran una frecuencia similar de presentación como GNRP (25/520, 4,8% de la cohorte), todos recibieron corticoides, solo uno otro fármaco inmunosupresor, pero a los cinco años solo 6/25 (24%) habían ingresado a TSR.
Histología
En 2009, un grupo de trabajo de consenso internacional publicó una nueva clasificación histológica, la clasificación de Oxford (12,13), realizada en una población con FG mayor a 30 ml/min y basada en el análisis de cuatro parámetros: proliferación mesangial (M), proliferación endocapilar (E), esclerosis glomerular (S) y daño túbulo-intersticial (T), que ha sido validada en varias cohortes internacionales(17-19). El análisis de las semilunas fue excluido en esta clasificación, aspecto que es actualmente un punto de interés para algunos estudios prospectivos(21). Lv y colaboradores(22), en un reciente metaanálisis, sugieren que debería considerarse la presencia de semilunas porque estas se asocian con mayor riesgo de ERCT. Sin embargo, hasta el momento no existe evidencia suficiente para orientar el tratamiento exclusivamente en los hallazgos histológicos, por lo que estos no están incluidos como criterio en las guías KDIGO(23), salvo en la definición de la forma semilunar o crescéntica, que la mayoría de los autores define por la presencia de más de 50% de semilunas(24).
En los hallazgos histológicos de la cohorte uruguaya estudiada (tabla 2) se destaca la presencia de semilunas, incluso en el subgrupo con AUA, y su correlación con peor sobrevida, en el análisis univariado, cuando se observan en 30% o más de los glomérulos (figura 3, curva de Kaplan-Mayer, log rank p < 0,05). Esta observación es coincidente con una reciente publicación(24) que muestra que el riesgo de ingreso a TSR o 50% de descenso del FG fue mayor en pacientes con semilunas celulares/fibrocelulares que en quienes no las presentaban. Tumlin y colaboradores(25) demostraron que el tratamiento con esteroides y ciclofosfamida reducía las lesiones histológicas y la proteinuria, y estabilizaba la función renal en pacientes con nefropatía IgA con semilunas (> 10%). En cambio, Lv y colaboradores(24) observaron que en la cohorte de IgA “crescéntica”, con una creatininemia inicial promedio de 4,3 mg/dl, la sobrevida renal a los cinco años era solo de 30%, y no encontraron correlación entre el porcentaje de semilunas y la evolución.
Factores pronósticos clínicos e histológicos
Los factores de riesgo de progresión han sido extensamente estudiados(11,16,17,19,24,26). Así se han elaborado scores de riesgo con el objetivo de intentar predecir la evolución y seleccionar a quienes puedan mejorar la evolución con tratamiento inmunosupresor. Se han identificado factores de riesgo: sexo masculino, edad, creatininemia mayor a 1 mg/dl, proteinuria mayor a 1 g/d e HTA, pero en el análisis multivariado solo los dos últimos se correlacionan con un peor pronóstico, al igual que en otras glomerulopatías. Reich y colaboradores(26) destacan la importancia de la proteinuria sostenida en el tiempo y observan que si la inicial es ≥ 1 g/d y permanece en este rango, el pronóstico será mejor que si aumenta, en tanto que si al inicio es mayor a 3 g/d, pero remite a ≥ 1 g/d, el pronóstico será igual que en el grupo que inició en este rango. Otros autores asocian criterios clínicos e histológicos para calcular el riesgo de progresión, como Berthoux y colaboradores(19), que en una cohorte francesa utilizan tres factores de riesgo (proteinuria > 1 g/d, PA > 140/90 mmHg y daño histológico), para calcular un score de riesgo renal que predice la muerte o ingreso a TSR a diez o veinte años. Investigadores japoneses desarrollaron también modelos de estimación pronóstica(6) que han sido validados, por ejemplo, por un estudio noruego(14). En la cohorte uruguaya analizada, los resultados confirman el valor pronóstico de estos factores (tabla 3); así, en el análisis univariado, la proteinuria inicial mayor a 1 g/d, la HTA, una creatininemia inicial mayor a 2,5 mg/dl, la presencia de semilunas, proliferación endocapilar, o daño túbulo-intersticial, se asociaron con peor pronóstico, pero solo la creatininemia de 2,5 mg/dl o mayor fue significativa en el análisis multivariado, hallazgo coincidente con el de varios autores(24,27), lo que probablemente marque un “punto de no retorno”.
La evolución del subgrupo que debuta como AUA, si bien es globalmente benigna, con mayor sobrevida que la cohorte global, incluye pacientes que desarrollan proteinuria, HTA o deterioro del FG, y a los veinte años de evolución, 10% ingresan a TSR o fallecen (figura 2). La histología mostraba casos con semilunas, proliferación endocapilar y/o daño túbulo-intersticial (tabla 2). Gutiérrez y colaboradores(28) han analizado un subgrupo con alteraciones urinarias mínimas, microhematuria persistente, sin proteinuria o menor de 0,5 g/d y FG inicial mayor de 60 ml/min/1,73 m2, que mostraron una excelente evolución: un tercio presentó remisión espontánea y fue excepcional el deterioro del FG. Sin embargo, se observó una minoría que desarrolló proteinuria mayor a 1 g/d e HTA, por lo que el control seriado y tratamiento oportuno de estos pacientes es mandatorio y puede tener impacto pronóstico.
Evolución y tratamiento
A lo largo de los 25 años que comprende el presente estudio los protocolos terapéuticos recomendados han variado, por lo que se analizó el uso de IECA/ARAII como tratamiento nefroprotector y la asociación de corticoides, azatioprina y/o ciclofosfamida.
En este análisis se destaca que solo recibieron IECA/ARAII 56%, (con un leve aumento en el período más reciente), aunque al final del seguimiento el control de la PA y la proteinuria eran excelentes, significativamente menores que en la presentación, como fue referido previamente. Planteamos que puede existir un subregistro de esta medicación como una de las limitaciones de un estudio retrospectivo, basado en datos de un registro nacional. Según las guías KDIGO(23), el tratamiento con mayor nivel de evidencia (1B) en esta nefropatía son los IECA/ARAII. Varios estudios(29,30) prospectivos demuestran el beneficio de los mismos, con una mejoría significativa de la sobrevida renal en los pacientes con nefropatía IgA proteinúricos y función renal normal o levemente descendida.
El tratamiento corticoideo(31-35) se indica, según las guías, en pacientes con nefropatía IgA con proteinuria significativa, mayor de 0,5-1 g/d(23) que persiste luego de seis meses de recibir IECA/ARAII con adecuado control de la PA. Lv y colaboradores(33) mostraron una asociación entre tratamiento esteroideo y menor riesgo de falla renal y/o reducción de proteinuia, al tiempo que aumentaba 55% el riesgo de efectos adversos. Una dosis de prednisona mayor a 30 mg/día por períodos cortos (hasta un año) producía una protección renal significativa frente a bajas dosis por períodos prolongados. Dado que el número y nivel de evidencia de los estudios incluidos era bajo, los resultados no pueden generalizarse. Pozzi y colaboradores(36,37) demostraron que en pacientes proteinúricos no se observa diferencia significativa en la evolución entre el tratamiento corticoideo solo o asociado a azatioprina, por lo que las guías actuales recomiendan un tratamiento exclusivamente corticoideo por seis meses en esos casos. En la cohorte uruguaya recibieron prednisona sola 16% de los pacientes incluidos y asociada a azatioprina o ciclofosfamida, o ambas, 35%, ya que era lo que proponían las guías nacionales en ese momento, basadas en protocolos internacionales contemporáneos(38). Al analizar la evolución, el tratamiento con inmunosupresores no se asoció con una diferencia significativa en la supervivencia. Coincidente con lo observado por Herzenberg y colaboradores(18), los pacientes con proliferación endocapilar y extracapilar recibieron inmunosupresores con mayor frecuencia, tanto en la cohorte de Oxford como en el grupo de validación americano. La presencia de semilunas se asoció significativamente con tratamiento inmunosupresor, lo que traduce la práctica clínica nacional e internacional hasta el 2009 aproximadamente, y podría explicar la similar evolución de los pacientes tratados con inmunosupresores, a pesar de presentar más factores de riesgo clínico o histológico, o ambos.
Si bien, como fue reportado por Knoop y colaboradores(5), la supervivencia de los pacientes con nefropatía IgA es menor que en la población general, el mayor riesgo es de ingreso a TSR. En la cohorte uruguaya analizada la supervivencia renal (ingreso a TSR o fallecimiento) es similar a la reportada en otras cohortes, con una supervivencia de 90% a los cinco años y de 75% a los diez años. En una cohorte china(39) observaron una supervivencia renal a diez años de 83% y a veinte años de 64%, aunque otro grupo encuentra una supervivencia renal a diez años de 77%(14).
El diagnóstico oportuno y un tratamiento basado en la mejor evidencia, obtenida a través de un registro completo de la evolución, permitirán optimizar el pronóstico vital y funcional en este grupo de pacientes jóvenes, lo que justifica continuar con vigilancia epidemiológica.
Conclusiones
- La presentación de nefropatía IgA como AUA ha aumentado su frecuencia en Uruguay en la última década.
- Las formas con proliferación extracapilar fueron frecuentes en nuestra población aun en el grupo con AUA.
- En nuestro estudio, la presencia de semilunas en 30% o más de glomérulos se asoció con peor supervivencia renal (en análisis univariado).
- Se detectaron varios factores de riesgo de progresión, pero el único factor de riesgo independiente en análisis multivariado de la supervivencia renal fue la creatininemia inicial ≥ 2,5 mg/dl, probable “punto de no retorno”.
- La presentación variable y los diferentes esquemas terapéuticos propuestos justifican la realización de nuevos estudios prospectivos.
Abstract
IgA nephropathy is a frequent condition in Uruguay and treating it is controversial.
Objective: to analyse incidence, clinical presentation, histology, treatment and evolution of nephropathy in Uruguay.
Method: we conducted a retrospective study of data kept at the Uruguayan Registry of Glomerulopathies and medical records under strict confidentiality. Age, sex, date of the kidney biopsy, clinical presentation, blood pressure, proteinuria, hematuria and creatininemia (initial and in the last evolution recorded), histology, treatment and evolution were registered. Single-variate and multivariate statistic analysis were applied. The study was approved by the Ethics Committee of the Clínicas University Hospital.
Results: Three hundred and forty one patients with IgA nephropathy – confirmed with histopathology analysis - were studied. Sixty five per cent were men, average age was 31 ± 13 year old and follow-up median 52 months (1-271); 14% started with dialysis and 1.2% died. The most common clinical presentation was asymptomatic urinary alterations (42%), (and this was more evident in the 2000-2009 period, chi2 p < 0.05). At the beginning, proteinuria was 1.7 ± 1.9 g/l; creatininemia 1.6 ± 1.8 mg/dl, and blood pressure was PA ≥ 140/90 mmHg in 32% of patients. Crescent formations were observed in 48%. Fifty six per cent of them received angiotensin-converting enzyme (ACE) / angiotensin receptor blockers and 52% of patients received immunosuppressants. Blood pressure significantly dropped in the evolution. In the single-variate analysis, initial creatininemia was ≥ 2.5 mg/dl, proteinuria, crescent formations and endocapillary proliferation were associated to starting dialysis or death, although in the multivariate analysis (Cox regression) only the level of creatininemia was significant.
Conclusions: the clinical presentation of IgA nephropathy has changed in the past decade, being the asymtomatic urinary alterations the most frequent. Creatininemia ≥ 2.5 mg/dl is associated to a worse renal survival, probably the “point of no return”.
Resumo
A nefropatia IgA é frequente no Uruguai e seu tratamento conflitivo.
Objetivo: analisar a incidência, apresentação clínica, histologia, tratamento e evolução da nefropatia IgA no Uruguai.
Material e método: uma análise retrospectiva dos dados do Registro Uruguaio de Glomerulopatias (RUG) e prontuários médicos com absoluta confidencialidade foi realizada; foram registrados idade, sexo, data da biopsia renal, apresentação clínica, pressão arterial (PA), proteinúria, hematúria e creatininemia (no inicio e na última evolução registrada), histologia, tratamentos e evolução. Análise estatística uni e multivariada. Aprovado pelo Comitê de Ética do Hospital das Clínicas.
Resultados: foram estudados 341 pacientes com nefropatia IgA, confirmada por histologia, no período 1º de janeiro de 1985 - 31 de dezembro de 2009; 65% eram homens, idade média 31 ± 13 anos e mediana de seguimento de 52 meses (1-271); 14% ingressaram a diálise e 1,2% faleceu. A apresentação clínica mais frequente foi presença de alterações urinárias assintomáticas (AUA) (42%), (maior no período 2000-2009, chi2 p < 0,05). No inicio, a proteinuria era 1,7 ± 1,9 g/l; creatininemia 1,6 ± 1,8 mg/dl, e 32% apresentaram PA ≥ 140/90 mmHg. Foram observadas crescentes celulares em 48%. Receberam inibidores da enzima conversora da angiotensina/antagonistas dos receptores da angiotensina (IECA/ ARA) 56% e imunossupressores, 52%. A PA diminuiu significativamente na evolução. Na análise univariada, a creatininemia inicial foi ≥2,5 mg/dl, proteinúria, crescentes celulares e proliferação endocapilar estavam associados ao ingresso à diálise e ao falecimento, porém na análise multivariada (regressão de Cox) somente o nível de creatininemia foi significativo.
Conclusões: a apresentação clínica da nefropatía IgA mostrou mudanças na última década, sendo mais frequente as AUA. A creatininemia ≥ 2,5 mg/dl está associada a pior supervivência renal, provável “ponto de não retorno”.
Bibliografía
1. D’Amico G. Natural history of idiopathic IgA nephropathy: role of clinical and histological prognostic factors. Am J Kidney Dis 2000; 36:227-37.
2. Appel GB, Waldman M. The IgA nephropathy treatment dilemma. Kidney Int 2006; 69:1939-44.
3. Wyatt R, Julian B. IgA Nephropathy. N Engl J Med 2013; 368:2402-14.
4. McGrogan A, Franssen CF, de Vries CS. The incidence of primary glomerulonephritis worldwide: a systematic review of the literature. Nephrol Dial Transplant 2011; 26(2): 414-30.
5. Knoop T, Vikse BE, Svarstad E, Leh S, Reisæter AV, Biørneklett R. Mortality in patients with IgA nephropathy. Am J Kidney Dis 2013; 62(5):883-90.
6. Goto M, Kawamura T, Wakai K, Ando M, Endoh M, Tomino Y. Risk stratification for progression of IgA nephropathy using a decision tree induction algorithm. Nephrol Dial Trasplant 2009; 24:1242-47.
7. Floege J, Feehally J. Treatment of IgA nephropathy and Henoch-Schönlein nephritis. Nat Rev Nephrol 2013; 9(6): 320-7.
8. Noboa O, Gadola L, Caorsi H, Garau M, González-Martíinez F, Acosta N, et al. Changes in the incidence of glomerular diseases in Uruguay during the last ten years. Abstract in ASN Meeting 2012, San Diego, USA. Obtenido de: www.asn-online.org/education/kidneyweek/archives/ [Consulta: mayo de 2014].
9. Levey AS, Stevens LA. Estimating GFR using the CKD Epidemiology Collaboration (CKD-EPI) creatinine equation: more accurate GFR estimates, lower CKD prevalence estimates, and better risk predictions. Am J Kidney Dis 2010; 55(4): 622-7.
10. Barratt J, Feehally J. IgA nephropathy. J Am Soc Nephrol 2005; 16:2088-97.
11. Coppo R, D’Amico G. Factors predicting progression of IgA nephropathies. J Nephrol 2005; 18:503-12.
12. Working Group of the International IgA Nephropathy Network and the Renal Pathology Society, Cattran DC, Coppo R, Cook HT, Feehally J, Roberts IS, Troyanov S, et al. The Oxford classification of IgA nephropathy: rationale, clinicopathological correlations, and classification. Kidney Int 2009; 76:534-45.
13. Working Group of the International IgA Nephropathy Network and the Renal Pathology Society, Roberts IS, Cook HT, Troyanov S, Alpers CE, Amore A, Barratt J, et al. The Oxford classification of IgA nephropathy: pathology definitions, correlations, and reproducibility. Kidney Int 2009; 76:546-56.
14. Bjørneklett R, Vikse BE, Bostad L, Leivestad T, Iversen BM. Long-term risk of ESRD in IgAN; validation of Japanese prognostic model in a Norwegian cohort. Nephrol Dial Transplant 2012; 27(4):1485-91.
15. Lee H, Kim DK, Oh KH, Joo KW, Kim YS, Chae DW, et al. Mortality of IgA nephropathy patients: a single center experience over 30 years. PLoS One 2012; 7(12):e51225.
16. Maixnerova D, Bauerova L, Skibova J, Rysava R, Reiterova J, Merta M, et al. The retrospective analysis of 343 Czech patients with IgA nephropathy—one centre experience. Nephrol Dial Transplant 2012; 27(4):1492-8.
17. Shi SF, Wang SX, Jiang L, Lv JC, Liu LJ, Chen YQ, et al. Pathologic predictors of renal outcome and therapeutic efficacy in IgA nephropathy: validation of the oxford classification. Clin J Am Soc Nephrol 2011; 6(9):2175-84.
18. Herzenberg AM, Fogo AB, Reich HN, Troyanov S, Bavbek N, Massat AE, et al. Validation of the Oxford classification of IgA nephropathy. Kidney Int 2011; 80(3):310-7.
19. Berthoux F, Mohey H, Laurent B, Mariat C, Afiani A, Thibaudin L. Predicting the risk for dialysis or death in IgA nephropathy. J Am Soc Nephrol 2011; 22:752-61.
20. Shimizu A, Takei T, Moriyama T, Itabashi M, Uchida K, Nitta K. Clinical and pathological studies of IgA nephropathy presenting as a rapidly progressive form of glomerulonephritis. Inter Med 2013; 52 (22):2489-94.
21. VALIGA-European validation study of the Oxford classification of IgA nephropathy. Obtenido de: www.era-edta.org/images/VALIGA.pdf [Consulta: mayo de 2014].
22. Lv J, Shi S, Xu D, Zhang H, Troyanov S, Cattran DC, Wang H. Evaluation of the Oxford Classification of IgA nephropathy: a systematic review and meta-analysis. Am J Kidney Dis 2013; 62(5):891-9.
23. Kidney Disease Improving Global Outcome. KDIGO Clinical Practice Guideline for Glomerulonephritis. Kidney Int Suppl 2012; 2:139-274.
24. Lv J, Yang Y, Zhang H, Chen W, Pan X, Guo Z, et al. Prediction of outcomes in crescentic IgA nephropathy in a multicenter cohort study. J Am Soc Nephrol 2013; 24(12):2118-25.
25. Tumlin JA, Lohavicha V, Hennigar R. Crescentic, proliferative IgA nephropathy: clinical and histological response to methylprednisolone and intravenous cyclophosphamide. Nephrol Dial Transplant 2003; 18(7):1321-9.
26. Toronto Glomerulonephritis Registry, Reich HN, Troyanov S, Scholey JW, Cattran DC. Remission of proteinuria improves prognosis in IgA nephropathy. J Am Soc Nephrol 2007; 18:3177-83.
27. Komatsu H, Fujimoto S, Sato Y, Hara S, Yamada K, Morita S, et al. “Point of no return (PNR)” in progressive IgA nephropathy: significance of blood pressure and proteinuria management up to PNR. J Nephrol 2005; 18(6):690-5.
28. Gutiérrez E, Zamora I, Ballarín JA, Arce Y, Jiménez S, Quereda C et al. Grupo de Estudio de Enfermedades Glomerulares de la Sociedad Española de Nefrología (GLOSEN) Long-term outcomes of IgA nephropathy presenting with minimal or no proteinuria. J Am Soc Nephrol 2012; 23(10):1753-60.
29. Praga M, Gutiérrez E, González E, Morales E, Hernández E. Treatment of IgA nephropathy with ACE inhibitors: a randomized and controlled trial. J Am Soc Nephrol 2003; 14(6):1578-83.
30. Coppo R, Peruzzi L, Amore A, Piccoli A, Cochat P, Stone R, et al. IgACE: a placebo-controlled, randomized trial of angiotensin-converting enzyme inhibitors in children and young people with IgA nephropathy and moderate proteinuria. J Am Soc Nephrol 2007; 18:1880-8.
31. Locatelli F, Pozzi C, Andrulli S. IgA nephritis: ACE inhibitors, steroids, both or neither? Nephrol Dial Transplant 2006; 21(12):3357-61.
32. Manno C, Torres DD, Rossini M, Pesce F, Schena FP. Randomized controlled clinical trial of corticosteroids plus ACE-inhibitors with long-term follow-up in proteinuric IgA nephropathy. Nephrol Dial Transplant 2009; 24(12):3694-701.
33. TESTING Study Group, Lv J, Xu D, Perkovic V, Ma X, Johnson DW, Woodward M, et al. Corticosteroid therapy in IgA nephropathy. J Am Soc Nephrol 2012; 23(6):1108-16.
34. Floege J, Eitner F. Current therapy for IgA nephropathy. J Am Soc Nephrol 2011; 22:1785-94.
35. Eitner F, Ackermann D, Hilgers RD, Floege J. Supportive Versus Immunosuppressive Therapy of Progressive IgA Nephropathy (STOP) IgAN trial: rationale and study protocol. J Nephrol 2008; 21:284-9.
36. Pozzi C, Andrulli S, Pani A, Scaini P, Roccatello D, Fogazzi G, et al. IgA nephropathy with severe chronic renal failure: a randomized controlled trial of corticosteroids and azathioprine. J Nephrol 2013; 26(1):86-93.
37. Pozzi C, Andrulli S, Pani A, Scaini P, Del Vecchio L, Fogazzi G, et al. Addition of azathioprine to corticosteroids does not benefit patients with IgA nephropathy. J Am Soc Nephrol 2010; 21(10):1783-90.
38. Ballardie FW, Roberts IS. Controlled prospective trial of prednisolone and cytotoxics in progressive IgA nephropathy. J Am Soc Nephrol 2002; 13(1):142-8.
39. Le W, Liang S, Hu Y, Deng K, Bao H, Zeng C, Liu Z. Long-term renal survival and related risk factors in patients with IgA nephropathy: results from a cohort of 1155 cases in a Chinese adult population. Nephrol Dial Transplant 2012; 27 (4):1479-85.














