Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Revista Médica del Uruguay
versão On-line ISSN 1688-0390
Rev. Méd. Urug. vol.27 no.4 Montevideo dez. 2011
Trombofilia y embarazo. Pautas de diagnóstico y tratamiento
Grupo de trabajo: Policlínicas de Alto Riesgo Obstétrico (PARO) de Hospital de Clínicas (HC) y Centro Hospitalario Pereira Rossell (CHPR); Cátedra de Hematología (Prof. Dra. L. Díaz); Clínica Médica B (Prof. Dr. L. Sosa), Clínica Ginecotocológica B (Prof. Dr. R. Medina), Clínica Ginecotocológica A (Prof. Dr. L. Briozzo), Clínica Ginecotocológica C (Prof. Dr. J. Alonso), Departamento de Laboratorio Clínico del HC- Sección Hematología (Prof. Ag. Dra. Graciela Pedreira) y Laboratorio Clínico de CHPR (Dra. Andrea Manzino)
1) Introducción
La trombofilia se relaciona con morbimortalidad materno-fetal, fundamentalmente en relación con eventos tromboembólicos venosos (ETEV) y arteriales en el período grávido puerperal, así como también con alteraciones obstétricas como PRE, restricción del crecimiento intrauterino (RCIU) o restricción del crecimiento fetal (RCF), Pre-E severa y precoz, entre otras complicaciones. Por lo tanto, es importante evaluar a aquellas embarazadas que tengan riesgo de enfermedad trombótica o de complicaciones obstétricas según los antecedentes personales o familiares, o ambos, en un intento de prevenir dichas complicaciones. Ante la falta de estudios de buena calidad metodológica y con el objetivo de realizar un trabajo interdisciplinario, es que a partir del curso de EMC de la Cátedra de Hematología sobre "Trombofilia y embarazo", en mayo de 2010, surgió la necesidad de efectuar estas pautas de diagnóstico y tratamiento que contemplen la mayor cantidad de situaciones sobre la base de la mejor evidencia disponible.
En primer lugar se revisa la evidencia y luego se exponen las recomendaciones consensuadas por el grupo de trabajo de PARO del Hospital de Clínicas y del Centro Hospitalario Pereira Rossell.
2) Metodología
Dr. Claudio Sosa
Las trombofilias incluyen a un grupo heterogéneo de alteraciones adquiridas y heredadas que se asocian con un incremento del riesgo de trombosis vascular, por lo cual se ha considerado que la presencia de éstas durante el embarazo podría estar asociada con resultados perinatales adversos. Si bien existe evidencia de que algunas trombofilias (por ejemplo, el SAFE) pueden tener una relación directa con el resultado perinatal adverso, esto no ha ocurrido en todas las trombofilias(1). Las evidencias actuales están fundamentadas en estudios observacionales que en su mayoría no han cumplido con criterios básicos de calidad. La mayoría de los estudios que han descripto asociaciones entre las diversas trombofilias están basados en estudios casos-control, los cuales han demostrado medidas de asociación discretas las que no están libres de presentar variables confundentes que estén interfiriendo con estos hallazgos, así como sesgos relacionados a los estudios observacionales(2). Otro elemento a considerar es que los estudios casos-control actualmente disponibles cuentan con insuficiente tamaño muestral para ser concluyentes. Se estima que para detectar una medida de asociación discreta que incremente el riesgo al doble (OR = 2), y considerando una prevalencia de 5% de una trombofilia en el embarazo, se requieren aproximadamente 1.000 pacientes (500 casos y 500 controles)(1). Existen pocos estudios publicados que superen este tamaño muestral. Estudios epidemiológicos de mejor calidad, como son los estudios de cohorte, están comenzando recientemente a ser publicados, lo cual podrá ser sustento científico de mayor calidad para futuras guías clínicas. Los hallazgos hasta el momento en estudios de este tipo no han demostrado una asociación real entre las trombofilias y los resultados perinatales adversos(1).
Sin embargo, el hecho de existir un fundamento teórico basado en que todas las potenciales trombofilias por asociarse a eventos trombóticos vasculares, y por tanto a resultados adversos perinatales, ha llevado que por extrapolación de las trombofilias adquiridas, sean estudiadas y tratadas la mayoría de las trombofilias hereditarias, al menos en nuestro medio. Basado en la política de "hacer todo lo posible" ante pacientes con antecedentes de malos resultados perinatales o incluso ante pacientes sin antecedentes, se ha promovido el estudio indiscriminado y el tratamiento cuando en realidad el estado de arte en relación con la causalidad entre las diferentes trombofilias y los resultados perinatales adversos así como la efectividad del tratamiento es aún controversial(1).
Es por eso que se plantea el desarrollo de una guía clínica basada en la evidencia disponible que nos permita guiar el manejo clínico de las diferentes pacientes. Esta guía clínica deberá considerar el estado de arte actual de la temática y deberá revisarse en forma periódica para incluir nuevas evidencias que actualmente se encuentran en desarrollo.
Objetivo
El propósito general de esta guía clínica es realizar un conjunto de recomendaciones basadas en la mejor evidencia disponible para al manejo clínico de la trombofilia y embarazo con el fin de guiar la práctica médica. Con ese fin se evaluó la evidencia existente tanto en las trombofilias congénitas como adquiridas, respecto a estudios diagnósticos y a terapéutica.
Participantes
Para la elaboración de esta guía clínica se consideró la participación de representantes de los grupos claves relacionados a la trombofilia y embarazo. Entre ellos se destaca la participación de obstetras, hematólogos, internistas y patólogos clínicos con experiencia en trombofilias, así como ecografistas con amplia experiencia en el área de la salud fetal. Se hizo hincapié en que en el comité estuvieran presentes profesionales que realizan asistencia de la población objeto de esta guía clínica(3,4).
Participaron técnicos de los siguientes departamentos: Clínicas Ginecotocológicas de la Facultad de Medicina, Clínica Médica B / UDA (Unidad Docente Asistencial) de ARO del Hospital de Clínicas, Cátedra de Hematología, Departamento de Laboratorio Clínico.
Finalmente, se destaca que no existe conflicto de interés de los participantes que colaboraron en esta guía clínica, no existiendo relación alguna con la industria farmacéutica, ya sea en relación con las pruebas diagnósticas como con las intervenciones terapéuticas(5,6).
Desarrollo de la guía clínica
Durante el segundo semestre de 2010 y con reuniones bimensuales se consideraron todos los temas relacionados al manejo clínico de la trombofilia y embarazo. Estas reuniones dieron lugar a una serie de preguntas clínicas que pretendían evaluar toda la evidencia relacionada a trombofilias específicas, patologías obstétricas específicas, y estudios utilizados en la práctica clínica aplicados específicamente para trombofilia y embarazo.
En base a estos criterios se realizó una búsqueda bibliográfica en las bases de datos accesibles en nuestro medio, destacando Medline, Cochrane, Lilacs, Bireme.
Mediante una búsqueda bibliográfíca sensible para la temática y específica para los diseños de estudio se recuperaron revisiones sistemáticas y metaanálisis de estudios observacionales y experimentales, así como también estudios clínicos aleatorizados individuales. Se recuperaron guías clínicas de la temática publicadas por instituciones o sociedades relevantes en la temática de trombofilia y embarazo. Esta búsqueda fue actualizada al 15 de diciembre de 2010.
En base a los documentos recuperados y mediante pesquisa de citas en sus respectivas bibliografías se recuperaron artículos potencialmente útiles que no fueran capturados en la búsqueda electrónica(4,7).
Este grupo específicamente no realizó ni actualizó revisiones sistemáticas. Cuando los metaanálisis no estuvieran actualizados por nuevos estudios publicados, se describieron los diferentes hallazgos. Tampoco se consideraron en esta guía clínica aspectos económicos, costo-eficacia ni preferencias de pacientes(6,8).
Posteriormente se realizó una evaluación crítica de las guías clínicas publicadas previamente, así como también una evaluación crítica de las revisiones sistemáticas más relevantes(9-11). Las recomendaciones fueron clasificadas de acuerdo al nivel de evidencia de donde procedía la información. Debido a las diferentes clasificaciones de niveles de evidencia en las guías clínicas previamente publicadas se utilizó una clasificación que se correlacionara con las diferentes clasificaciones manteniendo la jerarquía de las evidencias basada en la calidad de los diferentes estudios(9,10,12,13).
En el caso de que la evidencia no fuera contundente se discutieron en el grupo de trabajo los hallazgos de la literatura y se realizó una recomendación para la práctica clínica basada en el consenso o en el criterio de la mayoría.
Al final de cada capítulo publicado en esta guía clínica se presenta en forma resumida el nivel de evidencia y la fuerza de la recomendación para cada pregunta clínica planteada.
La siguiente tabla resume los niveles de evidencia y las recomendaciones de esta guía clínica.
*Adaptado de los criterios de evaluacion de la evidencia descriptos en la Canadian Task Force en cuidado preventivo de salud(12).
Bibliografía
1. Rodger MA, Paidas M, McLintock C, Middeldorp S, Kahn S, Martinelli I, et al. Inherited thrombophilia and pregnancy complications revisited. Obstet Gynecol 2008; 112(2 Pt 1): 320-4.
2. Kist WJ, Janssen NG, Kalk JJ, Hague WM, Dekker GA, de Vries JI. Thrombophilias and adverse pregnancy outcome: a confounded problem! Thromb Haemost 2008; 99(1): 77-85.
3. Eccles M, Clapp Z, Grimshaw J, Adams PC, Higgins B, Purves I, et al. Developing valid guidelines: methodological and procedural issues from the North of England Evidence Based Guideline Development Project. Qual Health Care 1996; 5(1): 44-50.
4. Shekelle PG, Woolf SH, Eccles M, Grimshaw J. Clinical guidelines: developing guidelines. BMJ 1999; 318(7183): 593-6.
5. Thompson DF. Understanding financial conflicts of interest. N Engl J Med 1993 Aug 19; 329(8): 573-6.
6. Downie J, Baird P, Thompson J. Industry and the academy: conflicts of interest in contemporary health research. Health Law J 2002; 10: 103-22.
7. Shekelle P, Eccles MP, Grimshaw JM, Woolf SH. When should clinical guidelines be updated? BMJ 2001; 323(7305): 155-7.
8. Cook DJ, Greengold NL, Ellrodt AG, Weingarten SR. The relation between systematic reviews and practice guidelines. Ann Intern Med 1997; 127(3) :210-6.
9. Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE Next Steps Consortium. Development of the AGREE II, part 1: performance, usefulness and areas for improvement. CMAJ 2010; 182(10): 1045-52.
10. Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE Next Steps Consortium. Development of the AGREE II, part 2: assessment of validity of items and tools to support application. CMAJ 2010; 182(10): E472-8.
11. Guyatt GH, Sinclair J, Cook DJ, Glasziou P. Users' guides to the medical literature: XVI. How to use a treatment recommendation. Evidence-Based Medicine Working Group and the Cochrane Applicability Methods Working Group. JAMA 1999; 281(19): 1836-43.
12. Canadian Task Force on Preventive Health Care. New grades for recommendations from the Canadian Task Force on Preventive Health Care. CMAJ 2003; 169(3): 207-8.
13. Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ 2010; 182(18): E839-42.
3) Trombofilia hereditaria: asociación con enfermedad tromboembólica venosa y complicaciones obstétricas
Dra. Eloísa Riva
Las trombofilias hereditarias (TH) son un grupo heterogéneo de condiciones genéticas que incrementan el riesgo de eventos trombóticos, fundamentalmente venosos. Dentro de las TH se destacan variantes genéticas que determinan hipercoagulabilidad como el factor V Leiden (FVL) y la mutación G20210A del factor II (FII G20210A) y las causantes de déficit de inhibidores naturales de la coagulación, proteínas C (PC), proteína S (PS) y antitrombina (AT)(1,2).
El embarazo genera un estado de hipercoagulabilidad fisiológico. La enfermedad tromboembólica venosa (ETEV) es la principal causa de muerte materna en los países desarrollados, con una prevalencia de 0,7-1/1.000 embarazos y aumenta notoriamente durante el puerperio(3).
En la mitad de las portadoras de TH que presentan ETEV, esta se produce en concurrencia con factores de riesgo (FR) clásicos como reposo, cirugía, embarazo, etc. Por otro lado, más de 50% de las pacientes que presentan ETEV durante el embarazo tienen una trombofilia subyacente. Sin embargo, la mayoría de las pacientes con TH tienen embarazos normales.
Numerosos estudios han buscado relacionar la presencia de TH con patologías del embarazo cuya aparición se vincula a fenómenos trombóticos vasculares: preeclampsia (PE), restricción del crecimiento intrauterino (RCIU), desprendimiento de placenta normoinserta (DPPNI) y muerte fetal intrauterina (MFIU). El fundamento de esta hipótesis radica en que una adecuada circulación placentaria es necesaria para que el embarazo transcurra con normalidad. Las trombofilias podrían causar placentación inadecuada y/o trombosis macro o microvascular placentaria y así vincularse con estas complicaciones obstétricas(4-7).
Sin embargo, los resultados de estos estudios son controversiales. Se requieren ensayos de mejor calidad metodológica para poder confirmar esta hipótesis.
TH y ETEV en embarazo
El 50% de los episodios de ETEV durante el embarazo se asocia con trombofilia adquirida o heredada. Se consideran TH de alto riesgo para ETEV a las portadoras de déficit de AT, FVL homocigoto, FII G20210A homocigoto y doble heterocigotas. El principal FR de ETEV en una paciente portadora de TH es el antecedente personal o en un familiar de primer grado de ETEV. Además, los factores de riesgo clásicos (edad > 35, multiparidad, obesidad, tabaquismo, reposo, cirugía reciente) tienen alto valor en la identificación de pacientes en riesgo trombótico. Las portadoras de TH que no sean de alto riesgo, que nunca hayan presentado ETEV y que no tengan otros factores de riesgo adicionales, se consideran de bajo riesgo(8,9).
TH y complicaciones obstétricas
Existe controversia respecto a la relación causal entre TH y complicaciones mediadas por la placenta debido a la carencia de estudios de cohortes, prospectivos, que aporten consistencia a esta asociación. Hay múltiples trabajos, de distinto valor estadístico y metodológicamente de difícil comparación, que reportan resultados contradictorios. Por lo tanto, hasta el momento no hay evidencia sólida que permita afirmar que exista relación causal entre TH y dichas complicaciones obstétricas(10-17).
¿Cuándo solicitar estudios de TH?
Debido a lo controversial de los reportes, todas las recomendaciones respecto al estudio de TH tienen nivel de evidencia débil. Las guías italianas recomiendan estudiar TH en las siguientes situaciones(18) #:
- Antecedentes personales de ETEV idiopática o asociada a FR menor. (C)
- Pérdida recurrente de embarazos >10 semanas o 1 MFIU. (C)
- Antecedentes de Pre-E, HELLP, DPPNI, RCIU. (D)
- Asintomática con antecedentes de familiar de primer grado menor de 50 años que haya presentado ETEV idiopática. (C)
- Asintomática con antecedente familiar de TH. (C) Sobre todo en casos de TH de alto riesgo.
- No se recomienda estudio de TH en pacientes asintomáticas con AF de complicaciones obstétricas (D).
El comité de expertos del Grupo CLAHT recomienda el estudio de TH en pacientes con historia obstétrica de complicaciones por insuficiencia placentaria(19).
Por el contrario, las guías del American College of Chest Physicians no mencionan el estudio de TH en relación con antecedentes de complicaciones mediadas por la placenta ni dirigidas a su prevención(20). Las guías británicas destacan que las decisiones terapéuticas deben tomarse en función de circunstancias clínicas, no recomendando el tratamiento antitrombótico en función de resultados de TH(21).
¿Cuál/es TH estudiar y cuándo?
Una vez adoptada la resolución de estudiar TH, se recomienda incluir FVL, FII G20210A, AT, PC y PS. Otros factores protrombóticos están en evaluación pero aún no hay suficiente evidencia respecto a su impacto ni en cuanto a las conductas a adoptar en caso de resultar patológicos.
Durante el embarazo existe aumento fisiológico de la resistencia a la PC activada (RPCA) y descenso de PS, por lo cual su determinación en este período puede generar confusión. Se han establecido puntos de corte para la PS libre en 30% para el segundo trimestre y 24% para el tercero. Por debajo de esas cifras podría considerarse como déficit real. De todos modos, es aconsejable que el estudio de TH se realice lejos de eventos trombóticos, sin anticoagulación (la heparina disminuye la AT y la warfarina desciende los niveles de PS y PC), sin tratamiento hormonal y en mujeres no embarazadas o luego de 6-8 semanas de puerperio.
Manejo de la paciente embarazada portadora de TH
Todas las guías mencionadas recomiendan prevención de ETEV en pacientes embarazadas portadoras de TH, ya que hay evidencia sólida respecto al riesgo incrementado de ETEV en esta situación. El momento de inicio, las dosis y la duración de la tromboprofilaxis varían según el tipo de TH y la presencia o no de complicaciones trombóticas previas.
Si la paciente es portadora de una TH de alto riesgo debe recibir tromboprofilaxis durante todo el embarazo y el puerperio.
Si tiene una TH de bajo riesgo y se le suman factores de riesgo adicionales al embarazo la conducta debiera ser la misma.
Si solo tiene una TH de bajo riesgo y sin factores adicionales aparte del embarazo, solo tromboprofilaxis en el puerperio.
Respecto a la prevención de complicaciones obstétricas en portadoras de TH, las guías italianas destacan que basados en la prevención de ETEV y en ausencia de estudios específicos, las pacientes con TH y antecedentes de complicaciones obstétricas deberían recibir dosis profilácticas de HBPM durante el embarazo y seis semanas de puerperio (D). Con iguales argumentos, recomiendan el uso de dosis moderadas de HBPM durante embarazo y seis semanas de puerperio para las portadoras de déficit de AT con complicaciones obstétricas previas. En pacientes con PRE y heterocigotas para FVL o FII G20210A recomiendan el uso de dosis profilácticas de HBPM durante el embarazo y seis semanas de puerperio (C). En pacientes con antecedentes de MFIU, Pre-E, HELLP, DPPNI, RCIU y portadoras de FVL o FII G20210A heterocigoto recomiendan dosis profilácticas de HBPM durante el embarazo y seis semanas de puerperio (D)(18).
Las recomendaciones del comité de expertos del Grupo CLAHT para pacientes portadoras de TH sin historia de trombosis ni complicaciones obstétricas y se embarazan son las siguientes(19):
- FVL heterocigoto o FII G20210A a heterocigoto o déficit de PC: seguimiento por obstetra y hematólogo y solo en caso necesario inicio de HBPM. En puerperio, profilaxis con HBPM por seis semanas.
- FVL homocigoto o FII G20210A a homocigoto o doble heterocigoto o déficit de AT III o déficit de PS o asociación de más de una trombofilia: HBPM durante el embarazo y seis semanas de puerperio.
Las restantes guías mencionadas solo reportan el uso de HBPM en portadoras de TH con el objetivo de prevenir ETEV(20,21).
Conclusiones
Está demostrada la asociación causal entre TH y ETEV.
No hay evidencia sólida aún de que exista asociación causal entre TH y complicaciones obstétricas vinculadas a la placenta.
El estudio de TH no debe realizarse de forma indiscriminada. La mayoría de las indicaciones terapéuticas deberían guiarse por criterios clínicos, ya que no hay evidencia de que la intervención terapéutica disminuya las complicaciones obstétricas mediadas por la placenta.
No hay evidencia respecto a la necesidad de estudio de TH en complicaciones obstétricas. No se ha demostrado que el tratamiento de TH disminuya las recurrencias de estas complicaciones(22).
En toda paciente embarazada portadora de TH debe considerarse tromboprofilaxis con el objetivo de prevenir ETEV. La existencia de antecedentes de complicaciones obstétricas podría inclinar hacia una actitud activa de profilaxis con HBPM aun en pacientes sin ETEV previa, según recomendación de expertos.
# Niveles de evidencia de guías italianas(18) basados en:
- Scottish Intercollegiate Guidelines Network, SIGN 50: A guideline developers'handbook, SIGN Publication Nº 50. February 2001, last updated May 2004.
- National Institute for Clinical Excellence, Guideline Development Methods.
Information for National Collaborating Centres and Guideline Developers, London.
National Institute for Clinical Excellence, February 2004, updated 2005.
Bibliografía
1. Rodeghiero F, Tosetto A. The epidemiology of inherited thrombophilia: the VITA Project. Vicenza Thrombophilia and Atherosclerosis project. Thromb Haemost 1997; 78(1): 636-40.
2. Souto JC, Coll I, Llobet D, del Río E, Oliver A, Mateo J, et al. The prothrombin 20210A allele is the most prevalent genetic risk factor for venous thromboembolism in the Spanish population. Thromb Haemost 1998; 80(3):366-9.
3. Health Canada. Special Report on Maternal Mortality and Severe Morbidity in Canada Enhanced Surveillance: the path to prevention. Ottawa: Minister of Public Works and Government Services Canada, 2004.
4. Thygesen LC, Andersen GS, Andersen H. A philosophical analysis of the Hill criteria. J Epidemiol Community Health 2005; 59(6): 512-6.
5. Lin J, August P. Genetic thrombophilias and preeclampsia: a meta-analysis. Obstet Gynecol 2005; 105(1): 182-92.
6. Wu O, Robertson L, Twaddle S, Lowe GD, Clark P, Greaves M, et al. Screening for thrombophilia in high-risk situations: systematic review and cost-effectiveness analysis. The Thrombosis Risk and Economic Assessment of Thrombophilia Screening (TREATS) study. Health Technol Assess 2006; 10(11): 1-110.
7. Howley HE, Walker M, Rodger MA. A systematic review of the association between factor V Leiden or prothrombin gene variant and intrauterine growth restriction. Am J Obstet Gynecol 2005; 192(3): 694-708.
8. Martinelli I, De Stefano V, Taioli E, Paciaroni K, Rossi E, Mannucci PM. Inherited thrombophilia and first venous thromboembolism during pregnancy and puerperium. Thromb Haemost 2002; 87(5): 791-5.
9. Zotz RB, Gerhardt A, Scharf RE. Inherited thrombophilia and gestational venous thromboembolism. Best Pract Res Clin Haematol 2003; 16(2): 243-59.
10. Dizon-Townson DS, Nelson LM, Easton K, Ward K. The factor V Leiden mutation may predispose women to severe preeclampsia. Am J Obstet Gynecol 1996; 175(4 Pt 1): 902-5.
11. Gris JC, Quéré I, Monpeyroux F, Mercier E, Ripart-Neveu S, Tailland ML, et al. Case-control study of the frequency of thrombophilic disorders in couples with late foetal loss and no thrombotic antecedent - the Nimes Obstetricians and Haematologists Study 5 (NOHA5). Thromb Haemost 1999; 81(6): 891-9.
12. Infante-Rivard C, Rivard GE, Yotov WV, Génin E, Guiguet M, Weinberg C, et al. Absence of association of thrombophilia polymorphisms with intrauterine growth restriction. N Engl J Med 2002; 347(1): 19-25.
13. Kupferminc MJ, Eldor A. Inhered thrombophilia and gestational vascular complications. Semin Thromb Hemost 2003; 29(2): 185-93.
14. Martinelli P, Grandone E, Colaizzo D, Paladini D, Sciannamé N, Margaglione M, et al. Familial thrombophilia and the occurrence of fetal growth restriction. Haematologica 2001; 86(4): 428-31.
15. Rey E, Kahn SR, David M, Shrier I. Thrombophilic disorders and fetal loss: a meta-analysis. Lancet 2003; 361(9361): 901-8.
16. Middeldorp S. Thrombophilia and pregnancy complications: cause or association? J Thromb Haemost 2007; 5(Suppl. 1): 276-82.
17. Rodger MA, Paidas M, McLintock C, Middeldorp S, Kahn S, Martinelli I, et al. Inherited thrombophilia and pregnancy complications revisited. Obstet Gynecol 2008; 112(2 Pt 1): 320-4.
18. Lussana F, Dentali F, Abbate R, d'Aloja R, D'Angelo A, De Stefano V, et al. Italian Society for Haemostasis and Thrombosis. Screening for thrombophilia and antithrombotic prophylaxis in pregnancy: Guidelines of the Italian Society for Haemostasis and Thrombosis (SISET). Thromb Res 2009; 124(5): e19-25.
19. Otero AM, Sarto A, Amigo MC, Mijares M, Amante de Guggiari P, De Lisa E, et al. Trombofilia y embarazo: consenso del Grupo CLAHT. Arch Med Interna (Montevideo) 2008; 30(2/3): 59-63.
20. Bates SM, Greer IA, Pabinger I, Sofaer S, Hirsh J; American College of Chest Physicians. Venous thromboembolism, thrombophilia, antithrombotic therapy, and pregnancy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008 Jun; 133(6 Suppl): 844S-86S.
21. Baglin T, Gray E, Greaves M, Hunt BJ, Keeking D, Machin S, et al. British Committee for Standards in Haematology. Clinical guidelines for testing for heritable thrombophilia. Br J Haematol 2010; 149(2): 209-20.
22. American College of Obstetricians and Gynecologists. Practice Bulletin nº.113: inherited thrombophilias in pregnancy. Obstet Gynecol. 2010; 116(1): 212-22.
4) Pérdida recurrente de embarazo
Dr. Juan Zunino
Se define como PRE a tres o más pérdidas consecutivas, menores a 20 semanas de gestación; si bien algunos grupos aceptan dos o más pérdidas(1-3). Algunos autores señalan que pueden incluirse pérdidas posteriores a 20 semanas(3), lo que hace variar la frecuencia de etiologías.
Epidemiología. El 15% de mujeres embarazadas presentan una pérdida esporádica y en 50% a 60% esta ocurre previamente a la detección clínica(1,2). Dos pérdidas ocurren en 5% de embarazos(4,5). Tres pérdidas en 0,4%-1%(1,4,5).
Etiología. La mayoría de pérdidas aisladas son debidas a aneuploidía fetal espontánea(2). Las pérdidas recurrentes son debidas a causas variadas(1,2): genéticas; autoinmunes; endócrinas; anatómicas maternas; infecciosas y trombofilia. La frecuencia de las distintas etiologías varía según las series. Es de señalar que la etiología es desconocida en 50% o más de los casos(1,2,4,5).
Diagnóstico. Se acepta que la oportunidad apropiada para iniciar estudios es luego de dos pérdidas(1,2). No existe un acuerdo de protocolo de estudio para la PRE(1,2,3,6,7).
Recomendación. Estas pacientes se deben estudiar y tratar en el contexto de un equipo interdisciplinario (obstetra, hematólogo, internista, genetista). Debido a que las etiologías de PRE son muy variadas, se sugiere el estudio de las causas genéticas, autoinmunes, endócrinas, anatómicas maternas, infecciosas, etcétera, adaptadas a cada paciente en particular; además de las trombofilias que más adelante se señalan.
Trombofilias
1) Trombofilia adquirida: síndrome antifosfolipídico (ver capítulo de SAFE). Se recomienda estudio de SAF en PRE(1,2,4-10).
2) Trombofilia hereditaria: en el estudio nacional sobre trombofilia y PRE (A. Otero y colaboradores(11) se constató asociación significativa de pérdida recurrente con FVL, Lipo A, MTHFR homocigota, FIIG20210A.
La revisión sistemática de Robertson y colaboradores(12) constató asociación significativa de FVL homocigoto y FIIG20210A heterocigoto en pérdida temprana, definida como menor a 24 semanas de gestación. Constató asociación significativa de déficit de PS, FVL y FIIG20210A en pérdida tardía, definida como mayor a 24 semanas de gestación.
Persiste polémica respecto al peso de la relación causal entre TH y pérdida de embarazo(3,7,9,10,13-16). En el trabajo de Robertson y colaboradores(12) se señala un riesgo absoluto bajo de las anteriores trombofilias hereditarias en la PRE.
En cuanto al estudio de trombofilia hereditaria en PRE persisten la polémica y las discrepancias entre las diferentes guías y consensos:
El Consenso Latinoamericano 2008 del grupo CLAHT(17) señala: "Cuando una mujer tiene una historia obstétrica de complicaciones por insuficiencia placentaria deben buscarse causas de trombofilia genética".
Las guías italianas(10) recomiendan realizar screening para trombofilia en mujeres con PRE o MFI Inexplicada. (Grado C*).
Las guías alemanas(7) recomiendan estudiar TH (AT, PC, PS, FVL, FII G20210A y factor VIII) únicamente en casos de antecedentes de ETEV y/o defectos conocidos de trombofilia en familiares de primer grado, en combinación con una historia de ETEV.
La guía del ACCP(9) 2008 no recomienda estudio de TH en PRE.
La guía británica(16) no efectúa recomendaciones sobre TH en PRE.
Recomendación
1) En PRE menor a 24 semanas de gestación se recomienda solicitar: FVL y FII G20210A (2B).
2) En PRE mayor a 24 semanas se recomienda solicitar: FVL, FII G20210A y PS (2B).
3) Debido a no encontrar claras recomendaciones de estudio se deja en libertad al médico actuante para solicitar otros estudios de TH según cada caso particular.
Tratamiento
1) PRE y SAFE (ver capítulo de SAFE).
2) PRE y TH: existe polémica respecto al tratamiento de la TH y PRE(18,19).
Existen estudios no randomizados versus placebo que evidencian un beneficio de heparinas de bajo peso molecular (HBPM) en TH y pérdida de embarazo(3,20,21).
Una revisión Cochrane(22) de 2010, no constató beneficio en el uso de HBPM o ácido acetil salicílico (AAS) en PRE sin presencia de SAFE.
Las guías italianas(10) recomiendan: dosis de HBPM profiláctica anteparto en mujeres heterocigotas para FVL o FII G20210A y PRE, y seis semanas luego del parto. (Grado C*).
ACCP(9) 2008: no indica tratamiento en caso de TH y PRE.
Guías alemanas(7) 2007: no recomiendan tratamiento dada la falta de evidencia.
Guías británicas(16) 2009: no recomiendan tratamiento antitrombótico a embarazadas basado en tests de TH.
Recomendación: HBPM profiláctica en casos de PRE y documentación de FVL, FII G20210A y déficit de PS. (3C)
PRE de causa inexplicada
Los estudios ALIFE(4) y SPIN(5) del año 2010, prospectivos y randomizados, evaluaron beneficio de tratamiento en PRE de causa inexplicada.
ALIFE(4): AAS aislada o combinada con nadroparina no mejoraron la tasa de nacidos vivos en comparación con placebo.
SPIN(5): el uso de AAS y enoxaparina en mujeres con PRE no tiene beneficio en prevención de una pérdida futura comparado con cuidado fetal intensivo.
Es de señalar que estos dos estudios no descartaron TH para definir PRE de causa inexplicada.
Recomendación: no estaría indicado el uso de AAS o HBPM en PRE de causa inexplicada (IE).
*Recomendaciones de PRE consensuadas en PARO (ver anexo)
Bibliografía
1. Tulandi T, Al-Fozan H, Lockwood C, Bars V. UpToDate. Definition and etiology of recurrent pregnancy loss: last literature review version 18.1. Feb. 2010.
2. Allison JL, Schust D. Recurrent first trimester pregnancy loss: revised definitions and novel causes. Curr Opin Endocrinol Diabetes Obes 2009; 16(6): 446-50.
3. Carp HJ. Thrombophilia and recurrent pregnancy loss. Obstet Gynecol Clin North Am 2006; 33(3): 429-42.
4. Kaandorp SP, Goddijn M, van der Post JA, Hutten BA, Verhoeve HR, Hamulyák K, et al. Aspirin plus heparin or aspirin alone in women with recurrent miscarriage. N Engl J Med 2010; 362(17): 1586-96.
5. Clark P, Walker ID, Langhorne P, Crichton L, Thomson A, Greaves M, et al. Scottish Pregnancy Intervention Study (SPIN) collaborators. SPIN (Scottish Pregnancy Intervention) study: a multicenter, randomized controlled trial of low-molecular-weight heparin and low-dose aspirin in women with recurrent miscarriage. Blood 2010; 115(21): 4162-7.
6. Royal College of Obstetricians and Gynaecologists. The investigation and treatment of couples with recurrent miscarriage: Green-top guideline no. 17. London: RCOG, 2003.
7. The Dutch Society of Obstetrics and Gynaecology (NVOG). Guideline recurrent miscarriage. The Netherlands: NVOG, 2007.
8. Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost 2006; 4(2): 295-306.
9. Bates SM, Greer IA, Pabinger I, Sofaer S, Hirsh J; American College of Chest Physicians. Venous thromboembolism, thrombophilia, antithrombotic therapy and pregnancy: American College of Chest Physicians Evidence-Based Clinical Preactice Guidelines (8th Edition). Chest 2008; 133(6 Suppl): 844S-86S.
10. Lussana F, Dentali F, Abbate R, d'Aloja E, D'Angelo A, De Stefano V, et al. Italian Society for Haemostasis and Thrombosis. Screening for thrombophilia and antithrombotic prophylaxis in pregnancy: Guidelines of the Italian Society for Haemostasis and Thrombosis (SISET). Thromb Res 2009; 124(5): e19-25.
11. Otero AM, Pou R, Pons JE, Lens D, De Lisa E, Dellepiane M, et al. Trombofilia y pérdida recurrente de embarazo. Rev Med Urug 2004; 20(2): 106-13.
12. Robertson L, Wu O, Langhorne P, Twaddle S, Clark P, Lowe GD, et al. Thrombosis Risk and Economic Assessment of Thrombophilia Screening (TREATS) Study. Thrombophilia and pregnancy: a systematic review. Br J Haematol 2006; 132(2): 171-96.
13. Middledorp S. Thrombophilia and pregnancy complications: cause or association? J Thromb Haemost 2007; 5(Suppl 1): 276-82.
14. Rodger MA, Paidas M, McLintock C, Middeldorp S, Kahn S, Martinelli I, et al. Inherites thrombophilia and pregnancy complications revisited. Obstet Gynecol 2008; 112(2 Part 1): 320-4.
15. Sarig G, Vidergor G, Brenner B. Assessment and management of high-risk pregnancies in women with thrombophilia. Blood Rev 2009; 23(4): 143-7.
16. Baglin T, Gray E, Greaves M, Hunt BJ, Keeling D, Machin S, et al. British Committee for Standards in Haematology. Clinical guidelines for testing for heritable thrombophilia. Br J Haematol 2010; 149(2): 209-20.
17. Otero AM, Sarto A, Amigo MC, Mijares M, Amante de Guggiari P, De Lisa E, et al. Trombofilia y embarazo: consenso del Grupo CLAHT. Arch Med Interna (Montevideo) 2008; 30(2/3): 59-63.
18. Middledorp S. Antithrombotic prophylaxis for women with thrombophilia and pregnancy complications- No. J Thromb Haemost 2003; 1(10): 2073-4.
19. Brenner B. Antithrombotic prophylaxis for women with thrombophilia and pregnancy complications-Yes. J Thromb Haemost 2003; 1(10): 2070-2.
20. Brenner B. Thrombophilia and adverse pregnancy outcome. Obstet Gynecol Clin North Am 2006; 33(3): 443-56.
21. Gris JC, Mercier E, Quéré I, Lavigne-Lissalde G, Cochery-Nouvellon E, Hoffet M, et al. Low-molecular-weight -heparin versus low-dose aspirin in women with one fetal loss and a constitutional thrombophilic disorder. Blood 2004; 103(10): 3695-9.
22. Kaandorp S, Di Nisio M, Goddijn M, Middeldorp S. Aspirin or anticoagulants for treating recurrent miscarriage in women without antiphospholipid syndrome. Cochrane Database Syst Rev 2009; (1):CD004734.
5) Amenaza de aborto y trombofilia
Dr. Sebastián Galeano
La amenaza de aborto (AA) corresponde a la hemorragia que se produce a través del cuello uterino cerrado en el primer trimestre de la gestación. Es la complicación más frecuente y ocurre aproximadamente en uno de cada cinco embarazos (16%-25%)(1). Habitualmente es indoloro y en general no es posible determinar la etiología del sangrado. Si bien no siempre es seguido de aborto espontáneo (AE), la existencia de AA se asocia con un incremento en el riesgo de complicaciones durante el embarazo(2). La ecografía puede constatar la presencia de hematoma subcoriónico que suele ser la fuente de hemorragia. Asimismo es útil en predecir la evolución, ya que de constatarse actividad cardíaca, es más probable que el embarazo continúe su curso(3).
Se define AE como la pérdida espontánea de embarazo antes de la viabilidad fetal (que se corresponde con un peso igual o inferior a 500 gramos o edad gestacional inferior a 22 semanas). Ocurre con alta frecuencia, se estima que entre 8%-20% de los embarazos menores a 20 semanas tendrán AE(4,5); 80% de estos en las primeras 12 semanas, disminuyendo la frecuencia con el incremento de la edad gestacional. Si se consideran los embarazos subclínicos (detectados exclusivamente por seguimiento con ß-HCG), la tasa de embarazos perdidos en un estudio poblacional llegó a 31% (70% de estos o 22% de todos los embarazos ocurrieron antes de que el embarazo sea detectado clínicamente)(5).
La etiología del AE es desconocida en 50% o más de los casos. Frecuentemente corresponde a huevo anembrionado cuando es precoz. Cuando la causa del AE es conocida corresponde en la mayoría a alteraciones cromosómicas(6). La posible asociación entre AA o AE aislado con la existencia de TH o adquirida es un tema de intenso debate e investigación.
Si bien se encuentra asociación entre PRE precoz del embarazo y la presencia de anticuerpos antifosfolípidos positivos(7), no parece haber asociación significativa entre AE aislado y la existencia de positividad para inhibidor lúpico o anticuerpos anticardiolipina(8).
Sin embargo, la presencia de anticuerpos anti ß2-glicoproteína I parece incrementar el riesgo de pérdida de la gestación en pacientes con AA durante el primer trimestre(9).
Respecto a TH y pérdida de embarazo, los resultados de los estudios son discordantes(10-14), pero un metaanálisis que evaluó la asociación entre TH y complicaciones obstétricas concluye que si bien la presencia de FVL, FII G20210A y deficiencia de PS se asocian con PRE en el primer trimestre, no fue posible demostrar una asociación entre TH y pérdida del embarazo temprana no recurrente, indicando la necesidad de estudios específicos para evaluar esta situación(15).
Si bien existen diversos estudios de intervención terapéutica en AA (principalmente con progestágenos y reposo en cama), no parecería haber estudios clínicos adecuados de evaluación del uso de anticoagulantes/antiagregantes o en función del estudio de trombofilia en el contexto de AA(1).
Las guías terapéuticas, en el contexto de AA o AE precoz no recurrente, no realizan mención a la necesidad de evaluar trombofilia o de realizar intervención terapéutica en función de la existencia de trombofilia(16-20).
Conclusiones respecto a AA:
- Complicación frecuente del embarazo.
- Generalmente de causa desconocida.
- Asociación entre estudio positivo para anticuerpos anti ß2-GP1 y progresión a AE.
- Guías no indican conducta respecto a valoración de TH y trombofilia adquirida en AA.
- Sin estudios clínicos controlados que establezcan beneficios de intervención terapéutica en función de estudios de TH o trombofilia adquirida en AA.
*Recomendaciones consensuadas en PARO (ver anexo)
Bibliografía
1. Sotiriadis A, Papatheodorou S, Makrydimas G. Threatened miscarriage: evaluation and management. BMJ 2004 Jul 17; 329(7458): 152-5.
2. Saraswat L, Bhattacharya S, Maheshwari A, Bhatta-charya S. Maternal and perinatal outcome in women with threatened miscarriage in the first trimester: a systematic review. BJOG 2010; 117(3): 245-57.
3. Deaton JL, Honoré GM, Huffman CS, Bauguess P. Early transvaginal ultrasound following an accurately dated pregnancy: the importance of finding a yolk sac or fetal heart motion. Hum Reprod 1997; 12(12): 2820-3.
4. Wang X, Chen C, Wang L, Chen D, Guang W, French J. Conception, early pregnancy loss, and time to clinical pregnancy: a population-based prospective study. Fertil Steril 2003; 79(3): 577-84.
5. Wilcox AJ, Weinberg CR, O'Connor JF, Baird DD, Schlatterer JP, Canfield RE, et al. Incidence of early loss of pregnancy. N Engl J Med 1988; 319(4): 189-94.
6. Stephenson MD, Awartani KA, Robinson WP. Cytogenetic analysis of miscarriages from couples with recurrent miscarriage: a case-control study. Hum Reprod 2002; 17(2): 446-51.
7. Opatrny L, David M, Kahn SR, Shrier I, Rey E. Association between antiphospholipid antibodies and recurrent fetal loss in women without autoimmune disease: a metaanalysis. J Rheumatol 2006; 33(11): 2214-21.
8. Infante-Rivard C, David M, Gauthier R, Rivard GE. Lupus anticoagulants, anticardiolipin antibodies, and fetal loss: a case-control study. N Engl J Med 1991; 325(15): 1063-6.
9. Mezzesimi A, Florio P, Reis FM, D'Aniello G, Sabatini L, Razzi S, et al. The detection of anti-beta2-glycoprotein I antibodies is associated with increased risk of pregnancy loss in women with threatened abortion in the first trimester. Eur J Obstet Gynecol Reprod Biol 2007; 133(2): 164-8.
10. Preston FE, Rosendaal FR, Walker ID, Briët E, Berntorp E, Conard J, et al. Increased fetal loss in women with heritable trombophilia. Lancet 1996; 348 (9032): 913-6.
11. Dawood F, Farquharson R, Quenby S, Toh CH. Acquired activated protein C resistance may be a risk factor for recurrent fetal loss. Fertil Steril 2003; 80(3): 649-50.
12. Roqué H, Paidas MJ, Funai EF, Kuczynski E, Lockwood CJ. Maternal thrombophilias are not associated with early pregnancy loss. Thromb Haemost 2004; 91(2): 290-5.
13. Carp H , Dolitzky M, Tur-Kaspa I, Inbal A. Heriditary thrombophilias are not associated with a decreased live birth rate in women with recurrent miscarriage. Fertil Steril 2002; 78(1): 58-62.
14. van Dunné FM, Doggen CJ, Heemskerk M, Rosendaal FR, Helmerhorst FM. Factor V Leiden mutation in relation to fecundity and miscarriage in women with venous thrombosis. Hum Reprod 2005; 20(3): 802-6.
15. Rey E, Kahn SR, David M, Shrier I. Thrombophilic disorders and fetal loss: a meta-analysis. Lancet 2003; 361(9361): 901-8.
16. Baglin T, Gray E, Greaves M, Hunt BJ, Keeling D, Machin S, et al. British Committee for Standards in Haematology. Clinical guidelines for testing for heritable thrombophilia. Br J Haematol 2010; 149(2): 209-20.
17. Royal College of Obstetricians and Gynaecologists. The management of early prenancy loss: Guideline N° 25. London: RCOG, 2006.
18. Bates SM, Greer IA, Pabinger I, Sofaer S, Hirsh J; American College of Chest Physicians. Venous thromboembolism, thrombophilia, antithrombotic therapy, and pregnancy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008; 133(6 Suppl): 844S-86S.
19. Lussana F, Dentali F, Abbate R, d'Aloja E, D'Angelo A, De Stefano V, et al; Italian Society for Haemostasis and Thrombosis. Screening for thrombophilia and antithrombotic prophylaxis in pregnancy: Guidelines of the Italian Society for Haemostasis and Thrombosis (SISET). Thromb Res 2009; 124(5): e19-25.
20. Otero AM, Sarto A, Amigo MC, Mijares M, Amante de Guggiari P, De Lisa E, et al. Trombofilia y embarazo: consenso del Grupo CLAHT. Arch Med Interna (Montevideo) 2008; 30(2/3): 59-63.
6) Síndrome antifosfolipídico del embarazo
Dra. Mariana Stevenazzi
El SAF, descripto por Hughes en 1983, es la trombofilia adquirida más frecuente. Puede ser primario (idiopático) o secundario (en 95% de los casos a LES). El SAFE es causa de importantes problemas para el binomio materno-fetal: trombosis materna, RCIU, abortos recurrentes, entre otros. Se postula también como causa probable de infertilidad. La importancia en el conocimiento de esta patología radica en la posibilidad de prevención de las complicaciones con el tratamiento (trombosis y abortos recurrentes, fundamentalmente).
Aún hay puntos controversiales y dificultades con respecto al SAFE. Es difícil definir la relación causa-efecto dada la patogenia multifactorial. Se plantean, además de los efectos en relación con los factores de la coagulación (protrombóticos), efecto contra la anexina V y activación del complemento como factores etiológicos para la falla de implantación y PRE. Se discute también el variable potencial trombogénico de los diferentes anticuerpos en relación con la clínica así como la presencia de anticuerpos antifosfolipídicos (APAs) en mujeres sanas. Por otra parte, siempre deben excluirse otras causas de mala historia obstétrica en relación con el inadecuado control de enfermedades coexistentes (HTA, enfermedad renal crónica, LES, diabetes).
Cuándo debemos sospechar un SAF
Frente a la ocurrencia de trombosis inexplicadas, alteraciones del embarazo vinculables, trombocitopenia inexplicada, alargamiento del tiempo de protrombina o aPTT, livedo reticularis, u otras alteraciones relacionadas a SAF (nefrológicas, neurológicas, cardíacas, entre otras).
Recomendación de screening de APAs según la ACCP 2008, COGA (Colegio Americano de Ginecólogos y Obstetras), grupo CLATH 2008, entre otros (guías italianas, británicas, entre otras):
1) Frente a historia médica u obstétrica sugestiva de SAF.
2) PRE (tres o más AE < de 10 semanas) o pérdida fetal tardía (PFT) (AE10 semanas)-ACCP: (IA), pretérminos <34 semanas con relación a Pre-E severa o eclampsia, RCIU (2C) o insuficiencia placentaria documentada (eco Doppler, Non Stress Test/NST) (algunos consideran PRE dos o más AE<10 semanas)(1-5).
Definición de SAFE
Se define SAFE según los criterios de Sapporo (1999) y revisados en Sydney 2006 (Miyakis y colaboradores), debiendo estar presente un criterio clínico más uno de laboratorio(6,7).
Criterios clínicos: uno o más episodios de trombosis venosa, arterial y/o de pequeño vaso (imagen o evidencia histológica) en cualquier órgano o tejido y/o morbilidad del embarazo: una o más muertes fetales >10 semanas de feto morfológicamente normal; uno o más pretérminos < de 34 semanas secundario a: Pre-E severa o eclampsia (de acuerdo a la definición estándar) o insuficiencia placentaria (RCIU < p5 por ECO), oligohidramnios, hipoxemia fetal sugeridos por eco Doppler o NST, de fetos morfológicamente normales; tres o más abortos espontáneos consecutivos inexplicados < de 10 semanas (excluidas otras causas: cromosómicas maternas o paternas, y anatómicas o endócrinas maternas).
Criterios de laboratorio: presencia de APAs en dos o más ocasiones, con una diferencia de 12 semanas como mínimo, según criterios de la Sociedad Internacional de Trombosis y Hemostasis (ISTH) 2005: ACA (anticuerpos anticardiolipinas): isotipos IgG o IgM > de 40U GPL o MPL o > de percentil 99. Anti ß2 GPI (anti beta 2 glicoproteína I) IgG o IgM > percentil 99. AL (anticoagulante lúpico) positivo.
El punto de corte y el requisito de dos o más determinaciones es importante para descartar falsos positivos, los cuales pueden ser a bajo título y transitorios vinculados a fármacos e infecciones, etcétera. El estudio de otros Ac que pueden estar presentes en el SAF, pero menos frecuentes y de dudosa sensibilidad y especificidad (anti- anexina V, anti-fosfatidilinositol, anti-protrombina, etcétera) aún no han sido avalados, si bien están en desarrollo importantes estudios de investigación, así como el isotipo IgA de los APAs.
Test para APAs: ELISA (para ACA y anti ß2GPI) y LA test para AL (aPTT-adecuado a la detección de AL); test de veneno de víbora de Russell diluido (dVVRT).(8).
Evidencia sobre manifestaciones clínicas en SAFE: hay clara evidencia en cuanto al riesgo de trombosis en relación con SAFE, si bien es variable. La mayoría son venosos. Este riesgo aumenta aun más si se asocia a TH. Con respecto a las manifestaciones obstétricas hay evidencia de asociación con: Pre-E precoz y severa (ACA: OR 2,72 y AL: OR 1,45)(9); RCIU, se vio un aumento en la frecuencia 30% versus 10% en población control (AL positivo 12% versus AL- 2%)(10); PFT, se vio una fuerte asociación y mayor riesgo de recurrencia (AL OR 13, ACA IgG OR 3,6 e IgM OR 5,6)(11) y con AE<10 semanas, si bien hay datos controversiales (unos a favor y otros en contra)(12-14).
Tratamiento
La meta es prevenir complicaciones (morbimortalidad) materno-fetales (trombosis maternas y prevenir complicaciones obstétricas). El tratamiento siempre debe ser individualizado según cada caso.
Hay diferentes fármacos que se han utilizado y estudiado para el tratamiento del SAFE(15). El ácido acetil salicílico (AAS) tiene un efecto beneficioso demostrado para prevención de pérdidas fetales, con tasa de nacidos vivos (NV) variable de hasta más de 72% según reportes. Se recomienda a dosis bajas (50 a 100 mg/día) y debería suspenderse a las 35 semanas de gestación(16). Las heparinas (no fraccionadas [HNF] o de bajo peso molecular [HBPM]) han sido estudiadas también en varios trabajos. Hay evidencia sobre el beneficio de su uso por sus efectos antitrombóticos conocidos, antiinflamatorios y por inhibición del complemento; ya sea asociada a AAS o no (tasas de NV 70% a 80%)(17-21). Se recomiendan las HBPM por tener igual eficacia que las HNF y menos efectos secundarios (menos osteoporosis, menor incidencia de trombocitopenia inducida por heparina-HIT). Los GC (glucocorticoides) no se recomiendan. La gama globulina hiperinmune (IVIG) tiene un lugar sobre todo para casos refractarios o vinculados a plaquetopenia autoinmune. La tasa de NV en un trabajo que comparó IGIV fue de 57% versus 84% para el grupo que recibió HBPM más AAS(15). La hidroxicloroquina se reserva para las pacientes portadoras de LES, en las cuales tiene un beneficio sobre la evolución de la enfermedad y efecto antiplaquetario. Es segura en el embarazo. En estudio su uso para SAFE primario. Las estatinas, si bien tienen un rol antiinflamatorio y antitrombótico, se contraindican en el embarazo.
Se recomienda monitorear cifras plaquetarias durante el uso de heparinas y de indicarse AAS en puerperio, el consentimiento del neonatólogo. (ver tabla)
Conclusiones
Según las revisiones bibliográficas se concluye que son necesarios estudios de buena calidad estadística para claras recomendaciones en SAFE. Existen aún puntos controversiales.
Bibliografía
1. American College of Obstetricians and Gynecologists. Practice Bulletin Nro. 68: antiphospholipid syndrome. Obstet Gynecol 2005; 106(5 Pt 1): 1113-21.
2. Bates SM, Greer IA, Pabinger I, Sofaer S, Hirsh J; American College of Chest Physicians. Venous Thromboembolism, thrombophilia, antithrombotic therapy and pregnancy: American College of Chest Physicians Evidence-Based Clinical Preactice Guidelines (8th Edition). Chest 2008; 133(6 Suppl): 844S-86S.
3. Otero AM, Sarto A, Amigo MC, Mijares M, Amante de Guggiari P, De Lisa E, et al. Trombofilia y embarazo: consenso del Grupo CLAHT. Arch Med Interna (Montevideo) 2008; 30(2/3): 59-63.
4. Lussana F, Dentali F, Abbate R, d'Aloja E, D'Angelo A, De Stefano V, et al; Italian Society for Haemostasis and Thrombosis. Screening for thrombophilia and antithrombotic prophylaxis in pregnancy: Guidelines of the Italian Society for Haemostasis and Thrombosis (SISET). Thromb Res 2009; 124(5): e19-25.
5. Royal College of Obstetricians and Gynaecologists. The investigation and treatment of couples with recurrent miscarriage: Green-top guideline no. 17. London: RCOG, 2003.
6. Wilson WA, Gharavi AE, Koike T, Lockshin MD, Branch DW, Piette JC, et al. International consensus statement on preliminary classification criteria for definite antiphospholipid syndrome: report of an international workshop. Arthritis Rheum 1999; 42(7): 1309-11.
7. Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome. J Thromb Haemost 2006; 4(2): 295-306.
8. Reber G, Tincani A, Sanmarco M, de Moerloose P, Boffa MC; Standardization group of the European Forum on Antiphospholipid Antibodies. Proposals for the measurement of anti-beta2-glycoprotein I antibodies. Standardization group of the European Forum on Antiphospholipid Antibodies. J Thromb Haemost 2004; 2(10): 1860-2.
9. Robertson L, Wu O, Langhorne P, Twaddle S, Clark P, Lowe GD, et al; Thrombosis Risk and Economic Assessment of Thrombophilia Screening (TREATS) Study. Thrombophilia in pregnancy: a systematic review. Br J Haematol 2006; 132(2): 171-96.
10. Yasuda M, Takakuwa K, Tokunaga A, Tanaka K. Prospective studies of the association between anticardiolipin antibody and outcome of pregnancy. Obstet Gynecol 1995 Oct; 86(4 Pt 1): 555-9.
11. Opatrny L, David M, Kahn SR, Shrier I, Rey E. Association between antiphospholipid antibodies and recurrent fetal loss in women without autoimmune disease: a metaanalysis. J Rheumatol 2006; 33(11): 2214-21.
12. Roqué H, Paidas MJ, Funai EF, Kuczynski E, Lockwood CJ. Thrombophilias are not associates with early pregnancy loss. Thromb Haemost 2004; 91(2): 290-5.
13. Oshiro BT, Silver RM, Scott JR, Yu H, Branch DW. Antiphospholipid antibodies and fetal death. Obstet Gynecol 1996; 87(4): 489-93.
14. Cowchock FS, Reece EA, Balaban D, Branch DW, Plouffe L. Repeated fetal losses associated with antiphospholipid antibodies: a collaborative randomized trial comparing prednisone with low dose heparin treatment. Am J Obstet Gynecol 1992; 166(5): 1318-23.
15. Triolo G, Ferrante A, Ciccia F, Accardo-Palumbo A, Perino A, Castelli A, et al. Randomized study of subcutaneous low molecular wieght heparin plus aspirin versus intravenous immunoglobulin in the treatment of recurrent fetal loss associated with antiphospholipid antibodies. Arthritis Rheum 2003; 48(3): 728-31.
16. Pattison NS, Chamley LW, Birdsall M, Zanderigo AM, Liddell HS, McDougall J. Does aspirin have a role in improving pregnancy outcome foor women with antiphospholipid syndrome? A randomized controlled trial. Am J Obstet Gynecol 2000; 183(4): 1008-12.
17. Empson M, Lassere M, Craig JC, Scott JR. Recurrent pregnancy loss with antiphospholipid antibody: a systematic review of therapeutic trials. Obstet Gynecol 2002; 99(1): 135-44.
18. Rai R, Cohen H, Dave M, Regan L. Randomized controlled trial of aspirin and aspirin plus heparin in pregnant women with recurrent miscarriage associated with phospholpid antibodies. BMJ 1997; 314(7076): 253-7.
19. Kutteh WH. Antiphospholipid antibody-associated recurrent pregnancy loss: treatment with heparin and low-dose aspirin is superior to low-dose aspirin alone. Am J Obstet Gynecol 1996; 174(5): 1584-9.
20. Noble LS, Kutteh WH, Lashey N, Franklin RD, Herrada J. Antiphospholipid antibodies associated with recurrent pregnancy loss: prospective, multicenter, controlled pilot study comparing treatment with low-molecular-weight heparin versus unfractionated heparin. Fertil Steril 2005; 83(3): 684-90.
21. Farquharson RG, Quenby S, Greaves M. Antiphospholipid síndrome in pregnancy: a randomized controlled trial of treatment. Obstet Gynecol 2002; 100(3): 408-13.
7) Preeclampsia
Dra. Isabel Moro
Definiciones
Pre-E: presión arterial (PA)=140/90 mm Hg + proteinuria = 0,3g de 24 horas luego de la semana 20 de EG (ACO&G)
Pre-E severa: = 160/110 mm Hg, proteinuria = 5 g de 24 horas, oliguria, edemas, dolor en epigastrio o HD, disturbios cerebrales o visuales y/o edema pulmonar. Alteración de función hepática y trombocitopenia (síndrome HELLP)
Eclampsia: convulsiones en el contexto de Pre-E.
Factores de riesgo para desarrollar Pre-E
Índice de masa corporal (IMC)> 35 kg/m2, diabetes, HTA previa, enfermedad renal, edad = 35 años, Pre-E previa.
La presencia de TH o adquirida puede contribuir a la expresión de severidad una vez que la Pre-E se ha desarrollado(3).
Se encontró asociación entre TF y Pre-E severa. No se ha encontrado asociación entre mayor incidencia de Pre-E y TF.
La clínica de la Pre-E es proteiforme, dependiente del fenotipo de cada paciente y de la presencia de factores de riesgo. Se puede considerar como una respuesta materna a la placentación anormal.
Pronóstico
El 6% a 55% presentan riesgo de recurrencia. Mayor riesgo si Pre-E < 28 semanas de gestación (precoz) y HTA crónica. El 35% de embarazadas con HTA gestacional (previo a semana 34) desarrollarán Pre-E. Por otra parte, se asocia a mayor riesgo materno de HTA, cardiopatía isquémica y stroke a largo plazo.
Haber padecido Pre-E severa y precoz en embarazos previos puede ser indicación de derivación a hematólogo para valoración de SAF (ver capítulo de SAFE)(1).
Valorar en cada caso particular la solicitud del resto de exámenes de trombofilia; en reportes se las asoció a mayor severidad de Pre-E. Un metaanálisis de 25 estudios de 11.500 mujeres concluye sobre la asociación significativa de Pre-E y las siguientes trombofilias: FVL y FII G20210A heterocigoto y MTHFR homocigoto, ACA + e hiperhomocisteinemia(3). Las proteínas C y S y la AT no se asociaron ni a mayor incidencia ni a mayor severidad de Pre-E, por lo que no se sugiere su solicitud(2,3).
Polimorfismos de la ACE (enzima conversora de angiotensina): en ausencia de trombofilia parecen ser un marcador predictivo de muerte fetal. La ACE está involucrada en eventos clave de la hemostasis y en procesos inflamatorios relacionados con Pre-E, además de su rol como modulador del tono vascular y de la proliferación de la célula muscular. Los polimorfismos de la ACE fueron asociados con mayor incidencia de Pre-E severa y según algunos autores su presencia sería indicación de profilaxis con HBPM 40 mg /día en embarazos futuros(2,4).
Recomendaciones según revisión bibliográfica
1) No se recomienda el uso de HBPM profiláctica en mujeres con antecedentes personales (AP) de Pre-E(1,2,5) (excepto SAFE).
2) Se recomienda el uso de ácido acetil salicílico (AAS) 75-100 mg/día (en la noche) (2B) comenzando previo a la planificación del embarazo (3B) y continuar hasta el parto (1A).
3) Suplementar con calcio 1 g/día a mujeres que consumen menos de 600 mg de calcio diario (1A).
4) La recomendación 2) pasa a ser (1A) en caso de mujeres con alto riesgo de Pre-E (<18 años, multíparas, AP de Pre-E severa en gestación previa)(1,2,5).
*Recomendaciones consensuadas en PARO (ver anexo)
Bibliografía
1. Bates SM, Greer IA, Pabinger I, Sofaer S, Hirsh J; American College of Chest Physicians. Venous thromboembolism, thrombophilia antithrombotic therapy, and pregnancy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008; 133(6 Suppl): 844S-86S.
2. Lowe SA, Brown MA, Dekker GA, Gatt S, McLintock CK, McMahon LP, et al; Society of Obstetric Medicine of Australia and New Zealand. Guidelines for the management of hypertensive disorders of pregnancy 2008. Aust N Z J Obstet Gynaecol 2009; 49(3): 242-6.
3. Robertson L, Wu O, Langhorne P, Twaddle S, Clark P, Lowe GD, et al; Thrombosis Risk and Economic Assessment of Thrombophilia Screening (TREATS) Study. Thrombophilia in pregnancy: a systematic review. Br J Haematol 2006; 132(2): 171-96.
4. Mello G, Parretti E, Fatini C, Riviello C, Gensini F, Marchionni M, et al. Low molecular weight heparin lowers the recurrence rate of preeclampsia and restores the physiological vascular changes in angiotensin-converting enzyme DD women. Hypertension 2004; 45(1): 86-91.
5. Magee LA, Helewa M, Moutquin JM, von Dadelszen P; Hypertension Guideline Committee; Strategic Training Initiative in Research in the Reproductive Health Sciences (STIRRHS) Scholars. Diagnosis, evaluation, and management of the hypertensive disorders of pregnancy. J Obstet Gynaecol Can 2008; 30(3 suppl 1): S1-48.
8) Rol de la ecografía y eco Doppler color
Dr. Marcelo De Agostini, Dra. Inés Alonzo, Dra. Rosario Morán, Dra. Cristina Cordano
Consideraciones generales
La vigilancia prenatal tiene como objetivo proporcionar información acerca de la salud fetal, para lo cual entre otros parámetros es fundamental el estudio de su crecimiento y hemodinamia.
La ecografía obstétrica hoy día es una herramienta inocua, no invasiva y de bajo costo que nos permite la determinación y el seguimiento de la biometría fetal en función de la edad gestacional, con la posibilidad de elaborar "curvas" de crecimiento (1-3). En base a estas es posible la pesquisa precoz de la restricción del crecimiento fetal, que comprende a aquellos fetos que no pueden alcanzar su potencial de crecimiento predeterminado (menor al P5) y se asocia a mayor morbimortalidad perinatal como ya ha sido ampliamente demostrado(4).
De los parámetros biométricos ecográficos, el "perímetro abdominal" ha demostrado ser el de mayor sensibilidad y especificidad para la detección de la restricción de crecimiento fetal (RCF)(3,5,6). El estudio ecográfico se completa con la valoración del líquido amniótico y de la placenta (maduración, decolamientos, hematomas), elementos estos que también pueden mostrar cambios cuando se altera la salud fetal.
El eco Doppler color-feto-placentario permite el estudio del flujo sanguíneo materno-fetal y de la circulación placentaria de forma no invasiva, inocua y reproducible. Su eficacia ha sido demostrada en el control del embarazo de alto riesgo obstétrico (EARO), logrando una reducción de la mortalidad perinatal de 49% vinculada a la hipoxia crónica, así como otras complicaciones y costos vinculados al embarazo y parto(7-10).
El eco Doppler-feto-placentario evalúa los compartimentos maternos (arterias uterinas), placentario (arteria umbilical) y fetal (arteria cerebral media [ACM]). También permite el estudio de flujos venosos (ductus venoso, vena vava inferior, vena umbilical)(10,11).
Las arterias uterinas sufren cambios propios del embarazo que llevan a una disminución gradual de la impedancia en estas hasta las 24 semanas, logrando un flujo de baja resistencia que se mantiene normalmente por el resto de la gravidez. Son cambios patológicos los aumentos de la resistencia en estos vasos o la persistencia de Notch (incisión protodiastólica) del lado placentario o bilateral(12). La persistencia de Notch en el tercer trimestre es un elemento de alerta y por tanto de vigilancia de la salud fetal(13).
La arteria umbilical conceptualmente evalúa la placenta. La insuficiencia placentaria se refleja en la disminución de los flujos de fin de diástole en este vaso y/o por aumentos de su resistencia, lo cual no solo es un marcador de RCF de causa placentaria, sino que además es un signo de hipoxia fetal y plantea necesidad de vigilancia estricta. La ausencia de flujo de fin de diástole o el flujo reverso son indicadores que se asocian con una mortalidad perinatal elevada(11,14,15).
El feto ante la hipoxia crónica reacciona poniendo en juego mecanismos compensadores con el fin de preservar órganos nobles. En estudios prospectivos ha sido demostrado que este efecto protector alcanza su máxima intensidad 2 a 3 semanas antes de que se presenten alteraciones en el monitoreo fetal(11,14-16).
La aparición de vasodilatación en la ACM se considera un signo de alerta y vigilancia estricta, a diferencia de cuando desaparece (retorna a valores de alta resistencia), momento que se considera de alarma dado que se corresponde con fetos graves con acidosis y riesgo de muerte fetal inminente. Pueden considerarse además relaciones en la toma de decisiones obstétricas. Se ha visto que la relación cerebro/umbilical predice "mejor" el riesgo y el aumento de la morbimortalidad que la arteria umbilical por sí sola. La alteración de los flujos venosos es un signo tardío y se corresponde con descompensación de los mecanismos compensadores, por tanto reflejan acidosis e insuficiencia cardíaca y preceden a la muerte fetal. De las alteraciones venosas se pueden destacar: vena umbilical pulsátil, flujo reverso en la vena cava inferior y aumento del índice de pulsatilidad en el ductus venoso con flujo ausente o reverso. El hallazgo de un flujo alterado en cualquiera de estos vasos venosos se correlaciona con un PH < a 7,2. Las alteraciones en el ductus preceden en días a la muerte fetal(8,17-20).
Vigilancia fetal y trombofilia
Las trombofilias son un grupo heterogéneo de alteraciones, que como se ha discutido a lo largo de la guía, algunas de ellas pueden asociarse a malos resultados obstétricos. Sin embargo, no todas las "trombofilias" se asocian a complicaciones materno-perinatales, por lo cual deben identificarse claramente aquellas que requieren de un control más estricto y eventualmente se vean beneficiadas por el tratamiento médico. En nuestro medio se ha generalizado que las pacientes con trombofilia y mala historia obstétrica deben considerarse de alto riesgo y debe indefectiblemente extremarse el control de salud fetal. Sin embargo, esta recomendación está basada en evidencia indirecta, extrapolada de estudios que demostraron asociación entre las pruebas de salud fetal y la morbimortalidad perinatal pero en poblaciones específicas (por ejemplo, RCIU, síndrome Pre-E)(4), pero no precisamente en poblaciones con trombofilias.
Se ha determinado que cuando la trombofilia se asocia con estos resultados -como la presencia de RCIU- la utilización de la ecografía Doppler tiene su máxima efectividad aumentando el valor predictivo positivo y la posibilidad de detectar poblaciones con alteración de la salud fetal. Cuando estos estudios se utilizan en forma de tamizaje (por ejemplo, paciente con trombofilia pero ausencia de alteraciones materno-fetales clínicas) el valor predictivo positivo desciende dramáticamente y se pone en duda la efectividad del estudio.
La búsqueda bibliográfica actualizada a la fecha en que se finalizó esta guía nos demuestra que aún no existen publicaciones que nos permitan realizar recomendaciones basadas en buena evidencia y con un claro beneficio.
En cuanto al manejo del tratamiento con anticoagulantes y el control mediante eco Doppler-feto-útero-placentario, se han publicado estudios observacionales y experimentales muy limitados (en calidad y en tamaño muestral) que han sugerido que el tratamiento con anticoagulantes logra una mejora de los diferentes parámetros hemodinámicos a nivel de la arterial umbilical(21-23) sin identificar beneficios clínicos relevantes.
En base a lo previamente descripto surge que a nivel internacional no existen guías clínicas específicas para el seguimiento ecográfico ni con Doppler-feto-placentario de los embarazos complicados con trombofilia. Sin embargo, existe la necesidad de pautar el seguimiento de estos embarazos realizando recomendaciones genéricas para ayudar a los clínicos en el seguimiento ecográfico y con Doppler-feto-placentario. Las evidencias relacionadas al control de la salud fetal y extrapoladas de poblaciones de alto riesgo obstétrico nos permiten clasificarla como evidencia de buena calidad asociadas con beneficio (1A y 1B); sin embargo, el uso de la ecografía Doppler en pacientes para guiar el tratamiento anticoagulante se basa en recomendaciones donde no existe evidencia para aconsejar ni desaconsejar su uso, por lo cual deberá ser evaluado por el clínico tratante.
*Recomendaciones consensuadas en PARO (ver anexo)
Bibliografia
1. Campbell S, Dewhurst CJ. Diaqgnosis of the small for datas fetus by serial ultrasonic cephalometry. Lancet 1971; 2(7732): 1002-6.
2. Fescina RH, Ucieda FC, Cordano MC, Nieto F, Tenzer SM, López R. Ultrasonic patterns of intrauterine foetal growth in a Latin American country. Early Hum Dev 1982; 6(3): 239-48.
3. Royal College of Obstetricians and Gynecologists. The investigation and management of the small-for-gestational-age fetus: Guideline No.31. London: RCOG, 2002.
4. Resnik R. Intrauterine growth restriction. Obstet Gynecol 2002; 99(3): 490-6.
5. Cordano MC, Compte E, Bessis R, Papiernik E. Longitudinal follow-up of 100 patients at risk of intrauterine growth retardation: comparison of diagnosis in two periods. J Perinat Med 1988; 16(1): 61-6.
6. American College of Obstetricians and Gynecologists. Practice Bulletin Nro. 12: intrauterine growth restriction. Washington DC: ACOG; 2000.
7. Campbell S, Wilkin D. Ultrasonic measurement of fetal abdomen circumference in the estimation of fetal weight. Br J Obstet Gynaecol 1975; 82(9): 689-97.
8. Alfirevic Z, Stampalija T, Gyte GM. Fetal and umbilical Doppler ultrasound in high-risk pregnancies. Cochrane Database Syst Rev 2010; (1): CD007529.
9. Cnossen JS, Morris RK, ter Riet G, Mol BW, van der Post JA, Coomarasamy A, et al. Use of uterine artery Doppler ultrasonography to predict pre-eclampsia and intrauterine growth restriction: a systematic review and bivariable meta-analysis. CMAJ 2008; 178(6): 701-11.
10. Gagnon R, Van den Hof M; Diagnostic Imaging Committee, Executive and Council of the Society of Obstetricians and Gynaecologists of Canada. The use of fetal Doppler in obstetrics. J Obstet Gynaecol Can 2003; 25(7): 601-14.
11. Baschat AA, Gembruch U, Harman CR. The sequence of changes in Doppler and biophysical parameters as severe fetal growth restriction worsens. Ultrasound Obstet Gynecol 2001; 18(6): 571-7.
12. Becker R, Vonk R. Doppler sonography of uterine arteries at 20-23 weeks: depth of notch gives information on proba-bility of adverse pregnancy outcome and degree of fetal growth restriction in a low-risk population. Fetal Diagn Ther 2010; 27(2): 78-86.
13. Harrington K, Cooper D, Less C, Hecher K, Campbell S. Doppler ultrasound of the uterine arteries: the importance of bilateral notching in the prediction of the pre-eclampsia placental abruption, or delivery of a small for gestational age baby. Ultrasound Obstet Gynecol 1996; 7(3): 182-8.
14. Bilardo CM, Wolf H, Stigter RH, Ville Y, Baez E, Visser GH, et al. Relationship between monitoring parameters and perinatal outcome in severe, early intrauterine growth res-triction. Ultrasound Obstet Gynecol 2004; 23(2): 119-25.
15. Turan OM, Turan S, Gungor S, Berg C, Moyano D, Gembruch U, et al. Progression of Doppler abnormalities in intrauterine growth restriction. Ultrasound Obstet Gynecol 2008; 32(2): 160-7.
16. Hecher K, Bilardo CM, Stigter RH, Ville Y, Hackeloer BJ, Kok HJ, et al. Monitoring of fetuses with intrauterine growth restriction: a longitudinal study. Ultrasound Obstet Gynecol 2001; 18(6): 564-70.
17. Morris RK, Selman TJ, Verma M, Robson SC, Kleijnen J, Khan KS. Systematic review and meta-analysis of the test accuracy of ductus venosus Doppler to predict compromise of fetal/neonatal wellbeing in high risk pregnancies with placental insufficiency. Eur J Obstet Gynecol Reprod Biol 2010; 152(1): 3-12.
18. Morris RK, Malin G, Robson SC, Kleijnen J, Zamora J, Khan KS. Fetal umbilical artery Doppler to predict compromise of fetal/neonatal wellbeing in a high risk population: systematic review and bivariate meta-analysis. Ultrasound Obstet Gynecol 2011; 37(2): 135-42.
19. Brar HS, Platt LD. Reverse end-diastolic flow velocity on umbilical artery velocimetry in high-risk pregnancies: an ominous finding with adverse pregnancy outcome. Am J Obstet Gynecol 1988; 159(3): 559-61.
20. Valcamonico A, Danti L, Frusca T, Soregaroli M, Zucca S, Abrami F, et al. Absent end-diastolic velocity in umbilical artery: risk of neonatal morbidity and brain damage. Am J Obstet Gynecol 1994; 170(3): 796-801.
21. Yu YH, Shen LY, Wang ZJ, Zhang Y, Su GD. Effect of heparin on umbilical blood flow in patients with fetal growth retardation. Di Yi Jun Yi Da Xue Xue Bao 2004; 24(4): 423-5.
22. Chu HN. Effect of heparin on the ratio of peak systolic to least diastolic flow velocity of umbilical artery at second-trimester pregnancies. Zhonghua Fu Chan Ke Za Zhi 2005; 40(2): 109-11.
23. Magriples U, Ozcan T, Karne A, Copel JA. The effect of anticoagulation on antenatal ultrasound findings in pregnant women with thrombophilia. J Matern Fetal Neonatal Med 2006; 19(1): 27-30.
9) Dímeros D (DD) o antígeno D
Dra. Cecilia Guillermo, Dra. Graciela Pedreira
El antígeno D-dímero es un marcador de la degradación de la fibrina que se forma por la acción secuencial de tres enzimas: la trombina, el factor XIIIa y la plasmina. La utilidad clínica de la determinación de los D-dímeros ha sido establecida en múltiples situaciones, especialmente para la exclusión de ETEV(1,2).
Los ensayos comerciales actuales miden un epítope de los productos de degradación de la fibrina-FXIIIa por diferentes métodos. Todos usan anticuerpos monoclonales que detectan este epítope luego de la acción del FXIIIa sobre la fibrina, y no los productos de degradación del fibrinógeno o de la fibrina previamente a la exposición del FXIIIa(1,3).
Se ha comparado el desempeño de múltiples ensayos para la detección de D-dímeros y su rol potencial en el diagnóstico de ETEV. ELISA, ensayos de fluorescencia, ELISA en microplaca y los ensayos turbidimétricos automatizados cuantitativos tienen más alta sensibilidad que la aglutinación de sangre entera (95% versus 85%) pero muy baja especificidad (50% versus 70%)(1,3).
De ahí que la mayor utilidad de la detección de D-dímeros en la ETEV sea por su alto valor predictivo negativo especialmente en población de bajo riesgo para ETEV.
La naturaleza del D-dímero como antígeno y su comportamiento en los diferentes ensayos hace que sea necesaria una adecuada utilización e interpretación de los resultados en el contexto clínico del paciente, y que desde el laboratorio se establezcan los valores de corte para cada población en estudio de tal manera que la decisión clínica sea la más apropiada(1,3).
En el embarazo se agrega, además, el hecho de que numerosos marcadores de activación de los sistemas de coagulación y fibrinólisis, entre ellos los D-dímeros, se encuentran aumentados, indicando una activación de la trombina y de la fibrinólisis luego de la fibrinoformación. A esto se agrega la necesidad imperiosa de establecer valores de corte de acuerdo a la edad gestacional y para cada técnica utilizada con el objetivo de establecer niveles de decisión terapéutica(4,5).
En este contexto surge la hipótesis de que la determinación de D-dímeros durante la gestación pudiera ser de utilidad en el diagnóstico y predicción de ETEV, complicaciones del embarazo y monitorización del tratamiento antitrombótico. Sin embargo, el hecho de que el embarazo normal de mujeres sanas se acompañe de aumento progresivo de los D-dímeros, empaña la utilidad clínica de este ensayo(4).
Esta hipótesis fue desarrollada en nuestro país por la Dra. Ana María Otero, quien en su trabajo "D-dímeros ELISA en el control biológico de los tratamientos con heparina de bajo peso molecular del embarazo"(6), plantea dos objetivos primarios: "a) Mostrar los valores esperados de D-dímeros ELISA en los tres trimestres del embarazo de pacientes que siendo tratadas con HBPM por diferentes causas de trombofilia, cursaron su gestación sin complicaciones atribuibles a la misma, obteniendo como producto final un recién nacido vivo, y b) Mostrar la sensibilidad de los mismos para advertir la aparición de complicaciones obstétricas que pueden aparecer aun bajo tratamiento con las dosis comúnmente empleadas de HBPM".
En cuanto a las características de la población, "para el primer objetivo se incluyeron 113 pacientes con trombofilia documentada y malos antecedentes obstétricos que cursaron un nuevo embarazo bajo tratamiento con HBPM sin complicaciones y con recién nacido vivo". Para el segundo objetivo se presentan como ejemplo cuatro pacientes con SAFE y pérdida recurrente de embarazo que cursando un nuevo embarazo con HBPM mostraron una elevación inesperada de los D-dímeros coincidiendo con la aparición de complicaciones obstétricas".
A partir de los estudios realizados, concluye: "De esta manera podemos obtener algunas conclusiones y hacer algunas sugerencias:
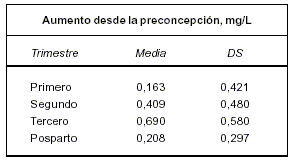
1. Los D-dímeros ELISA aumentan progresivamente durante todo el embarazo en estas pacientes como sucede en un embarazo normal.
2. La duplicación del valor de los D-dímeros de un mes a otro es sugestiva de una activación excesiva de la coagulación, que deberá valorarse en conjunto con el obstetra. Si en esa valoración no se demuestran complicaciones se pasará a una vigilancia clínica más cercana.
3. La triplicación del valor de los D-dímeros en 30 días es una indicación de aumentar la dosis de HBPM, realizar control de crecimiento fetal y circulación feto placentaria en conjunto con el obstetra".
En base a esta recomendación de experto (nivel de evidencia 3-4, C), se puso en práctica en nuestro país el control de las gestaciones complicadas con trombofilia y tratadas con HBPM, con D-dímeros cuantitativos en forma periódica y modificándose la dosis de HBPM de acuerdo a las sugerencias surgidas en este trabajo.
Sin embargo, a nivel internacional esta no es una práctica difundida.
En el trabajo de Yacizugliu y colaboradores "The Role of Uterine Artery Doppler and Maternal Serum D-dimer Levels in Prediction of Preterm Labor", estos autores concluyen que los niveles de D-dímeros en el plasma materno y el Doppler de las arterias uterinas serían dos parámetros promisorios como predictores de parto prematuro, pero estas conclusiones deberían ser respaldadas por estudios prospectivos más amplios antes de realizar una recomendación formal sobre su uso clínico(7).
Dada la escasa bibliografía hallada, se consultaron a otros expertos en cuanto al uso de los D-dímeros en este escenario en su práctica diaria y se encontró que los mismos no son utilizados con estos objetivos(8) (nivel de evidencia 4, C).
Serían deseables, y es conocido que se encuentran en marcha, estudios estadísticamente robustos que respalden la experiencia adquirida durante años en nuestro país y evidencien la utilidad de los D-dímeros en las gestaciones complicadas con trombofilia.
Otro aspecto que dificulta el uso práctico de los D-dímeros en el embarazo es la necesidad de establecer valores de referencia para cada trimestre, valores de corte para cada patología, y cada técnica utilizada, y cada población de usuarias.
En este sentido, contamos con algunas publicaciones que tratan este punto.
Otero y colaboradores(6) establecen para pacientes con trombofilia documentada y malos antecedentes obstétricos que cursaron un nuevo embarazo bajo tratamiento con HBPM sin complicaciones y con recién nacido vivo, los siguientes valores de referencia: (ver tabla)
Kline y colaboradores(9) establecen los siguientes valores de referencia en 50 embarazadas sin trombofilia cursando gestaciones normales, utilizando quimioluminiscencia en la determinación de D-dímeros. (ver tabla)
Finalmente, en el trabajo de Kovac y colaboradores se establecen valores de corte para predecir ETEV durante el embarazo(5) en una población de 89 embarazadas sanas y 12 con sospecha de ETEV. Para la determinación de D-dímero se utilizó D-dimer testing HemosIl D-dimer HS (IL), test rápido automatizado cuantitativo por inmunoaglutinación basado en látex (valor de ref. 230 ng/mL).
Los valores propuestos fueron 286 para el primer trimestre, 457 para el segundo y 644 ng/mL para el tercero.
Conclusiones
Por lo tanto, no se encuentra hasta el momento en la bibliografía revisada evidencia suficiente para recomendar la utilización de los D-dímeros en el seguimiento de pacientes embarazadas portadoras de trombofilia con gestaciones complicadas, ni para la toma de decisiones terapéuticas basadas en su determinación(1,4) (4C).
Bibliografía
1. Adam SS, Key NS, Greenberg CS. D-dimer antigen: current concepts and future prospects. Blood 2009; 113(13): 2878-87.
2. Philbrick JT, Heim S. The d-dimer test for deep venous thrombosis: gold standards and bias in negative predictive value. Clin Chem 2003; 49(4): 570-4.
3. Siemens Healthcare Diagnostic. D-Dimer PLUS. Dade Behring. New York: Siemens, 2003. Disponible en: http://www.dadebehring.com [Consulta: 24 may 2010].
4. Eichinger S. D-dimer testing in pregnancy. Pathophysiol Haemost Thromb 2003/2004; 33(5-6): 327-9.
5. Kovac M, Mikovic Z, Rakicevic L, Srzentic S, Mandic V, Djordjevic V, et al. The use of D-dimer with new cutoff can be useful in diagnosis of venous thromboembolism in pregnancy. Eur J Obstet Gynecol Reprod Biol 2010; 148(1): 27-30.
6. Otero AM, Lens D, Pons E, Pou Ferrari R, Attarian D, Motta N. D-dímeros ELISA en el control biológico de los tratamientos con heparina de bajo peso molecular del embarazo. Rev Med Urug 2006; 22(1): 52-8.
7. Yazicioglu F, Rusen OR, Özsoy B, Aygün M, Özyurt ON, Demirbas R, Çebi Z. The role of uterine artery doppler and maternal serum d-dimer levels in prediction of preterm labor. Perinatal J 2007; 15(3): 99-107.
8. Sarig G, Many A, Gris Christophe J, Middeldorp S, Carp H, De Santis M, et al. Uso de los d-dímeros: Comunicación personal. (*).[Consulta: 21 abr-15 may 2010].
9. Kline JA, Williams GW, Hernandez-Nino J. D-Dimer Concentrations in Normal Pregnancy: New Diagnostic Thresholds Are Needed. Clin Chem 2005 May; 51(5): 825-9.
Nota: (*), mails a disposición del lector (hematología@hc.edu.uy)
10) Lipoproteína A
Dra. Graciela Pedreira, Dra. Cecilia Guillermo
La lipoproteína a (LipoA) fue descripta por Berg en 1963 y pertenece a las LP con mayor poder trombogénico. Respecto a su estructura la LipoA es una LP de baja densidad (LDL). Su acción fisiológica no es bien conocida, ya que personas con valores indetectables de la misma no presentan un fenotipo específico. Numerosos estudios, por otra parte, han demostrado que valores aumentados de LipoA en plasma se asocian con aumento del riesgo para el desarrollo de patología aterotrombótica (enfermedad coronaria, arteriopatía obstructiva, accidente cerebrovascular)(1,2).
Su síntesis se realiza a nivel hepático y poco se sabe sobre su catabolismo. El riñón tiene una función importante en el mismo, ya que pacientes con síndrome nefrótico o insuficiencia renal severa presentan aumento de la concentración plasmática de LipoA. La LipoA es una forma modificada de LDL en la cual una gran glicoproteína, ApoA, se une en forma covalente a la ApoB a través de puentes disulfuro. La ApoA contiene cinco dominios ricos en cisteína, llamados "kringles" por su parecido con las galletitas danesas de ese nombre(3).
El cuarto kringle es homólogo al dominio del plasminógeno que se une a la fibrina. Dada esta homología, la LipoA interfiere en la fibrinólisis compitiendo con el plasminógeno en su unión molecular(3).
La LipoA también se une a macrófagos a través de un receptor de alta afinidad que promueve la formación de células espumosas, así como el depósito de colesterol en las placas de ateroma. Elevadas concentraciones de LipoA tendrían una actividad antifibrinolítica. La LipoA inhibe competitivamente al plasminógeno en su unión al fibrinógeno y fibrina, inhibiendo también la activación del plasminógeno a plasmina a través de la vía del tPA(3).
Como otros compuestos que contienen grupos sulfidrilo, la homocisteína aumenta la unión de la LipoA a la fibrina.
La LipoA estimularía la síntesis de PAI I en las células endoteliales y PAI II en los monocitos. También tiene la propiedad de unirse al TFPI, regulador de la vía de coagulación dependiente de factor tisular, expresado en monocitos, células endoteliales y plaquetas, inactivando este factor(3).
También tendría propiedades antitrombogénicas inhibiendo, por ejemplo, la agregación plaquetaria inducida por colágeno, lo que explicaría la diferencia de conclusiones realizadas en diferentes cohortes de pacientes.
No obstante, existe un porcentaje elevado de estudios que concluyen en su importancia como factor de riesgo independiente, en la ocurrencia de síndromes coronarios, accidente cerebrovascular (ACV), trombosis y trombo embolismo venoso. Como ya mencionáramos esta propiedad se relacionaría por su similitud estructural con el plasminógeno(3).
El embarazo se asocia con un estado de hipofibrinólisis. El aumento de la LipoA influye en la fibrinólisis y podría tener un efecto desfavorable en la evolución del mismo. La concentración de LipoA aumenta en el embarazo normal entre las 10 y 35 semanas de gestación, duplicando su valor aproximadamente(4,5).
Los estudios realizados a pacientes con y sin embarazos complicados brindan resultados diversos.
Las pacientes con Pre-E suelen tener valores aumentados de LipoA(6).
Elevadas concentraciones plasmáticas de LipoA, genéticamente determinada, son un factor de riesgo conocido de la enfermedad cardiovascular. Del mismo modo influirían en el desarrollo de la Pre-E al promover una disfunción endotelial, teniendo a nivel de la placenta un ambiente fibrinolítico empobrecido(3).
Los métodos utilizados para determinar las concentraciones plasmáticas de LipoA son de diferente tipo: electroforéticos, electroinmunodifusión, EIA, RIA, inmunoturbidimetria y ELISA(7).
En nuestro medio se realizó un trabajo para establecer la "Prevalencia de altas concentraciones de lipoproteína (a) en embarazos complicados con restricción del crecimiento fetal intrauterino"(8).
Transcribimos los resultados obtenidos en la tabla 1.
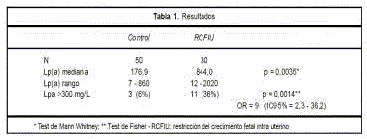
Este trabajo concluye: "La Lp(a) se encontró en valores superiores a 300 mg/L en 3/50 (6%) de la población control y en 11/30 (36,6%) de las mujeres con RCFIU. Los valores elevados de Lp(a) en las mujeres con RCFIU oscilaron entre 930 y 2.020 mg/L. Los valores elevados de Lp(a) se confirmaron fuera del embarazo en 100% de las mujeres con RCFIU. Todas las mujeres con niveles altos de Lp(a) tenían historia familiar de enfermedades cardiovasculares. Conclusión: existe una asociación significativa de altos niveles de Lp(a) en mujeres con RCFIU. Estudios más completos de los mecanismos fibrinolíticos podrían ser de interés en mujeres con RCFIU".
A nivel internacional, Gwendolyn TR y colaboradores(9) realizan una revisión respecto a la importancia de la determinación de la Lipo A durante el embarazo normal y complicado con preeclampsia o restricción del crecimiento intrauterino (RCIU). Se utilizó Medline, en una revisión desde enero de 1966 a mayo de 2003, para la búsqueda de artículos relevantes en inglés. Se identificaron publicaciones adicionales a través de las referencias bibliográficas de artículos seleccionados. Los estudios fueron revisados aplicando criterios estrictos predefinidos. La metodología y los resultados de los estudios de la Lp(a) en el embarazo normal y complicado fueron muy diversos. La Lp(a) en el transcurso de un embarazo normal puede aumentar o mantenerse inalterada. Se vio que mujeres con preeclampsia tuvieron valores de Lp(a) más altos, más bajos o inalterados, comparados con mujeres con embarazos normales.
En conclusión, los estudios publicados sobre Lp(a) en el embarazo difieren sustancialmente en los métodos de estudio utilizados, en el tamaño de las muestras, en el diseño del estudio y en la etnia de la población estudiada.
Por lo tanto, no hay evidencia suficiente hasta el momento que justifique en la mujer embarazada la determinación sistemática de la Lipo A como factor de riesgo obstétrico(*) (3C).
Sin embargo, en mujeres con patología obstétrica (abortos repetidos, RCIU, Pre-E) y antecedentes familiares de enfermedad aterotrombótica en edades precoces, podría considerarse su determinación, aunque por el momento no conlleva a la instauración de ninguna medida terapéutica.
*Recomendaciones consensuadas en PARO (ver anexo)
Bibliografía
1. Sattar N, Clark P, Greer IA, Shepherd J, Packard CJ. Lipoprotein (a) levels in normal pregnancy and in pregnancy complicated with preeclampsia. Atherosclerosis 2000; 148(2): 407-11.
2. Manten GT, Voorbij HA, Hameeteman TM, Visser GH, Franx A. Lipoprotein (a) in pregnancy: a critical review of the literature. Eur J Obstet Gynecol Reprod Biol 2005; 122 (1): 13-21.
3. Siekmeier R, Scharnagl H, Kostner GM, Grammer T, Stojakovic T, März W. Lipoprotein (a): structure, epidemiology, function and diagnostic of a cardiovascular risk marker. Open Clin Chem J 2008; 1: 79-91.
4. Manten GT, Franx Y, van der Hoek YY, Hameeteman TM, Voorbij HA, Smolders HC, et al. Changes of plasma lipoprotein (a) during and after normal pregnancy in Caucasians. J Matern Fetal Neonatal Med 2003; 14(2): 91-5.
5. Mori M, Mori A, Saburi Y, Sida M, Ohta H. Levels of lipoprotein (a) in normal and compromised pregnancy. J Perinat Med 2003; 31(1): 23-8.
6. Manten GT, van der Hoek YY, Marko Sikkema J, Voorbij HA, Hameeteman TM, Visser GH, et al. The role of lipoprotein (a) in pregnancies complicated by pre-eclampsia. Med Hypotheses 2005; 64(1): 162-9.
7. Marcovina SM, Lippi G, Guidi G. Lipoprotein(a) immunoassays: comparison of a semi-quantitative latex method and two monoclonal enzyme immunoassays. Int J Clin Lab Res 1995; 25(4): 201-4.
8. Otero AM, Bianchi A, Dellepiane M, Pou Ferrari R, Storch E, Pons JE, et al. Prevalencia de altas concentraciones de lipoproteína (a) en embarazos complicados con restricción del crecimiento fetal intrauterino. Rev Med Urug 2005; 21(3): 236-41.
9. Manten GT, Voorbij HA, Hameeteman TM, Visser GH, Franx A. Lipoprotein (a) in pregnancy: a critical review of the literature. Eur J Obstet Gynecol Reprod Biol 2005; 122(1): 13-21.
11) Factor VIII. Niveles durante el embarazo y su relación con la pre-eclampsia, síndrome HELLP y RCIU severo
Dra. Graciela Pedreira, Dra. Cecilia Guillermo
El embarazo normal cursa con un estado de hipercoagulabilidad. El FVIII, entre otros, aumenta durante el embarazo(1).
Nos referiremos a la relevancia que pudieran tener los valores elevados de FVIII en relación con la presencia de ETEV, insuficiencia uteroplacentaria, en particular con la Pre-E, síndrome HELLP y RCIU(2).
Según Witsenburg y colaboradores(3), entre 1%-5% de los embarazos presentan complicaciones importantes tales como: Pre-E, síndrome HELLP, RCIU severo, aborto y prematurez. Ello se relacionaría con una pobre invasión trofoblástica de las arterias espiraladas maternas, lo que daría lugar a un síndrome de insuficiencia uteroplacentaria. El mecanismo de esta situación aún no está totalmente aclarado, pero se piensa que sería multifactorial: causas inmunológicas así como factores genéticos estarían involucrados. Entre ellos podría contarse la presencia de factores que intervienen en la coagulación sanguínea.
Estos autores estudiaron la importancia del FVIII y su vínculo con las complicaciones mencionadas(3-5).
Asimismo, los valores encontrados difieren según el grupo sanguíneo(3). Sin embargo, estos autores encontraron tanto en el grupo de pacientes embarazadas con ETEV, como en el grupo control, valores similares de FVIII C: 123 UI/dl, estratificando los mismos según el grupo sanguíneo ABO(3). Se encontró en este trabajo, usando un modelo de regresión logística ajustado a edad y grupo sanguíneo, que no habría un claro vínculo entre los niveles de FVIII y las complicaciones mencionadas a excepción del RCIU severo, con (OR 2.9, CI 1,0-8,7) o sin (OR 2.0, CI 0,7-6,4) hipertensión asociada. Se vio que el aumento de los niveles de FVIII se asociaría con un riesgo dos a tres veces mayor de presentar RCIU severo, si bien el tamaño de la muestra no permite sacar conclusiones definitivas(3).
Marietta y colaboradores evidenciaron que niveles elevados del FVIII podrían constituir un factor de riesgo para pérdidas de embarazo tempranas, aunque dada la variabilidad fisiopatológica que presenta este factor, no habría evidencia para incluirlo dentro de los estudios de screening para aborto recurrente(6).
Conclusión
Si bien se sabe que un aumento en los valores del FVIII se vincula a un mayor riesgo de eventos trombóticos, no se encontró una asociación similar respecto a complicaciones referidas al embarazo(7,8).
Bibliografía
1. Bremme KA. Haemostatic changes in pregnancy. Best Pract Res Clin Haematol 2003; 16(2): 153-68.
2. Prisco D, Ciuti G, Falciani M. Hemostatic changes in normal pregnancy. Haematol Rep 2005; 1(10): 1-5.
3. Witsenburg CP, Rosendaal FR, Middeldorp JM, Van der Meer FJ, Scherjon SA. Factor VIII levels and the risk of pre-eclampsia, HELLP syndrome, pregnancy related hypertension and severe intrauterine growth retardation. Thromb Res 2005; 115(5): 387-92.
4. Kraaijenhagen RA, in't Anker PS, Koopman MM, Reitsma PH, Prins MH, van den Ende A, et al. High plasma concentration of factor VIIIc is a major risk factor for venous thromboembolism. Thromb Haemost 2000; 83(1): 5-9.
5. James AH. Venous thromboembolism in pregnancy. Arterioscler Thromb Vasc Biol 2009; 29(3): 326-31.
6. Marietta M, Fachinetti F, Sgarbi L, Simoni L, Bertesi M, Torelli G, et al. Elevated plasma levels of factor VIII in women with early recurrent miscarriage. J Thromb Haemost 2003; 1(12): 2536-9.
7. Brenner B. Haemostatic changes in pregnancy. Thromb Res 2004; 114(5-6): 409-14.
8. James AH, Tapson VF, Goldhaber SZ. Thrombosis during pregnancy and the postpartum period. Am J Obstet Gynecol 2005; 193(1): 216-9.
12) Anexo
13) Participantes
Díaz, Lilián. (Profesora Directora de Cátedra de Hematología-Hospital de Clínicas-HC)
Sosa, Leonardo. (Profesor Director de Clínica Médica B y de UDA ARO HC)
Conselo, Estela. (Profesora Agregada de Cátedra Ginecotocológica B y de UDA ARO)
Sosa, Claudio. (Profesor Adjunto de Clínica Ginecotocológica CHPR/Profesor Adjunto del Departamento de Medicina Preventiva y Social - Instituto de Higiene)
Guillermo, Cecilia. (Profesora Agregada de Cátedra de Hematología-HC)
Isaurralde, Hugo. (Profesor Agregado de Cátedra de Hematología-HC)
Pedreira, Graciela. (Profesora Agregada de Laboratorio-Hematología-HC)
Zunino, Juan. (Profesor Adjunto de Cátedra de Hematología-HC)
Stevenazzi, Mariana. (Profesora Adjunta de Clínica Médica B y de UDA ARO HC)
Riva, Eloísa. (Asistente de Cátedra de Hematología-HC)
Moro, Isabel. (Ex Asistente de Cátedra de Hematología-HC)
Galeano, Sebastián. (Ex Asistente de Cátedra de Hematología-HC)
Kescherman, Francis. (Ex Asistente de Cátedra de Hematología-HC)
Rocca, Alejandra. (Asistente de Cátedra de Hematología-HC)
Oliver, Carolina. (Asistente interina de Cátedra de Hematología-HC)
De Agostini, Marcelo. (Profesor Adjunto de Clínica Ginecotocológica B- UDA ECO HC)
Cordano, Cristina. (Profesora Agregada de Ginecotocología B- UDA ECO de HC)
Alonzo, Inés. (Asistente de Clínica Ginecotocológica B-UDA ECO de HC)
Nozar, Fernanda. (Ex asistente de Clínica Ginecotocológica C y Docente Honoraria Especializada de Clínica Ginecotocológica A)
Lorenzo, Mariana. (Residente de Cátedra de Hematología-HC)
Sosa, Carolina. (Residente de Cátedra de Hematología-HC)
Córdoba, Carolina. (Residente de Cátedra de Hematología-HC)
Guadagna, Regina. (Residente de Cátedra de Hematología-HC)
Oholeguy, Paula. (Residente de Clínica Ginecotocológica B)
Morán, Rosario. (Residente de Clínica Ginecotocológica B)
Manzino, Andrea. (Hematóloga-PARO de CHPR-Lab. CHPR)
Damiano, Sandra. (Hematóloga-INCA)
Pérez, Natalia. (Asistente de Clínica Ginecotocológica B y de UDA ARO HC)
Cora, Mariana. (Ex Asistente de Clínica Médica B - GIII en UDA ARO de HC)
Guirado, Mariana. (Asistente de Clínica Médica B y de UDA ARO HC)
Leites, Laura. (Asistente de UDA ARO HC)
Zubiaurre, Valentina. (Asistente de Clínica Médica B y de UDA ARO HC)
Oper, Djalma. (Residente de Clínica Médica B)
Irureta, Sebastián. (Residente de Clínica Médica B)
Blanco, Lucía. (Postgrado de Hematología)
Villano, Fiorella. (Postgrado de Hematología)
Laluz, Florencia. (Hematóloga de Paysandú)
Santamarina, Cynthia. (Postgrado de Hematología)
Larraburu, Soledad. (Postgrado de Hematología)
De Guida, Rosanna. (Postgrado de Hematología)
Agradecemos el invalorable aporte de la Biblioteca Nacional de Medicina (BINAME) y del Centro Nacional de Documentación en Información en Medicina y Ciencias de la Salud (CENDIM), en la persona de la Lic. Carmen Poittevin, quien realizó la corrección de la presentación bibliográfica del trabajo en su conjunto.
Estas pautas serán revisadas por el grupo de trabajo cada dos años. Próxima revisión prevista para marzo de 2013 (o cuando el surgimiento de nueva evidencia lo haga necesario).














