Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Revista Médica del Uruguay
versão On-line ISSN 1688-0390
Rev. Méd. Urug. vol.27 no.2 Montevideo jun. 2011
Desarrollo y ensayo de dos procedimientos para la detección rápida de Streptococcus agalactiae en exudados vaginorrectales
Tamara Iglesias*, Quím. Farm. Susana Cáceres*, Dr. Gustavo Rey†, Lic. Geraldine Rimsky*, Dres. Gustavo Varela‡, María Inés Mota‡, Técs. Ivalú Tallac§, Mariana Silveira§, Dres. Leonardo Anzalone§, Alberto Nieto*, Iris Miraballes-Martínez*
Resumen
Introducción: la infección por Estreptococo grupo B (EGB) puede afectar gravemente a la madre y al feto durante la gestación y al recién nacido luego del parto. Actualmente, el diagnóstico de colonización durante el embarazo se realiza por métodos microbiológicos a partir de exudados vaginorrectales.
Objetivo: desarrollar métodos rápidos y de bajo costo para la detección del antígeno grupo específico de EGB en exudados vaginorrectales.
Material y método: se utilizaron dos cepas de EGB, una autóctona (IH23) y la cepa de referencia O90R, que solo expresa el polisacárido específico de grupo. Para cada una se preparó un antisuero policlonal que se utilizó para el desarrollo de un test inmunocromatográfico y uno de aglutinación de látex. Como controles se emplearon cultivos bacterianos, polisacáridos purificados de EGB y muestras vaginorrectales.
Resultados: los límites de detección obtenidos para la inmunocromatografía fueron de 210 µg/ml y 50 µg/ml para los polisacáridos purificados de sobrenadante y pared, respectivamente, no lográndose detectar antígenos de EGB en las muestras clínicas analizadas. El límite de detección del látex fue 65 µg/ml frente al polisacárido purificado de sobrenadante de cultivo de IH23 y 6,5 x 107 UFC/ml de IH23. La sensibilidad y especificidad para el látex fue de 30% y 90%, respectivamente.
Conclusiones: los métodos desarrollados no alcanzaron el límite de detección requerido para su aplicación en muestras clínicas. Esto concuerda con lo descripto en la bibliografía para ensayos rápidos basados en reacciones antígeno-anticuerpo y muestra la necesidad de agregar pasos previos de extracción y concentración o mejorar la calidad de los reactivos inmunológicos empleados.
Palabras clave: STREPTOCOCCUS AGALACTIAE.
COMPLICACIONES INFECCIOSAS DEL EMBARAZO - diagnóstico.
Keywords: STREPTOCOCCUS AGALACTIAE.
PREGNANCY COMPLICATIONS, INFECTIOUS - diagnosis.
* Laboratorio del Área Biotecnología. Polo Tecnológico de Pando, Facultad de Química (LBT-PTP-FQ). Universidad de la República. Uruguay.
† Clínica Ginecológica B. Hospital de Clínicas. Facultad de Medicina. Universidad de la República. Uruguay.
‡ Cátedra de Bacteriología y Virología, Facultad de Medicina. Universidad de la República. Uruguay.
§ Laboratorio Central de la Red de Atención Primaria en Salud (LAPS) de ASSE (MSP) Uruguay.
Correspondencia:
Dra. Iris Miraballes-Martínez
CP 91000 - Cno. Aparicio Saravia s/n, Polo Tecnológico de Pando, Pando, Canelones. Uruguay.
Correo electrónico: iris.miraballes@gmail.com
Recibido: 18/10/10.
Aceptado: 16/5/11.
Trabajo realizado en el marco del Proyecto Nº 384 financiado por la Comisión Sectorial de Investigación Científica (CSIC) - Programa de Investigación para la Inclusión Social. Universidad de la República. Uruguay
Introducción
Streptococcus agalactiae o Estreptococo grupo B (EGB) es un coco grampositivo anaerobio facultativo, encapsulado y de acuerdo al polisacárido de su cápsula, se pueden distinguir los serotipos: Ia, Ib, Ia/c, II, III, IV, V, VI, VII y VIII(1).
Puede encontrarse formando parte de la "flora normal" del aparato digestivo, urinario y genital de los adultos y, aunque normalmente no ocasiona problemas a las mujeres sanas no embarazadas, puede provocar una enfermedad grave al recién nacido después del parto y también a la madre y al feto durante la gestación(2,3). La infección por EGB puede incrementar el riesgo de parto prematuro, rotura prematura de las membranas y de óbito fetal, así como provocar, además, complicaciones maternas como endometritis posparto(3).
El screening que se realiza entre las 35-37 semanas de gestación de la colonización maternal por EGB y el uso de antibióticos profilácticos intraparto ha resultado en una importante reducción de la infección temprana en recién nacidos. Sin embargo, las tasas de colonización materna permanecen incambiadas desde los años 70(4).
La frecuencia de portación de EGB en mujeres embarazadas es variable y depende de varios factores como edad, nivel socioeconómico, raza, entre otros. En países desarrollados los porcentajes van desde 34% en Estados Unidos(5) a 15% en Francia(6). En América Latina, la frecuencia global es de 14%(7), con extremos como Trinidad y Tobago con una prevalencia de 32,9%(8) y México con 4%(9).
En Uruguay, estudios realizados en 2001 en el Hospital Central de las Fuerzas Armadas, y en 2006 en una institución de asistencia médica colectiva de Montevideo, en embarazadas entre las 35 y 37 semanas de gestación, mostraron que el porcentaje de aislamiento de EGB fue de 20% y 25%, respectivamente(10,11). En un trabajo realizado en Minas, Uruguay, en 2004 se reportaron cinco casos de sepsis y meningitis por EGB en nueve meses, cuatro de ellos fatales(12).
Más recientemente, en un estudio llevado a cabo durante el año 2009 en el Centro Hospitalario Pereira Rossell se determinó una prevalencia de 17,3%(13).
En Uruguay, las pautas del control de embarazo emitidas por el Ministerio de Salud Pública (MSP)(14), según las recomendaciones del CDC 2002(15), hacen obligatorio el tamizaje para el EGB entre las 35 y 37 semanas de gestación. Si no se realizó dicho estudio se tratarán en forma profiláctica todas las embarazadas con riesgo de presentar infección(14,16-19), es decir, aquellas que presenten trabajo de parto de pretérmino, rotura prematura de membranas de más de 18 horas, fiebre durante el trabajo de parto, infección urinaria o bacteriuria por EGB, o antecedentes obstétricos de recién nacido con infección de EGB. En muchos de estos casos el tratamiento es empírico, pudiendo tener consecuencias graves aunque poco frecuentes (shock anafiláctico).
Dado que actualmente el diagnóstico se realiza por ensayos microbiológicos y que los cultivos demoran más de 48 horas, los resultados no están disponibles a tiempo para realizar la profilaxis antibiótica preparto. Estas dificultades han llevado a que las investigaciones en el ámbito mundial se dirijan al desarrollo de pruebas de detección precoz rápidas y de alta precisión que puedan realizarse durante el parto(20,21). La implementación de un test rápido y sencillo sería muy útil para su aplicación: a) durante la consulta con el obstetra; b) en el preparto, especialmente en aquellas mujeres con amenaza de parto de pretérmino o rotura de membranas en las que actualmente no se realiza el despistaje; c) en el caso de embarazos no controlados para EGB con el fin de poder detectar la bacteria en el preparto y comenzar el tratamiento.
Dentro de los posibles formatos de tests rápidos, puede mencionarse la aglutinación de partículas de látex y la inmunocromatografía. Se trata de ensayos de bajo costo y fácil implementación, que no requieren entrenamiento especializado y en los que es mínimo el equipamiento necesario para su ejecución.
Los tests de inmunocromatografía son ampliamente utilizados(22,23) y han alcanzado gran desarrollo en las dos últimas décadas. El revelado de la reacción antígeno-anticuerpo ocurre por la concentración del conjugado a oro coloidal en zonas de la tira de nitrocelulosa donde previamente se han fijado anticuerpos de captura del analito a determinar.
El objetivo del presente trabajo fue desarrollar y evaluar ambas alternativas de tests rápidos para la detección de EGB en exudados vaginorrectales.
Material y método
Se cultivaron dos cepas de EGB, un aislado local (IH23) y la cepa O90R (ATCC Nº 12386), que solo expresa el polisacárido específico del grupo B(24,25). Con cada cepa se preparó un antisuero policlonal específico en conejo. Se purificaron las fracciones inmunoglobulina (Ig) conteniendo los anticuerpos específicos por precipitación con sulfato de amonio y con ellas se procedió al desarrollo de los tests rápidos.
En el sistema de inmunocromatografía se usaron los anticuerpos de conejo tanto para la captura de las bacterias como para el revelado de la misma mediante conjugados de dichos anticuerpos a oro coloidal.
En el caso del reactivo látex se estandarizaron las condiciones óptimas de adsorción de los anticuerpos a las partículas de poliestireno así como las condiciones para la estabilización coloidal del sistema.
A. Obtención de los antígenos/inmunógenos
Cultivo e inactivación
Se utilizaron dos cepas de EGB: una cepa local (IH23), aislada del introito vaginal de una mujer embarazada (Instituto de Higiene, Facultad de Medicina) y la cepa de referencia O90R (ATCC Nº 12386) que solo expresa el polisacárido específico de grupo y no el específico de serotipo. Sobre cada una se realizó: estudio de la morfología colonial y tipo de hemólisis en placas de tripteína soya agar con el agregado de sangre ovina al 5% (ASO 5%), coloración de gram, prueba de catalasa y test de CAMP. La producción del carbohidrato específico de grupo B se confirmó mediante un ensayo comercial de aglutinación de látex (Oxoid(r), UK).
Cada cepa se sembró en placas de ASO 5% incubándose en aerobiosis a 37 ºC por 24 horas. Cuatro a ocho colonias de cada una se resuspendieron en solución salina estéril para alcanzar una concentración de 108 UFC/ml (MacFarland 0,5). Un ml de cada suspensión se sembró en 100 ml caldo Todd-Hewitt (Oxoid(r), UK) incubándose a 37 ºC, en aerobiosis con agitación a 200 rpm por 24 horas.
Lotes de cultivo de cada cepa fueron inactivados por el agregado de formaldehído a una concentración final de 1% (Sigma, USA) o azida de sodio (Sigma, USA), 1 mg/ml e incubación durante una hora. Se verificó la inactivación por siembra en ASO 5% y en caldo Todd-Hewitt.
Purificación de polisacáridos de sobrenadante de cultivo de la cepa IH23
Se procedió según el procedimiento descripto por Wessels y colaboradores(26). Manteniendo la temperatura de trabajo en 4 ºC, se centrifugó el cultivo a 10.000 rpm durante 20 minutos (Beckman Avanti, USA), el sobrenadante se filtró a través de membranas de 0,22 µm de poro, concentró por pasaje a través de membrana de hemodiálisis (Renak-E, RE-15H, Cuprophan 1,5 m2), dializó exhaustivamente contra agua destilada y liofilizó.
Se redisolvió el liofilizado en 2,5 ml de buffer Tris 10mM pH 7.2, obteniéndose una solución límpida y llevó a 30% v/v de etanol. Luego de una hora, se centrifugó durante 20 minutos a 4.050 rpm, y descartó el precipitado. El sobrenadante se ajustó a 80% v/v de etanol y luego de 18 horas se centrifugó a 4.300 rpm durante 20 minutos, descartó el sobrenadante, el sedimento de aspecto gelatinoso y color grisáceo se disolvió en 300 µl de agua, dializó contra agua destilada y liofilizó.
Purificación de polisacáridos de pared a partir de los cultivos de la cepa IH23
Se mantuvo la temperatura de trabajo en 4 ºC. A partir de un cultivo inactivado con azida(26), se lavaron las células dos veces con solución de NaCL 9g/L y centrifugaron a 10.000 rpm durante 20 minutos. Se resuspendieron en solución de fosfato de potasio 50 mM pH 7.5, EDTA 10 mM, NaCl 150 mM en relación 1g de sedimento húmedo por 2,5 ml de solución, dializaron contra fosfato de potasio 50 mM pH 7.5, EDTA 10 mM, NaCl 150 mM, azida de sodio al 0,1%, se aplicó ultrasonido (Hielscher UP200S, Alemania) (50% amplitud, 0,5 ciclos, 20 minutos) y agitó en vaivén toda la noche, en presencia de esferas de vidrio. Se centrifugaron los restos de células a 12.000 rpm, 15 minutos. Se adicionó etanol al 30% (v/v) gota a gota al sobrenadante límpido con agitación en baño de hielo, centrifugó en las condiciones descriptas antes y descartó el precipitado. El sobrenadante se llevó a 80% (v/v) en etanol y almacenó toda la noche. El precipitado se recuperó por centrifugación a 4.300 rpm, 20 minutos, redisolvió, dializó contra agua destilada y liofilizó.
Preparación de antisueros anti EGB
El protocolo utilizado fue sometido a la Comisión Honoraria de Experimentación Animal (CHEA). Se preparó un antisuero policlonal específico en conejo con cada cepa (IH23 y O90R).
Se emplearon conejos raza New Zealand de ocho semanas de edad; en el día 0 se extrajo de la vena central una muestra de sangre (5 ml) como referencia (suero preinmune). En los días 1, 3 y 5 se inyectó por vía intravenosa (iv), 1 ml de una suspensión de 2 x 109 UFC formoladas/ml en solución salina estéril. En los días 8, 10, 12, 15, 17, 19, 22, 24 y 26 se inyectó por vía iv 1 ml de una suspensión de 4 x 109 UFC formoladas/ml en solución salina estéril. El día 29 del protocolo se realizó el sangrado, se separaron los sueros y estos se conservaron a -20 ºC hasta su uso.
Titulación sueros conejo anti EGB
Se usaron suspensiones de bacterias formoladas de la cepa O90R y de la cepa IH23 a una concentración de 4 x 109 UFC/ml empleando una gota de Giemsa como líquido de contraste. En una placa de fondo blanco se colocaron 50 µL de diluciones de los antisueros y cada una se enfrentó a 50 µL de las suspensiones de bacterias correspondientes. Se mezcló y se agitó en agitador orbital (60-80 rpm) durante 5 minutos. La presencia o ausencia de aglutinación se observó bajo luz directa e intensa. El título se definió como el inverso de la última dilución que presentó aglutinación.
Desarrollo del reactivo látex
La fracción inmunoglobulinas de los sueros de conejo anti EGB (antiI H23 y anti O90R) obtenidos se purificó por precipitación con sulfato de amonio al 37% y posterior diálisis contra buffer fosfato 20 mM pH 7. Se ensayaron dos tamaños de partículas de látex: 0,3 y 0,8 µm; diferentes relaciones de masa anticuerpos/látex; distintas condiciones de adsorción (pH y fuerza iónica) y la coadsorción al látex de las inmunoglobulinas con otra proteína tal como la seroalbúmina bovina (BSA, Sigma, USA).
Los diferentes reactivos se prepararon incubando directamente muestras de las inmunoglobulinas con las partículas de látex o, en el caso de la coadsorción, premezclando la fracción inmunoglobulina anti EGB con BSA en relación 1 mg de inmunoglobulina: 1 mg BSA en buffer fosfato 20 mM pH 7 hasta un volumen final de 2,9 ml. Se agregó 280 µl de látex (Ikerlat, España) sobre agitador magnético. Las relaciones ensayadas en mg de inmunoglobulinas/mg de látex fueron de 0,036 a 0,048 para las partículas de 0,3 y de 0,009 a 0,015 para las partículas de 0,8 µm. Se incubó 30 minutos a temperatura ambiente con agitación de vaivén (Varimix Thermolyne, USA), se agregó 100 µl de una solución 100 mg/ml de BSA en agua e incubó 30 minutos más en las mismas condiciones. Por último, se agregó 0,8 ml de buffer glicina 0,5 M, NaCl 0,75 M, BSA 1 mg/mL, azida de sodio 0,5 mg/mL, pH 8,3 agitando un minuto más. Los reactivos preparados se mantuvieron a 4 ºC hasta su uso.
Desarrollo del test de inmunocromatografía
Se prepararon partículas de oro coloidal de diferentes diámetros por reducción de ácido tetracloroáurico (Sigma) con ácido cítrico(27). Se realizó su caracterización (?máx y Abs máx) por espectrofotometría (espectrofotómetro UV-visible GE Healthcare Ultrospec 3100 Pro, Suecia) y se determinó el diámetro promedio por dispersión de luz láser (Malvern Zetasizer Nano, UK).
Se realizó su conjugación a los Ac anti EGB cepa IH23(28), mezclando 100 mL de la suspensión de oro coloidal con 125 µL de los anticuerpos a la concentración de 0,1 mg/mL, y se adicionó 2,5 mL de una solución de polietilenglicol PM 20000 al 1% en fosfato de sodio 5 mM pH 7. Luego se concentró el conjugado por centrifugación a 20.000 rpm por 20 minutos a 10 °C (Beckman Avanti, USA) y se resuspendió el sedimento en fosfato de sodio 10 mM sacarosa 10% pH 7.
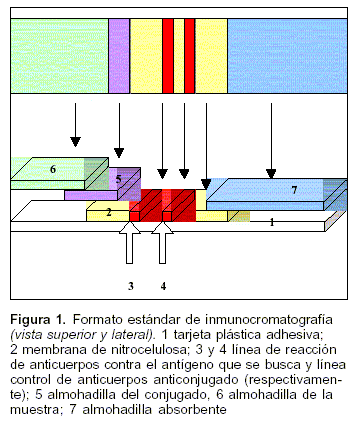
Para la preparación de laminados de fases sólidas para inmunocromatografía, como reactivo para la línea de test, se utilizaron anticuerpos anti EGB cepa IH23 de conejo preparados, como se describió antes, y para la línea de control anticuerpos antiinmunoglobulinas de conejo hechos en cabra (Dako, Denmark) que se aplicaron mediante el dispensador IsoFlow (IsoFlowTM Dispenser, Arista Biologicals, USA). Se preparó la membrana del conjugado a oro coloidal impregnándola con el mismo. Luego se procedió al laminado según la figura 1, guillotinado (Arista Biologicals, USA) y armado de los casetes para inmunocromatografía.
Recolección de muestras clínicas
Las muestras se tomaron y procesaron de acuerdo con los procedimientos empleados en el Laboratorio Central de la Red de Atención Primaria en Salud (LAPS) a partir de mujeres que cursaban el último trimestre de gestación (35-37 semanas) y que concurrieron al centro de salud para su control de acuerdo a la recomendación vigente. De cada una se obtuvo previamente el consentimiento informado. El diseño del estudio fue aprobado por el Comité de Ética de la Facultad de Química.
Se tomaron muestras por duplicado de vagina (pared y fondo de saco) y del canal rectal mediante hisopos de algodón. Un hisopo de cada tipo de muestra se colocó en caldo de enriquecimiento Todd Hewitt suplementado (THS) con ácido nalidíxico (15 µg/ml) y gentamicina (8 µg/ml) (BBL, Becton Dickinson) y se incubó por 24 horas a 37 ºC. Los reaislamientos se realizaron en placa de ASO 5% (TSA, Lonifar SA y sangre ovina Biokey) y en medio Granada (Bioplak). En este segundo medio se colocó un cubreobjetos sobre las líneas de siembra para crear una cámara microaerófila. Las placas se incubaron durante 24 horas a 37 ºC. Transcurrido este tiempo se observó la presencia de crecimiento en el medio Granada, tomando como positivas para EGB las colonias de color anaranjado.
También se realizó la lectura de las placas ASO 5% en busca de colonias beta-hemolíticas sospechosas de EGB. Para confirmar se realizó prueba de aglutinación de látex (Pastorex Strep B, Bio-Rad y Streptoccocal grouping Kit, Oxoid) y una prueba de CAMP.
Los otros dos hisopos se colocaron en un tubo estéril con 2 ml del medio THS y se conservó a 4 ºC. Estos tubos fueron remitidos al laboratorio de biotecnología en un plazo máximo de 48 horas, donde se analizaron por las técnicas desarrolladas. Para ello se agitó cada tubo con los hisopos mediante vórtex durante 30 segundos y se tomó una alícuota de la suspensión.
El total de muestras remitidas desde el LAPS con consentimiento informado durante el período de estudio (mayo a setiembre de 2009) fue de 77.
Evaluación de los prototipos preparados
Test de aglutinación de látex
Los reactivos látex preparados se evaluaron por aglutinación de: a) suspensiones de EGB (cepa local IH23 y cepa O90R) de diferentes concentraciones determinadas por recuento en superficie; b) diferentes soluciones de polisacárido purificado obtenido a partir del sobrenadante del cultivo de la cepa IH23; c) muestras de exudados vaginorrectales.
Para los ensayos, sobre tarjetas de fondo negro se mezclaron y agitaron sobre agitador orbital a 80 rpm (Thermoline, USA), durante 5 minutos a temperatura ambiente, 50 µl de cada muestra a), b) o c) en PBS con 30 µl de cada uno de los diferentes reactivos látex.
Test de inmunocromatografía
Se ensayó la inmunorreactividad utilizando: a) soluciones de polisacárido purificado de sobrenadante de cultivo de la cepa IH23; b) de pared celular de la cepa IH23; c) muestras de exudados vaginorrectales. Para los ensayos se aplicó 100 µL de las muestras a), b) o c) en la zona de reacción y se dejó que avanzara la reacción leyéndose los resultados entre los 5-15 minutos.
Resultados
Titulación antisueros
El título del suero anti O90R fue 1024 y el antiI H23 fue 256.
Evaluación de los reactivos látex
Se prepararon 19 reactivos (identificados con letras A a S). En la tabla 1 se muestran los resultados obtenidos con algunos de los reactivos preparados.
El menor límite de detección obtenido fue de 65 µg /ml (reactivo O) de polisacárido IH23 purificado y de 6,5 x 107 UFC/ml en suspensiones de bacterias obtenidas por cultivo de la cepa IH23 (reactivos K y L).
El reactivo K se evaluó en un estudio a ciegas frente a exudados vaginorrectales para determinar la sensibilidad y especificidad diagnóstica del ensayo. Los resultados fueron comparados con los obtenidos por el procedimiento estándar de búsqueda de S. agalactiae en el laboratorio de bacteriología del LAPS.
Se procesaron 67 muestras negativas y 10 positivas, obteniéndose una sensibilidad de 30% (3/10) y especificidad de 90% (60/67).
El reactivo O se evaluó frente a algunas muestras conocidas positivas y negativas de exudados vaginorrectales no observándose reactividad para las mismas.
Evaluación de las tiras de inmunocromatografía
Las tiras de inmunocromatografía fueron ensayadas frente a diferentes concentraciones de polisacárido purificado y a algunas muestras de exudados. Luego de ajustar los distintos elementos componentes de la tira de inmunocromatografía, se obtuvo un límite de detección de 210 µg/ml frente a polisacárido purificado de sobrenadante y de 50 µg/ml frente a polisacárido purificado de pared, ambos de la cepa IH23 (figura 2). No fue posible detectar antígenos de EGB en las muestras positivas de exudados. Al emplear suspensiones de bacterias IH23, el límite de detección obtenido fue de 1x 105 UFC/ ml.

Discusión
Reactivo látex
Las partículas de 0,8 µm permitieron obtener los menores límites de detección, con anticuerpos específicos obtenidos contra cualquiera de las cepas. Los límites de detección tanto frente a polisacárido purificado como frente a bacterias enteras fueron similares para los reactivos preparados con los anticuerpos específicos contra una u otra cepa.
En los ensayos realizados con el reactivo K frente a muestras de exudados se vio que la sensibilidad diagnóstica del reactivo látex fue baja (30%) mientras que la especificidad fue de 90%. Esto puede deberse a que los límites de detección de los reactivos preparados no llegaron a ser lo suficientemente bajos como para detectar la bacteria/antígenos en las muestras clínicas. Según la bibliografía, en el exudado vaginorrectal la concentración de EGB es relativamente baja, siendo la cantidad máxima esperada en una paciente con un alto grado de colonización de 3 x 104 microorganismos por hisopo(29).
Con esta sensibilidad el reactivo de látex no podría utilizarse como test de tamizaje ya que se planteaba emplear la técnica en el consultorio del ginecólogo o en el momento del parto, donde no habría una instancia de enriquecimiento como la que se utiliza en la técnica actual de detección microbiológica.
Sin embargo, por otra parte, el reactivo mostró buena especificidad ya que el número de falsos positivos es solo de 7 en 67 individuos, un valor bajo considerando que la flora vaginorrectal es bastante compleja y que podrían darse reacciones cruzadas entre el EGB y diferentes microorganismos presentes en la muestra.
La baja sensibilidad alcanzada pudo también haberse debido a que el título en anticuerpos del antisuero de conejo anti EGB obtenido fuera bajo, y/o que la mayor parte de la respuesta esté dirigida hacia antígenos capsulares serotipo específicos y no grupo específicos. Sin embargo, el antisuero proveniente de la inmunización con la segunda cepa (O90R) (que no expresa los antígenos serotipo específicos) no mejoró la sensibilidad del sistema. El reactivo preparado con este nuevo antisuero tuvo un menor límite de detección del polisacárido en solución pero mantuvo el mismo límite de detección que los reactivos anteriores cuando se lo enfrentó a bacterias inactivadas con formol.
Esta diferencia de reconocimiento entre la bacteria entera y el polisacárido en solución podría deberse a que los epitopos se encuentren estéricamente impedidos sobre la superficie bacteriana como para ser reconocidos por anticuerpos específicos inmovilizados sobre las partículas de látex.
Una posibilidad a ensayar sería el tratamiento de la muestra con ácido o enzimas de modo de liberar los antígenos de la estructura bacteriana y facilitar el reconocimiento, sin embargo, antecedentes que emplean este tratamiento solo logran alcanzar una sensibilidad que va de 33% a 62%(29).
Los resultados obtenidos coinciden con los que describe la bibliografía para tests rápidos de exudados vaginorrectales sin enriquecimiento de la muestra, con sensibilidades que van de 4% a 37%(20).
También se han desarrollado ELISA que llevan mayor tiempo de ejecución y equipamiento más sofisticado, que han logrado una sensibilidad de entre 11% y 74%(29).
Los mejores resultados se han logrado mediante el empleo de pruebas para la detección de ácido desoxirribonucleico o ácido ribonucleico, como la técnica de real time PCR (polimerase chain reaction)(21). Cuando se combinan los resultados obtenidos en muestras de exudados vaginales con las rectales alcanza un máximo de 84% de sensibilidad con una especificidad de 84%. Si bien los resultados obtenidos con este método son muy buenos, es un método que requiere instrumentación y reactivos de alto costo. Además, aunque es una técnica más rápida que los cultivos tradicionales, requiere por lo menos dos horas para llevarla a cabo(30).
Inmunocromatografía
El límite de detección alcanzado con una suspensión de bacterias de IH23 fue de 1x105 UFC/ml, similar a los tests comerciales disponibles(31). Solo se han logrado buenos niveles de detección a partir de las muestras de polisacárido purificado a partir de células de cultivo, no siendo posible la detección del EGB en muestras de exudados posiblemente por ser demasiado baja la concentración bacteriana.
Teniendo en cuenta las investigaciones y recomendaciones internacionales, el reporte del CDC 2010(4) hace hincapié en la necesidad de sostener y mejorar los progresos realizados en la prevención de la enfermedad neonatal por EGB en cuanto a tamizaje y la profilaxis antibiótica hasta que se disponga de una vacuna. Es por esto que cualquier progreso relacionado con el mejoramiento de técnicas diagnósticas puede ser una herramienta útil en aquellos casos en los que el tamizaje no se haya realizado. Aunque en el presente trabajo no se ha logrado la sensibilidad adecuada, se han identificado potenciales alternativas para aumentarla.
Conclusiones
No fue posible la detección de antígenos de EGB mediante los tests rápidos desarrollados en las muestras de exudados. Una alternativa para superar este problema sería la introducción de un paso previo de enriquecimiento con una duración de una o dos horas, previo a la realización del test, que permitiera la concentración de antígenos a niveles que fueran detectables por los reactivos preparados. Aunque dicho paso limitaría su empleo durante la consulta con el obstetra, tendría importante aplicación en la detección de madres portadoras que llegan al parto sin el diagnóstico previo. Otra posibilidad es la búsqueda de protocolos de inmunización alternativos que permitan mejorar el título y la avidez de los anticuerpos generados.
Por último, cabe destacar la integración lograda entre los distintos laboratorios involucrados en el trabajo y el avance alcanzado en el tema en el ámbito local.
Summary
Introduction: group B streptococcal infection (GBS) may seriously affect mother and fetuses during pregnancy, and the newborn after delivery. Today, diagnosis of colonization during pregnancy is done by means of microbiological methods of vaginal and rectal exudates.
Objective: to develop fast and low cost methods to detect the GBS specific group antigen in vaginal-rectal exudates.
Method: we used two EGB strains, one of the (IH23) autochthonous and the reference strain O90R, that only expresses the group specific polysaccharide. We prepared a polyclonal antiserum for each one of them which was used to conduct an immunochromatographic test and a latex agglutination test. We used bacterial culture, EGB purified polysaccharides and vagina,-rectal samples as control.
Results: detection limits obtained for the immunochromatographic test were 210 µg/ml and 50 µg/ml for purified polysaccharides and cell wall, respectively, there being no EGB antigens detected in the clinical samples analyzed. Latex detection limit was 65 µg/ml compared to purified polysaccharides of IH23 culture supernatant and 6,5 x 107 UFC/ml of IH23. Sensitivity and specificity for latex was 30% and 90% respectively.
Conclusions: the methods used failed to reach the detection limit required for its application in our clinical samples. This agrees with what is described in bibliography about quick tests based on antigen-antibody reactions and indicated the need to add previous extraction and concentration steps or to improve the quality of the immunologic reagents used.
Resumo
Introdução: a infecção por Estreptococo grupo B (EGB) pode afetar gravemente a mãe e o feto durante a gravidez e o recém nascido imediatamente depois do parto. Atualmente, o diagnóstico de colonização durante a gestação é feita por métodos microbiológicos empregando exsudados vaginorretais.
Objetivo: desenvolver métodos rápidos de baixo custo para a detecção do antígeno grupo específico de EGB em exsudados vaginorretais.
Material e método: foram utilizadas duas cepas de EGB, uma autóctone (IH23) e a cepa de referência O90R, que expressa somente o polissacarídeo específico do grupo. Para cada uma foi preparado um antisoro policlonal utilizado para o desenvolvimento de um teste imunocromatográfico e um de aglutinação de látex. Foram empregados cultivos bacterianos, polissacarídeos purificados de EGB e amostras vaginorretais como controles.
Resultados: os limites de detecção obtidos para a imunocromatografia foram de 210 µg/ml e 50 µg/ml para os polissacarídeos purificados de sobrenadante e parede, respectivamente, no sendo possível detectar antígenos de EGB nas amostras clínicas analisadas. O limite de detecção do látex foi 65 µg/ml quando comparado com o polissacarídeo purificado de sobrenadante de cultivo de IH23 y 6,5 x 107 UFC/ml de IH23. A sensibilidade e especificidade para o látex foi de 30% y 90%, respectivamente.
Conclusões: os métodos desenvolvidos não alcançaram o limite de detecção requerido para sua aplicação em amostras clínicas. Estes resultados são similares aos dados descritos na bibliografia para ensaios rápidos baseados em reações antígeno-anticorpo e mostram a necessidade de agregar passos prévios de extração e concentração ou melhorar a qualidade dos reativos imunológicos utilizados.
Bibliografía
1. Lindahl G, Stalhammar-Carlemalm M, Areschoug T. Surface proteins of Streptococcus agalactiae and related proteins in other bacterial pathogens. Clin Microbiol Rev 2005; 18(1): 102-27.
2. Edwards M. Group B Streptococcal Infections. In: Remington J, Klein J, Wilson Ch, Baker C, eds. Infectious diseases of the fetus and newborn infant. 6th ed. Philadelphia: Elsevier, Saunders, 2006: 404-64.
3. Centers for Disease Control and Prevention. Group B Streptococcal Prevention. Atlanta: CDC, 2006.
4. Verani JR, McGee L, Schrag SJ; Division of Bacterial Diseases, National Centerfor Immunization and Respiratory Diseases, Centers for Disease Control and Prevention. Prevention of perinatal group B streptococcal disease: revised guidelines from CDC, 2010. MMWR Recomm Rep 2010; 59(RR-10): 1-36.
5. Jaime WE, Edwards RK, Duff P. Vaginal-perianal compared with vaginal-rectal cultures for identification of group B streptococci. Obstet Gynecol 2004; 104(5 Pt 1): 1058-61.
6. Jauréguy F, Carton M, Teboul J, Butel MJ, Panel P, Ghnassia JC, et al. Risk factors and screening strategy for group B streptococcal colonization in pregnant women: results of a prospective study. J Gynecol Obstet Biol Reprod (Paris) 2003; 32(2): 132-8.
7. Stoll BJ, Schuchat A. Maternal carriage of group B streptococci in developing countries. Pediatr Infect Dis J 1998; 17(6): 499-503.
8. Orrett F. Colonization of Group B Streptococci in pregnancy and outcome of infected neonates in Trinidad. Pediatr Int 2003; 45(3): 319-23.
9. de Lourdes Collado M, Kretschmer RR, Becker I, Guzmán A, Gallardo L, Lepe CM. Colonization of Mexican pregnant women with group B Streptococcus (Letter). J Infect Dis 1981; 143(1): 134.
10. Barillaro S, Monzo C, Negrin G, Brazeiro D. Prevalencia del estreptococo beta agalactiae en la población de embarazadas que consultan en la D.N.S.FF.AA. Salud Militar 2003; 25(1). Disponible en: http://www.dnsffaa.gub.uy/revista/vol25/P48a57V25.htm (Consulta: 7/6/2010).
11. Rivas C, Tallac I, Etchenique A. Colonización vaginorrectal por Streptococcus del grupo B en mujeres embarazadas, entre las 35 a 37 semanas de gestación. Rev Méd Urug 2006; 22(3): 191-6.
12. Bello Pedrosa O, Perotti Pais E. Enfermedad invasiva por estreptococo del grupo B. Arch Pediatr Urug 2004; 75(2): 150-4
13. Laufer J, Scasso S, Sosa C, Rodríguez-Cuns G, Alonso J, Pons J. Group B streptococcus colonization among pregnant women in Uruguay. Int J Gynaecol Obstet 2009; 104(3): 242-3.
14. Ministerio de Salud Pública. Dirección General de la Salud. Programa Nacional Prioritario de Salud de la Mujer y Género. Guías en salud sexual y reproductiva: normas de atención a la mujer embarazada. Disponible en: http://www.msp.gub.uy/uc_1667_1.html (Consulta: 7/6/2010).
15. Schrag S, Gorwitz R, Fultz-Butts K, Schuchat A. Prevention of perinatal group B streptococcal disease: revised guidelines from CDC. MWWR Recomm Rep 2002; 51(RR-11): 1-22.
16. Smaill F. Intrapartum antibiotics for group B streptococcal colonisation. Cochrane Database Syst Rev 2000;(2): CD000115.
17. Money DM, Dobson S; Canadian Paediatric Society. Infectious Diseases Commitee. The prevention of early-onset neonatal group B streptococcal disease. J Obstet Gynaecol Can 2004; 26(9): 826-32.
18. Amstey MS, Gibbs RS. Is penicillin G a better choice than ampicillin for prophylaxis of neonatal group B streptococcal infections? Obstet Gynecol 1994; 84(6): 1058-9.
19. Royal College of Obstetricians and Gynaecologists. Group B Streptococcal Disease, Early Onset (Green-top 36): prevention of early onset neonatal group B streptococcal disease. London: RCOG, 2003.
20. Picard F, Bergeron M. Laboratory detection of group B Streptococcus for prevention of perinatal disease. Eur J Clin Microbiol Infect Dis 2004; 23(9): 665-71.
21. Edwards RK, Novak-Weekley SM, Koty PP, Davis T, Leeds LJ, Jordan JA. Rapid group B streptococci screening using a real-time polymerase chain reaction assay. Obstet Gynecol 2008; 111(6): 1335-41.
22. Hujakka H, Koistinen V, Eerikäinen P, Kuronen I, Mojonen I, Parviainen M, et al. New immunochromatographic rapid test for diagnosis of acute Puumala Virus Infection. J Clin Microbiol 2001; 39(6): 2146-50.
23. Wever PC, Yzerman EP, Kuijper EJ, Speelman P, Dankert J. Rapid diagnosis of legionaries disease using an immunochromatographic assay for Legionella pneumophila serogroup 1 antigen in urine during an outbreak in the Netherlands. J Clin Microbiol 2000; 38(7): 2738-9.
24. Curtis SN, Krause RM. Antigenic Relationships between groups B and G streptococci. J Exp Med 1964; 120: 629-37.
25. Baker CJ, Kasper DL, Davis CE. Immunochemical characterization of the nativetype III polysaccharide of group B streptococcus. J Exp Med 1976; 143(2): 258-70.
26. Wessels MR, Benedí WJ, Jennings HJ, Michon F, DiFabio JL, Kasper DL. Isolation and characterization of type IV group B Streptococcus capsular polysaccharide. Infect Immun 1989; 57(4): 1089-94.
27. Horisberger M. Evaluation of colloidal gold as a cytochemical marker for transmission and scanning electron microscope. Biol Cell 1979; 36: 253-8.
28. Hermanson GT. Bioconjugate Techniques. San Diego, California: Academic Press, 1996: 593-604.
29. Yancey MK, Armer T, Clark P, Duff P. Assessment of rapid identification tests for genital carriage of group B streptococci. Obstet Gynecol 1992; 80(6): 1038-47.
30. Daniels J, Gray J, Pattison H, Roberts T, Edwards E, Milner P, et al. Rapid testing for group B streptococcus during labour: a test accuracy study with evaluation of acceptability and cost-effectiveness. Health Technol Assess 2009; 13(42): 1-154.
31. Helvetica Health Care. Bionexia Streptokokken B antigen. Disponible en:http://www.helveticahealthcare.com/BioNexia%20-%20brochures/Bionexia-flyer-StrepB%20-%20ENG-FR-GER.pdf (Consulta: 8/6/2010).














