Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Revista Médica del Uruguay
versão On-line ISSN 1688-0390
Rev. Méd. Urug. vol.21 no.3 Montevideo out. 2005
Síndrome de insuficiencia androgénica en la mujer
Dres. Francisco Cóppola* , José Nader† , Rafael Aguirre‡
Unidad de Climaterio del Hospital de la Mujer. Centro Hospitalario Pereira Rossell.
Facultad de Medicina. Universidad de la República. Montevideo, Uruguay
Resumen
Los andrógenos cumplen importantes funciones fisiológicas en la mujer, sin embargo un síndrome de deficiencia androgénica es difícil de caracterizar y su tratamiento motivo de controversia. Generalmente se considera a los andrógenos como un elemento "nocivo" sobre la belleza y salud femeninas. Aunque cumplen importantes roles y en la posmenopausia constituyen el principal sustrato a partir del cual se sintetizan los estrógenos. Los escasos o antiguos conocimientos, o ambos, sobre el rol de los andrógenos en la mujer son uno de los problemas para optimizar el diagnóstico y el tratamiento. El presente artículo busca realizar una revisión de los conocimientos sobre los cambios del nivel de andrógenos con la edad y el uso de medicación, los caracteres de la insuficiencia androgénica en la mujer y las bases de la sustitución androgénica. Se busca optimizar el diagnóstico y el tratamiento del déficit androgénico en la mujer.
Palabras clave: ANDRÓGENOS - deficiencia.
POSMENOPAUSIA.
* Prof. Adj. Clínica Ginecotocológica "C". Coordinador de la Unidad de Climaterio del Hospital Pereira Rossell. Centro Hospitalario Pereira Rossell. Ex Asistente de Cátedra de Endocrinología. Facultad de Medicina. Universidad de la República. Montevideo. Uruguay. Presidente de la Sociedad de Endocrinología Ginecológica y Menopausia del Uruguay.
† Ex Asistente de Clínica Ginecotocológica "C". Docente Honorario Clínica Ginecotocológica "C". Coordinador de la Unidad de Climaterio del Hospital Pereira Rossell. Centro Hospitalario Pereira Rossell. Facultad de Medicina. Universidad de la República. Montevideo. Uruguay. Vicepresidente de la Sociedad de Endocrinología Ginecológica y Menopausia del Uruguay.
‡ Ex Asistente de Clínica Ginecotocológica "C". Docente Honorario Clínica Ginecotocológica "C". Unidad de Climaterio del Hospital Pereira Rossell. Centro Hospitalario Pereira Rossell. Facultad de Medicina. Universidad de la República. Montevideo. Uruguay. Secretario de la Sociedad de Endocrinología Ginecológica y Menopausia del Uruguay.
Correspondencia: Dr. Francisco Cóppola
Cuareim 2131 AP. 1008, Montevideo, Uruguay
E-mail: fracopp@adinet.com.uy
Recibido: 7/5/04.
Aceptado: 25/2/05.
Introducción
En la premenopausia los andrógenos son habitualmente considerados negativos y antagonizar sus efectos es considerado casi sinónimo de realzar lo femenino. En la posmenopausia es frecuente pregonar el concepto de insuficiencia estrogénica, pero pocas veces se tiene en cuenta el rol de los andrógenos en esta etapa de la vida.
Últimamente, en la mujer climatérica es más común el tratamiento con derivados de testosterona para mejorar las alteraciones de la libido. Generalmente se utilizan dosis suprafisiológicas, con marcados efectos colaterales y potenciales consecuencias a largo plazo.
Ambas situaciones marcan aspectos de un mismo problema: el escaso conocimiento del papel de los andrógenos en la mujer.
Hay claridad en el manejo de los estados hiperandrogénicos, pero enorme dificultad para caracterizar un síndrome de insuficiencia androgénica en la mujer y su tratamiento.
Este artículo pretende ser una síntesis del conocimiento actual sobre el tema. Se ha seleccionado la mejor literatura tomando como base la principal revisión disponible (Female androgen insufficiency: the Princeton consensus state-ment on definition, classification and assessment Fertility and Sterility 2002;77:660), complementado con investigaciones disponibles en Medline y se concluye con la opinión de los autores.
Los andrógenos en la mujer
Los andrógenos plasmáticos en la mujer son cinco(1,2). En orden decreciente según su concentración plasmática son:
1. Dehidroepiandrosterona sulfato (DHEAS).
2. Dehidroepiandrosterona (DHEA).
3. Androstenediona (A).
4. Testosterona (T).
5. Dihidrotestosterona (DHT).
Sin embargo, los tres primeros se consideran pro hormonas que deben convertirse a testosterona para luego unirse al receptor. Los principales aspectos de cada uno son:
1. Dehidroepiandrosterona sulfato (DHEAS)
Es secretada por la corteza suprarrenal (zona reticular) y está influenciada por ACTH(3). No se modifica durante el ciclo menstrual ni se afecta por la menopausia(4). DHEAS tiene una disminución relacionada con la edad que continúa a través de la vida y forma parte de la "adrenalopausia"(5,6). Su secreción puede modificarse, además, en las enfermedades suprarrenales primarias que afecten la esteroidogénesis (por ejemplo, enfermedad de Addison) o en afecciones secundarias a enfermedades hipofisarias que afecten la ACTH (hipopituitarismos). La medida de la DHEAS en el suero proporciona una guía útil de la producción de andrógenos suprarrenales.
2. Dehidroepiandrosterona (DHEA)
Es producida en su mayor parte (50%) por la zona reticularis de la corteza suprarrenal; 20% es producido por la teca ovárica y 30% por conversión mediada por una sulfatasa a partir de DHEAS(7).
3. Androstenediona (A)
Secretada en partes iguales por la suprarrenal (50%) y el estroma del ovario (50%). El nivel en suero de androstenediona está en correlación con las concentraciones de testosterona y, por consiguiente, no proporciona información adicional útil para evaluar el estado de los andrógenos de una mujer.
4. Testosterona (T)
Es secretada por la suprarrenal y el estroma ovárico (25% respectivamente), 50% restante resulta de la conversión periférica. Ya sea de forma directa o indirecta, 50% proviene del ovario y otro 50% de la suprarrenal. Esto explica la reducción en 50% que ocurre luego de una ooforectomía.
La importancia de la testosterona en la mujer está señalada por su nivel en el suero durante el pico ovulatorio. En dicho momento el nivel de testosterona es aproximadamente 1,5 veces el nivel de estrógenos (350 pg/ml versus 200 pg/ml), de forma que los ovarios producen más andrógenos que estrógenos(7). El nivel de testosterona es más bajo en la fase folicular y más alto en la fase lútea, siendo su pico en la mitad del ciclo(8). Al final del período reproductivo tardío se pierde ese pico de la mitad del ciclo que caracteriza el ciclo menstrual de las mujeres ovulatorias jóvenes(9). Además, tiene ciclo diurno-nocturno con niveles mayores por la mañana(10). Todos estos elementos hay que tenerlos en cuenta al momento de solicitar dosificaciones de testosterona. La testosterona funciona como una pro hormona circulante que se convierte en los tejidos blanco en parte a 5[alpha]-dihidrotestosterona y en parte a estradiol (E2).
5. Dihidrotestosterona (DHT)
En el tejido blanco periférico, la testosterona es 5-hidroxilada a dihidrotestosterona por la 5 alfa reductasa, su metabolito activo es la DHT y su nivel periférico es bajo(11,12). Una vez dentro de la célula, la DHT se une al receptor intracelular localizado en el núcleo(13,14). El receptor DNA de andrógenos es similar al de progesterona, glucocorticoides y mineralocorticoides. La regulación de la expresión genética de este receptor involucra un complejo mecanismo que requiere interacción entre un sistema de transactivación con otros mecanismos accesorios, factores transcripcionales, coactivación y correpresión, que escapan al enfoque de este artículo.
Las dosificaciones de DHT se utilizan principalmente en investigación y raramente en la clínica.
Finalmente, en la vía final común del metabolismo de los andrógenos se convierten a 3alfa-androstanediol-glucurónido(1,15). La medida de estos metabolitos (glucurónidos) ha tenido alguna utilidad en el diagnóstico del exceso de andrógeno clínico con androgenemia normal, donde los niveles son a menudo elevados. No se han evaluado y es improbable que sean de utilidad en la valoración de pacientes que puedan tener insuficiencia androgénica.
Los esteroides sexuales y la globulina transportadora de hormonas sexuales (SHBG)
Los esteroides sexuales van unidos a una proteína plasmática, la SHBG. En las mujeres, aproximadamente 78% de la testosterona circulante se liga a SHBG, mientras que entre 20% a 33% se liga débilmente a la albúmina, resta no más de 2% del total, que circula libre.
La testosterona unida a SHBG no es biológicamente activa y la proporción unida puede cambiar muy rápidamente durante varias condiciones clínicas comunes que afectan su producción. Por ejemplo, los estrógenos estimulan la producción de SHBG y los andrógenos la suprimen. Con la elevación de la SHBG, aumenta la T total, pero la T libre o activa se reduce. La T total, posiblemente, puede dar información falsa sobre la T biológicamente activa.
La concentración de SHBG no sólo varía con el tenor estrogénico-androgénico, puede afectarse por una variedad de fármacos y condiciones clínicas. Así, puede disminuir en pacientes que reciben glucocorticoides exógenos o progestágenos, en pacientes con obesidad e hiperinsulinemia, hipotiroidismo, acromegalia o síndrome de Cushing. Se encuentran niveles elevados en el embarazo, en el hipertiroidismo, así como en la cirrosis.
Andrógenos, envejecimiento y menopausia natural
En un concepto tradicional, se considera que las mujeres que presentan una menopausia natural también padecen un significativo declive en la producción de andrógenos(16).
Sin embargo, gracias a mejores estudios sabemos que la testosterona total circulante no cambia, y que la testosterona libre realmente aumenta con la transición menopáusica, por lo tanto los síntomas en este momento no son causados por los niveles de los andrógenos(4).
La reducción androgénica en realidad no depende de la menopausia (natural), depende del avance de la edad (envejecimiento). Los niveles de T y A en mujeres de 60 años están en la mitad que a los 40 años y son significativamente más bajos que los niveles máximos observados en las mujeres a los 20 años(17). Por lo tanto, la reducción en la producción de andrógenos ováricos comienza muchos años antes de la menopausia e incluso hay evidencia de que aumenta la producción estromal de andrógenos inmediatamente después de ésta (aumento del estímulo de hormona luteotrófica [LH]).
Un declive del nivel de andrógenos ováricos ocurre muchos años después de la transición menopáusica en la mujer que ya tiene atrofia ovárica(18).
Para comprender el significado de los cambios en la secreción androgénica (y de testosterona en particular) que rodean a la menopausia, deben ser analizados en conjunto con los cambios estrogénicos.
En las mujeres premenopáusicas los ovarios son la fuente principal de estrógenos que funcionan como hormonas circulantes para actuar en el tejido blanco.
En las mujeres posmenopáusicas los ovarios dejan de producir estrógenos. Bajo estas circunstancias, el estradiol se produce localmente en varios tejidos extragonadales y hay un cambio desde un mecanismo endócrino a uno paracrino o intracrino (acción local dentro del mismo tejido o de la misma célula)(19,20). Así, los niveles circulantes de estrógenos en las mujeres posmenopáusicas (y en los hombres), no son los que dirigen la acción estrogénica.
Los estrógenos circulantes en esta situación se originan en tejidos extragonadales, en el mismo tejido en el que actúan, y sólo si escapan al metabolismo local entran en la circulación. Por esta razón los niveles circulantes de estrógenos no reflejan la real acción estrogénica a nivel tisular en las mujeres posmenopáusicas.
La producción estrogénica extragonadal es dependiente de los precursores androgénicos, porque estos tejidos son incapaces de convertir el colesterol a derivados estrogénicos. Como consecuencia, T, A, DHEA y DHEAS son muy importantes para mantener el sustrato adecuado para la biosíntesis de estrógeno en estos sitios.
El hecho de que la testosterona circulante en la mujer posmenopáusica sea mayor que el estradiol circulante sugiere la importancia de este sistema.
La reducción de los estrógenos circulantes que ocurre en la posmenopausia provoca una disminución de la producción hepática de SHBG, lo que lleva a un aumento de andrógenos libres, que a su vez ofrecen sustrato para la conversión periférica de andrógenos a estrógenos, por lo que en la menopausia natural funciona como un sistema adaptativo y compensatorio.
Con la caída de los andrógenos suprarrenales propia del avance de la edad (adrenalopausia), aumenta la importancia relativa de la fuente ovárica de andrógenos. Como prueba de ello, en las posmenopáusicas la concentración de testosterona en la vena ovárica es mayor que en la sangre periférica(18).
Los andrógenos después de una menopausia quirúrgica
El declive súbito en los andrógenos circulantes caracteriza a la ooforectomía, con una reducción abrupta de T y A en aproximadamente 50% en las primeras 24 a 48 horas del posoperatorio(21,22). La ovariectomía unilateral o histerectomía sola también se asocia con reducción de la T total circulante y biodisponible aunque posiblemente en menor grado(23).
Otra causa iatrogénica de deficiencia de T incluye ooforectomía química. Por ejemplo, el uso de antagonistas de factor hipotalámico liberador de gonadotrofinas (GnRH) para el tratamiento de miomatosis o endometriosis y después de quimioterapia o radioterapia para el tratamiento por cáncer.
Estas alteraciones desde el punto de vista endócrino (caída abrupta de estrógenos y andrógenos) nada tiene que ver con los cambios que ocurren en la menopausia natural (caída de estrógenos pero con aumento de andrógenos). Estas diferencias tienen traducción clínica, la menopausia quirúrgica es menos tolerada, con síntomas más frecuentes y severos que la menopausia natural(24-28).
Los andrógenos, la sustitución estrogénica y la corticoterapia
Los estrógenos afectan a los andrógenos
Tanto la reducción de los estrógenos, propia de la menopausia, como el reemplazo de los mismos puede tener un efecto importante en el nivel de los andrógenos libres con una consiguiente expresión clínica significativa. La terapia estrogénica, particularmente a dosis altas y cuando se administra vía oral, aumenta la SHBG y, por lo tanto, reduce los andrógenos libres, tanto ováricos como suprarrenales(29,30). La administración exógena de estrógenos por vía oral puede no afectar los niveles de testosterona total, pero al aumentar los niveles de SHBG reducen la fracción biodisponible, por lo que la T libre es normal o baja(31,32).
En la posmenopausia hay un incremento de LH que ejerce un efecto trófico sobre el ovario. La administración de estrógenos puede suprimirlo coadyuvando a la reducción androgénica(33). Los efectos de la sustitución con estrógenos en el nivel de los andrógenos puede no tener traducción clínica en casos de menopausia natural, pero es más probable que sí la tenga en la menopausia quirúrgica, donde ya se parte de un nivel de andrógenos reducido.
En algunas pacientes que cursan una menopausia natural, conjuntamente con el aumento de andrógenos libres se observa un incremento del deseo sexual(34). Este hecho se atribuye a determinantes psicológicos, por ejemplo la existencia de una seguridad anticoncepcional absoluta, pero bien podría deberse a determinantes hormonales (reducción de SHBG). Así al iniciar una terapia de sustitución con estrógenos se puede empeorar la función sexual(31).
Anticonceptivos orales (ACO)
Es importante saber que las píldoras de ACO no sólo aumentan la SHBG, también disminuyen la producción ovárica de hormonas mediante la supresión de la producción de LH por la hipófisis y la disminución del estímulo para la producción estromal ovárica de T, igual a lo que ocurre en la mujer posmenopáusica que recibe terapia con estrógenos(35).
La utilización de ACO que contienen una progestina de bajo poder androgénico como opción de tratamiento para las mujeres con hiperandrogenismo, subraya sus habilidades en disminuir el nivel de andrógeno libre(36).
Los contraceptivos orales pueden tener un efecto adverso en la libido en algunas mujeres(37), y se señalan efectos negativos relacionados con el humor(38).
Los anticonceptivos con marcada acción antiandrogénica son recursos terapéuticos útiles en pacientes hiperandrogénicas, sin embargo, no está suficientemente evaluado el efecto a largo plazo de reducir el tenor androgénico en pacientes con andrógenos normales.
La corticoterapia afecta los andrógenos suprarrenales
La A y la T son reducidas por la administración de corticoides, lo que está acorde con su origen suprarrenal parcial, probablemente pueda explicarse por la supresión de hormona adrenocorticotrófica (ACTH) secundaria a la corticoterapia prolongada, predominando sobre la reducción de globulina transportadora de hormonas sexuales (SHBG) que es capaz de provocar(39).
Función de los andrógenos en la mujer
Los receptores androgénicos están presentes extensamente en el organismo. Se han descrito más de 200 acciones celulares de los andrógenos. El conocimiento actual de sus efectos biológicos en la mujer es superficial. Las investigaciones se han enfocado en el deseo sexual, el humor, la función cognoscitiva y el bienestar global, pero además tiene que ver con otros aspectos como la masa ósea y muscular, la respuesta inmunológica, etcétera(32,40,41).
Desde el punto de vista endócrino, el ovario después de la menopausia se transforma desde su función primordialmente reproductiva en una glándula con funciones extrarreproductivas.
Insuficiencia androgénica femenina
La insuficiencia androgénica femenina es una entidad discutida por algunos, fundamentalmente porque no están determinados los valores normales de testosterona libre plasmática para definirla. Esto se debe a que los ensayos fueron diseñados para el hombre y son deficitarios para discriminar los valores bajos de la mujer. Una dificultad adicional es que los síntomas remiten generalmente sólo cuando se usan dosis que superan los rangos fisiológicos sanguíneos mediante administración exógena, lo que de alguna forma contradice el concepto de insuficiencia endócrina.
Hay un grupo de pacientes que nos permite una excelente observación clínica: las que tienen pérdida de tejido ovárico debido a cirugía, quimioterapia o radioterapia. En estos casos, la reducción resultante en la producción de andrógenos lleva a alteraciones comunes, que incluyen:
1. Deterioro en el funcionamiento sexual, (motivación sexual, fantasía, goce, excitación, etcétera).
2. Pérdida del vello pubiano y axilar.
3. Síntomas vasomotores más intensos.
4. Osteoporosis y sarcopenia (pérdida de masa muscular), adiposidad.
5. Dolores de cabeza.
6. Disminución en la calidad de vida.
La administración de T parece revertir el cuadro clínico, además baja los niveles de SHBG resultando en un aumento de estradiol libre (E2) y en el incremento de la T libre que, a su vez, es una fuente importante de E por la aromatización(32,42).
Las pacientes jóvenes ooforectomizadas presentan una caída abrupta de los niveles androgénicos. Es cuando el cuadro clínico es menos discutido, y por lo tanto, más probable la respuesta terapéutica. No es raro, en estos casos, observar una caída en el deseo sexual de inicio brusco luego de la cirugía, que previamente era normal. De esta forma, a pesar de no tener un umbral de testosterona claramente establecido, puede definirse el comienzo de un cuadro de insuficiencia androgénica femenina.
Que las mujeres con menopausia natural experimenten síntomas debido a la insuficiencia androgénica es difícil de argumentar, principalmente basado en la evidencia de que los andrógenos sanguíneos (androgenemia) no cambian agudamente con la menopausia (y aun pueden aumentar).
También hay otras situaciones que pueden ser responsables de una insuficiencia androgénica: la administración crónica de glucocorticoides y las enfermedades como la amenorrea hipotalámica y la hiperprolactinemia, que se caracterizan por T baja y evolución a la osteoporosis.
En casos de una falla ovárica prematura o disgenesia gonadal, se demuestran niveles más bajos de DHEAS, A y T. Estas pacientes, como están habituadas a un bajo nivel de andrógenos, generalmente no reconocen los síntomas(43). Son frecuentemente medicadas con estrógenos, sin tener en cuenta los andrógenos, con lo cual la pérdida ósea puede persistir a pesar de la sustitución adecuada de estrógenos y progestágenos.
Con ovarios ovulatorios es muy difícil postular la insuficiencia androgénica, a menos que otras circunstancias afecten la función ovárica, (ACO o agonistas GnRH, etcétera)(44).
La pérdida de andrógenos suprarrenales y ováricos puede combinarse como en los casos de panhipopituitarismo o las pacientes con enfermedad de Addison (que frecuentemente asocian falla ovárica prematura)(45).
Finalmente, se observa insuficiencia androgénica con sarcopenia en la infección por HIV, lupus eritematoso sistémico y artritis reumatoidea(46,47). Por lo tanto, si la historia es intrincada con otros aspectos, de larga evolución, y cuando la paciente no tiene una causa concreta a la que atribuir una reducción de la producción androgénica, la posibilidad de que el deterioro en la función sexual se deba a una insuficiencia androgénica es baja. Como los síntomas no son específicos y la dosificación de testosterona de valor limitado, es muy importante la valoración clínica.
Función sexual
Los trastornos sexuales parecen ser bastante prevalentes (43%), al menos en los estudios realizados en mujeres de Estados Unidos(48). La alteración en la función sexual es uno de los aspectos más relacionado con los andrógenos. Sin embargo, la función sexual es una respuesta fisiológica compleja, dependiente de múltiples factores (disponibilidad de un compañero, expectativa personal, humor, factores psicológicos, aspectos de salud general de la mujer y su compañero, medicación, etcétera) y no exclusivamente del estatus hormonal. Atribuirle únicamente a los aspectos hormonales la alteración de la libido, frecuentemente implica subestimar y dejar de lado estos otros factores. Se cae así en una simplificación del cuadro clínico y en un apresuramiento terapéutico. Muchos trabajos relacionan el nivel de testosterona con la libido, incluso en las variaciones en el ciclo menstrual(49,50).
En mujeres perimenopáusicas, el nivel plasmático de testosterona se relaciona con la frecuencia del coito y la libido(51,52). No obstante, estos conceptos fueron puestos en duda por otras observaciones contradictorias(53-58).
Un reflejo indirecto de la importancia de los andrógenos en la función sexual es en las situaciones que se usan moléculas antiandrogénicas, donde frecuentemente se produce una reducción o supresión de la libido(59). Por ejemplo, el acetato del ciproterona puede afectar hasta 60% de las mujeres que mantienen relaciones sexuales frecuentes en el momento que se inició la administración del fármaco(59,60). A la inversa, la administración de andrógenos a las mujeres hipoandrogénicas mejora varios parámetros de la función sexual (el deseo, las fantasías, la frecuencia de la actividad sexual, la facilidad para alcanzar el orgasmo, la satisfacción sexual y el placer)(34,61,62).
Osteoporosis y sarcopenia
Varios hechos sugieren la importancia de los andrógenos en el metabolismo óseo. Osteoblastos, osteoclastos y osteocitos tienen receptores andrógenicos que además son más numerosos en la zona de osteogénesis(63). Los estudios epidemiológicos han demostrado una correlación positiva entre los andrógenos endógenos y la densidad mineral ósea (DMO) en las mujeres jóvenes y adultas premenopáusicas(64). Las pacientes hiperandrogénicas con hirsutismo, síndrome de ovario poliquístico, tienen a menudo una DMO aumentada(65-67).
Se ha discutido si el efecto es propio de la acción androgénica o resultado de la aromatización a estrógenos. Los estudios en las mujeres premenopáusicas han mostrado un efecto independiente y posiblemente aditivo de andrógenos y estrógenos en la masa de hueso(41).
La T libre es el andrógeno que está más consistentemente asociado con DMO en la columna lumbar, cadera, y radio(68). También se ha encontrado una relación inversa entre SHBG y DMO tanto en mujeres premenopáusicas como en perimenopáusicas(69).
La situación en las mujeres posmenopáusicas es menos clara que en las pre y perimenopáusicas. Se ha señalado una asociación significativa entre el total de T y la masa ósea vertebral(70). Otros no han encontrado asociación entre T libre y fracturas vertebrales en las mujeres posmenopáusicas, después de corregir para niveles de E2(71).
En algunos estudios clínicos los estrógenos, cuando son asociados con andrógenos, incrementan los marcadores de osteoformación(72). No obstante todos estos datos indirectos, se necesitan estudios de intervención clínica (con diferentes dosis y vías), con fracturas como punto final, y en población con hipoandrogenismo, a fin de conocer la real eficacia de los andrógenos para la prevención o el tratamiento de la osteoporosis.
Por otra parte, mucho se ha hablado del efecto de los andrógenos sobre la masa muscular. Si bien es conocida la acelerada pérdida de masa ósea en los primeros tres años de la posmenopausia, menos conocidas son las bases fisiopatológicas de la pérdida similar de masa muscular que ocurre en dicho período(73). La masa muscular aumenta claramente cuando los hombres hipogonádicos y atletas reciben tratamiento con testosterona(74,75). Sin embargo, el efecto anabólico de los derivados de la testosterona en pacientes con hipoandrogenismo es menos conocido. El nivel de testosterona de las mujeres no supera 10% de lo normal para los hombres. Cuando se usa en las atletas, aumenta el nivel hasta el valor de los hombres, por lo que se trata de dosis en extremo suprafisiológicas. Hay información de los efectos de estas dosis en publicaciones sobre los deportistas de Alemania oriental de los años 1970(76).
Dentro de todos los efectos negativos llamó la atención el desarrollo de una verdadera adicción reflejada por la presentación de síntomas psicológicos, fatiga, anorexia, insomnio, inquietud, dolor muscular y articular, depresión y deseo de recibir más andrógenos (abstinencia) cuando los atletas dejan de usarlos(77,78).
Algunos estudios clínicos muestran mejoría de la masa muscular en posmenopáusicas a las que se les agrega andrógenos al tratamiento(79,80). Sin embargo, en todos estos estudios se usaron dosis que consideramos suprafisiológicas.
Si bien es aceptada la importancia de los andrógenos para el mantenimiento y desarrollo de la masa muscular, no es extrapolable el uso de dosis suprafisiológicas en mujeres normoandrogénicas (por ejemplo, atletas) con el uso de dosis fisiológicas en mujeres hipoestrogénicas.
En suma: hay suficientes datos que permiten afirmar que los andrógenos tienen un papel fundamental en la fisiología del hueso y el músculo, tanto por acción directa o por aromatización a estrógenos. El resultado es el aumento de la masa ósea y de la fuerza muscular. Sin embargo, falta precisar la acción de la sustitución terapéutica a dosis fisiológicas.
Por último, se ha mostrado mejoría en enfermedades autoinmunes, como lupus y poliartritis reumatoidea, cuando se administra testosterona, reafirmando que esta hormona juega un papel importante en la inmunidad(46,81,82).
Sustitución androgénica: tipos y dosis
Hay tres rangos de dosis que pueden ser utilizadas:
– Fisiológicas.
– Suprafisiológicas (de uso habitual).
– Supra-suprafisiológicas (atletas).
De estos tres rangos, la última, usada por atletas, aumenta hasta 100 veces los valores normales y nada tienen que ver con la sustitución androgénica por las dosis usadas y porque se utilizan en pacientes con andrógenos previamente normales(83,84).
El modelo de sustitución más aplicable es en la menopausia quirúrgica.
Andrógenos para la menopausia quirúrgica
A pesar de ser el mejor modelo de insuficiencia androgénica, en el reemplazo hormonal que involucra a las mujeres ooforectomizadas hay diferencias entre los estudios y discrepancias entre poblaciones estudiadas. Por un lado, están las pacientes con problemas sexuales previos y, por otro, las que tenían sexualidad normal pero que se ven afectadas ahora por la menopausia quirúrgica(85,86). Las pacientes sin problemas sexuales previos, pero que los presentaron inmediatamente después de la ooforectomía, son las que resultan con beneficios claros luego del tratamiento con T si lo comparamos con placebo(87). Las pacientes ooforectomizadas que previamente estaban envueltas en problemas sexuales muestran un efecto placebo poco diferenciable del tratamiento(32).
El otro problema para sacar conclusiones es la dosis utilizada. La mayoría de los estudios utilizan dosis suprafisiológicas de T, en las que el efecto es farmacológico en lugar de un reemplazo hormonal, por lo que las posibilidades de respuesta son mayores y también la de efectos secundarios. El único estudio de reemplazo con T en mujeres ooforectomizadas que ha considerado un nivel de reemplazo fisiológico, mostró efecto beneficioso tenue, determinado por un marcado efecto del placebo(32).
Por lo tanto, parece haber mejoría de la función sexual cuando hay cierta seguridad de que la causa es la insuficiencia androgénica. Sin embargo, la respuesta se ve con dosis suprafisiológicas, cuando las dosis tienden solamente a sustituir el nivel normal para la mujer, la respuesta es pobre.
Sustitución androgénica, diferentes tipos
Todos los esteroides anabólicos actualmente usados son derivados de testosterona o son modificaciones estructurales de la testosterona para cambiar la farmacocinética o la biodisponibilidad, o ambas.
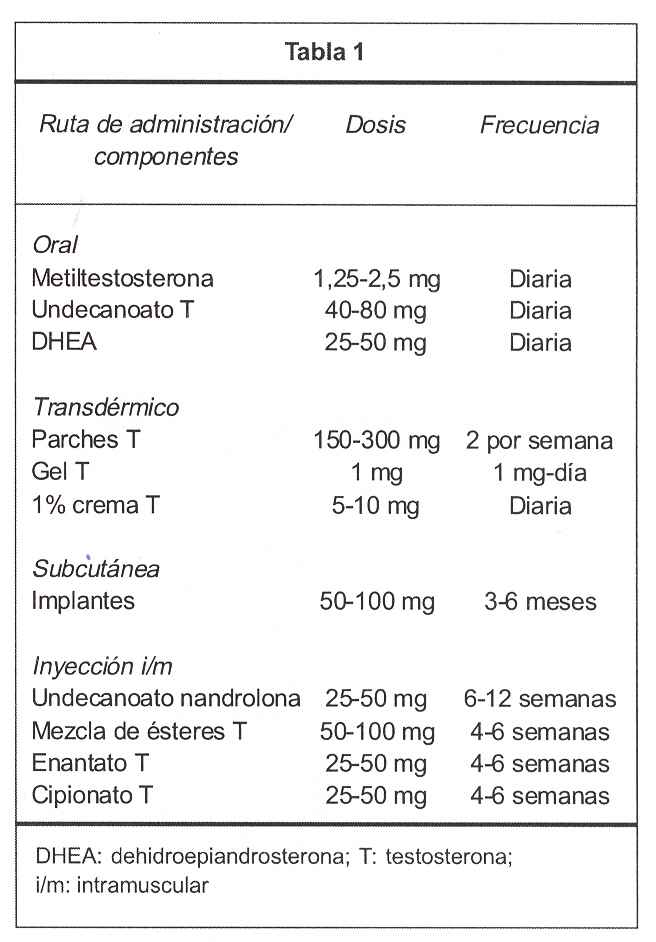
En términos generales hay preparaciones de testosterona inyectable, parches transdérmicos o cremas, y preparación oral micronizada - ésteres de testosterona como cipionato, propionato, enantato y undecanoato(88). Esto se esquematiza en la tabla 1.
Testosterona inyectable
Cuando utilizamos testosterona inyectable junto a estrógenos se produce un rápido pico farmacológico por encima de 150 ng/dl, la absorción es errática y los niveles sanguíneos inconstantes y no es raro que lleve a acumulación con dosis repetidas. Con el tratamiento prolongado, al reducirse la concentración sanguínea, la rápida aparición de síntomas lleva a nuevas dosis antes de la normalización de la androgenemia. Se ha criticado el uso de estos preparados por este hecho, por lo que no es muy recomendable su uso en mujeres.
Las dosis fisiológicas para mujeres de los ésteres de testosterona están alrededor de 50 mg cada cuatro a seis semanas. En nuestro país se dispone de una ampolla de 250 mg de propionato de testosterona, lo usado más frecuentemente.
Metiltestosterona oral
Es difícil separar la acción de sustitución de la farmacológica en el caso de la metiltestosterona. Si bien con dosis baja (1,25 a 2,5 mg/día) los niveles sanguíneos se aproximan a los fisiológicos (20 a 30 ng/dl)(89), esta potente testosterona oral provoca una modificación de las proteínas plasmáticas (SHBG) aproximadamente en 45%, lo que determina un aumento suprafisiológico de la T libre(53,90).
En muchos países no está autorizada por el informe de daño hepático en el uso de dosis altas y prolongadas. La dosis no debería de superar los 1,5 mg a 2,5 mg diarios.
En nuestro medio hay metiltestosterona oral, pero siempre combinada con yohimbina o vitaminas, o ambas, en preparados que contienen desde 1,5 mg hasta 10 mg para la disfunción eréctil masculina.
DHEA oral
En mujeres con insuficiencia androgénica suprarrenal, el tratamiento con DHEA oral puede mejorar la respuesta sexual (no demostrado en hombres)(62). En pacientes de más de 65 años que no padecen insuficiencia suprarrenal pero tienen niveles bajos de DHEA, parece mejorar la sensación de bienestar y humor(91). El beneficio del tratamiento con DHEA es menos discutido en mujeres.
La dosis recomendada es de 25 a 50 mg diarios, disponible en nuestro medio.
Testosterona percutánea
Parches
En un estudio se comparan dos dosis diferentes de testosterona transdérmica durante 12 semanas junto a estrógenos. Con parches de 300 µg la testosterona sérica sube a 102 ng/dl y con parches de 150 µg sube a 64 ng/dl, ambos por encima del rango normal (14-54 ng/dl). Pero sólo los parches de 300 provocaron mejoría de la función sexual(27).
Las dosis sugeridas recomendadas van de 150 mg a 300 mg, dos veces por semana. No se dispone de estos parches en nuestro medio.
Gel de testosterona
También se ha diseñado gel de testosterona para uso en hombres que a dosis de 5 mg determina una sustitución fisiológica. Si extrapoláramos, se necesitaría 1/5 o menos para las mujeres, pero no se ha estudiado debidamente(92,93).
Una dosis aceptable de gel es de 1 mg diario y de crema al 1%, 5 mg diarios.
No existe en el momento gel de testosterona en nuestro medio, hay un gel de DHT, pero que no se ha estudiado en mujeres. Conceptualmente, al ser un potente andrógeno (mayor riesgo de virilización) que además no admite aromatización a E, no estaría indicado en mujeres.
Implantes y otros
En algunos países se dispone de implantes subcutáneos de testosterona (pellets) de 50 mg, que se colocan cada cuatro a seis meses. También en estos casos los valores séricos alcanzados superan los fisiológicos (llegan a 70 a 90 ng/dl) con grandes variaciones individuales. Cuando se implantan subcutáneos, se metabolizan muy lentamente y los niveles suprafisiológicos se prolongan al menos cuatro semanas(61,94,95).
Las dosis sugeridas son de 50 mg cada seis meses. No se dispone en nuestro medio.
Otras vías de administración como la sublingual y vaginal, se investigan, pero la eficacia está sujeta a futuros estudios(96).
Tibolona
La tibolona es una molécula con acción androgénica y estrogénica, además de progestágena, que por los cambios en las lipoproteínas reduce la SHBG y aumenta la testosterona libre, el riesgo de efectos androgénicos es mínimo. Por lo referido anteriormente se adapta mucho mejor que los estrógenos solos en las pacientes ooforectomizadas y se traduce en mejoría en la función sexual(97,98).
Efectos secundarios de la sustitución andrógenica
Tres categorías de riesgo hay que tener en cuenta:
1. Masculinizantes: (hirsutismo, acné, cambios de voz, clitoromegalia). Estos efectos son dependientes de la dosis y de la sensibilidad propia del receptor. De las mujeres que reciben 150 mg de enantato de testosterona intramuscular más estradiol cada 28 días, 20% probablemente desarrollan hirsutismo leve, si la dosis se reduce a la mitad, sólo 5% presentará hirsutismo(99). La administración oral de andrógenos tiene un marcado efecto en reducir la SHBG. La vía parenteral, en cambio, tiene un menor efecto, por lo que es menos androgenizante. El tratamiento transdérmico parece no provocar hirsutismo(32).
2. Somáticos: retención hídrica, cambios en la composición corporal(100).
3. Complicaciones graves: aumento en el riesgo cardiovascular: puede haber incremento de la presión arterial y cambios en la proporción de los lípidos en sangre (reducción de lipoproteínas de alta densidad [HDL], aumento de lipoproteínas de baja densidad [LDL]).También en este caso la vía oral es la que provoca cambios en las lipoproteínas por pasaje hepático (el tratamiento oral reduce la HDL en 20%)(101). Cuando se combina estrógenos con A, el LDL se reduce en forma similar que con estrógenos solos y los triglicéridos que aumentan con estrógenos se reducen en 15% al asociarse metiltestosterona(90).
Los preparados intramusculares combinados, implantes subcutáneos y transdérmicos parecen no modificar las lipoproteínas en comparación a estrógenos solos(102,103).
Puede observarse hipertrombicidad, poliglobulia e hipertrofia ventricular izquierda(104). Estos efectos se dan fundamentalmente con dosis suprafisiológicas. No está debidamente estudiado a dosis fisiológicas, probablemente el efecto puede ser diferente(105). Se ha informado lesión hepatocelular, fundamentalmente con metiltestosterona en dosis altas y prolongadas.
Cáncer
En el cáncer de mama se observan receptores de andrógenos; además estos se aromatizan a estrógenos, los datos en relación con el cáncer de mama aún son insuficientes(11).
Dado que en nuestro país existe una combinación intramuscular de estradiol y DHEA es importante recordar que la adición de un andrógeno a los estrógenos no previene la hiperplasia endometrial(106).
Los datos disponibles de tratamiento androgénico son siempre de asociación de andrógenos a estrógenos. No se dispone de suficientes datos de tratamiento con andrógenos solos en las mujeres. En términos generales la vía oral se desaconseja por los cambios en las lipoproteínas, que aumenta el riesgo cardiovascular, es muy androgenizante, y puede provocar daño hepático. La vía intramuscular se desaconseja por efecto acumulativo y absorción errática.
Si bien cada uno de estos métodos tiene ventajas y desventajas, las terapias transdérmicas parecen dar el mejor equilibrio para lograr concentraciones fisiológicas de T, sin los picos y valles vistos con las otras rutas de administración, y con una seguridad más favorable.
La tibolona puede ofrecer una opción fácil de manejar en pacientes con síndrome de insuficiencia androgénica de causa ovárica y la DHEA en igual sentido en la insuficiencia suprarrenal(107-110).
Summary
Although androgens have important physiologic functions in women, the female androgen insufficiency syndrome is difficult to characterize and its management is controversial. Generally, androgens are considered as nocive factors to feminine health and beautifulness, even if they play an important role in the post-menopause such as to be the main substrate from which estrogens can be sinthetized. Considering diagnosis and treatment, the current limited knowledge regarding androgen role in women is a problem. The article aims at reviewing knowledge concerning changes due to androgens, age, farmacologic treatment, female androgen insufficiency and the bases of androgen replacement. The purpose is to maximize female androgen insufficiency diagnosis and treatment.
Résumé
Les androgènes jouent un rôle très important chez la femme. Cependant, un syndrôme d’insuffisance androgé-nique est difficile à caractériser et son traitement est motif de controverse. D’habitude, on considère les androgènes comme un élément nocif sur la beauté et la santé féminines, quoiqu’ils jouent un rôle important et que pendant la post-ménopause c’est à partir d’eux que les estrogènes se synthétisent. Cette controverse sur le rôle des androgènes chez la femme est un problème pour le traitement et le diagnostic. On cherche ici à faire une révision des connaisances sur le changement du niveau des androgènes avec l’âge et de la prescription de médicaments, les caractères de l’insuffisance androgénique chez la femme et les bases de la substitution androgénique. On vise à optimiser le diagnostic et le traitement du déficit androgénique chez la femme.
Bibliografía
1. Demers LM. Biochemistry and laboratory measurement of androgens in women. In: Redmond GP, ed. Androgenic disorders. New York: Raven Press, 1995: 21-34.
2. Vermeulen A. Plasma androgens in women. J Reprod Med 1998 Aug; 43(8 suppl): 725-33.
3. Endoh A, Kristiansen SB, Casson RP, Buster JE, Hornsby PJ. The zona reticularis is the site of biosynthesis of dehydroepiandrosterone and dehydroepiandrosterone sulfate in the adult human adrenal cortex, resulting from its low expression of 3[beta]-hydroxysteroid dehydrogenase. J Clin Endocrinol Metab 1996; 81(10): 3558-65.
4. Burger HG, Dudley EC, Cui J, Dennerstein L, Hopper JL. A prospective longitudinal study of serum testosterone dehydroepiandrosterone sulphate and sex hormone binding globulin levels through the menopause transition. J Clin Endocrinol Metab 2000; 85(8): 2832-938.
5. Carlstrom K, Brody S, Lunell NO, Lagrelius G, Mollerstrom A, Pousette G, et al. Dehydroepiandrosterone sulphate and dehydroepiandrosterone in serum: differences related to age and sex. Maturitas 1988; 10(4): 297-306.
6. Ravaglia G, Forti P, Maioli F, Boschi F, Bernardi M, Pratelli L, et al. The relationship of dehydroepiandrosterone sulphate (DHEAS) to endocrine-metabolic parameters and functional status in the oldest-old. Results from an Italian study on healthy free-living over ninety-year-olds. J Clin Endocrinol Metab 1996; 81(3): 1173-8.
7. Longcope C. Adrenal and gonadal androgen secretion in normal females. Clin Endocrinol Metab 1986; 15(2): 213-27.
8. Vermeulen A, Verdonck L. Plasma androgen levels during the menstrual cycle. Am J Obstet Gynecol 1976; 125(4): 491-4.
9. Mushayandebvu T, Castracane DV, Gimpel T, Adel T, Santoro N. Evidence for diminished midcycle ovarian androgen production in older reproductive aged women. Fertil Steril 1996; 65(4): 721-3.
10. Vermeulen A. The hormonal activity of the postmenopausal ovary. J Clin Endocrinol Metab 1976; 42(2): 247-53.
11. Lobo RA. Androgens in postmenopausal women: production, possible role, and replacement options. Obstet Gynecol Surv 2001; 56(6): 361-76.
12. Roger M, Nahoul K, Scholler R, Bagrel D. Evolution with ageing of four plasma androgens in postmenopausal women. Maturitas 1980; 2(3): 171-7.
13. Keller ET, Ershler W, Chang C. The androgen receptor: a mediator of diverse responses. Front Biosci 1996; 1: d59-71.
14. Maclean HE, Warne GL, Zajac JD. Localization of functional domains in the androgen receptor. J Steroid Biochem Mol Biol 1997; 62(4): 233-42.
15. Moghissi E, Ablan F, Horton R. Origin of plasma androstanediol glucuronide in man. J Clin Endocrinol Metab 1984; 59(3): 417-21.
16. Zumoff B, Strain GW, Miller LK, Rosner W. Twenty-four hour mean plasma testosterone concentration declines with age in normal premenopausal women. J Clin Endocrinol Metab 1995; 80(4): 1429-30.
17. Longcope C. Hormone dynamics at the menopause. Ann NY Acad Sci 1990; 592: 21-30. Discussion 44-51.
18. Judd HL, Judd GE, Lucas WE, Yen SSC. Endocrine function of the postmenopausal ovary: concentrations of androgens and estrogens in ovarian and peripheral vein blood. J Clin Endocrinol Metab 1974; 39(6): 1020-4.
19. Labrie F, Belanger A, Cusan L, Gomez JL. Candas B. Marked decline in serum concentrations of adrenal C19 sex steroid precursors and conjugated androgen metabolites during aging. J Clin Endocrinol Metab 1997; 82(8): 2396-02.
20. Simpson ER, Rubin G, Clyne C, Robertson K, O’Donnell, L, Jones M, et al. The role of local estrogen biosynthesis in males and females. Trends Endocrinol Metab 2000; 11(5): 184-8.
21. Longcope C. Metabolism clearance and blood production rates of estrogen in postmenopausal women. Am J Obstet Gynecol 1971; 111(6): 779-85.
22. Judd HL, Lucas WE, Yen SCS. Effect of oophorectomy on circulating testosterone and androstenedione levels in patients with endometrial cancer. Am J Obstet Gynecol 1974; 118(6): 793-8.
23. Laughlin GA, Barrett-Connor E, Kritz-Silverstein D, Von-Muhlen D. Hysterectomy, oophorectomy, and endogenous sex hormone levels in older women: the Rancho Bernardo Study. J Clin Endocrinol Metab 2000; 85(2): 645-51.
24. Oldenhave A, Jaszmann LJB, Everaerd WTAM, Haspels AA. Hysterectomized women with ovarian conservation report more severe climacteric complaints than do normal climacteric women of similar age. Am J Obstet Gynecol 1993; 168(3 Pt 1): 765-71.
25. Centerwall BS. Premenopausal hysterectomy and cardiovascular disease. Am J Obstet Gynecol 1981; 139(1): 58-61.
26. Stewart WF, Lipton RB, Celentano DD, Reed ML. Prevalence of migraine headache in the United States. JAMA 1992; 267(1): 64-9.
27. Sherwin BB, Gelfand MM. The role of androgen in the maintenance of sexual functioning in oophorectomized women. Psychosom Med 1987; 49(4): 397-409.
28. Roos NP. Hysterectomies in one Canadian province: a new look at risks and benefits. Am J Public Health 1984; 74(1): 39-46.
29. Tazuke S, Shaw K-T, Barrett-Connor E. Exogenous estrogen and endogenous sex hormones. Medicine (Baltimore) 1992; 71(1): 44-51.
30. Simon JA, Klaiber E, Wiita B, Bowen A, Yang HM. Differential effects of estrogen-androgen and estrogen-only therapy on vasomotor symptoms, gonadotropin secretion, and endogenous androgen bioavailability in postmenopausal women. Menopause 1999; 6(2): 138-46.
31. Casson PR, Elkind-Hirsch KE, Buster JE, Hornsby PJ, Carson SA, Snabes MC. Effect of postmenopausal estrogen replacement on circulating androgens. Obstet Gynecol 1997; 90(6): 995-8.
32. Shifren JL, Braunstein GD, Simon JA, Casson PR, Buster JE, Redmond GP, et al. Transdermal testosterone treatment in women with impaired sexual function after oophorectomy. N Engl J Med 2000; 343(10): 682-8.
33. Chetkowski RJ, Meldrum DR, Steingold KA, Randle D, Lu JK, Eggena P, et al. Biological effects of transdermal estradiol. N Engl J Med 1986; 314(25): 1615-20.
34. Masters WH, Johnson VE. Human sexual response. Boston: Little, Brown, 1966.
35. Davis SR, Tran J. Testosterone influences libido and well being in women. Trends Endocrinol Metab 2001; 12(1): 33-7.
36. Derman RJ. Effects of sex steroids on women’s health: implications for practitioners. Am J Med 1995; 98(1A): 137S-143S.
37. Graham CA, Ramos R, Bancroft J, Maglaya C, Farley TM. The effects of steroidal contraceptives on the well-being and sexuality of women: a double blind, placebo-controlled, two centre study of combined and progestogen-only methods. Contraception 1995; 52(6): 363-9.
38. Sanders SA, Graham CM, Bass J, Bancroft J. A prospective study of the effects of oral contraceptives on sexuality and well-being and their relationship to discontinuation. Contraception 2001; 64(1): 51-8.
39. Abraham GE. Ovarian and adrenal contribution to peripheral androgens during the menstrual cycle. J Clin Endocrinol Metab 1974; 39(2): 340-6.
40. Sherwin BB. Hormones, mood, and cognitive functioning in postmenopausal women. Obstet Gynecol 1996; 87(2 Suppl): 20S-6S.
41. Raisz L, Wiita B, Arthis A, Bowen A, Schwartz S, Trahiotis M, et al. Comparison of the effects of estrogen alone and estrogen plus androgen on biochemical markers of bone formation and resorption in postmenopausal women. J Clin Endocrinol Metab 1996; 81(1): 37-43.
42. Burger HG, Hailes J, Menelaus M, Nelson J, Hudson B, Balazs N. The management of persistent menopausal symptoms with oestradiol-testosterone: Clinical, lipid and hormonal results. Maturitas 1984; 6(4): 351-8.
43. Doldi N, Relvisi L, Bassan M, Fusi F, Ferrari A. Premature ovarian failure: steroid synthesis and autoimmunity. Gynecol Endocrinol 1998; 12(1): 23-8.
44. Anasti JN, Kalantaridou SN, Kimzey LM, Defensor RA, Nelson LM. Bone loss in young women with karotypically normal spontaneous premature ovarian failure. Obstet Gynecol 1998; 91(1): 12-5.
45. Miller K, Sesmilo G, Schiller A, Schonfeld D, Burton S, Klibanski A. Androgen deficiency in women with hypopituitarism. J Clin Endocrinol Metab 2001; 86(2): 561-7.
46. Masi AT, Feigenbaum SL, Chatterton RT. Hormonal and pregnancy relationships to rheumatoid arthritis: convergent effects with immunological and microvascular systems. Semin Arthritis Rheum 1995; 25(1): 1-27.
47. Wilder RL. Adrenal and gonadal steroid hormone deficiency in the pathogenesis of rheumatoid arthritis. J Rheumatol Suppl 1996; 44: 10-2.
48. Laumann EO, Paik A, Rosen RC. Sexual dysfunction in the United States: prevalence and predictors. JAMA 1999; 281(6): 537-44. Erratum in JAMA 1999; 281(13): 1174.
49. Persky H, Lief AI, Strauss D, Miller WR, O’Brien CP. Plasma testosterone levels and sexual behavior of couples. Arch Sex Behav 1978; 7(3): 157-73.
50. Bancroft J, Sanders D, Davidson D, Warner P. Mood, sexuality, hormones, and the menstrual cycle. III. Sexuality and the role of androgens. Psychosom Med 1983; 45(6): 509-16.
51. McCoy N, Davidson J. A longitudinal study of the effects of menopause on sexuality. Maturitas 1985; 7(3): 203-10.
52. Flöter A, Nathorst-Böös J, Carlstrom K, von-Schoultz B. Androgen status and sexual life in perimenopausal women. Menopause 1997; 7(1): 95-100.
53. Myers LS, Dixen J, Morrissette D, Carmichael M, Davidson JM. Effects of estrogen, androgen, and progestin on sexual psychophysiology and behavior in postmenopausal women. J Clin Endocrinol Metab 1990; 70(4): 1124-31.
54. Bachmann GA, Leiblum SR, Kemmann E, Colburn DW, Swartzman L, Shelden R. Sexual expression and its determinants in the post-menopausal woman. Maturitas 1984; 6(1): 19-29.
55. Dennerstein L, Dudley EC, Hopper JL, Burger H. Sexuality, hormones and the menopausal transition. Maturitas 1977; 26(2): 83-93.
56. Cawood EHH, Bancroft J. Steroid hormones. The menopause, sexuality and well-being of women. Psychol Med 1996; 26(5): 925-36.
57. Dennerstein L, Smith AMS, Morse CA, Bourger HG. Sexuality and the menopause. J Psychosom Obstet Gynaecol 1994; 15(1): 59-66.
58. Hallstrom T. Sexuality in the climacteric. Clin Obstet Gynecol 1977; 4(1): 227-39.
59. Appelt H, Strauss B. The psychoendocrinology of female sexuality: a research project. Gynakologe 1986; 19(1): 11-8.
60. Nathorst-Böös J, von Schoultz B, Carlström K. Elective ovarian removal and estrogen replacement therapy-effects on sexual life, psychological well-being and androgen status. J Psychosom Obstet Gynaecol 1993; 14(4): 283-93.
61. Davis SR, McCloud P, Strauss BJG, Burger H. Testosterone enhances estradiol’s effects on postmenopausal bone density and sexuality. Maturitas 1995; 21(3): 227-36.
62. Arlt W, Callies F, van-Vlijmen JC, Koehler I, Reincke M, Bidlingmaier M, et al. Dehydroepiandrosterone replacement in women with adrenal insufficiency. N Engl J Med 1999; 341(14): 1013-20.
63. Kasperk C, Helmboldt A, Borcsok J, Heuthe S, Cloos O, Niethard F, et al. Skeletal site dependent expression of the androgen receptor in human osteoblastic cell populations. Calcif Tissue Int 1997; 61(6): 464-73.
64. Zborowski JV, Cauley JA, Talbott EO, Guzick DS, Winters SJ. Bone mineral density, androgens and the polycystic ovary: the complex and controversial issue of androgenic influence in female bone. J Clin Endocrinol Metab 2000; 85(10): 3496-506.
65. Gregoriou O, Kouskouni E, Bakas P, Konidaris S, Papadias K, Kalovidouris A, et al. Bone mineral density in women with idiopathic hirsutism. Gynecol Endocrinol 2000; 14(5): 364-8.
66. Dixon JE, Rodin A, Murby B, Chapman MG, Fogelman I. Bone mass in hirsute women with androgen excess. Clin Endocrinol (Oxf) 1989; 30(3): 271-7.
67. Di-Carlo C, Shoham Z, MacDougall J, Patel A, Hall ML, Jacobs HS. Polycystic ovaries as a relative protective factor for bone mineral loss in young women with amenorrhea. Fertil Steril 1992; 57(2): 314-9.
68. Buchanan JR, Myers C, Lloyd T, Leuenberger P, Demers LM. Determinants of peak trabecular bone density in women: the role of androgens, estrogen and exercise. J Bone Miner Res 1988; 3(6): 673-80.
69. Steinberg KK, Freni-Titulaer LW, DePuey EG, Miller DT, Sgoutas DS, Coralli CH, et al. Sex steroids and bone density in premenopausal and perimenopausal women. J Clin Endocrinol Metab 1989; 69(3): 533-9.
70. Davidson BJ, Ross RK, Paganini-Hill A, Hammond GD, Siiteri PK, Judd HL. Total free estrogens and androgens in postmenopausal women with hip fracture. J Clin Endocrinol Metab 1982; 54(1): 115-20.
71. Cummings SR, Browner WS, Bauer D, Stone K, Ensrud K, Jamal S, et al. Endogenous hormones and the risk of hip and vertebral fractures among older women. Study of Osteoporotic Fractures Research Group. N Engl J Med 1998; 339(11): 733-8.
72. Savvas M, Studd JWW, Fogelman I, Dooley M, Montgomery J, Murby B. Skeletal effects of oral estrogen compared with subcutaneous oestrogen and testosterone in postmenopausal women. Br Med J 1988; 297(6644): 331-3.
73. Aloia JF, McGowan DM, Vaswani AN, Ross P, Cohn SH. The relationship of menopause to skeletal and muscle mass. Am J Clin Nutr 1991; 53(6): 1378-83.
74. Kopera H. The history of anabolic steroids and a review of clinical experience with anabolic steroids. Acta Endocrinol Suppl (Copenh) 1985; 271: 11-8.
75. Bross R, Javanbakht M, Bhasin S. Anabolic interventions for aging-associated sarcopenia. J Clin Endocrinol Metab 1999; 84(10): 3420-30.
76. Franke WW, Berendonk B. Hormonal doping and andro-genization of athletes: a secret program of the German Democratic Republic government. Clin Chem 1997; 43(7): 1262-79.
77. Uzych L. Anabolic-androgenic steroids and psychiatric-related effects: a review. Can J Psychiatry 1992; 37(1): 23-8.
78. Bahrke MS, Yesalis CE. Psychological and behavioral effects of endogenous testosterone and anabolic-androgenic steroids. Sports Med 1990; 10(5): 303-37.
79. Labrie F, Diamond P, Cusan L, Gomez JL, Belanger A, Candas B. Effect of 12- month dehydroepiandrosterone replacement therapy on bone, vagina, and endometrium in postmenopausal women. J Clin Endocrinol Metab 1997; 82(10): 3498-505.
80. Engelson ES, Rabkin JG, Rabkin R, Kolter DP. Effects of testosterone upon body composition. J Acquir Immune Defic Syndr Hum Retrovirol 1996; 11(5): 510-1.
81. Miller K, Corcoran C, Armstrong C, Caramelli K, Anderson E, Cotton D, et al. Transdermal testosterone administration in women with acquired immunodeficiency syndrome wasting: A pilot study. J Clin Endocrinol Metab 1998; 83(8): 2717-25.
82. Cutolo M, Seriolo B, Sulli A, Accardo S. Androgens in rheumatoid arthritis. In: Bijlsma JWJ, Linden S, van der Barnes CG, eds. Rheumatology Highlights 1995. Rheumatol Eur 1995; 24: 211-4
83. Malarkey WB, Strauss RH, Leizman DJ, Liggett M, Demers LM. Endocrine effects in female weight lifters who self-administer testosterone and anabolic steroids. Am J Obstet Gynecol 1991; 165(5 Pt 1): 1385-90.
84. Wilson JD. Androgen abuse by athletes. Endocr Rev 1988; 9(2): 181-99.
85. Tuiten A, Laan E, Panhuysen G, Everaerd W, de Haan E, Koppeschaar H, et al. Discrepancies between genital responses and subjective sexual function during testosterone substitution in women with hypothalamic amenorrhea. Psychosom Med 1996; 58(1): 234-41.
86. Riley A, Riley E. Controlled studies on women presenting with sexual drive disorder. I. Endocrine status. J Sex Marital Ther 2000; 26(3): 269-83.
87. Sherwin BB, Gelfand MM, Brender W. Androgen enhances sexual motivation in females: a prospective, crossover study of sex steroid administration in the surgical menopause. Psychosom Med 1985; 47(4): 339-51.
88. Casson PR, Carson SA, Buster JE. Testosterone delivery systems for women: present status and future promise. Semin Reprod Endocrinol 1998; 16(2): 153-9.
89. Sarrel P, Dobay B, Wiita B. Estrogen and estrogen-androgen replacement in postmenopausal women dissatisfied with estrogen-only therapy. Sexual behavior and neuroendocrine responses. J Reprod Med 1998; 43(10): 847-56.
90. Hickok LR, Toomey C, Speroff L. A comparison of esterified estrogens with and without methyltestoterone: Effects on endometrial histology and serum lipoproteins in postmenopausal women. Obstet Gynecol 1993; 82(6): 919-24.
91. Baulieu EE, Thomas G, LeGrain S, Lahlou N, Roger M, Debuire B, et al. Dehydroepiandrosterone (DHEA) DHEA sulfate and aging: contribution of the DHEAge Study to a sociobiomedical issue. Proc Natl Acad Sci USA 2000; 97(8): 4279-84.
92. Stanczyk FZ, Shoupe D, Nunez V, Macias-Gonzales P, Vijod MA, Lobo RA. A randomized comparison of nonoral estradiol delivery in postmenopausal women. Am J Obstet Gynecol 1988; 159(6): 1540-6.
93. Javanbakht M, Singh AB, Mazer NA, Beall G, Sinha-Hikim I, Shen R, et al. Pharmacokinetics of a novel testosterone matrix transdermal system in health, premenopausal women and women infected with the human immunodeficiency virus. J Clin Endocrinol Metab 2000; 85(7): 2395-401.
94. Buckler HM, Robertson WR, Wu FC. Which androgen replacement therapy for women? J Clin Endocrinol Metab 1998; 83(11): 3920-4.
95. Lobo RA, March CM, Goebelsmann U, Krauss RM, Mishell DR Jr. Subdermal estradiol pellets following hysterectomy and oophorectomy. Effect upon serum estrone, estradiol, luteinizing hormone, follicle-stimulating hormone, corticosteroid binding globulin-binding capacity, testosterone-estradiol binding globulin-binding capacity, lipids, and hot flushes. Am J Obstet Gynecol 1980; 138(6): 714-9.
96. Wang C, Eyre DR, Clark R, Kleinberg D, Newman C, Irannanessh A, et al. Sublingual testosterone replacement improves muscle mass and strength, decreases bone resorption, and increases bone formation markers in hypogonadal man: A clinical research center study. J Clin Endocrinol Metab 1996; 81(10): 3654-62.
97. Modeska K. Tibolone for postmenopausal women: Systematic Review of Randomized Trial. J Clin Endocrinol Metab 2001; 87(1): 16-23.
98. Coppola FA, Nader JA. Tibolone review. Arch Gin Obstet 2003; 41: 24-8.
99. Phillips E, Bauman C. Safety surveillance of esterified estrogens-methylthestosterone (Estratest and Estratest HS) replacement therapy in the United States. Clin Ther 1997; 19(5): 1070-84.
100. Davis SR, Walker KZ, Strauss BJ. Effects of estradiol with and without testosterone on body composition and relationships with lipids in postmenopausal women. Menopause 2000; 7(6): 395-401.
101. Watts NB, Notelovitz M, Timmons MC, Addison WA, Wiita B, Downey LJ. Comparison of oral estrogens and estrogens plus androgen on bone mineral density, menopausal symptoms and lipid-lipoprotein profiles in surgical menopausal women. Obstet Gynecol 1995; 85(4): 529-37.
102. Sherwin BB, Gelfand MM, Schucher R, Gabor J. Postmenopausal estrogen and androgen replacement and lipoprotein lipid concentrations. Am J Obstet Gynecol 1987; 156(2): 414-9.
103. Farish E, Fletcher CD, Hart DM, Azzawi FA, Abdalla HI, Gray CE. The effect of hormone implants on serum lipoproteins and steroid hormones in bilaterally oophorectomized women. Acta Endocrinol (Copenh) 1984; 106(1): 116-20.
104. Sullivan ML, Martinez CM, Gennis P, Gallagher EJ. The cardiac toxicity of anabolic steroids. Progr Cardiovasc Dis 1988; 41(1): 1-15.
105. Yue P, Chatterkee K, Beale C. Testosterone relaxes rabbit coronary arteries and aorta. Circulation 1995; 91(4): 1154-60.
106. Gelfand MM, Ferenczy A, Bergeron C. Endometrial response to estrogen-androgen stimulation. In: Hamond CB, Haseltine FB, Seniff I, eds. Menopause evaluation, treatment and health concerns. New York: Alan R. Liss, 1989: 29-40.
107. Barrett-Connor E, Young R, Notelovitz M, Sullivan J, Wiita B, Yang HM, et al. A two-year, double-blind comparison of estrogen-androgen and conjugated estrogens in surgically menopausal women. J Reprod Med 1999; 44(12): 1012-20.
108. Dören M, Rubig A, Coelingh Bennink HJ, Holzgreve W. Differential effects on the androgen status of postmenopausal women treated with tibolone and continuous combined estradiol and norethindrone acetate replacement therapy. Fertil Steril 2001; 75(3): 554-9.
109. Doren M. Changes of DHEAS and SHBG from baseline: percent within 1 year, tibolone group. Fertil Steril 2001; 75(3): 559.
110. Modelska K, Cummings S. Female sexual dysfunction in postmenopausal women: Systematic review of placebo-controlled trials. Am J Obstet Gynecol 2003; 188(1): 286-93.