Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Revista Médica del Uruguay
versão On-line ISSN 1688-0390
Rev. Méd. Urug. vol.18 no.3 Montevideo dez. 2002
Factores de riesgo para desarrollar neumonía asociada a la ventilación por Acinetobacter spp.
Dres. Julio Medina1, Carlos Formento2, Julio Pontet3,
Andrea Curbelo4, Eduardo Savio5
Resumen
La incidencia de neumonía asociada a la ventilación (NAV) por Acinetobacter spp. a nivel nacional e internacional es creciente y determina una elevada mortalidad atribuible. Los factores de riesgo para adquirir una neumonía por este patógeno varían en los diferentes centros.
El objetivo del trabajo fue identificar los factores de riesgo específicos para adquirir NAV por Acinetobacter spp.
El estudio clínico prospectivo se realizó durante un período de 24 meses (entre mayo del año 2000 a mayo del año 2002) en las unidades de cuidados intensivos (UCI) del Hospital Pasteur y Hospital Policial. Se incluyeron todos los pacientes ventilados por un período mayor o igual a 48 horas que tuvieran sospecha de estar desarrollando una NAV. Se analizaron solo las neumonías bacteriológicamente confirmadas.
Resultados: se enrolaron 137 pacientes por tener sospecha clínica de NAV, de los que 77 episodios de NAV fueron bacteriológicamente confirmados: 27 por Acinetobacter spp. y
50 por otros patógenos.
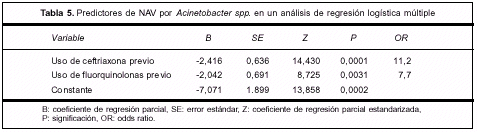
Los datos fueron analizados en un modelo de regresión logística donde la variable dependiente fue Acinetobacter spp. El uso previo de ceftriaxona (CRO) (p=0,0001, OR=11,2) y el uso previo de fluorquinolonas (p=0,003, OR=7,0) predicen significativamente y en forma independiente el desarrollo de NAV por Acinetobacter spp.
Conclusiones: se identificaron como factores de riesgo para desarrollar NAV por Acinetobacter spp. el uso previo de CRO y fluorquinolonas. Se sugiere la restricción de ceftriaxona - fluorquinolonas y rotación con otras moléculas de espectro similar.
Palabras clave: NEUMONÍA - etiología.
RESPIRACIÓN ARTIFICIAL - efectos adversos.
INFECCIONES POR ACINETOBACTER.
FACTORES DE RIESGO.
Centro de Terapia Intensiva del Hospital Pasteur.
Centro de Terapia Intensiva del Hospital Policial.
1. Médico Intensivista. Posgrado de Enfermedades Infecciosas, Escuela de Graduados, Facultad de Medicina. Universidad de la República.
2. Residente de Medicina Intensiva.
3. Médico Intensivista. Asistente Grado II Medicina Intensiva. Profesor Adjunto de Fisiología. Facultad de Medicina. Universidad de la República.
4. Médico Intensivista.
5. Profesor Director de la Cátedra y Clínica de Enfermedades Infecciosas, Facultad de Medicina. Universidad de la República.
Correspondencia: Julio César Medina.
Oficial 2 Nº 184 Paso Carrasco (Canelones) Uruguay.
E-mail: jcmedina@adinet.com.uy
Presentado: 1/7/02.
Aceptado: 11/10/02.
Introducción
Al igual que Pseudomonas aeruginosa, la neumonía asociada al ventilador (NAV) producida por Acinetobacter spp. tiene una mortalidad atribuible elevada(1). La NAV producida por este patógeno obliga, además, a la utilización muchas veces prolongada de antimicrobianos de amplio espectro ya que no se ha determinado cuál es la duración óptima del tratamiento. Esto determina un elevado costo económico y coadyuva a la emergencia de nuevos patógenos multirresistentes(2).
Acinetobacter spp. es un microorganismo cocobacilo, gramnegativo, aerobio, no fermentador de la glucosa, oxidasa negativa, de alta prevalencia en la naturaleza. Se trata de un patógeno ubicuo de crecimiento en ambientes húmedos que se ha aislado tanto en alimentos como en objetos inanimados como, por ejemplo, grifos de agua corriente, lavabos, bocales de pacientes, ambiente hospitalario y equipamientos médicos(3).
La incidencia de NAV por Acinetobacter spp. a nivel nacional e internacional es creciente(4-7), debido a esto, a la elevada morbimortalidad, a la multirresistencia de este microorganismo y con el fin de desarrollar estrategias de prevención, se han estudiado e identificado varios factores de riesgo vinculados a la NAV por Acinetobacter spp.: traumatismo de cráneo, síndrome de distrés respiratorio agudo (SDRA), neurocirugía, aspiración pulmonar voluminosa, Glasgow menor o igual a 9, uso previo de ceftazidime, infección previa, terapia antimicrobiana previa y uso previo de fluorquinolonas intravenosas(8-13).
La adquisición y diseminación de Acinetobacter spp. varía para cada institución dependiendo de múltiples factores.
El objetivo del presente trabajo es identificar los factores de riesgo específicos para adquirir NAV por Acineto-bacter spp. en las unidades de cuidados intensivos (UCI) del Hospital Pasteur y del Hospital Policial.
Material y método
Tipo de estudio: estudio clínico prospectivo.
Selección de pacientes: el estudio se realizó durante un período de 24 meses (entre mayo del año 2000 a mayo del año 2002) en las unidades de cuidados intensivos del Hospital Pasteur y del Hospital Policial. Ambas son unidades polivalentes, el Hospital Pasteur cuenta con un total de 23 camas (10 con posibilidad de asistencia respiratoria invasiva) (ARM) y 14 camas en la UCI del Hospital Policial (8 con posibilidad de asistencia respiratoria invasiva). La UCI del Hospital Pasteur no asiste posoperatorios de neurocirugía a diferencia de la UCI del Hospital Policial.
Criterios de inclusión: se incluyeron todos los pacientes ventilados por un período mayor o igual a 48 horas que tuvieran sospecha de estar desarrollando una NAV.
Se analizaron solo las neumonías bacteriológicamente confirmadas. Se dividieron en dos grupos: los pacientes que desarrollaron una NAV por Acinetobacter spp. se analizaron como grupo A y las NAV por otros patógenos como grupo B.
En el caso de NAV por Acinetobacter spp solamente se consideraron los primeros episodios de neumonía.
Criterios de exclusión: se excluyeron las NAV no confirmadas y las NAV desarrolladas en las primeras 48 horas de pacientes provenientes de otro centro.
Diagnóstico de NAV: El diagnóstico de NAV sospechada se hizo cuando se documentó un infiltrado nuevo y persistente en la radiología de tórax sumado a por lo menos dos de los siguientes criterios: A) temperatura rectal mayor o igual 38,5ºC o menor de 36ºC; B) leucocitosis mayor o igual a 12 x 103/mm3 o menor o igual a 4 x 103/mm3; C) purulencia en la vía aérea(14).
La neumonía se consideró confirmada bacteriológicamente si al síndrome clínico radiológico desarrollado previamente se agregó por lo menos uno de los siguientes criterios: A) aislamiento de un patógeno en el lavado bronquiolo alveolar no broncoscópico (LBA NB) mayor o igual 104 UFC/ml; B) aspirado traqueal (AT) positivo más clinical pulmonary infection score (CPIS)(15) mayor a seis; C) microorganismo aislado en dos o más hemocultivos positivos con idéntica sensibilidad al hallado en secreciones y sin otra fuente de infección probable; D) cultivo positivo de líquido pleural en ausencia de instrumentación pleural previa.
El número de unidades formadoras de colonia (UFC) para el análisis semicuantitativo del aspirado traqueal se determinó por el método de cuatro cuadrantes y se clasificó como: no crecimiento, desarrollo de un cuadrante o más (hasta 4). Se consideró positivo cuando hubo crecimiento en cuatro cuadrantes (4+) de la placa de Petri, lo que tiene una excelente correlación con los métodos cuantitativos y equivale a un conteo mayor o igual a 106 UFC/ml(16).
Definiciones
Para el diagnóstico de SDRA se siguieron las pautas del consenso Europeo-Americano(17).
Se consideró sepsis severa y shock séptico según la reunión del Consenso publicado en el año 1992(18). Se incluyó como neumonía aguda comunitaria (NAC) severa a los pacientes que cumplieron con los criterios descritos por Ewig y colaboradores(19), pero si el paciente presentaba una disfunción multiorgánica fue incluido como sepsis respiratoria(18).
Se definió uso previo de antibióticos si al paciente se le administró antimicrobianos por vía intravenosa por 48 horas o más.
Se consideró mortalidad cruda al total de pacientes fallecidos con la NAV independientemente de la causa que los llevó a la muerte. Mortalidad relacionada con la neumonía a los pacientes fallecidos por la NAV y a los fallecidos sin una causa clara.
Se consideró NAV curada si los cultivos microbiológicos de la vía aérea (LBA NB o AT) de control resultaron negativos con resolución de todos los síntomas clínicos y disminución o desaparición de la imagen radiológica. No se estableció un día determinado para el control microbiológico, pero a todos los pacientes se les realizó un cultivo de control entre el día 7 del comienzo de la terapia antimicrobiana y los cinco días de suspendido el tratamiento antibiótico. También fue criterio de NAV curada si los cultivos microbiológicos de control persistieron positivos, pero el paciente presentó buena evolución y fue dado de alta del hospital.
Recolección de datos: todos los pacientes incluidos se siguieron diariamente hasta el alta de la UCI. Se registró en todos los casos las características demográficas, sexo, edad, estado nutricional, tabaquismo, alcoholismo, diabetes, corticoterapia, hemodiálisis, cáncer, enfermedad pulmonar obstructiva crónica (EPOC), síndrome de inmunodeficiencia adquirida (sida), insuficiencia cardíaca (IC) clase funcional III-IV, aspiración de la vía aérea, uso de presión positiva al final de la espiración (PEEP), uso de anti H2, reintubación, cirugía previa, traumatismo encéfalo craneano (TEC), neurocirugía, Glasgow coma score (GCS). También se registró el motivo de la ARM según los criterios de Zwillich y colaboradores(20), la condición médica previa valorada por los criterios de McCabe y Jackson(21), los días de ARM, el diagnóstico de NAV, CPIS adaptado por Flanagan y colaboradores(15). También se registró el día de aparición de la NAV, microorganismo, uso de antibióticos previos, tipo de antibiótico utilizado y número de antibióticos. Se cuantificó la severidad a través del score inespecífico Acute Physiology and Chronic Health Evaluation II (APACHE II) a las 24 horas del ingreso(22) y al momento de realizar el diagnóstico de NAV y escores específicos de disfunción multiorgánica (DMO) como Multiple Organ Dysfunction Score (MODS)(23) y Sepsis-related Organ Failure Assessment (SOFA)(24) .También se tomaron como índice de severidad la presencia de shock séptico y de SDRA.
Análisis estadístico: las variables numéricas se expresaron con desviación estándar. Se utilizó chi cuadrado en los casos en que se dividió la variable intervalar en categorías o paravariables nominales. Cuando el valor esperado de alguna casilla en las tablas de contingencia fue menor o igual a 5 se usó el test exacto de Fisher. Un valor de p <0,05 se consideró significativo.
Odds ratios (OR), riesgos relativos (RR) e intervalo de confianza (IC) al 95% fueron calculados usando métodos estándar. Para identificar variables de aporte independiente a la aparición de NAV por Acinetobacter spp. se realizó un análisis multivariado usando un modelo de regresión logística (método enter) con un software adecuado (SPSS 10.0.1, Inc; Chicago). Las variables fueron seleccionadas al momento de la confirmación del diagnóstico de neumonía, entrando al modelo de regresión múltiple si estaban asociadas en el análisis univariado a un valor p<0,20.
Resultados
Durante el período de estudio se enrolaron 137 pacientes por tener sospecha clínica de NAV, de estos, 77 episodios de NAV fueron bacteriológicamente confirmados y a su vez fueron analizados: 27 por Acinetobacter spp. y 50 por otros patógenos.
El diagnóstico de NAV por Acinetobacter spp. se hizo por LAB NB en 12 casos, AT + CPIS > 6 en 13 oportunidades y AT más hemocultivos en los restantes dos casos.
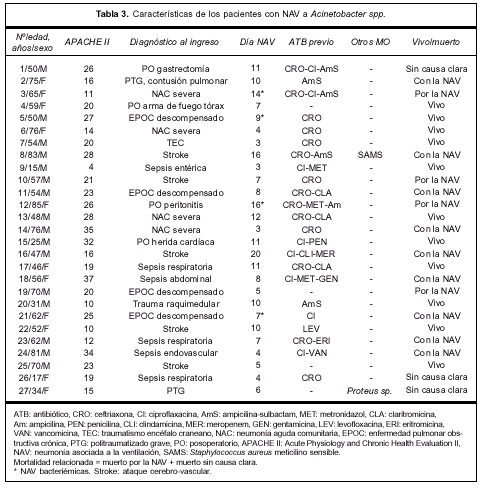
En el grupo de neumonías producidas por Acine-tobacter spp. 16 pacientes fueron de sexo masculino y 11 de sexo femenino, la edad promedio fue de 55 ±19; 23 pacientes fueron catalogados como enfermedad no fatal y cuatro como últimamente fatal, 20 pacientes presentaban un APACHE II al ingreso mayor o igual a 15 y los restantes siete presentaban un APACHE II menor a 15. La mayoría de las NAV a Acinetobacter spp. se desarrollaron luego del séptimo día de ventilación mecánica (18/27=67%), sin embargo, 33% (9/27) se desarrolló antes del día 7.
El diagnóstico al ingreso consistió en: exacerbación de una enfermedad pulmonar obstructiva crónica (EPOC) en cuatro pacientes, neumonía comunitaria grave en cuatro pacientes, cirugía toracoabdominal en cuatro casos, trauma en dos oportunidades, enfermedad del sistema nervioso central en seis pacientes, sepsis severa en seis casos y misceláneas en una oportunidad. La NAV resultó multilobar o bilateral, o ambos, en 14 pacientes (51%). Se registró shock séptico en 12 pacientes (44%) y SDRA en 11 (40%). Tuvieron criterio de curación 16 pacientes (59%), con una mortalidad cruda de 59% (16/27) (tabla 1).
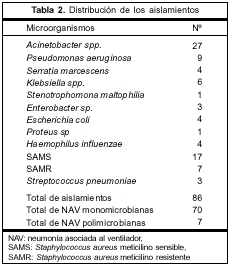
La distribución de los diferentes patógenos está representada en la tabla 2. Un total de 86 aislamientos fueron documentados; Staphylococcus aureus meticilino sensible (SAMS) y Pseudomonas aeruginosa fueron los que siguieron en frecuencia a Acinetobacter spp. Hubo dos NAV a Acinetobacter spp. polimicrobiana, asociada a Proteus sp. en un caso y a SAMS en otro.
La tabla 3 expresa las características principales del grupo que desarrolló NAV por Acinetobacter spp.
Un total de 38 variables fueron estudiadas por análisis univariado (tabla 4).
Un GCS de 8 o menor se asoció con mayor riesgo para desarrollar NAV por patógenos diferentes a Acinetobacter spp. (p=0,044, RR 1,45, IC 95% 1,07-1,97).
El uso de antibióticos previos se asoció con mayor riesgo de desarrollar NAV por Acinetobacter spp. (p=0,0029, RR 3,47, IC 95% 1,33-9,04). Acinetobacter spp. se presentó solo en 13,8% de NAV cuando no recibían antibióticos previos; y en los pacientes con NAV que recibían antibióticos previos tuvieron a Acinetobacter spp como agente etiológico en 48% de los casos. Cuando el antibiótico previo era ceftriaxona y el paciente desarrollaba NAV la frecuencia de Acinetobacter spp. fue de 72% (14 en 18) frente a sólo 22% (13 en 59) de Acinetobacter spp. de los que no recibían ceftriaxona. El haber recibido en los días previos un plan antimicrobiano que incluía ceftriaxona se asoció claramente en el análisis univariado a un mayor riesgo de desarrollar una neumonía por este patógeno (p=0,0002, RR 3,28, IC 95% 1,89-5,69).
El uso previo de fluorquinolonas también fue un factor de riesgo para adquirir NAV por Acinetobacter spp. (p=0,0349, RR 2,06, IC 95% 1,17-3,64). El tener una sepsis grave como enfermedad de ingreso fue un factor de riesgo para desarrollar neumonía por este patógeno (p=0,0065, RR 2,8, IC 95% 1,78-4,56) (tabla 4).
Los datos fueron analizados en un modelo de regresión logística donde la variable dependiente fue Acinetobacter spp. Las variables independientes fueron: shock séptico, traqueostomía, uso previo de antibióticos, uso previo de ceftriaxona (CRO), uso previo de fluorquinolonas y sepsis severa. Se obtuvo que el uso previo de CRO (p=0,0001, OR=11,2) y el uso previo de fluorquinolonas (p=0,003, OR=7,0) predicen significativamente y en forma independiente el desarrollo de NAV por Acinetobacter spp. (tabla 5).
Discusión
El principal hallazgo de este estudio fue poder identificar que el uso previo de fluorquinolonas y principalmente de ceftriaxona es factor de riesgo para adquirir una NAV por Acinetobacter spp. en la población estudiada.
Distintos investigadores ya han documentado el impacto que genera el uso previo de antimicrobianos en el desarrollo posterior de NAV por Acinetobacter spp.
Lortholary y colaboradores refieren que 75% de los pacientes que fueron colonizados o infectados con Acinetobacter spp. habían recibido antimicrobianos(11).
Fagon y colaboradores documentaron que la frecuencia de NAV causada por especies de Pseudomonas y Acinetobacter spp. fue más alta en pacientes que recibieron terapia antimicrobiana previa (65% versus 19%, p=0,001)(12).
Sin embargo, los antibióticos que se asociaron a mayor riesgo fueron diferentes; en un estudio retrospectivo sobre 15 episodios de NAV por Acinetobacter baumannii en pacientes que recibieron asistencia respiratoria mecánica, al menos una semana, un análisis univariado evidenció que el uso previo de ceftazidime incrementó el riesgo de adquirir neumonía por este patógeno(10).
En este estudio, coincidentemente con Villers y colaboradores(13), el uso previo de fluorquinolonas se asocia a mayor riesgo de desarrollar NAV por Acinetobacter spp.
Otros autores identificaron factores de riesgo diferentes al uso de antibióticos previos como asociados con el desarrollo de NAV por Acinetobacter spp.: TEC, SDRA, neurocirugía y aspiración pulmonar voluminosa(8) fueron documentados en un análisis de regresión logística analizando 12 neumonías producidas por Acinetobacter baumannii.
Akca y colaboradores analizan nueve neumonías a Acinetobacter spp. identificando como factores de riesgo a la aspiración de vía aérea y a un score de Glasgow menor o igual a 9(9). Los factores de riesgo de los autores previamente citados no fueron encontrados en el presente trabajo. A su vez la comorbilidad, gravedad del enfermo, motivo de ingreso y algunas intervenciones terapéuticas como uso de PEEP, anti H2, sonda nasogástrica, no se asociaron a mayor riesgo de infección por este patógeno.
Los marcadores de infección cruzada encontrados por Baraibar y colaboradores(8) no se hallaron en el presente trabajo. Una explicación posible es que en estas UCI, Acinetobacter spp. es endémico y la manipulación de la vía aérea pierde valor como determinante de colonización y posterior infección.
Puede verse que la adquisición y diseminación de Acinetobacter spp. varía para cada institución dependiendo de múltiples factores de riego analizados.
Los antibióticos previos ejercen una presión selectiva facilitando la colonización por este patógeno. En el presente estudio 33% de las NAV por Acinetobacter spp. se desarrollaron antes del día 7, lo que traduce, entre otras cosas, que este patógeno coloniza y produce infección rápidamente.
Si se quiere disminuir la incidencia creciente de este patógeno se deberían instaurar políticas de restricción o rotación de antimicrobianos, o ambos, principalmente el uso de ceftriaxona y fluorquinolonas. La restricción o rotación de antimicrobianos, o ambos, ha demostrado ser una buena opción a la hora de disminuir la incidencia de la NAV(25,26).
Siete de los 14 pacientes que recibieron ceftriaxona tenían una neumonía comunitaria de base, ya sea una sepsis respiratoria severa o una NAC severa. Por lo tanto es vital revalorar la inclusión casi sistemática en nuestro medio de ceftriaxona dentro del plan terapéutico para el manejo de las NAC que requieren ARM. Se deben proponer planes alternativos de restricción o rotación, o ambos, con aminopenicilinas asociadas a betalactámicos.
Se reafirma, además, el concepto de que cada unidad debe saber cuáles son los factores de riesgo para desarrollar una NAV y particularmente para patógenos multirresistentes.
Las limitaciones del presente estudio radican en que al no hacer tipificación molecular no sabemos si en este período de estudio no hubo una emergencia monoclonal en unidades que tienen a este microorganismo en forma endémica y, por lo tanto, los factores de riesgo ser diferentes.
En conclusión, teniendo en cuenta las limitaciones señaladas, los presentes resultados parecen indicar que si se quiere disminuir el aumento constante en la incidencia de Acinetobacter spp. se debe valorar exhaustivamente la indicación de ceftriaxona o fluorquinolonas, o ambas, dentro de los planes terapéuticos. Se sugiere la restricción de ceftriaxona-fluorquinolonas y rotación con otras moléculas de espectro similar.
Agradecimientos
A los doctores Solveig Bentancourt, Ana Soca, Cristina Bazet y Jorge Gerez por el apoyo siempre constante a la investigación.
Summary
The incidence of pneumonia associated with Acinetobacter spp.-ventilation (PAV) has risen both at national and international levels and determines high mortality rates. Risk factors for developing this hospital-acquired pneumonia vary in every centre.
We aimed at identifying specific risk factors for developing PAV.
This 24-month prospective study (May 2000-May 2002) took place in the intensive care units (IUC) of the Hospital Pasteur and the Hospital Policial. All ventilated patients for a period of 48 hours or more, suspected to carry PAV were enrolled. Only pneumonias bacterial-proved were analyzed.
Results. In a sample of 137 patients, suspected carriers of PAV, 77 PAV events were bacterial-proved: 27 for Acinetobacter spp. and 50 for other pathogens.
Logistic regression was used to analyze data, the independent variable was Acinetobacter spp. Previous use of ceftriaxone (CRE) (p = 0,0001, OR = 11,2) and flurquinolone (p=0,003, OR=7,0) significant and independently predicted PAV.
Conclusions. CRE and fluorquinolone were indentified as risk factors for developing PAV. Restriction on CRE and fluorquinolone and use of other molecules of similar spectrum in rotation.
Résumé
L'incidence de pneumonie associée à la ventilation (NAV) par Acinetobacter spp. au domanine national et interna-tional est croissante et détermine un ehaite mortalité attribuable. Les facteurs de risque pour acquérir une pneu-monie par ce pathogène varient aux différents centres.
Le but de ce travail a été d'identifier les facteurs de risque spécifiques pour acquérir NAV par Acinetobacter spp.
L'étude clinique prospective a été faite pendant une période de 24 mois (entre mai 2000 et mai 2002) aux unités de soins intensifs (UCI) de l'Hôpital Pasteur et de l'Hôpital Policier. On a inclu tous les patients ventilés pour une période de 48 heures ou plus qui soient soupçonnés de développer une NAV. On n'a analysé que les pneumonies bactériologiquement confirmées.
Résultats: 137 patients à soupçon clinique de NAV, dont 77 épisodes de NAV ont été confirmées bactériolo-giquement: 27 par Acinetobacter spp. et 50 par d'autres pathogènes.
Les données ont été analysées dans un modèle de régression logistique où la variable dépendante a été Acinetobacter spp. L'emploi préalable de cephriaxone (CRO) (p=0,0001, OR=11,2) et l'emploi préalable de fluorquinolones (p=0,0003, OR=7,0) prédisent remar-quablement et de manière indépendante le développement de NAV par Acinetobacter spp.
Conclusions: On a identifié comme facteurs de risque pour développer NAV par Acinetobacter spp. l'emploi préalable de CRO et de fluorquinolones. On suggère la restriction de cephriaxone-fluorquinolones et rotation avec d'autres molécules à spectre semblable.
Bibliografía
1. Fagon JY, Chastre J, Hance AJ, Montravers P, Novara A, Gibert C. Nosocomial Pneumonia in Ventilated Patients: A Cohort Study Evaluating Attributable Mortality and Hospital Stay. Am J Med 1993; 94(3): 281-8.
2. Medina J, Correa H, Formento C, Pontet J, Curbelo A. ¿Cuál es la duración adecuada del tratamiento antimicrobiano en la Neumonía Asociada a la Ventilación? Pac Crít (Montevideo) 2002; 15(1-2-3): 58-66.
3. Bergogne-Bérézin E, Towner KJ. Acinetobacter spp. as nosocomial pathogens: microbiological, clinical, and epidemiological features. Clin Microbiol Rev 1996; 9(2): 148-65.
4. Medina J, Soca A, Bazet C, Bentancourt S. Neumonía Asociada a la Ventilación. Incidencia, agentes etiológicos y evolución según tratamiento. Pac Crít (Montevideo) 2000; 13(1-2): 8-22.
5. Medina J, Formento C, Pontet J, Curbelo A, Soca A, Bazet C, et al. Neumonía Asociada a la Ventilación. Estrategia empírica precoz vs. estrategia específica en el tratamiento antibiótico. Datos preliminares. Pac Crít (Montevideo) 2001; 14(3): 30-46.
6. Lombardi R, Guerra S, Pivel L, Rodríguez C, Toja G, Pacheco L. Infección/colonización respiratoria por S. maltophilia y Acinetobacter spp. en el paciente crítico. Pac Crít (Montevideo) 2000; 13(3): 93-108.
7. Torres A, Aznar R, Gatell JM, Jiménez P, González J, Ferrer A et al. Incidence, risk and prognosis factors of nosocomial pneumonia in mechanically ventilated patients. Am Rev Respir Dis 1990; 142(3): 523-8.
8. Baraibar J, Correa H, Mariscal D, Gallego M, Valles J, Rello J. Risk factors for infection by Acinetobacter baumannii in intubated patients with nosocomial pneumonia. Chest 1997; 112(4): 1050-4.
9. Akca O, Koltka K, Uzel S, Cakar N, Pembeci K, Sayan MA, et al. Risk factors for early-onset, ventilator-associated pneumonia in critical care patients: selected multiresistant versus nonresistant bacteria. Anesthesiology 2000; 93(3): 638-45.
10. Husni RN, Goldstein LS, Arroliga AC, Hall GS, Fatica C, Stoller JK, et al. Risk Factors for an Outbreak of Multi-Drug-Resistant Acinetobacter Nosocomial Pneumonia Among Intubated Patients. Chest 1999; 115(5): 1378-82.
11. Lortholary O, Fagon JY, Hoi AB, Slama MA, Pierre J, Giral P, et al. Nosocomial acquisition of multiresistant Acinetobacter baumannii: risk factors and prognosis. Clin Infect Dis 1995; 20(4): 790-6.
12. Fagon JY, Chastre J, Domart Y, Trouillet JL, Pierre J, Darne C, et al. Nosocomial Pneumonia in Patients Receiving Continuous Mechanical Ventilation: Prospective Analysis of 52 Episodes with use of a Protected Specimen Brush and Quantitative Culture Techniques. Am Rev Respir Dis 1989; 139(4): 877-84.
13. Villers D, Espaze E, Coste-Burel M, Giauffret F, Ninin E, Nicolas F, et al. Nosocomial Acinetobacter baumannii infections: microbiological and clinical epidemiology. Ann Intern Med 1998; 129(3): 182-9.
14. Johanson WG Jr, Pierce AK, Sanford JP, Thomas GO. Nosocomial respiratory infections with gram negative bacilli. The significance of colonization of the respiratory tract. Ann Intern Med 1972: 77(5): 701-6.
15. Flanagan PG, Findlay GP, Magee JT, Ionescu A, Barnes RA, Smithies M. The diagnosis of ventilator-associated pneumonia using non-bronchoscopic, non-directed lung lavages. Intensive Care Med 2000; 26(1): 20-30.
16. Bergmans DC, Bonten MJ, Leeuw PW, Stobberingh EE. Reproducibility of quantitative cultures of endotracheal aspirates from mechanically ventilated patients. J Clin Microbiol 1997; 35(3): 796-8.
17. Bernard GR, Artigas A, Brigham KL, Carlet J, Falke K, Hudson L, et al. The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med 1994; 149(3 Pt 1): 818-24.
18. Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, et al. Definitions for sepsis and organ failure and guidelines for the use of innovatives therapies in sepsis. The ACCP/SCCM. (American College of Chest Physician/Society of Critical Care Medicine). Consensus Conference Comitee. Chest 1992; 101: 1644-55.
19. Ewig S, Ruiz M, Mensa J, Marcos MA, Martínez JA, Arancibia F, et al. Severe community-acquired pneumonial. Assessment of severity criteria. Am J Respir Crit Care Med 1998; 158(4): 1102-8.
20. Zwillich CW, Pierson DJ, Creagh CE, Sutton FP, Schatz E, Petty TL. Complications of Assisted Ventilation. A prospective Study of 354 consecutive Episodes. Am J Med 1974; 57(2): 161-70.
21. McCabe WR, Jackson GG. Gram-negative bacteriemia. Arch Intern Med 1962; 110: 847-64.
22. Knaus WA, Draper EA, Wagner DP, Zimmerman JE. APACHE II: a severity of disease classification system. Crit Care Med 1985; 13(10): 818-9.
23. Marshall JC, Cook DJ, Christou NV, Bernard GR, S prung CL, Sibbald WJ. Multiple organ dysfunction score: a reliable descriptor of a complex clinical outcome. Crit Care Med 1995; 23(10): 1638-52.
24. Vincent JL, Moreno R, Takala JS, Willatts S, De Mendonca A, Bruining H, et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on Sepsis. Related Problems of the European Society of Intensive Care Medicine. Intensive Care Med 1996; 22(7): 707-10.
25. Gruson D, Hilbert G, Vargas F, Valentino R, Bebear C, Allery A, et al. Rotation and Restricted use of antibiotics in a medical intensive care unit. Impact on the incidence of ventilator-associated pneumonia caused by antibiotic-resistent gram-negative bacteria. Am J Respir Crit Care Med 2000; 162(3 Pt 1): 837-43.
26. Raymond DP, Pelletier SJ, Crabtree TD, Gleason TG, Hamm LL, Pruett TL, et al. Impact of a rotating empiric antibiotic schedule on infectious mortality in an intensive care unit. Crit Care Med 2001; 29(6): 1101-8.