Serviços Personalizados
Journal
Artigo
Links relacionados
Compartilhar
Revista Médica del Uruguay
versão On-line ISSN 1688-0390
Rev. Méd. Urug. vol.18 no.1 Montevideo maio 2002
Vigilancia de las neumococcias del niño hospitalizado: su prevención específica (1994-2000)
Dra. María Hortal1, MSc. Teresa Camou2, Dra. Rosario Palacio3,
Lic. Gabriel Pérez-Giffoni4, Dr. José Luis Di Fabio5
y el grupo OPS/SIREVA-Uruguay*6
Resumen
Considerando que están siendo liberadas al mercado vacunas conjugadas con fórmulas que incluyen diferentes serotipos capsulares de Streptococcus pneumoniae y que éstos están sometidos a variación geográfica, el objetivo de este trabajo consiste en difundir la información nacional disponible y analizar la potencial cobertura que ofrecerán estas nuevas vacunas en niños hasta de 14 años.
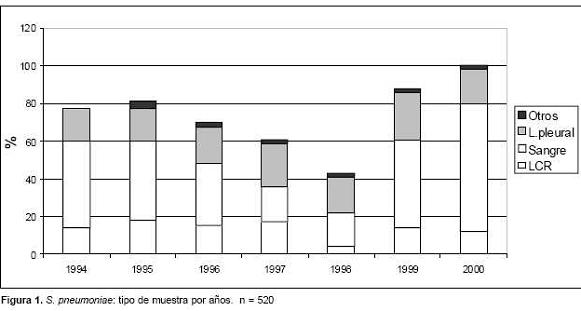
En siete años (1994-2000) se recolectaron 520 S.pneumoniae invasores aislados de pacientes con neumonía (67%), meningitis (21%), bacteriemia/sepsis (8%) y otros procesos (4%) tales como peritonitis, osteomielitis, celulitis y abscesos.
Al analizar la distribución de serotipos se pudo estimar una potencial cobertura global de 44,4% con la vacuna heptavalente (serotipos 4, 6B, 9V, 14, 18C, 19F y 23F), de 77,7% con la nonavalente (además serotipos 1 y 5) y de 86,9% con la 11-valente (además serotipos 3 y 7F). Los cruces antigénicos con otros serotipos no incluidos en las vacunas permite estimar un incremento en los porcentajes que llegarían a 53,2%, 86,5% y 95,7% respectivamente. Considerando el grupo de pacientes afectados de neumonía entre 4 meses y 5 años de edad, principales beneficiarios de las nuevas vacunas, el porcentaje de cobertura osciló entre 40% (2-5 años) y 67% (4-11 meses), mientras que la nonavalente evidenció una mejor cobertura, entre 78% y 86%. En los casos de meningitis se observó una mayor dispersión de serotipos por lo que las coberturas alcanzadas son generalmente menores que las de neumonía.
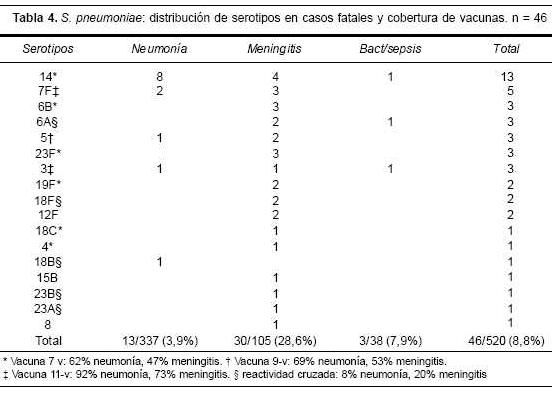
Los 43 casos fatales registrados en meningitis (n=30) y neumonías (n=13) podrían ser potencialmente prevenidos en 67%-70%, 73%-78% y 93%-100% con cada una de las vacunas en desarrollo.
Las cepas con sensibilidad disminuida a penicilina, presentes en todo el país, se aislaron más frecuentemente de casos de neumonía (39%) que en meningitis (12%). Con cualquiera de las fórmulas de vacunas, la cobertura global sería 92% para cepas con resistencia intermedia y 100% para las cepas con resistencia alta.
En resumen, considerando la relación costo-beneficio, la vacuna nonavalente sería la mejor opción para la prevención de las neumococcias invasoras y especialmente de las neumonías de los niños uruguayos, por incluir los tres serotipos más frecuentes en esta población de riesgo. Obviamente, la vacuna 11-valente, de ser económicamente accesible, optimizaría las coberturas.
Palabras clave: VACUNAS.
STREPTOCOCCUS PNEUMONIAE.
INFECCIONES NEUMOCÓCICAS - prevención y control.
VIGILANCIA EPIDEMIOLÓGICA.
NIÑO.
ADOLESCENCIA.
1. Ex Prof. Agregado, Depto. de Bacteriología y Virología, Facultad de Medicina. Prof. (de primer nivel) Programa de Desarrollo de las Ciencias Básicas (PEDECIBA), Universidad de la República.
Coordinador Nacional Programa OPS/SIREVA, e Investigador principal del proyecto sobre Carga de Enfermedad de las Neumonías y Meningitis del Niño.
2. Bacteriólogo, Depto. de Laboratorios, Ministerio de Salud Pública (MSP) e Investigador asociado Programa OPS/SIREVA.
3. Médico Infectólogo. Bacteriólogo en el Depto. de Laboratorios, MSP e Investigador asociado Programa OPS/SIREVA.
4. Microbiólogo, Depto. de Laboratorios, MSP y Docente titular grado 2, Laboratorio de Microbiología, Facultad de Ciencias, Universidad de la República.
5. Asesor en investigación, producción y control de calidad de vacunas. Programa especial de vacunas e inmunizaciones. OPS, Washington, DC, EEUU.
6. OPS/SIREVA: Oficina Panamericana de la Salud/Sistema Regional de Vacunas
Correspondencia: Dra. María Hortal. Hidalgos 532. Montevideo, CP 11.300 - Uruguay. E-mail: mhortal@st.com.uy
Recibido: 13/07/01.
Aceptado: 25/02/02.
Introducción
Streptococcus pneumoniae es una de las principales causas de infecciones adquiridas en la comunidad y aunque afecta a individuos de todas las edades predomina en los extremos de la vida. El tratamiento de las infecciones neumocóccicas tales como las neumonías, meningitis, bacteriemias/sepsis y otitis se ha complicado en la última década por el aumento de la resistencia de S. pneumoniae a los antibióticos de primera elección y por la multirresistencia de cepas que se han diseminado a nivel mundial(1). En el país, su relevancia resulta aun mayor al haberse eliminado prácticamente con la vacuna anti-Hib las enfermedades severas por Haemophilus influenzae tipo b (Hib)(2).
Hasta la fecha, solo se dispone de una vacuna anti-neumococo polivalente, integrada por polisacáridos purificados de 23 serotipos, cuya capacidad inmunogénica es variable y no es efectiva en niños menores de 2 años de edad por tratarse de antígenos "T" independientes(3). Las vacunas conjugadas actuales y en desarrollo, conteniendo 7, 9 u 11 poli u oligosacáridos capsulares covalentemente unidos cada uno a una proteína transportadora, prometen un éxito similar al obtenido con las vacunas anti- Hib, pero constituyen un producto final complejo y de elevado costo de elaboración. Ya en Estados Unidos, en el año 2000, la Food and Drug Administration (FDA) aprobó una vacuna conjugada heptavalente (Prevenar,Wyeth/Lederle), y se efectuaron recomendaciones para su aplicación en ese país(4,5).
Se han reconocido 90 serotipos capsulares diferentes en S. pneumoniae, pero a pesar de ello, en diferentes áreas geográficas unos pocos son responsables de infecciones invasoras y menor aun es el número de serotipos que expresan susceptibilidad disminuida a los b-lactámicos(6). En consecuencia, no es posible extrapolar información foránea para orientar antibioterapias empíricas ni para predecir la efectividad de una vacuna, debido a que la distribución de serotipos cambia con el tiempo y las distintas áreas geográficas, así como según la edad de los pacientes y las enfermedades(7,8).
A diferencia de las infecciones por Haemophilus influenzae donde la casi totalidad de la mortalidad y morbilidad severa era producida por un único serotipo(9), la elección de la mejor fórmula de vacuna conjugada para S. pneumoniae deberá basarse en los datos nacionales sobre frecuencia de serotipos para lograr una cobertura lo más amplia posible.
En Uruguay, ya en los años 80 se había iniciado una vigilancia de las neumococcias invasoras, estableciendo un centinela en el Hospital de Niños Pereira Rossell. A partir de 1994, la Oficina Panamericana de la Salud (OPS) a través del Sistema Regional de Vacunas (SIREVA), y en colaboración con la Canadian International Development Agency (CIDA), promovieron un estudio multicéntrico en seis países de Latinoamérica (México, Colombia, Brasil, Argentina, Chile y Uruguay), para recabar información sobre la frecuencia de serotipos capsulares y resistencia a los antibióticos de los neumococos invasores aislados de niños hospitalizados menores de 5 años. En el marco de ese programa se logró establecer una red nacional, incluyendo laboratorios de instituciones públicas y privadas de todo el país(10,11).
Considerando que próximamente serán liberadas al mercado vacunas conjugadas con fórmulas que incluyen diferentes serotipos capsulares, resulta oportuno hacer uso de la información existente a nivel nacional para la toma de decisiones. Por lo tanto, el objetivo del presente trabajo es difundir la información disponible a la fecha (edades de los niños con neumococcias, las distintas enfermedades, serotipos y susceptibilidad a los antibacterianos), y analizar la potencial cobertura que ofrecerán las vacunas antineumococo, tanto para evitar las enfermedades severas por esa causa como para aminorar el impacto de la resistencia del neumococo a los antibacterianos.
Material y método
Al inicio de la vigilancia promovida por OPS/SIREVA se estableció un protocolo de consenso con una ficha clínico-epidemiológica y datos microbiológicos que aseguraban la comparabilidad de los resultados entre los países participantes(10). Se establecieron los criterios de inclusión y exclusión de casos. En todos los pacientes con sospecha de neumonía según las pautas de AIEPI, el diagnóstico se confirmó radiológicamente vinculando así el aislamiento del neumococo de la sangre con la presencia de un foco pulmonar. Otras bacteriemias correspondieron a cuadros febriles sin foco clínicamente aparente. A cada paciente incluido en el estudio, se le contabilizó un solo aislamiento de S. pneumoniae recuperado de un compartimento corporal normalmente estéril (sangre, derrame pleural, peritoneal, líquido cefalorraquídeo [LCR], etcétera). Se dio preferencia a los neumococos aislados de LCR o de derrame pleural en las ocasiones en que también se le aisló de la sangre.
En el Departamento de Laboratorios de Salud Pública (DLSP), se efectuaron dos talleres sobre técnicas de laboratorio conducidos por bacteriólogos canadienses y nacionales de los que participaron técnicos de las principales instituciones públicas y privadas de Montevideo (n=8) y del interior del país (n=12). A partir de esa fecha se ha mantenido un control de calidad externo mediante envío y recepción cuatrimestral de cepas de neumococos por parte del National Centre of Streptococcus de Canadá localizado en la Universidad de Alberta, y a partir del año 2000, con la extensión de la red, por un subcentro para el área ubicado en el Instituto Adolfo Lutz de San Pablo.
Todos los aislamientos logrados durante el estudio fueron referidos al DLSP para su confirmación, realización de pruebas complementarias y almacenamiento en un banco histórico de cepas. La identificación de cada cepa se basó en la morfología colonial en medio de agar sangre, prueba de optoquina (³20 mm, Difco) y solubilidad en bilis. La serotipificación se llevó a cabo mediante reacción de "quellung" con 12 "pooles" de antisueros y factores producidos en el Statens Seruminstitut de Dinamarca(12). Las fórmulas de las vacunas heptavalente (4,6B, 9V, 14, 18C, 19F y 23F), nonavalente, que agrega a los anteriores los serotipos 1 y 5 y la 11-valente, que adiciona los serotipos 3 y 7F, se tomaron de base para los cálculos de cobertura. Además se tuvo en cuenta los cruces antigénicos intra serogrupo que fueron aislados en nuestro estudio (6A, 9N,18B, 18F, 19A, 23A y 23B)(13). La susceptibilidad a la penicilina se investigó mediante tamizaje con disco de oxacilina(14). En las cepas resistentes se determinó por microdilución o por E-test la concentración inhibitoria mínima (CIM) para penicilina y ceftriaxone. Según los criterios establecidos por el NCCLS, se consideró susceptible a penicilina a las cepas con CIM £0,06 mg/ml, con resistencia intermedia, 0,12-1,0 mg/ml y resistente ³ 2,0 mg/ml para penicilina y a ceftriaxone: susceptible £ 0,5 mg/ml, con resistencia intermedia 1 mg/ml y resistente ³ 2,0 mg/ml(14). En todos los casos se empleó la cepa ATCC 49619 como control de calidad interno. Salvo se especifique lo contrario, cuando se habla de resistencia o de susceptibilidad disminuida a penicilina se refiere a resistencia intermedia y alta. Se investigó también por difusión en disco la susceptibilidad a algunos antibióticos no b-lactámicos (trimetoprim/sulfametoxazol, eritromicina, cloranfenicol y vancomicina)(14).
Los datos clínico epidemiológicos y microbiológicos de cada paciente fueron ingresados en una base de datos en EPI-Info (6.04), utilizándose el mismo programa para su análisis.
Resultados
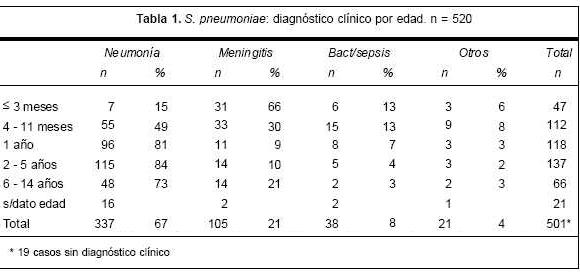
En siete años (1994-2000) de vigilancia de las neumococcias invasoras del niño se recolectaron 520 S. pneumoniae aislados de compartimentos corporales normalmente estériles (figura 1). La población captada abarcó pacientes con infecciones adquiridas en la comunidad en diferentes áreas geográficas del país, desde recién nacidos (menores de 28 días) a 14 años de edad. La distribución por edades y los principales diagnósticos clínicos se muestran en la tabla 1, en la que se observa que 277 (55,3%) pacientes eran menores de 2 años. La neumonía fue el diagnóstico clínico más frecuente (65%) en el conjunto de la población y también en cada grupo etario excepto en los menores de 1 año. Los diagnósticos de meningitis fueron más frecuentes en pacientes menores de 1 año, con un notorio predominio en los £ 3 meses. Ese grupo también incluye 14 recién nacidos con diversos diagnósticos clínicos. En los menores de 1 año, también fueron más frecuentes las bacteriemias y sepsis, y otros procesos tales como peritonitis, osteomielitis, celulitis y abscesos. Los mayores de 5 años fueron un grupo minoritario (13,8%), sobre todo hospitalizados por neumonías complicadas (73%).
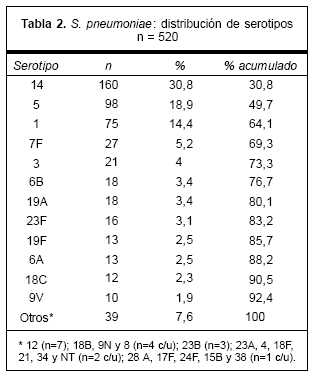
En la tabla 2 se muestran los 12 serotipos más frecuentes, con el 14, 5 y 1 ocupando los tres primeros lugares, los cuales representan 64,1% del total. De acuerdo con esos datos se puede estimar una potencial cobertura global de 44,4% con la vacuna heptavalente, de 77,7% con la nonavalente y de 86,9% con la 11-valente que añade los serotipos 3 y 7F. El notorio aumento de la cobertura de la segunda vacuna está influido por la incorporación en su fórmula de los serotipos 5 y 1, segundo y tercero en frecuencia en Uruguay. La vacuna 11-valente, si bien logra una mejor cobertura, no evidencia un aumento tan marcado como entre las dos primeras. Los serotipos con reactividad cruzada representaban 8,8%, lo que aumentaría las coberturas de cada una de las vacunas a 53,2%, 86,5% y 95,7% respectivamente.
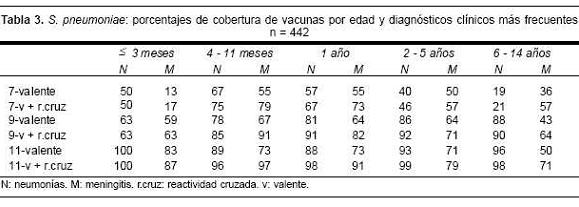
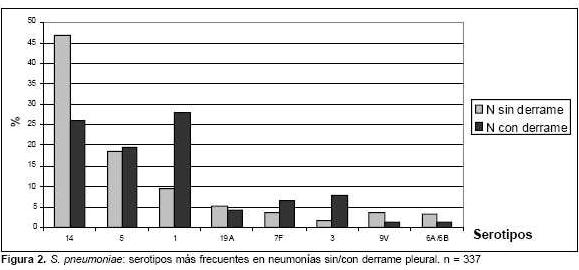
Si se discrimina a los serotipos según las edades de los pacientes y los diagnósticos clínicos más frecuentes (tabla 3), se aprecian diferencias en los porcentajes globales de coberturas mencionados anteriormente, así como aquellos que tienen en cuenta la reactividad cruzada. La menor cobertura de la vacuna heptavalente se registra en las neumonías del niño mayor de 2 años, llegando a significar solamente 19% en los mayores de 5 años y en las meningitis de los lactantes menores de 3 meses de edad (13%), coberturas que mejoran sustancialmente con la vacuna nonavalente. Esta proporciona también una mejor cobertura a los pacientes entre 4 meses y 5 años de edad, y es mayor en los casos de neumonía que para los de meningitis. De los aislamientos de neumonía (n=143), 42% tenía derrame pleural. Seis de estos pacientes fallecieron, dos eran inmunocomprometidos y de ellos se aislaron neumococos resistentes a penicilina. La máxima frecuencia se registró entre 1 y 5 años, a pesar de que los derrames ocurrieron en todas las edades. En la figura 2 se observa que las neumonías asociadas a los neumococos de los serotipos 1 (p<0,00001), 3 (p<0,005) tienen una mayor frecuencia en los derrames pleurales que los serotipos restantes.
Durante el estudio se registraron 46 casos fatales (tabla 4), que correspondieron a 30 meningitis (tasa de mortalidad 28,6%), 13 neumonías (tasa de mortalidad 3,9%) y tres bacteriemias/sepsis. Las edades de los pacientes fallecidos fueron: nueve menores de 3 meses (con tres recién nacidos), 20 de 3 meses a 2 años, 14 de 3 a 5 años y tres de 8, 9 y 11 años. En los aislamientos del LCR de los casos fatales, hubo una gran dispersión de serotipos, en tanto que entre las neumonías el serotipo 14 correspondió a la mayoría de los aislamientos (8/13). Las vacunas en consideración ofrecerían la posibilidad de prevenir las muertes por meningitis entre 67% y 93%, en tanto que en las causadas por neumonía la cobertura alcanzaría entre 70% y 100%.
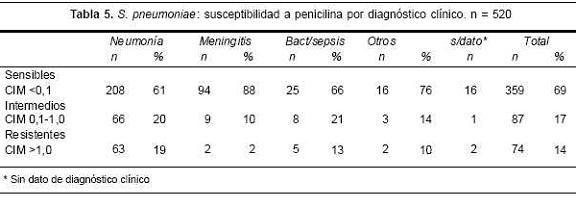
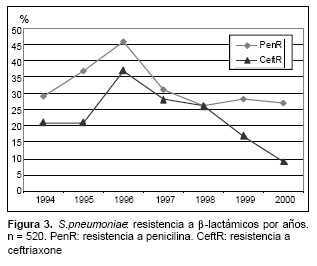
En la tabla 5 se detalla la susceptibilidad de S. pneu-moniae a la penicilina según los diferentes diagnósticos clínicos. Sesenta y nueve por ciento de los aislamientos fueron susceptibles, pero mientras que en las meningitis hubo solo 12% de susceptibilidad disminuida a penicilina, el porcentaje en las bacteriemias y sepsis fue de 34%, y de 39% en las neumonías. En la figura 3 se observa la evolución de la resistencia a b-lactámicos en los años estudiados. Se registró un ascenso de la resistencia con un máximo en 1996, seguido de una declinación relativa. Mientras que la resistencia a la penicilina se mantuvo estable desde 1997 (entre 25% y 30%), la resistencia a ceftriaxone continuó descendiendo hasta 9% en el año 2000. La mayor parte de las cepas resistentes pertenecía al serotipo 14 (90%). Con cualquiera de las fórmulas de las vacunas la cobertura sería 92% para cepas con resistencia intermedia y 100% para las cepas con resistencia alta. El resto de los aislamientos correspondía al serotipo 19A (n=9) y al 23B (n=2), que tienen reactividad cruzada con los serotipos incluidos en la vacuna heptavalente.
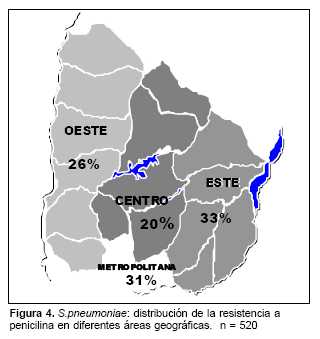
Los porcentajes de resistencia a penicilina de los aislamientos recuperados de pacientes de diferentes áreas geográficas del país oscilaron entre 20% en el área central y 33% en el área este (figura 4). El mayor número de aislamientos correspondió a pacientes residentes en el área metropolitana (Montevideo, Canelones y San José) con una resistencia a penicilina cercana al máximo hallado (31%).
La resistencia a antibióticos no b-lactámicos fue frecuente para trimetoprim-sulfametoxazol (41%), pero baja para eritromicina (4%) y cloranfenicol (2%). Ninguno de los 520 aislamientos mostró resistencia a vancomicina.
Discusión
La captación de 520 pacientes con neumococcias severas y la caracterización de los aislamientos de S. pneumoniae invasores permitieron fundamentar recomendaciones para la aplicación de las nuevas vacunas conjugadas. Los aislamientos de los hemocultivos relacionados con las neumonías tuvieron un rendimiento menor para aclarar la etiología del proceso que el cultivo de los derrames pleurales, hecho ya señalado previamente por los autores(15).
Los siete años de vigilancia le confieren a nuestros resultados un especial valor, que obvia modificaciones estacionales o circunstanciales, configurando así un patrón epidemiológico nacional por su representabilidad de las diferentes áreas del país. Sin embargo, este estudio evidencia solo parte del impacto para la salud ocasionado por S. pneumoniae, por tratarse únicamente de casos hospitalizados en los cuales se reconoció la etiología neumocóccica. Por ese motivo, los organismos sanitarios internacionales proponen complementar la estimación del impacto basándose en datos clínico-radiológicos con cuyo aporte se logrará una mejor aproximación de la carga de enfermedad que representan las neumonías(16). Se está aceptando, entonces, que la neumonía neumocóccica es una entidad clínica subdiagnosticada ya que solo se logra entre 5% y 15% de diagnóstico etiológicos. Sin embargo, resultados de estudios serológicos realizados en Finlandia determinaron la causa en 85% de los niños con neumonía menores de 2 años, de las cuales 30% evidenciaba infecciones concomitantes de virus y bacterias(17). Aunque en nuestro país la neumonía es la segunda causa de mortalidad en el período posneonatal(18) y 21,7% de las necropsias de las muertes inesperadas del lactante, la involucran(19); la letalidad por neumonías neumocóccicas en el presente estudio fue muy baja (3,9%). No siendo esta una enfermedad de denuncia obligatoria como las meningitis, existe un importante subregistro, por lo que se requiere de estudios prospectivos controlados para estimar el número real de neumonías, la magnitud del problema que representan y el potencial impacto que proporcionaría la vacunación. Resultados de los estudios de campo en Estados Unidos, con vacuna heptavalente, pusieron de manifiesto que se prevendría 10,7% de las neumonías clínicamente diagnosticadas, 35% de aquellas con radiografía de tórax alterada y 63% de las que se acompañaban de un foco de consolidación pulmonar(4).
Características de la población. En términos generales, la distribución por edades de las neumococcias estudiadas coincide con lo reportado en otros estudios(20). El predominio de pacientes menores de 2 años permite recalcar la trascendencia de disponer en un futuro próximo de vacunas conjugadas aptas para la protección de estos grupos de riesgo. Se espera prevenir las neumococcias invasoras luego de la administración de las tres dosis recomendadas, lo que recién se logrará a los 6 meses de edad del niño. No obstante, si se confirma lo verificado en la experiencia de campo de California, una sola dosis administrada a los 2 meses de edad prevendría las bacteriemias(21). Aun cuando se confirmen esas observaciones quedarían expuestos los menores de 2 meses. En consecuencia, la inmunización materna o del recién nacido son alternativas a seguir considerando(22). Por otra parte, de mantenerse un programa de vacunación, la memoria inmunológica conferida por las vacunas conjugadas en pocos años lograría una protección que paulatinamente alcanzaría a los niños mayores, lo que justifica desde ya el interés de recabar información sobre ellas. Además la posible disminución de la portación orofaríngea de los serotipos presentes en la vacuna evitaría su diseminación(23).
Implicancias de los serotipos. La distribución y frecuencia de los serotipos en Uruguay reviste características especiales, con un neto predominio del serotipo 14. Frecuente en todo el mundo, es considerado un serotipo pediátrico por excelencia. En Uruguay ya era prevalente en la década del 80 con 39,6% de participación(24,25). Sin embargo, a partir de 1994 se introdujo en el país un clon serotipo 14 resistente a penicilina y trimetoprim/sulfametoxazol que determinó el aumento abrupto de resistencia a penicilina y que paulatinamente fue sustituyendo a los aislamientos serotipo 14 susceptibles(26).
Le sigue, en frecuencia, el serotipo 5, considerado habitual en los países en desarrollo. En concordancia con ello se le ha encontrado en los seis países latinoamericanos participantes del programa OPS/SIREVA, con una frecuencia que varía entre 2,6% en México y 14% en Uruguay.
El serotipo 1, tercero en nuestra población pediátrica, y catalogado también como propio de los países en desarrollo, no es aislado en Estados Unidos y Canadá, pero se le encuentra con relativa frecuencia en aislamientos de los países europeos y constantemente en cinco de los seis países latinoamericanos (excepto México) con una frecuencia global de 8,8%(27,28). En nuestro país es notoria su participación en los casos de neumonías con derrame pleural.
Considerando las formulaciones de las vacunas a liberarse próximamente al mercado, éstas resultan, en general, potencialmente más efectivas para prevenir las neumonías que las meningitis u otras enfermedades. Como la neumonía es la infección neumocóccica severa que representa la mayor carga de enfermedad, y tiene el mayor impacto para la salud, se considera que la cobertura de esta enfermedad es el principal objetivo de una vacunación, conjuntamente con el control de la otitis media aguda(29).
La fórmula de la vacuna heptavalente proporciona una cobertura global de 44,4% para prevenir las neumococcias de los niños uruguayos, pero ésta aumenta al considerar los cruces antigénicos (53,2%). En un estudio de eficacia de esta vacuna en Finlandia, la reducción del número de episodios de otitis media atribuidos a los serotipos con reactividad cruzada fue similar a aquellos causados por los serotipos incluidos en la vacuna(13). Además, en las neumonías de los niños que serían directamente beneficiados por la vacuna, esa cobertura oscila entre 46% para el grupo de 2 a 5 años y 75% para los lactantes de 4 a 11 meses. La cobertura también sería baja en los niños mayores de 5 años, pero se trata de edades no previstas por los calendarios de vacunación propuestos. Las coberturas alcanzadas por las vacunas 9 y 11-valente mejoran sustancialmente, aunque siempre son superiores para las neumonías.
Las variaciones en los porcentajes de cobertura, según grupo etario y patología, confirman lo destacado por Scott y colaboradores(30), quienes señalan que los neumococos según las edades se comportan como si fuesen agentes diferentes.
Los casos fatales tendrían también una razonable cobertura con esa vacuna, a pesar de que la mayor virulencia del serotipo 3, y una asociación observada entre los casos fatales con el 7F podrían apoyar la elección de la vacuna 11-valente, en la cual esos serotipos están incluidos. Otro aspecto a considerar es la posibilidad de mejorar la inmunización combinando las vacunas conjugadas con la 23-valente, particularmente en los casos especiales de niños de mayor edad, entre los cuales hay importante dispersión de serotipos(3).
Neumococos resistentes a penicilina. La disminución de la susceptibilidad a los b-lactámicos en las cepas aisladas de población pediátrica urgió a un empleo más racional de los antibióticos y se constituyó en un argumento más para promover acciones de prevención(31). En contraste, en los neumococos aislados de adultos la resistencia a penicilina no ha sobrepasado el 10%(32). La prevención por las nuevas vacunas lograría controlar la diseminación de cepas resistentes. En Uruguay, a diferencia de otros países, la multirresistencia es excepcional. El patrón de resistencia más frecuente incluye penicilina y trimetoprim-sulfametoxazol, predominio que ha sido explicado por la introducción y diseminación en el país de un clon serotipo 14, originado en España en la década del 80(26).
La mayor parte de los serotipos asociados a resistencia a penicilina es cubierta por cualquiera de las tres vacunas, con 92% de cobertura para los S. pneumoniae con resistencia intermedia y 100% para los con resistencia alta. El serotipo 14 tiene alta prevalencia en los aislamientos de neumonías bacteriémicas, con CIMs de 1 o 2 ug/ml, los que son fácilmente superados por los niveles que se logran en sangre(33). No sucede lo mismo con los neumococos resistentes recuperados de casos de meningitis, pues, aunque menos frecuentes, la disminución de su susceptibilidad puede comprometer los tratamientos. En los últimos años se registró un descenso en la resistencia a ceftriaxone, probablemente como resultado de un uso más racional del fármaco, reservado actualmente para el tratamiento de las meningitis(34).
Perspectivas y conclusiones
La vacuna heptavalente ya está disponible en el país. Si bien su fórmula no proporciona una cobertura recomendable para intervenciones de Salud Pública, a nivel individual ofrece algunas ventajas. Contiene el serotipo 14 que frecuentemente se asocia a neumonías del niño, y es el principal responsable de la resistencia a los antibióticos b-lactámicos. Sin embargo, en base a la información nacional disponible, la vacuna nonavalente sería una mejor opción, ya que cubre los tres primeros serotipos prevalentes en nuestra población infantil. Obviamente, la vacuna 11-valente, de ser económicamente accesible, optimizaría las coberturas.
Una segunda generación de vacunas se encuentra en desarrollo, basada en una proteína específica de la superficie de S. pneumoniae (PspA). Esta vacuna, además de disminuir costos de producción, permitiría una protección total de las infecciones, independientemente de los serotipos y de particularidades geográficas(35). En un futuro cercano se aprobarán vacunas que, sin duda, contribuirán a aminorar la carga de enfermedad que en la actualidad representan las neumococcias del niño.
Agradecimientos
A OPS y a CIDA por el apoyo técnico y financiero que hicieron posible la realización de esta vigilancia, en especial y respectivamente al doctor C. de Quadros y a M. Lovgren. A las autoridades de las diferentes instituciones asistenciales y a su personal que posibilitaron la obtención de la información clínica. Al director del DLSP, doctor E. Civila, y a su personal, que brindaron la infraestructura necesaria para los estudios microbiológicos. En especial a las doctoras G. Algorta y L. Pivel y a los bacteriólogos clínicos:
S. Assandri, C. Bazet, G. Borthagaray, M. Castro, M. de los Santos, R. Diez, C. Fajardo, S. Fazzio, C. Fernández, A. Galiana, A. Giordano, P. Giordano, L. Jorge, L. Maurin, N. Milanese, C. Mogdasy, C. Pallas, W. Pedreira, A. Pisano, G. Rodríguez, E. San Martín, E. Torres, M.C. Viegas, representantes de las siguientes instituciones: Hospital Pereira Rossell, Casa de Galicia, IMPASA, Hospital Británico, Asociación Española, CASMU, Central Médica, CRAMI, Médica Uruguaya, Sanatorio Mautone y los hospitales Bella Unión, Cerro Largo, Clínicas, Colonia, Evangélico, Durazno, Español, Florida, Maldonado, Militar, Pan de Azúcar, Paysandú, Rivera, Salto, Tacuarembó, Treinta y Tres.
Summary
The aim of this paper are to promote available national information and to analyze the effects of the recently released vaccinations such as serum streptococcus pneumo-niae capsules in infants up to 14 years old.
During seven years (1994-2000) 520 isolate invaders were collected in patients with pneumonia (67%), meningitis (21%), bacteremia/sepsis (8%), and other processes (4%) such as peritonitis, osteomyelitis, cellulite, and abscess. Serotype distribution showed a global potentially coverage of 44% with heptavalent vaccine (serotypes 4, 6B, 9V, 14, 18C, 19F and 23F), 77% with nonavalent vaccine (plus serotypes 1 and 5), and 86,9% with 11-valent vaccine (plus serotypes 3 and 7F). Antigenic combination with other serotypes not included in vaccines allows to estimate rate increase up to 53.2%, 86.5% and 95,7% respectively. In patients from 4 months to 5 years old, primary beneficiaries of recent vaccines, coverage rates ranged from 40% (2-5 years) to 67% (4-11 months), whereas nonavalent vaccine showed a better coverage, 78% to 86%. Coverage reached in patients with meningitis was lower compared to patients with pneumonia since serotype dispersion was higher.
Forty-three fatal cases (meningitis, 30 and pneumonia, 13) could have potentially been prevented in 67-70%, 73-78% and 93-100% with these new vaccines.
Strains with diminished susceptibility to penicillin, countrywide found, were more frequently isolated in cases of pneumonia (39%) than in cases of meningitis (12%). Overall coverage of any of these vaccines was 92% for intermediate resistant strains and 100% for high resistant strains.
In summary, considering cost effectiveness, nonava-lent vaccine appears to be as the best choice to prevent invasive pneumococcia, particularly in Uruguayan infants since it includes three of the most frequent serotypes found in this population at risk. Obviously, 11-valent vaccine may widen coverage in case costs were lower.
Résumé
Tenant compte qu’on est en train de libérer dans le marché des vaccins conjugués à des formules qui incluent de différents sérotypes capsulaires de Streptococcus pneu-moniae et que ceux-ci sont soumis à des variantes géographiques, le but de ce travail est de diffuser l’informa-tion nationale disponible et d’analyser la couverture que ces nouveaux vaccins offriront aux enfants jusqu’à 14 ans.
En sept ans (1994-2000), on a recueilli 520 S.pneumo-niae envahissants isolés de patients avec pneumonie (67%), méningite(21%), bactériémie/septicémie (8%) et d’autres (4%) tels que péritonite, ostéomyélite, cellulite et abcès. Tout en analysant la distribution de sérotypes, on a pu estimer une couverture potentielle globale de 44,4% avec le vaccin hebdo-valent (sérotypes 4, 6B, 9V, 14, 18C, 19F et 23F), de 77,7% avec le none-valent (en plus sérotypes 1 et 5) et de 86,9% avec le 11-valentiel (en plus sérotypes 3 et 7F). Les croisements antigéniques avec d’autres sérotypes pas inclus dans les vaccins permet d’estimer une croissance aux pourcentages qui attein-draient 53,2%, 86,5% et 95,7% respectivement.
Tenant compte du groupe de patients atteints de pneumonie d’un âge d’ entre 4 mois et 5 ans, principaux bénéficiaires des nouveaux vaccins, le pourcentage de couverture a varié entre 40% (2-5 ans) et 67% (4-11 mois), tandis que le none-valent a montré une meilleure couverture, entre 78% et 86%. Dans les cas de méningite, on a constaté une plus grande dispersion des sérotypes ce qui a fait que les couvertures atteintes soient générale-ment inférieures à celles de la pneumonie.
Les 43 cas de mort par méningite (n=30) et par pneu-monie (n=13) pourraient être potentiellement prévenus en 67%-70%-78% et 93%-100% avec chacun des vaccins en voie de développement.
Les cèpes ayant sensibilité diminuée à la pénicilline, présentes dans tout le pays, ont été isolées plus fréquem-ment des cas de pneumonie (39%) que de méningite (12%). Avec n’importe laquelle des formules des vaccins, la cou-verture globale serait de 92% pour des cèpes à résistance intermédiaire et de 100% pour les cèpes à haute résistance.
Bref, si on considère la relation coût-bénéfice, le vaccin none-valent serait le meilleur choix pour la prévention des pneumococcies envahissantes, en particulier des pneu-monies des enfants uruguayens, puisqu’il contient les trois sérotypes les plus fréquents dans cette population à risque. Evidemment, le vaccin 11-valentiel, s’il était écono-miquement accessible, il optimiserait les couvertures.
Bibliografía
1. Musher DM. Infections caused by Streptococcus pneumoniae: clinical spectrum, pathogenesis, immunity and treatment. Rev Infect Dis 1992; 14: 801-7.
2. Ruocco G, Curto S, Savio M, Laurani H, Frocht R. Impacto y experiencia de vacunación contra Haemophilus influenzae tipo b. Rev Panam Salud Pública 1999; 5: 197-8.
3. Fedson DS, Musser MD. Pneumococcal vaccine. In: Plotkin SA, Mortimer EA Jr., eds. Vaccines. 2a ed. Philadelphia: WB Saunders, 1994: 517-63.
4. Shinefield HR, Black S. Efficacy of pneumococcal conjugate vaccines in large scale field trials. Pediatr Infect Dis J 2000; 19: 394-7.
5. Klein DL. Pneumococcal disease and the role of conjugate vaccines. Microb Drug Resist 1999; 5: 147-57.
6. Fenoll A, Jado I, Vicioso D, Pérez A, Casal J. Evolution of Streptococcus pneumoniae serotypes and antibiotic resistance in Spain: update (1990 to 1996). J Clin Microbiol 1998; 36: 3447-54.
7. Hausdorff WP, Bryant J, Kloek C, Paradiso PR, Siber GR. The contribution of specific pneumococcal serogroups to different disease manifestations: implications for conjugate vaccine formulation and use. Part II. Clin Infect Dis 2000; 30: 122-40.
8. Baquero F. Pneumococcal resistance to b-lactam antibiotics: a global geographic overview. Microb Drug Resist 1995; 1: 115-20.
9. Hortal M, Camou T, Fajardo C, Palacio R, Pallas C, Palma L, et al. Caracteres biológicos de Haemophilus influenzae aislados de diferentes poblaciones infantiles. Arch Pediatr Urug 1993; 64: 15-8.
10. Di Fabio JL, Homma A, De Quadros C. Pan American Health Organization Epidemiological surveillance network for Streptococcus pneumoniae Microb Drug Resist 1997; 2: 131-3.
11. Hortal M and the Pneumococcus study group. Capsular type distribution and susceptibility to antibiotics of Streptococcus pneumoniae Clinical strains isolated from Uruguayan children with systemic infections. Microb Drug Resist 1997; 2: 159-63.
12. Sorensen UBS. Typing of pneumococci by using 12 pooled sera. J Clin Microbiol 1993; 31: 2097-100.
13. Eskola J, Kilpi T, Palmu A, Jokinen J, Haapakoski J, Herva E, et al. Efficacy of a pneumococcal conjugate vaccine against acute otitis media. N Engl J Med 2001; 344(6): 403-9.
14. National Committee for Clinical Laboratory Standards. Performance standards for antimicrobial susceptibility testing. Ninth information supplement M100- S9. Wayne: National Committee for Clinical Laboratory Standards, 1999: 52-4.
15. Hortal M, Mogdasy C, Russi JC, Deleón C, Suárez A. Microbial agents associated with pneumonia in children from Uruguay. Rev Infect Dis 1990; 12(8): S915-22.
16. Mulholland K. Strategies for the control of pneumococcal diseases. Vaccine 1999; 17: S 79-84.
17. Juven T, Mertsola J, Warris M, Leinonen M, Meurman O, Roivainen M, et al. Etiology of community-acquired pneumonia in 245 hospitalized children. Pediatr Infect Dis J 2000; 19: 293-8.
18. División Estadística del Ministerio de Salud Pública (Uruguay). Informe anual. Montevideo: MSP, 1999.
19. Gutiérrez C, Palenzuela S, Rodríguez A, Balbela B, Rubio I, Lenes A, et al. Muerte inesperada del lactante. Diagnóstico de situación en la ciudad de Montevideo. Arch Pediatr Uruguay 2001; 72: 185-97.
20. Castañeda E, Leal AL, Castillo O, De La Hoz F, Vela MC, Aramgo M, et al. Distribution of capsular types and antimicrobial susceptibility of invasive isolates of Streptococcus pneumoniae in Colombian children. Microb Drug Resist 1997; 3: 147-52.
21. Black S, Shinefield H, Fireman B, Lewis E, Ray P, Hansen JR, et al. Efficacy, safety and immunogenicity of heptavalent pneumococcal conjugate vaccine in children. Pediatr Infect Dis J 2000; 19(3): 187-95.
22. Mulholland K. Maternal immunization for the prevention of bacterial infection in young infants. FRACP, Global Programme for Vaccines and Immunization. Geneve: WHO/VRD/GEN/, 1998.
23. Raymond J, Le Thomas I, Moulin F, Commeau A, Gendrel D, Berche P. Sequential colonization by Streptococcus pneumoniae of healthy children living in an orphanage. J Infect Dis 2000; 181: 1983-8.
24. Mogdasy C, Camou T, Fajardo C, Hortal M. Colonizing and invasive strains of Streptococcus pneumoniae in Uruguayan children: type distribution and patterns of antibiotic resistance. Pediat Infect Dis J 1992; 11: 648-52.
25. Hortal M, Palacio R, Camou T, Mogdasy C. Antimicrobial resistance in Streptococcus pneumoniae strains from Uruguay. Pediatr Infect Dis J 1994; 13: 542-3.
26. Camou T, Hortal M, Tomasz A. The apparent importation of penicillin resistant capsular type 14 Spanish/ French clone of Streptococcus pneumoniae into Uruguay in the early 1990s. Microb Drug Resist 1998; 4: 219-24.
27. Kertesz DA, Di Fabio JL, Brandileone MC, Castañeda E, Echaniz-Aviles G, Heitman I, et al. Invasive Streptococcus pneumoniae infection in Latin American children: results of the Pan American Health Organization surveillance study. Clin Infect Dis 1998; 26: 1355-61.
28. Di Fabio JL, Castañeda E, Agudelo CI, De la Hoz F, Hortal M, Camou T, et al. Evolution of Streptococcus pneumoniae serptypes and penicillin susceptibility in Latin America, SIREVA-Vigía Group.1993-1999. Pediatr Infect Dis J 2001; 20: 959-67.
29. Eskola J, Kilpi T, Palmu A. Efficacy of a pneumococal conjugate vaccine against acute otitis media. N Engl J Med 2001; 344: 403-9.
30. Scott JAG, May AJ, Dagan R, Dixon JMS, Eykyn SJ, Fenoll A, et al. Serogroup-specific epidemiology of Streptococcus pneumoniae: association with age, sex, and geography in 7.000 episodes of invasive disease. Clin Infect Dis 1996; 22: 973-81.
31. Hortal M, Lovgren M, De la Hoz F, Agudelo CL, Brandileone MC, Camou T, et al. Antibiotic resistance in Streptococcus pneumoniae in six Latin American countries: 1993-1999 surveillance. Microb Drug Resist 2001; 7: 391-401.
32. Hortal M, Camou T, Palacio R, Dibarboure H, García A. Ten-year review of invasive pneumococcal diseases in children and adults from Uruguay: clinical spectrum, serotypes and antimicrobial resistance. Int Infect Dis 2000; 4: 91-5.
33. Heffelfinger JD, Dowell SF, Jorgensen JH, Klugman KP, Mabry LR, Musher DM, et al. Management of community-acquired pneumonia in the era of pneumococcal resistance. Arch Intern Med 2000; 160: 1399-1408.
34. Pírez MC, Martínez O, Ferrari AM, Nairac A, Montano A, Rubio I, et al. Standard case management of pneumonia in hospitalized children in Uruguay, 1997 to 1998. Pedatr Infect Dis J 2001; 20: 283-9.
35. Briles DE, Hollingshead S, Brooks-Walter A, Nabors GS, Fergusson L, Schilling M, et al. The potential to use PspA and other pneumococcal proteins to elicit protection against pneumococcal infection. Vaccine 2000; 18: 1707-11.