Introducción
Los tumores odontogénicos (TO) constituyen un espectro de lesiones que afecta principalmente a los huesos gnáticos, e incluye desde proliferaciones hamartomatosas hasta neoplasias benignas y tumores malignos 1,2. El mixoma odontogénico (MO) es un TO mesenquimal benigno (con o sin epitelio odontogénico), sin embargo, presenta un comportamiento agresivo: un importante potencial de crecimiento, así como un alto índice de recurrencia (25%) 3.
Mundialmente, los MO representan entre el 2.2 y el 17% de los TO y afectan principalmente la zona posterior de mandíbula, y ocasionalmente el maxilar 4. Raros casos de MO periférico han sido reportados, siendo menos agresivos que el MO central 5. El MO ocurre con mayor frecuencia entre la segunda y cuarta décadas de vida (media 28.6 años), y clínicamente se presenta como un aumento de volumen de crecimiento lento, generalmente asintomático 6, por lo que puede alcanzar grandes dimensiones al momento del diagnóstico. Radiográficamente el aspecto puede ser unilocular (lesiones pequeñas), o más comúnmente multilocular (clásicamente descrito como “raqueta de tenis”) 3.
Microscópicamente, el MO se caracteriza por la presencia de células fusiformes a estrelladas dispersas en una abundante matriz mixoide compuesta principalmente por glicosaminoglicanos, pudiendo presentar o no islas de epitelio odontogénico, la presencia de fibras de colágeno es variable (3,4 6,).
A la fecha existen pocos trabajos que describan los componentes moleculares del MO, por lo cual, el objetivo de este trabajo es establecer un perfil inmunohistoquímico de diversos marcadores tumorales y analizar la microdensidad vascular (MDV) con el fin de discutir sus posibles implicaciones en el comportamiento biológico del MO.
Metodología
Selección de la muestra
Se incluyeron 31 casos de MO mandibulares obtenidos del Área de Patología Molecular de la Facultad de Odontología de la Universidad de la República (Uruguay). Dichas muestras se obtuvieron mediante biopsia incisional, fueron fijadas en formaldehido al 10% y posteriormente se incluyeron en bloques de parafina. Este trabajo fue aprobado por el Comité de Ética de la Facultad de Odontología de la Universidad de la República, número de protocolo: 091900-000113-14. Se obtuvo el consentimiento informado de todos los participantes incluidos en el estudio, al momento de la toma de biopsia.
Inmunohistoquímica
Se realizaron cortes de 3µm y se colocaron sobre laminillas, los cortes se desparafinaron en xilol y posteriormente se hidrataron mediante baños en concentraciones decrecientes de alcohol. Para la recuperación antigénica se utilizó una solución de citrato de (pH 6.2) en olla de presión-horno de microondas a máxima potencia por un minuto. Para el bloqueo de la peroxidasa endógena, se utilizó peróxido de hidrógeno al 0,9%, durante 5 minutos. Los anticuerpos primarios para fueron incubados durante una hora (Tabla 1).
Posteriormente, los cortes se incubaron con el anticuerpo secundario biotinilado anti-ratón/anti conejo y con el complejo streptavidina/peroxidasa (LSA-B+Dako Corporation, Carpintería CA, USA) por 30 minutos cada uno. La reacción se visualizó con sustrato de 3,3’-diaminobenzidinaH2O2 (Dako Corporation, Carpintería, CA, USA). Por último, los cortes fueron contrastados con hematoxilina de Mayer.
Como controles positivos se utilizaron: mucosa oral para CK19 y CD138; cáncer de mama para Calretinina; carcinoma oral para Orosomucoide-1 y p53; intestino para Mast Cell Tryptase, CD34 y VEGF-A; y amígdala Bcl-2 y Ki-67.
Análisis microscópico
Las reacciones fueron consideradas positivas al observar marcación marrón celular (células tumorales, endoteliales o de islas de epitelio odontogénico), o en la matriz extracelular (MEC). Los patrones de marcación (nuclear, citoplasmática, membranosa o de MEC) varían con cada tipo de anticuerpo.
Proteínas evaluadas en islas de epitelio odontogénico: CK19 y CD138
Cada corte fue visualizado por completo bajo un objetivo de 10x para identificar las áreas de positividad y, posteriormente, a 40x para confirmar que se tratara de epitelio odontogénico. El resultado se expresó como positivo o negativo.
Proteínas evaluadas en células tumorales y matriz extracelular: CD138, Calretinina, Orosomucoide-1, Mast Cell Tryptase, Bcl-2, Ki-67, p53 y VEGF-A.
En un microscopio óptico, se visualizaron los cortes completos bajo el objetivo de 40x para determinar un porcentaje de inmunoexpresión en la totalidad del tejido tumoral presente en la laminilla. Los porcentajes se clasificaron en 4 grupos: 0%, expresión negativa; de 1% a 10%, expresión baja; 11% a 50%, expresión moderada y mayor de 50% expresión alta 7.
Proteínas evaluadas en vasos sanguíneos: VEGF-A y CD34.
Para determinar la MDV, se empleó el método descrito por Weidner et al. Los tejidos fueron visualizados inicialmente bajo un objetivo de 10x, para identificar 3 zonas con la mayor concentración de vasos positivos (hot spots), en las cuales, bajo el objetivo de 40x se realizó el contaje de vasos manualmente. Finalmente se calculó la media del número de vasos en los cinco campos de cada muestra 8.
Resultados
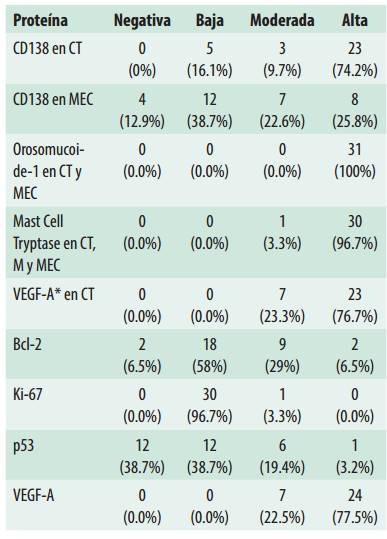
Epitelio odontogénico positivo para CK19 y CD138 fue detectado en cuatro casos. Adicionalmente CD138 mostró una inmunoexpresión alta en las células tumorales de la mayoría de las muestras (74.2%) y una expresión baja en la MEC en el 38.7% de los casos (Figura 1 A, B).
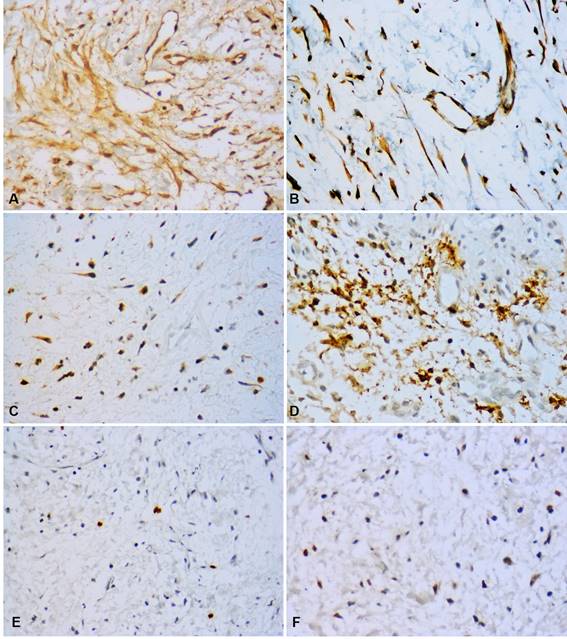
Calretinina fue negativa en todas las muestras de MO. Por el contrario, fue observada alta inmunopositividad de Orosomucoide-1 en células tumorales y MEC en el 100% de los casos, mientras que Mast Cell Tryptase pudo observarse en forma de gránulos mastocitos, focalmente en la MEC y con una alta expresión en las células tumorales 96.7% de los casos (n=30) (Figura 2 A, D) (Figura 2 C, E, F).
Una baja marcación de Bcl-2 (citoplasmática), Ki-67 (nuclear) y p53 (nuclear) fue observada en las células tumorales (n=18, 58.1%; n=28, 90.3% y n=12, 38.7% respectivamente).
CD34 y VEGF-A fueron positivas en las células endoteliales (vasos sanguíneos). Adicionalmente, VEGF-A mostró una expresión predominantemente alta en las células tumorales del MO (n=24, 77.5%) (Tabla 2). La MDV fue de 7.51 vasos con CD34 y 5.35 vasos con VEGF-A (Figuras 1C y 2D).
La mayoría de las proteínas que fueron detectadas en células tumorales y en MEC tuvieron una inmunoexpresión alta, a excepción de Bcl-2. La tabla 3 muestra el patrón, nivel y distribución de inmunoexpresión de cada proteína en los casos de MO.
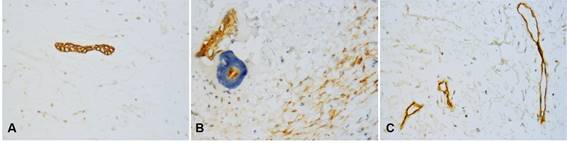
Fig. 1: Marcadores inmunohistoquímicos en mixoma odontogénico. Pequeñas islas de epitelio odontogénico mostraron positividad para CK19 (A), y CD138 (B), la cual también se expresó en células tumorales y MEC. Únicamente las células endoteliales de los vasos sanguíneos mostraron positividad para CD34 (C). (Magnificación original, A-C: 400x).
Tabla 2: Distribución de la expresión de los marcadores dentro de los componentes del mixoma odontogénico
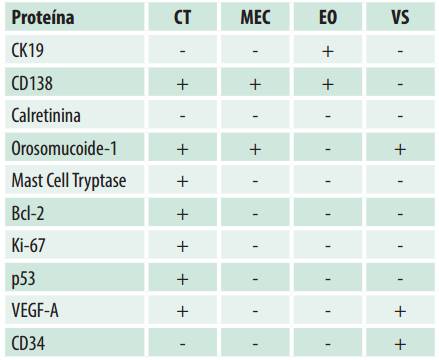
Abreviaciones. CT: células tumorales, MEC: matriz extracelular, EO: epitelio odontogénico, VS: vasos sanguíneos
Discusión
Se ha propuesto un origen odontogénico del MO con base en la presencia ocasional de pequeñas islas de epitelio odontogénico, su localización en mandíbula y maxilares, y su similitud histomorfológica con la porción mesenquimal del germen dentario 9.
En el presente estudio, en el 13.3% de la muestra se encontraron islas de epitelio odontogénico positivas para CD138 y CK19, coincidiendo con estudios anteriores en los que usando CK19, se detectaron islas epiteliales en el 4.8% y 14% de los casos 9,10). Adicionalmente, nuestros resultados corroboran la utilidad de CD138 como un marcador alternativo de epitelio odontogénico en el MO.
Una alta expresión de CD138 fue observada en células tumorales en la mayoría de los casos (73.30%), mientras que, en la MEC, la inmunoexpresión fue principalmente baja (46.70% de los casos). Contrario a nuestros resultados, en el estudio de Etemad-Moghadam et al. (2017) CD138 fue negativo en todas sus muestras 11. El papel fisiológico de CD138, en conjunto con la MEC es la participación en la inducción y regulación de la proliferación mediante la interacción con familias de factores de crecimiento ligados a la heparina 12; además, interactúa con otros componentes de la MEC 13, algunos de los cuales (colágeno tipo I, fibronectina y tenascina) forman parte de la MEC del MO 14, sugiriendo así que CD138, además de la función de mantenimiento estructural propia de una proteína de adhesión epitelial, al ser liberada en la MEC, podría estar involucrada en diversas vías de señalización al interactuar con factores de crecimiento y otras moléculas presentes en la MEC.
A pesar de que la expresión de calretinina ha sido descrita en ameloblastomas, y ha sido asociada a la producción de esmalte en germen dentario, en nuestro estudio resultó negativa en MO, al igual que en trabajos previos 15,16. Esta ausencia de calretinina puede ser explicada por el origen mesenquimal del MO, a diferencia del ameloblastoma y el órgano del esmalte 17,18.
Un estudio previo determinó la MDV en el MO mediante CD34, mostrando resultados similares a los nuestros 7. El ameloblastoma presenta una mayor MDV comparado con otros tumores y quistes odontogénicos, lo que sugiere una asociación con un comportamiento más agresivo 19,20. En nuestro estudio, el MO mostró una MDV aproximadamente 5 veces menor que los ameloblastomas del estudio de Seifi et al. (2001), sugiriendo que, en el MO, la angiogénesis podría contribuir limitadamente al potencial de crecimiento tumoral 19.
En MO, VEGF-A (una de las principales proteínas señalizadoras para la angiogénesis), se expresó en células endoteliales y en las células tumorales. Investigaciones recientes sugieren que la inmunoexpresión de VEGF-A en el epitelio de quistes odontogénicos y TO epiteliales como el ameloblastoma, influye en la proliferación epitelial mediante un mecanismo autócrino; mientras que la actividad anigiogénica mediada por un mecanismo parácrino 7,21. Sin embargo, en el único estudio describiendo la expresión de VEGF-A en MO, se ha asociado principalmente a mecanismos angiogénicos de este tumor 7.
En las muestras de MO analizadas, se observó una inmunoexpresión alta de Orosomucoide-1 en células tumorales y MEC. Confirmando los hallazgos de los dos estudios que reportaron la sobreexpresión de Orosomucoide-1 en MO mediante inmunohistoquímica y preoteómica 7,22.
Macroscópicamente, el MO tiene la apariencia de una masa mucoide altamente viscosa, la cual, de acuerdo a nuestros resultados, podría deberse en parte a la presencia de Orosomucoide-1 (que es una mucoproteína) en la MEC. Es ampliamente aceptado que la viscosidad estructural del MO, le confiere la habilidad de infiltrar e invadir 7. Por otra parte, García Muñoz et al. (2012), propusieron que la sobreexpresión de Orosomucoide-1 en el MO podría jugar un papel importante en el crecimiento y potencial de invasión de las células tumorales, al inhibir respuesta inmune antitumoral 22.
Se ha demostrado que Orosomucoide-1 participa en la regulación e inducción de VEGF-A.23,24) De esta manera, la sobreexpresión de ambas proteínas en las células tumorales y endoteliales del MO podría indicar una interacción entre Orosomucoide-1 y VEGF-A en este tumor, indicando con un rol colaborativo pro-angiogénico 7.
En el presente estudio, la mayoría de los casos expresaron inmunopositividad alta para Mast Cell Tryptase (96,70%) en células tumorales, mastocitos y MEC. Un estudio previo en siete casos de MO, reportó la ausencia de expresión de Mast Cell Tryptase; sin embargo, el tamaño de la muestra podría no ser representativa 25. Otra pesquisa en una muestra mayor (62 casos), encontró la presencia de Mast Cell Tryptase en el 72.6% de los MO localizándose principalmente en los mastocitos, los cuales contienen grandes cantidades de triptasa activa almacenada que al ser liberada es capaz de degradar fibronectina (uno de los componentes de la MEC del MO), lo que sugiere que, en parte, la degradación de la MEC podría estar mediada por la liberación de Mast Cell Tryptase.9,26) Adicionalmente, existe una asociación relación entre la presencia de mastocitos y Mast Cell Tryptase con la reabsorción ósea en quistes odontogénicos 27, y a pesar de que la incidencia de mastocitos en el MO es variable entre algunos estudios, se ha descrito que estas células frecuentemente se distribuyen adyacente a trabéculas óseas residuales 28. Dichos hallazgos sugieren que la degradación de la MEC y procesos de remodelación ósea mediante la triptasa, contribuye de manera importante en el potencial de invasión del MO 27,28.
El desbalance entre los mecanismos de apoptosis y proliferación celular representan importantes alteraciones moleculares tumorigénicas en diversas neoplasias.
En el presente estudio fueron evaluadas p53, Bcl-2 y Ki-67, proteínas relacionadas con procesos apoptóticos, anti apoptóticos y de proliferación celular respectivamente. Se ha demostrado que la apoptosis inducida por p53 puede ser bloqueada por Bcl-2 29. Al igual que p53, Bcl-2 mostró una baja inmunoexpresión en la mayoría de los MO, lo que coincide con reportes previos 9,30. De igual manera, Ki-67 mostró un bajo índice proliferativo en nuestros casos coincidiendo con diversos autores 9,30, Estos resultados podrían indicar que, debido al bajo nivel de actividad anti-apoptótica y proliferativa en este tumor, estos no serían los principales mecanismos asociados a el potencial de crecimiento y agresividad del MO.
Conclusiones
La marcación CK19 y CD138 es útil para detectar epitelio odontogénico en el MO. La alta expresión de Orosomucoide-1 en la MEC lo indica como un componente estructural que contribuye a su viscosidad y, por ende, facilitando la invasión. Orosomucoide-1 también mostró un patrón semejante a VEGF-A en las células tumorales y endoteliales, sugiriendo una actividad colaborativa pro-angiogénica, posiblemente implicada en el desarrollo tumoral. La actividad anti-apoptótica y proliferativa no se perfilan como mecanismos cruciales en el comportamiento agresivo del MO. Sin embargo, la degradación de la MEC y la reabsorción ósea mediada por Mast Cell Tryptase, podrían ser importantes para el alto potencial invasivo del MO.











 texto em
texto em