Introducción
El síndrome de Cushing (SC) es el conjunto de síntomas y signos que reflejan la exposición prolongada a niveles inapropiadamente elevados de glucocorticoides en los tejidos. Puede ser de origen exógeno o endógeno. Dentro de las causas endógenas, la más frecuente es la dependiente de la ACTH, hasta en un 80%-85% de los casos1. La hipersecreción de ACTH es debida en su gran mayoría (80%-85%) a un tumor hipofisario (enfermedad de Cushing, EC), y en el resto a tumores con producción ectópica de esta hormona. Identificar la causa de un SC ACTH dependiente es esencial para realizar un tratamiento correcto. Dado que la presentación clínica y de laboratorio son similares en ambas causas, es difícil realizar un diagnóstico definitivo. Los test no invasivos tienen baja sensibilidad y especificidad para diferenciarlos. Además, muchos de los tumores ectópicos (sobre todo los carcinoides bronquiales) pueden permanecer ocultos por años a las técnicas de imágenes. El patrón oro para el diagnóstico diferencial entre EC y un tumor ectópico secretor de ACTH es el cateterismo bilateral de los senos petrosos inferiores, un método invasivo pero con una sensibilidad de 88%-100% y especificidad de 67%-100%2. Este procedimiento involucra la cateterización de ambos senos petrosos inferiores, que constituyen el drenaje venoso proximal a la glándula hipofisaria. A partir del mismo se recolectan muestras para la medición de ACTH de ambos senos y de la periferia, en forma basal y luego del estímulo con hormona liberadora de adrenocorticotropina (CRH) o desmopresina. En Uruguay no hay publicaciones sobre la realización de esta técnica en el diagnóstico etiológico del síndrome de Cushing ACTH dependiente. El presente artículo tiene como objetivo presentar el primer caso en Uruguay en que se realizó la confirmación diagnóstica de EC mediante la realización del CSP.
Caso clínico
Mujer de 55 años, enviada de Colonia por endocrinóloga tratante, con antecedentes personales de obesidad, diabetes mellitus tipo 2, hipertensión y dislipemia. Como antecedentes ginecoobstétricos se destacan ciclos regulares previos, dos embarazos, dos cesáreas, y una histerectomía a los 50 años por miomatosis. Enviada para valoración por diagnóstico clínico presuntivo de SC, dado por historia de debilidad muscular proximal y equimosis fáciles, constatándose un “hábito cushingoide” al examen físico. Negaba consumo de glucocorticoides exógenos.
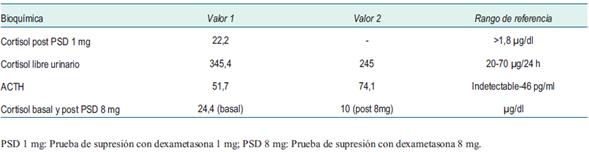
Se confirmó el diagnóstico bioquímico de hipercortisolismo mediante una prueba de supresión con dexametasona 1 mg alterada y dos cortisoles libres urinarios inequívocamente elevados, ACTH dependiente por presentar dos dosificaciones de ACTH >20 pg/ml (tabla 1). Para determinar la localización hipofisaria o ectópica, se solicitó una prueba de supresión fuerte con dexametasona 8 mg, que orientó a un tumor hipofisario por cursar con una supresión del cortisol mayor al 50% del valor basal (tabla 1). No contamos con disponibilidad de CRH en nuestro medio, por lo que no realizamos test de estímulo con dicha hormona. La RNM de cráneo con enfoque selar mostró una imagen sugestiva de adenoma hipofisario con un diámetro de 4 mm (figura 1). No contamos con fotos de RNM en T1 luego de la administración de gadolinio.
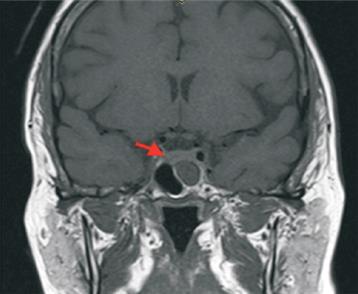
Figura 1: RNM de región selar, T1 sin contraste. Se evidencia pequeña zona de hipointensidad (flecha roja).
Por presentar un hipercortisolismo ACTH dependiente con una imagen adenohipofisaria compatible con un adenoma <6 mm, se decide realizar el CSP con estímulo con desmopresina para confirmar la localización de la hipersecreción de ACTH.
Las determinaciones de ACTH, cortisol y prolactina se realizaron mediantes inmunoensayos inmunométricos en el analizador multiparamétrico Cobas 6000 de Roche en el Departamento de Laboratorio Clínico del Hospital de Clínicas.
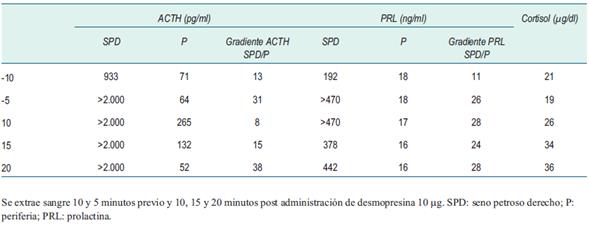
Se confirmó el hipercortisolismo en la mañana del procedimiento mediante un cortisol hora 8 >10 mcg/dl. Se realizó punción venosa femoral bilateral y se colocaron introductores 6 F. Se realizó flebografía, comprobando la permeabilidad de la vena yugular interna únicamente del lado derecho. Se ascendió un catéter Launcher 5 F MP y en forma coaxial un microcateter Echelon con microguía Excelsior SL 10 que se posicionó en el seno petroso inferior comprobando su posición bajo fluoroscopía. En las imágenes se aprecia en frente y perfil el microcatéter Echelon con sus marcas radioopacas posicionado en el seno petroso inferior derecho y se observa contraste en el mismo luego de una inyección retrógrada superselectiva en seno petroso para corroborar la posición (figura 2). No se pudo cateterizar el seno petroso izquierdo por razones anatómicas. Se tomaron muestras de sangre venosa del seno petroso cateterizado y de una vena periférica en forma basal (10 y 5 minutos previa administración de desmopresina) para medición de ACTH, cortisol y prolactina. Luego se administró una infusión de 10 g intravenosos de desmopresina y se tomaron nuevas muestras para iguales mediciones posteriores al estímulo (3, 5, 10 y 15 minutos después de la administración de desmopresina).
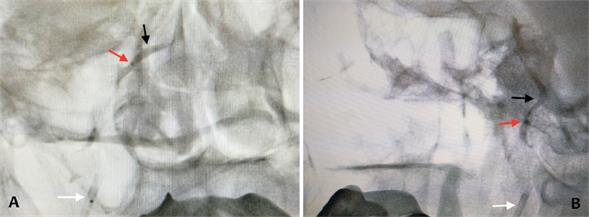
Figura 2: Venografía por fluroscopía. A) Frente. B) Perfil. Se evidencia el catéter guía (flecha blanca) y microcatéter Echelon con sus marcas radioopacas (flechas rojas) posicionado en el seno petroso inferior derecho. Se observa la inyección de contraste (flecha negra).
El gradiente petroso-periférico fue >2 en forma basal y >3 luego del estímulo con desmopresina, confirmando el diagnóstico de EC (tabla 2), (figura 3). No hubo complicaciones durante el procedimiento. Se realizó la resección del adenoma mediante cirugía transesfenoidal, con buena evolución posterior. La inmunohistoquímica mostró tinción para ACTH.
Discusión
No hay consenso actual respecto a la indicación del CSP. Mientras algunos lo recomiendan como un estudio de rutina en cualquier paciente con hipercortisolismo ACTH dependiente3-5, otros sugieren reservarlo para pacientes con evidencia clínica y bioquímica de SC y hallazgos en la RNM negativos o equívocos (como adenomas <6 mm)1,6. Si la RNM muestra un adenoma >6 mm, se verifica el tumor por cirugía en un 75%-98%7. En cambio, sólo se verifica el tumor por cirugía en 52% de los pacientes con imagen <6 mm8. Además, la RNM no logra identificar imagen del tumor hipofisario en hasta el 40% de los pacientes con EC, y pueden hallarse incidentalomas hipofisarios en al menos un 10% de la población general9.
Mediante el CSP se demuestra la hipersecreción de ACTH a nivel hipofisario al documentar un gradiente de ACTH central a periférico en el drenaje del tumor (figura 4)10. Se miden los niveles de ACTH en ambos senos petrosos y en una vena periférica, tanto en condiciones basales como tras estímulo con CRH. Dicho estímulo tiene como objetivo mejorar la sensibilidad del procedimiento. El uso de desmopresina en lugar de CRH es una alternativa segura con resultados comparables11-13. El CSP tiene un alto rendimiento en el diagnóstico del SC en centros experimentados. Se ha reportado una sensibilidad entre 88%-100% y una especificidad entre 67%-100%2. Un metaanálisis de 21 estudios reportó una sensibilidad de 96% y una especificidad de 100%. La sensibilidad aumenta hasta el 100% con la estimulación con CRH o desmopresina7.
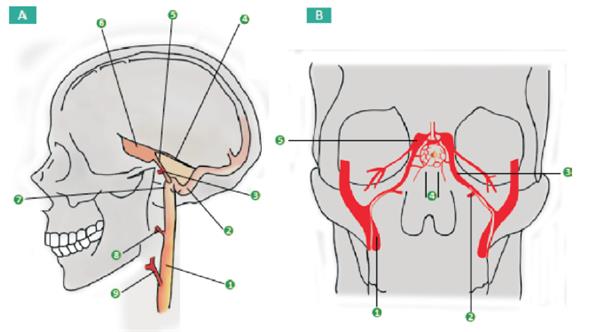
Figura 4: Drenaje venoso de la hipófisis. Los senos cavernosos drenan por los senos petrosos inferiores, que a su vez desembocan en las venas yugulares internas a través de los senos sigmoides. A) Corte sagital. (1) Vena yugular interna. (2) Seno sigmoideo. (3) Vena condilar anterior. (4) Seno petroso superior. (5) Seno petroso inferior. (6) Seno cavernoso. (7) Bulbo yugular. (8) Vena faríngea. (9) Vena facial. B) Corte coronal. (1) Vena yugular. (2) Vena condilaranterior. (3) Seno petroso inferior. (4) Venas hipofisarias confluentes. (5) Senos cavernosos. Reproducido con autorización de Montoya y col10.
El procedimiento debe realizarse en presencia de hipercortisolemia, que suprime tanto la actividad secretora basal como estimulada de las células corticotróficas normales, de forma que la ACTH medida sea el resultado de la actividad secretora del tejido tumoral. Una relación entre las concentraciones de ACTH central y periférica >2 en condiciones basales o >3 tras estímulo, indica un origen hipofisario de la secreción de ACTH14.
Dentro de los falsos negativos, se destacan la inadecuada cateterización o las alteraciones anatómicas, y dentro de los falsos positivos, la secreción cíclica de ACTH por un tumor ectópico que produciría una supresión incompleta de la ACTH hipofisaria2. Los falsos negativos son más frecuentes que los positivos, con una prevalencia reportada de entre 3%-19%15-17.
Algunos estudios sugieren que la medición de hormonas de la hipófisis anterior puede ser útil para evitar falsos positivos. La utilidad de medir la prolactina es para documentar la cateterización exitosa (gradiente de prolactina en SP/periferia >1,8). Asimismo, puede ayudar a diferenciar entre EC y tumor ectópico si no hay criterios en los gradientes de ACTH, mediante la división de los gradientes de ACTH SP/periferia con los de PRL SP/periferia (>1.3 consistente con EC)18-20.
El efecto adverso más comúnmente reportado del CSP es el hematoma en el sitio de acceso a la vena, que se ha reportado en 3%-4% de los pacientes21. La frecuencia de complicaciones severas es menor al 1% cuando es realizado por radiólogos experimentados (accidente cerebrovascular, tromboembolismo pulmonar, trombosis venosa profunda)2.
Conclusiones
La diferenciación entre las causas de hipercortisolismo ACTH dependiente es crucial para establecer un tratamiento adecuado para cada condición. El CSP es actualmente el método más preciso para demostrar hipersecreción hipofisaria de cortisol. Es un procedimiento invasivo, pero la aparición de eventos adversos es extremadamente rara cuando es realizado por radiólogos expertos.
Creemos que es un gran avance para el país disponer de este procedimiento, que es el patrón de oro para diferenciar EC de tumor ectópico secretor de ACTH, en casos en los que los exámenes no son concluyentes.












 Curriculum ScienTI
Curriculum ScienTI