Introducción
El género Listeria está constituido por bacterias gram positivas, ampliamente distribuidas en el medio ambiente (Vázquez-Boland y col., 2001; Linke y col., 2014). Hasta la fecha se han identificado 17 especies (Orsi y Wiedmann, 2016). Listeria monocytogenes es la principal especie que se asocia a enfermedad en animales y humanos (Vázquez-Boland y col., 2001), aunque también se han descrito casos de listeriosis con aislamiento de L. innocua (Walker y col., 1994; Rocha y col., 2013; Favaro y col., 2014). Los productos lácteos y cárnicos (frankfurters, chacinados), ensaladas y alimentos listos para el consumo (RTE) contaminados con L. monocytogenes son los alimentos más frecuentemente relacionados a casos de la enfermedad en humanos (Cartwright y col., 2013).
Los rumiantes son particularmente susceptibles a la infección por L. monocytogenes, siendo la forma nerviosa la presentación clínica más común, caracterizada por hipoalgesia de la cara, dificultades masticatorias, parálisis facial unilateral, nistagmo, marcha en círculos, entre otros signos de afectación de pares craneanos (Oevermann y col., 2010). También se han reportado, aunque menos frecuentemente, casos de abortos, septicemia neonatal, queratoconjuntivitis/uveítis y enteritis (Oevermann y col., 2010; Fairley y col., 2012). Muchos trabajos han demostrado que los rumiantes sanos son portadores asintomáticos de bacterias del género Listeria incluyendo L. monocytogenes, excretándolas a través de materia fecal (Nightingale y col., 2004; Esteban y col., 2009). Dentro de los rumiantes, la especie bovina es la que tiene mayor prevalencia de animales portadores (Nightingale y col., 2004; Esteban y col., 2009), esto se relacionaría a una mayor prevalencia de L. monocytogenes a nivel ambiental en los predios que contienen bovinos (Nightingale y col., 2005).
En Uruguay, las enfermedades nerviosas de los bovinos tienen particular interés en su estudio y diagnóstico, debido a que integran el diagnóstico diferencial de la encefalopatía espongiforme bovina (EEB) (Ministerio de Ganadería, Agricultura y Pesca, 2001). Un estudio retrospectivo realizado por Easton y col. (2012) reportó que las principales enfermedades infecciosas en Uruguay que afectan el sistema nervioso central de bovinos son rabia, meningoencefalitis por Herpesvirus bovino (BoHV), listeriosis y fiebre catarral maligna. Los objetivos de este trabajo fueron detectar la presencia de L. monocytogenes en un animal con signología nerviosa compatible, así como bovinos portadores asintomáticos en el mismo rodeo de carne pastoreando a campo natural. Además, detectar la presencia de bacterias del género Listeria sp. en el medio ambiente del predio.
Materiales y métodos
Predio en estudio
Este trabajo se realizó en un establecimiento agrícola ganadero ubicado en el Departamento de Paysandú (32º01’45” S, 57º25’17” W), Uruguay. El caso se presentó en un potrero de 100 hectáreas de campo natural donde pastoreaban 70 vacas de cría, algunas con cría al pie, sin suplementación. El agua de bebida se obtenía del arroyo que corría por el potrero.
En Setiembre de 2015 se consulta al Laboratorio Regional Noroeste DILAVE “Miguel C. Rubino” porque una vaca Hereford, de ocho dientes, con ternero al pie, presentaba marcha en círculos hacia el mismo lado, no podía alimentarse, ni tomar agua. En las 24 horas siguientes el animal adoptó posición de decúbito permanente y muere sin recibir tratamiento alguno. No se constató dentro del rodeo otro animal afectado, ni abortos. Al día siguiente 12 horas luego de ocurrida la muerte, se concurrió al predio a realizar la necropsia.
Durante la necropsia se colectaron muestras (1cm × 1cm) de todos los órganos parenquimatosos y se sumergieron en formol bufferado al 10%. Se extrajo sistema nervioso central (SNC) que se dividió en dos mitades, una se colocó en formol para estudio histopatológico y la otra en bolsa estéril refrigerada para estudio bacteriológico.
Muestreo del rodeo problema y del ambiente
Nueve días después, se concurrió al predio a extraer muestras de materia fecal de 27 bovinos (vacas de cría) que se encontraban pastoreando junto al animal enfermo, de pasturas del potrero donde se encontraba el rodeo y del agua de bebida.
Para el cálculo de la cantidad de animales que se debían muestrear para detectar portadores asintomáticos, se utilizó la fórmula de Dohoo y col. (2003): n= (1-(1-α)1/D) × (N - (D-1÷2).
Para este cálculo se asumió en base a la bibliografía (Nightingale y col., 2004; Esteban y col., 2009) que la prevalencia de portadores en el rodeo es del 10%, con un intervalo de confianza de 95% y que la sensibilidad de la prueba (cultivo en este caso) es del 90%, obteniéndose un número (n) de 27 animales a muestrear.
La elección de las vacas a muestrear fue aleatoria. La materia fecal se tomó del recto de cada animal con guante individual y se depositó en bolsas plásticas estériles individuales.
Se tomó una muestra de 500 mL de agua del arroyo que corría por el potrero. Para la recolección de esta muestra se sumergió un frasco estéril con tapa a rosca, allí se abrió la tapa y se cerró antes de sacarlo al exterior.
Se colectaron dos muestras de pastura (campo natural) del potrero donde se encontraba el animal afectado. Para la toma de muestras, se recorrió el potrero, colectando el forraje en 10 puntos distintos determinados aleatoriamente. El mismo se encontraba a una distancia de 5 cm del suelo, no incluía raíces, materia fecal, ni restos de suelo.
Cada muestra fue identificada y se mantuvo refrigerada en conservadoras a 4ºC hasta su procesamiento en el laboratorio.
Procedimiento
Esta actividad se realizó en la sección Bacteriología del Laboratorio Regional Noroeste. El procesamiento de las muestras de agua, pasturas, SNC y materia fecal se realizó siguiendo el protocolo de Nightingale y col. (2004).
La mitad del SNC, 25 g de cada muestra de materia fecal o pastura se colocaron en bolsas estériles Stomacher (Stomacher, UK) y se le agregó asépticamente 225 mL de caldo de enriquecimiento Listeria (Oxoid, UK). El agua fue filtrada utilizando un filtro de celulosa estéril de 0,45 µm (Sartorious, Alemania), el filtro se transfirió a una bolsa Stomacher estéril y se le agregó 100 mL de caldo de enriquecimiento Listeria (Oxoid, UK). Las muestras se homogeneizaron durante 30 segundos a 200 rpm en Stomacher Circulator 400 (Stomacher, UK) y se incubaron durante 24 horas en aerobiosis a 30ºC en estufa. Al día siguiente se transfirió asépticamente una alícuota de 100 μL a 10 mL de caldo de enriquecimiento secundario FRASER (Oxoid, UK) incubándose por otras 24 horas en aerobiosis a 30ºC. Luego se sembraron 100 μL de FRASER en placa de agar Oxford Modificado (Oxoid, UK). Las placas se incubaron a 35ºC, en aerobiosis durante 48 horas. A las 24 y 48 horas fueron inspeccionadas para detectar crecimiento bacteriano.
Identificación de cepas del género Listeria
Las colonias con morfología sospechosa en agar Oxford Modificado; (blancas, pequeñas y rodeadas de un halo marrón negruzco (hidrólisis de la esculina); fueron repicadas en placas de agar sangre ovina al 7% y se incubaron 24 horas a 37ºC en estufa. Sobre las colonias sospechosas de Listeria se realizaron las siguientes pruebas para la identificación de especie: tinción de Gram, prueba de catalasa, presencia/ausencia de un halo estrecho de β-hemólisis, prueba de CAMP con Staphylococcus aureus y Rhodococcus equi, y producción de ácido a partir de D-glucosa, L-ramnosa, manitol y D-xilosa.
Las colonias identificadas como L. monocytogenes fueron remitidas al Departamento de Bacteriología y Virología del Instituto de Higiene “Prof. Arnoldo Berta”, Facultad de Medicina, Universidad de la República, para la realización de estudios moleculares.
PCR multiplex para determinación del perfil de serotipo
Se utilizó un procedimiento de PCR múltiple para diferenciar los principales perfiles de serotipos de L. monocytogenes: 1/2a; 1/2b; 1/2c y 4b, según técnica descrita por Doumith y col. (2004).
Para la extracción de ADN las cepas de L. monocytogenes se sembraron en placas de agar infusión cerebro corazón (BHIA) y se incubaron a 37ºC durante 18 horas. Se tomaron 3 a 5 colonias de un cultivo puro con ansa descartable y se resuspendieron en 50 μl de solución de lisis (dodecil sulfato de sodio al 0,25% y NaOH 0,05 N). La suspensión se incubó a 99°C durante 15 minutos, se agregaron 100 μl de agua ultrapura tipo MilliQ a cada tubo y se centrifugaron a 12.000 rpm por 10 minutos. Cada sobrenadante se conservó a -20ºC hasta su utilización como molde (2 μl) en las distintas reacciones de amplificación.
Como controles se incluyeron las siguientes cepas de referencia: L. monocytogenes serotipo 1/2a (CIP 89381), L. monocytogenes serotipo 1/2b (CIP 90602), L. monocytogenes 1/2c (CIP 89756) y L. monocytogenes serotipo 4b (CIP 88868).
Las reacciones de amplificación se realizaron en un volumen final de 25 μl conteniendo 1,25 U de Taq DNA polimerasa, 0.2 mM de cada dinucleótido trifosfatado (dNTP’s), y 50 mM Tris-HCl-10 mM KCl-50 mM (NH4)2SO4 -2 mM MgCl2 por tubo, a pH 8,3. Los cinco sets de primers se utilizaron a las siguientes concentraciones finales: 1 μM para el L. monocytogenes o0737, ORF2819 y ORF2110; 1.5 μM para L. monocytogenes o1118; y 0.2 μM para prs.
Para las reacciones de amplificación se utilizó un termociclador GeneAmp PCR System 2700 (Applied Biosystems, EEUU) y el siguiente programa de temperaturas: desnaturalización inicial a 94ºC durante 3 minutos; seguido por 35 ciclos de 94ºC por 40 segundos, 53ºC por 75 segundos y 72°C por 75 segundos cada uno; con un ciclo de extensión final de 72ºC durante 7 minutos.
Los productos de PCR se separaron por electroforesis sumergida en geles de agarosa al 2%. Las condiciones de corrida fueron las siguientes: 100V y 40 mA en buffer TBE 0,5X (90 mM base Trizma, 90 mM ácido bórico y 2 mM EDTA a pH 8.3) durante al menos 1 hora. Los geles se tiñeron con una solución de bromuro de etidio (0,5 μl/ml) durante 15 minutos, se destiñeron con agua destilada durante 20 minutos, se observaron con luz ultravioleta y se fotografiaron.
Histopatología e inmunohistoquímica
Se realizó en la sección Patología del Laboratorio Regional Noroeste DILAVE “Miguel C. Rubino”. Se tomaron muestras representativas de todos los órganos muestreados así como de las principales regiones anatómicas del sistema nervioso central fijados en formol bufferado al 10%: corteza frontal, parietal y occipital, corpus striatum, tálamo, mesencéfalo, puente, cerebelo, bulbo y obex. Fueron procesadas en forma rutinaria para estudio histopatológico, cortadas a 5 micras de espesor y coloreadas con Hematoxilina y Eosina (H&E). La inmunohistoquímica se realizó siguiendo el protocolo de Easton y col. (2012). Los cortes de tronco encefálico se desparafinaron de forma rutinaria y se sumergieron en peróxido de hidrógeno al 10% en metanol durante 15 minutos. Luego se lavaron con agua destilada y se sumergieron en leche descremada al 5% por 25 minutos. Se lavaron nuevamente y se incubaron con el anticuerpo primario Listeria monocytogenes (Difco, EEUU) a una dilución de 1/200 durante una hora a 37ºC. Luego se incubaron con el anticuerpo secundario (LSAB) (Dako, EEUU) 20 minutos a temperatura ambiente. Se lavaron nuevamente y se sumergieron en streptavidina-peroxidasa de rábano picante (HRP) (Dako, EEUU) otros 20 minutos a temperatura ambiente. Para el revelado de la reacción se incubaron las láminas con solución cromógena DAB (Dako, EEUU) durante 5 a 10 minutos y como contraste se utilizó Hematoxilina de Harris. Los cortes se deshidrataron rutinariamente y se montaron para su observación al microscopio.
Resultados
Caso clínico
El animal en la necropsia presentó mucosas oculares congestivas. En cavidad abdominal se observó intestino delgado y grueso con escaso contenido. Al corte de los preestómagos no se observaron lesiones de significación. El hígado presentaba escasos trayectos fibrosados. En cavidad torácica destacaban áreas enfisematosas en ambos pulmones. En la apertura de cavidad craneana se observaron meninges congestivas.
En el SNC se aislaron colonias de L. monocytogenes.
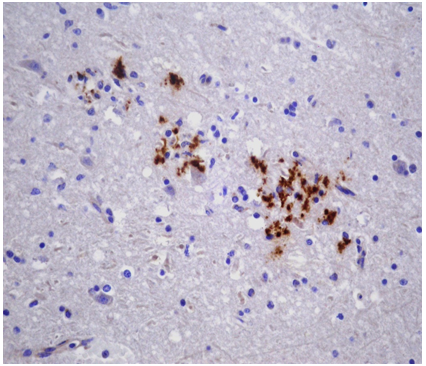
En el estudio histopatológico, a nivel de tronco encefálico (puente, bulbo raquídeo y obex) se observó severa romboencefalitis caracterizada por meningitis supurativa moderada, difusa; infiltrado perivascular multifocal (“manguitos perivasculares”) compuesto por células mononucleares; múltiples microabscesos y focos de malacia (Figura 1). En la inmunohistoquímica se observó inmunomarcación positiva a L. monocytogenes en el citoplasma de neutrófilos y linfocitos de múltiples microabscesos (Figura 2). No se observaron lesiones significativas en el resto de los órganos examinados.
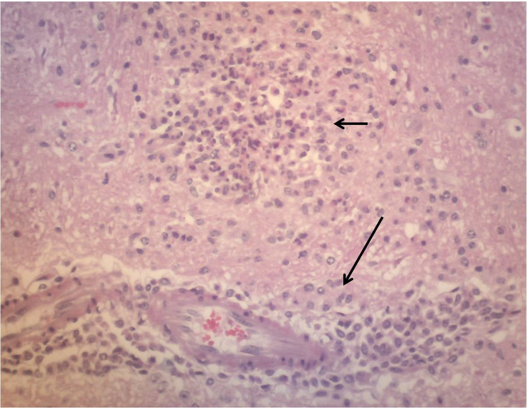
Figura 1: Bovino, SNC (puente). Infiltrado perivascular constituído por células inflamatorias mononucleares (flecha grande) y microabsceso (flecha pequeña). H&E, 100×
Muestreo del rodeo problema y el ambiente
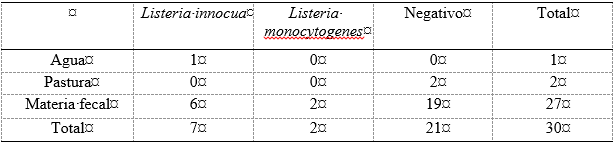
Se realizaron 30 cultivos, 27 correspondieron a muestras individuales de materias fecales de vacas, una muestra de agua y dos muestras de pasturas. Se obtuvieron 2 aislamientos de L. monocytogenes (6,6 %) y 7 de L. innocua (23,3 %) (Cuadro 1). En la muestra de agua se recuperó L. innocua. En las muestras de pasturas no se aislaron bacterias del genero Listeria. De las 27 muestras de materia fecal, hubo aislamiento de L. innocua en seis (22,2%) de ellas, mientras que en dos (7,4%) se recuperó L. monocytogenes (Cuadro 1).
PCR multiplex para determinación del perfil de serotipo
El aislamiento obtenido del sistema nervioso central así como uno de los aislamientos de materia fecal se tipificaron como perfil de serotipo 4b. El otro aislamiento obtenido de materia fecal se tipificó como perfil 1/2a (Figura 3).
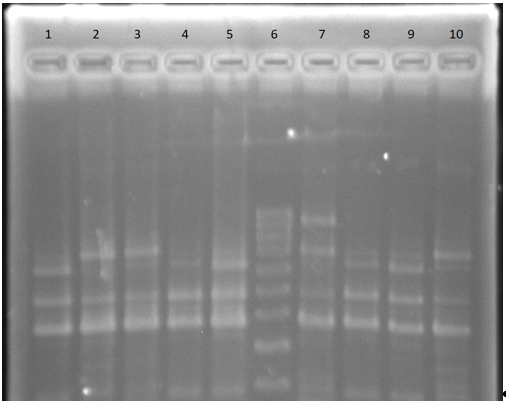
Figura 3: PCR Multiplex: Perfil de serotipo de los aislamientos de L. monocytogenes obtenidos. Línea 1: L. monocytogenes recuperada del sistema nervioso central de la vaca necropsiada. Línea 2: Control positivo de L. monocytogenes serotipo 1/2a. Línea 3: L. monocytogenes recuperada de materia fecal de bovino portador. Línea 4: Control positivo de L. monocytogenes serotipo 1/2b. Línea 5: L. monocytogenes recuperada de materia fecal de bovino portador. Línea 6: Marcador molecular. Línea 7: Control positivo de L. monocytogenes serotipo 1/2c. Línea 8: Control positivo de L. monocytogenes serotipo 4b. Línea 9: Control positivo de L. monocytogenes serotipo 4b. Línea 10: Control positivo de L. monocytogenes serotipo 1/2a.
Discusión
Se confirmó la sospecha clínica de listeriosis nerviosa en una vaca de cría con ternero al pie en un sistema extensivo de producción de carne. Esta enfermedad ha sido descrita en rumiantes en Uruguay por varios autores (Dutra, 2009; Dutra, 2010; Easton y col., 2012; Matto y col., 2017), sin embargo, existía un solo reporte en bovinos en condiciones extensivas (Dutra, 2009). En este caso, el aislamiento en SNC se asoció a las lesiones histológicas y la marcación inmunohistoquímica observada en tronco encefálico. La romboencefalitis es la forma más común de listeriosis en rumiantes (Oevermann y col., 2010) y en Uruguay L. monocytogenes es uno de los principales agentes causales de encefalitis en bovinos (Easton y col., 2012).
Teniendo en cuenta que solo enfermó un bovino en un total de 70 que formaban el rodeo, se sospecha que ese animal presentaba alguna afección que lo hizo susceptible a la infección, debido a que L. monocytogenes suele ser un patógeno oportunista (Vázquez-Boland y col., 2001; Oevermann y col., 2010). El factor predisponente para este episodio no pudo determinarse con los estudios realizados.
En coincidencia con lo registrado en este episodio, se ha reportado que los casos de listeriosis en rumiantes tienen una mayor prevalencia en invierno e inicio de la primavera, debido a una mayor excreción fecal del agente y, en consecuencia, mayor contaminación ambiental (Nightingale y col., 2005). Además se dan condiciones ambientales de mayor humedad y frío que permiten la sobrevivencia del agente (Vázquez-Boland y col., 2001).
Se detectaron dos vacas asintomáticas cohabitantes que excretaban L. monocytogenes dentro del rodeo. Esto favorecería la dispersión del agente en el predio a través de la materia fecal, perpetuando el ciclo de transmisión de la bacteria en el medio ambiente (Ivanek y col., 2006). En un estudio realizado por Nightingale y col. (2004), se reportó que en aquellos predios con casos de listeriosis, la prevalencia de L. monocytogenes en ambientes y animales fue significativamente mayor. Por otra parte, en la bibliografía existen escasos trabajos que estudien la prevalencia de bovinos portadores de L. monocytogenes en sistemas de producción de carne. Esteban y col. (2009) en un muestreo en el País Vasco, España, reportaron una prevalencia de 7,7% mientras que, Mohammed y col. (2009) describen una prevalencia promedio de portadores asintomáticos de 3,4 % en establecimientos de cría y 0,3 % en feedlots en el estado de California, Estados Unidos. En este trabajo se detectaron además 6 vacas que excretaban L. innocua en materia fecal; aunque es una especie clasificada como no patógena, se han reportado casos de listeriosis tanto en seres humanos como en rumiantes (Walker y col., 1994; Rocha y col., 2013; Favaro y col., 2014).
El hecho de detectar bovinos portadores asintomáticos que excreten L. monocytogenes en materia fecal, tendría repercusión además a nivel de la industria de la carne, ya que en el proceso de faena en el momento del cuereado podría contaminarse la carcasa (Rivera-Betancourt y col., 2004; Guerini y col., 2007). El trabajo de Rivera-Betancourt y col. (2004) reporta contaminación de los cueros bovinos por L. monocytogenes en plantas frigoríficas de Estados Unidos en una prevalencia de 9,9%.
Este caso se presentó en un bovino alimentado a campo natural, sin la administración de ensilado ni suplementos. Tradicionalmente, esta enfermedad se asocia al consumo de ensilado en mal estado (Nightingale y col., 2004). Sin embargo, en Nueva Zelanda, Argentina y Uruguay se han descrito casos de listeriosis en rumiantes asociados a condiciones de pastoreo (Fairley y col., 2012; Margineda y col, 2012; Matto y col., 2017). En el presente estudio no se detectó la presencia de Listeria sp. en las muestras de pasturas analizadas. Esto podría explicarse debido a que la pastura no fue la fuente de infección o que, debido a la extensión del potrero problema no se tomaron la cantidad de muestras suficientes para su detección. Mohammed y col. (2009) reportaron una prevalencia de 5,3% de L. monocytogenes en pasturas en establecimientos ganaderos, donde el 28% de los predios presentaban al menos una muestra positiva. Por otro lado, se detectó la presencia de L. innocua en muestra de agua del arroyo, este hallazgo podría indicar una posible fuente de infección. Estudios realizados por Lyautey y col. (2007), Mohammed y col. (2009) y Linke y col. (2014) recuperaron en aguas fluviales (lagos, tajamares y/o arroyos) especies no patógenas como L. innocua, L. seeligeri, L. floridensis entre otras, así como también especies patógenas como L. ivanovii y L. monocytogenes. Esto sugeriría que el agua no potable y contaminada con materia fecal de animales podría constituir un vehículo potencial para la diseminación de Listeria.
El aislamiento de L. monocytogenes del caso clínico y el de otro bovino portador asintomático fueron tipificados como perfil de serotipo 4b, el aislamiento restante (portador asintomático) se identificó como 1/2a. Estos serotipos se encuentran entre los más frecuentemente aislados en casos de enfermedad en humanos y animales (Vázquez-Boland y col., 2001; Oevermann y col., 2010). El serotipo 4b es frecuente en casos de listeriosis en humanos a nivel mundial. Tiende a producir brotes y formas clínicas severas, así como también se asocia a la forma nerviosa en rumiantes (Vázquez-Boland y col., 2001; Oevermann y col., 2010). Por otro lado, Nightingale y col. (2004) observaron mayor prevalencia del serotipo 1/2a en rumiantes clínicamente sanos. La presencia del serotipo 1/2a circulando en los animales y ambiente de los predios, constituye además un riesgo importante para la contaminación de los productos de origen animal. Este serotipo tiene mayor capacidad de adherirse a superficies inertes como acero inoxidable y formar biofilms, contaminando el ambiente de las industrias procesadoras y los alimentos (Borucki y col., 2003; Orsi y col., 2011).
En un estudio realizado en Uruguay en alimentos para consumo humano, se encontró que el 87% de los aislamientos de L. monocytogenes corresponden a los serotipos 1/2b y 4b, mientras que el 6,94% al serotipo 1/2a (Braga y col., 2017). En el mismo sentido, los serotipos 4b y 1/2b son los más frecuentes en casos humanos de listeriosis en nuestro país (Mota y col., 2018). Estos resultados sugieren que habría riesgo potencial de contaminación por L. monocytogenes de los subproductos de origen animal para consumo humano. Se necesitan más estudios que incluyan encuestas epidemiológicas detalladas y la comparación genética de aislamientos humanos y animales para establecer si existe un vínculo epidemiológico.
Conclusiones
Ante la sospecha clínica de la enfermedad se logró el aislamiento de L. monocytogenes del sistema nervioso central, confirmando el diagnóstico en un rodeo de bovinos de carne en un sistema de producción extensiva.
Se detectaron vacas de cría portadoras asintomáticas que excretaban L. monocytogenes o L. innocua en sus materias fecales. Esta situación contribuiría a la dispersión y perpetuación del agente en el ambiente del predio, así como también, podría ser un riesgo de contaminación de la canal en plantas de faena a través de cueros contaminados.
Sería necesario continuar los estudios epidemiológicos en los sistemas de producción cárnica y lechera de Uruguay para conocer la dispersión del agente, establecer su relación con casos de listeriosis en humanos y diseñar/aplicar medidas de control adecuadas que disminuyan su diseminación entre animales de producción.