Sra. Editora:
Introducción
El síndrome de Brugada es una entidad nosológica de origen genético en la que se observan arritmias ventriculares potencialmente letales que ocurren por mecanismos fisiopatológicos que no han sido totalmente aclarados1,2. Los hallazgos electrocardiográficos en los pacientes con síndrome de Brugada son diagnósticos y se caracterizan por elevación del segmento ST en las derivaciones precordiales derechas que son independientes de la presencia de isquemia, trastornos electrolíticos o enfermedades estructurales cardíacas subyacentes2. El tratamiento electivo para la prevención de muerte súbita es el implante de un cardiodesfibrilador (CDI)3. Estos pacientes pueden sufrir choques frecuentes del CDI que se asocian con mortalidad y morbilidad elevadas3. Este manuscrito tiene como objetivo describir el tratamiento ablativo del sustrato arritmogénico en una paciente con síndrome de Brugada que sufrió una tormenta eléctrica, recibiendo múltiples choques del CDI y que fue refractaria al tratamiento médico estándar. De acuerdo a nuestro conocimiento, este es el primer caso de ablación del sustrato arritmogénico del síndrome de Brugada realizado en Uruguay.
Caso clínico
La paciente es una mujer de 55 años sin cardiopatía estructural aparente, diagnosticada con síndrome de Brugada (figura 1) luego de presentar episodios repetitivos de síncope. En agosto del año 2014 se le implantó un CDI. En su evolución presentó episodios recurrentes de taquicardia ventricular que fueron apropiadamente tratados por el CDI con un choque único. Ante la repetición de los choques, se asoció tratamiento farmacológico con quinidina por vía oral que fue efectivo en la prevención de la arritmia, pero tuvo que ser discontinuado por causar agranulocitosis. En marzo de 2019 la paciente presentó múltiples choques apropiados causados por taquicardia ventricular recurrente. El interrogatorio del CDI reveló la presencia de extrasístoles ventriculares únicas con un intervalo de acoplamiento fijo que gatillaban episodios de taquicardia y fibrilación ventricular (figura 2). Ingresada a unidad de cuidados intensivos (UCI) fue tratada con isoproterenol en infusión intravenosa con abatimiento de la arritmia. Sin embargo, cada vez que se intentó discontinuar el isoproterenol, la paciente presentó taquicardia ventricular. Se decidió realizar, entonces, un procedimiento ablativo para la prevención de su taquicardia.
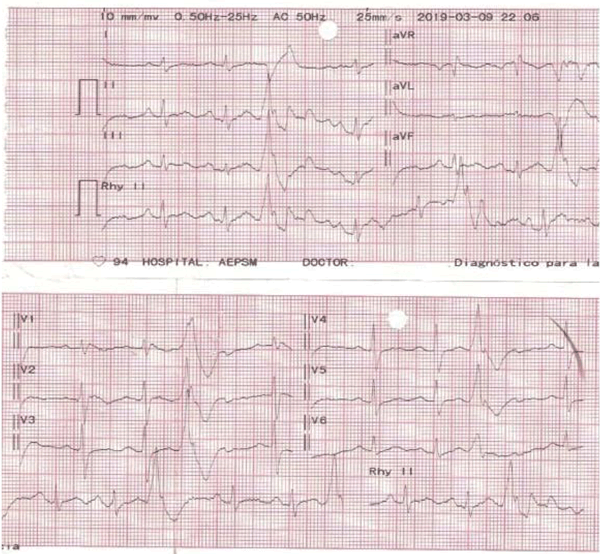
Figura 1: Electrocardiograma obtenido en la mañana del procedimiento (en UCI), mostrando un supradesnivel cóncavo del segmento ST de 1,5 mm en la derivación precordial V1 compatible con patrón electrocardiográfico de Brugada. Se observa también EV de localización epicárdica (pseudoonda delta mayor de 34 ms, tiempo de la deflexión intrinsecoide en V2 mayor de 84 ms y duración del QRS más corto mayor de 121 ms). Si bien el sitio de origen de la extrasístole no puede determinarse basados exclusivamente en el electrocardiograma de superficie, la salida de activación epicárdica se encuentra en el ventrículo izquierdo (bloqueo de rama derecha con eje vertical).
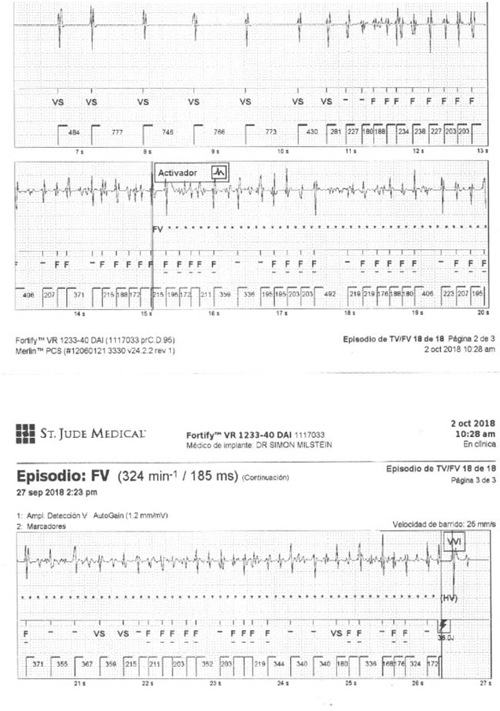
Figura 2: Registro obtenido del cardiodesfibrilador implantable (CDI) durante un episodio de fibrilación ventricular. Una extrasístole ventricular precede el inicio de la fibrilación ventricular. El CDI sensa apropiadamente la arritmia y descarga un choque de 36 J con restauración del ritmo sinusal.
Estudio electrofisiológico y procedimiento ablativo
Luego de obtener el consentimiento escrito, se realizó un estudio electrofisiológico y procedimiento ablativo bajo anestesia general. Un registro electrocardiográfico continuo de 12 derivaciones se mantuvo durante todo el procedimiento, pero debido al posicionamiento de los parches del sistema de mapeo electroanatómico en el toráx, no se pudieron posicionar los electrodos precordiales en segundo, tercer y cuarto espacio intercostales derechos e izquierdos como rutinariamente se efectúa en pacientes con patrón electrocardiográfico de Brugada. Se logró acceso endo y epicárdico al ventrículo derecho incluyendo el tracto de salida por vía transfemoral y percutánea subxifoidea, respectivamente. Se realizó registro de los electrogramas y mapeo tridimensional de voltaje de los potenciales eléctricos endo y epicárdicos del ventrículo derecho en ritmo sinusal en condiciones basales y luego de la administración de 10 mg/kg de procainamida intravenosa en 30 minutos, utilizando un sistema de mapeo electroanatómico (Ensite Velocity Navigation System - NavX; St. Jude Medical Inc., St. Paul, MN, USA). Los electrogramas anormales en ritmo sinusal fueron definidos como aquellos que presentaban: a) potenciales fraccionados (electrogramas con componentes múltiples separados o continuos con una amplitud <1 mV y duración >50 ms); b) electrogramas dispersos (electrogramas separados por un intervalo isoeléctrico >50 ms); c) potenciales tardíos aislados (los que se registraron luego del complejo QRS en el electrocardiograma de superficie), y d) electrogramas de bajo voltaje (voltaje bipolar <1,5 mV, con un filtrado de 30-300 Hz con un corte (notch filter) a 50 Hz).
Se intentó inducir arritmias ventriculares con estimulación ventricular programada desde dos sitios ventriculares derechos (apical y tracto de salida) con dos ciclos de longitud diferentes y usando hasta tres extraestímulos ventriculares. Se realizó también estimulación ventricular programada usando longitud de ciclo en secuencia corto-largo-corto con dos extraestímulos ventriculares. No se observaron arritmias ventriculares espontáneas ni inducidas con la paciente anestesiada. Se encontraron potenciales patológicos mayormente en el espacio epicárdico de la región anterior del tracto de salida del ventrículo derecho que se extendieron significativamente luego de la inyección de procainamida intravenosa (figuras3Ay3B).
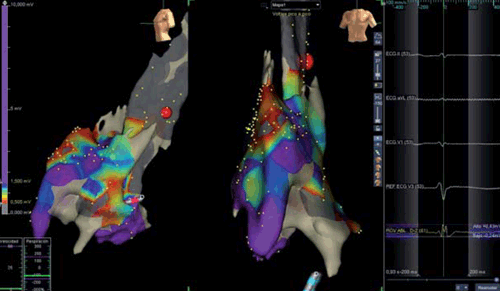
Figura 3A: Mapeo tridimensional de voltaje epicárdico del tracto de salida del ventrículo derecho en proyección oblicua anterior a lateral izquierda (a izquierda) y anterior (a derecha) en condiciones basales. El diferente color que se observa en el mapeo se corresponde con áreas de diferente voltaje codificadas en forma creciente de rojo a amarillo, luego celeste, posteriormente azul (todos estos voltajes <1,5 mV) y, por último, violeta, como indica la barra en el margen izquierdo de la imagen cardíaca. Las áreas en rojo y amarillo son aquellas con los voltajes más bajos (potenciales anormales), mientras que las áreas en violeta son las de voltaje normal, o sea >1,5 mV.
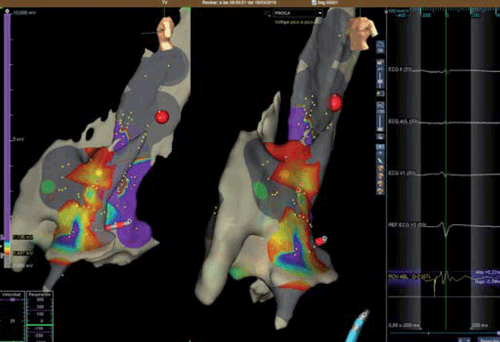
Figura 3B: Mapeo tridimensional de voltaje epicárdico de ventrículo derecho en proyección lateral izquierda (a izquierda) y oblicua anterior izquierda (a derecha) realizado luego de la administración de procainamida. Se observa extensión del área de potenciales patológicos a nivel del tracto de salida del ventrículo derecho cuando se compara con el mapeo obtenido en condiciones basales (figura 3A). El código de colores es idéntico al observado en la figura 3A.
Luego de completar el mapeo cardíaco se realizó ablación por radiofrecuencia de las regiones endocárdicas primero y epicárdicas después, que presentaban electrogramas anormales utilizando un catéter de ablación con irrigación externa (catéter 7F irrigado Therapy Coolpath, St. Jude Medical Inc., St. Paul, MN, USA) aplicando 35 W de energía a 42ºC con una irrigación de 2 ml/minuto en el espacio epicárdico y de hasta 30 ml/minuto en el endocardio. El procedimiento fue considerado exitoso cuando los electrogramas anormales fueron eliminados y el electrocardiograma perdió las características típicas de patrón de Brugada en las derivaciones precordiales derechas. Se otorgó el alta sanatorial a las 48 horas del procedimiento. Pasados tres meses, la paciente mantiene un electrocardiograma sin patrón de Brugada (figura 4) y no ha reiterado episodios de taquicardia ventricular/fibrilación ventricular como lo demuestra el interrogatorio de su CDI. Se realizó, además, un nuevo test provocativo con la administración de 10 mg/kg de procainamida intravenosa en 30 minutos, no lográndose inducir un patrón electrocardiográfico de Brugada (figura 4).
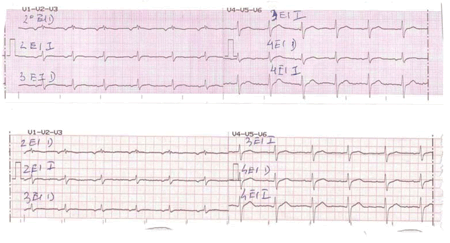
Figura 4: Se muestran las derivaciones precordiales en segundo, tercero y cuarto espacios intercostales derechos e izquierdos a los cuatro meses de la ablación; arriba en condiciones basales y abajo luego de la administración de 700 mg de procainamida intravenosa. No se objetiva un patrón electrocardiográfico de Brugada.
Discusión
El mecanismo de las arritmias ventriculares asociadas al síndrome de Brugada no ha sido debidamente aclarado todavía, lo que dificulta el manejo de estos pacientes. Los estudios disponibles sugieren que son secundarias a un sustrato eléctrico arritmogénico localizado en el tracto de salida del ventrículo derecho2. De acuerdo a las recomendaciones de las guías internacionales de prevención de arritmias ventriculares y muerte súbita, debe implantarse un CDI en los pacientes sintomáticos con síndrome de Brugada. Cuando estos pacientes tienen arritmias ventriculares frecuentes, se pueden tratar además con agentes antiarrítmicos. La quinidina, antiarrítmico tipo IA, con actividad bloqueadora de las corrientes eléctricas ITo y IKr, puede prevenir reentradas en fase II y fibrilación ventricular. Este tratamiento puede eliminar la inducibilidad de arritmias ventriculares en 76% a 88% de los pacientes con síndrome de Brugada que presentan arritmias ventriculares inducibles durante un estudio electrofisiológico4. Por esta razón, la quinidina ha sido usada en pacientes con síndrome de Brugada que sufren choques frecuentes del CDI por arritmias ventriculares o en el curso de tormentas eléctricas. Desafortunadamente, la quinidina tiene múltiples efectos colaterales. Nuestra paciente presentó agranulocitosis. Encontrándose sin tratamiento antiarrítmico, la paciente presentó una tormenta eléctrica y fue ingresada en UCI por múltiples choques de su CDI. Aunque la arritmia fue suprimida con el uso de isoproterenol, esta terapia es inadecuada para el manejo del paciente ambulatorio. Existen pocas publicaciones que destacan el uso de la terapia ablativa en pacientes con síndrome de Brugada y arritmias refractarias al tratamiento estándar5. Muchos pacientes presentan extrasístoles ventriculares que disparan los episodios de taquicardia ventricular. La ablación del sitio de origen de estas extrasístoles ventriculares, generalmente localizadas en el tracto de salida del ventrículo derecho, ha demostrado ser una terapia efectiva para la prevención de las arritmias ventriculares potencialmente letales. Aunque nuestra paciente tenía extrasístoles ventriculares frecuentes cuando estaba alerta, éstas desaparecieron por completo cuando se realizó anestesia general necesaria para el procedimiento ablativo. Los estudios electrofisiológicos realizados en los pacientes con síndrome de Brugada han mostrado trastornos eléctricos potencialmente arritmogénicos que se localizan preferentemente en el tracto de salida del ventrículo derecho5. En nuestra paciente se encontró un sustrato arritmogénico, precisamente en esta región, caracterizado por potenciales eléctricos fraccionados, tardíos y áreas de bajo voltaje. Este sustrato arritmogénico se encontró en ambos, endocardio y epicardio, y se extendió con el uso de procainamida intravenosa.
La ablación de los potenciales anormales resultó en la eliminación del patrón de Brugada en el electrocardiograma de superficie y en la prevención de las arritmias ventriculares espontáneas. El seguimiento posablativo es todavía breve (cuatro meses) pero promisorio; la paciente no ha tenido arritmias ventriculares y no presenta un patrón electrocardiográfico de Brugada espontáneo o luego de la infusión de procainamida intravenosa en el electrocardiograma.















