El ataque cerebrovascular (ACV) es la segunda causa de muerte en adultos en el mundo occidental y una de las principales causas de discapacidad permanente, aumentando su frecuencia con la edad 1,2. Aproximadamente el 85 % es de tipo isquémico (ACV-i), y entre estos, un 20 a 25 % de los afectados son personas en edad laboral activa 3. Estudios realizados en el país estiman una incidencia de 181 casos de ACV/100.000 habitantes/año, con una elevada tasa de mortalidad 3. Esta tasa ha disminuido en las últimas cuatro décadas, encontrándose actualmente en una posición intermedia comparada con otros países de Latinoamérica, y mayor a la de Estados Unidos y países europeos 2,4.
Los factores de riesgo vascular estándares o clásicos modificables para el ACV-i son, entre otros, la hipertensión arterial (HTA), la dislipemia, la diabetes mellitus (DM), el tabaquismo y las arritmias (particularmente la fibrilación auricular); y dentro de los no modificables los antecedentes familiares y personales de ACV, la edad avanzada y el sexo, existiendo una acción sinérgica entre todos ellos 5,6. La prevalencia de éstos varía a nivel mundial, por lo que es importante conocer la situación en cada región a los efectos de implementar las medidas de control adecuadas 7,8.
Dado que el mecanismo fisiopatológico de la mayoría de los ACV-i es la disminución o bloqueo del aporte sanguíneo al cerebro debido a un coágulo o a un embolismo, es importante distinguir si la hipercoagulabilidad, la hipofibrinolisis o un estado inflamatorio contribuyeron en dicho evento vascular.
Está demostrado que existe un mayor riesgo de ACV-i por presentar un estado de hipercoagulabilidad dado por niveles elevados de varios de los factores de la coagulación, donde uno de ellos es el fibrinógeno (Fg), que es además un marcador inflamatorio y es susceptible de sufrir distrés nitro-oxidativo 9,10. Otra razón de hipercoagulabilidad es la presencia de trombofilia, la cual es importante estudiar en el ACVi del joven (< 45 años), ya sea causada por variantes genéticas que disminuyen los inhibidores de la coagulación (proteína C (PC), proteína S (PS) y antitrombina (AT)), a variantes en el Factor II de la coagulación (Protrombina G20210A), a una resistencia a la proteína C activada (RPCA), siendo la variante del factor V de la coagulación la más relevante (Factor V Leiden (FVL)) 11,12. Incluso puede darse trombofilia adquirida por la presencia de anticuerpos antifosfolipídicos tales como inhibidor lúpico (IL) o anticuerpos anticardiolipina (ACL), que dan lugar al síndrome antifosfolipídico 13. Cabe destacar que aún existe controversia en el rol de las trombofilias genéticas y adquiridas en el ACVi arterial 14.
Si bien la hipofibrinolisis como causa de un ACVi ha sido poco estudiada, está descrita su presencia ya sea por aumento de factores trombóticos no coagulopáticos como homocisteína (Hcis) 15 y lipoproteína (a) (Lp(a)) 16, así como por factores directamente relacionados a una disminución de la fibrinólisis por aumento del inhibidor del activador del plasminógeno 1 (PAI-1) 17.
La Hcis, un producto intermediario del metabolismo de la metionina, es un aminoácido de 4 carbonos con un grupo tiol libre. Se ha reportado que está asociada a una alteración del estado oxidativo que afecta el endotelio, teniendo su elevación un rol predictivo del riesgo aterotrombótico 15,18,19. Además, estudios indican un aumento de susceptibilidad al ACVi en sujetos hipertensos con Hcis elevada (20.
La Lp(a) es una lipoproteína de baja densidad que contiene una apolipoproteína llamada apo(a) que es estructuralmente similar al plasminógeno y que compite con éste sobre la red de fibrina, evitando así la formación de plasmina y por ende una adecuada fibrinolisis. Además, el poseer apo B y fosfolípidos oxidados le otorga características aterogénicas, por lo que se considera un factor de riesgo independiente para la patología isquémica cardíaca y cerebrovascular 16,21,22,23.
El PAI-1 es una glicoproteína de cadena única que se sintetiza principalmente en las células endoteliales y hepáticas, y en menor medida en las células del músculo liso y el tejido adiposo. Su aumento es un marcador de disfunción del endotelio vascular por ser el principal inhibidor del sistema fibrinolítico in vivo. Estudios clínicos han demostrado que en el ACVi sus niveles plasmáticos aumentan significativamente 17,24.
En cuanto a los marcadores de inflamación, la proteína C reactiva (PCR) está involucrada como componente inflamatorio tanto en el desarrollo de la aterosclerosis como durante el evento isquémico. Su aumento puede considerarse un marcador predictivo de ACVi, que junto a la edad son factores de riesgo independientes para la recurrencia del mismo 25,26.
Por otra parte, algunos estudios sugieren un posible efecto de variantes genéticas asociadas con la inflamación en el desarrollo de un ACVi. Usando un sistema de score genético Muiño et al. 27 analizó una serie de variantes inflamatorias para la diferenciación de los subtipos de ACVi y reportó que 3 variantes tenían una asociación significativa con el ACVi cardioembólico (p < 0.05): rs1205 ubicado en la región no traducida del gen de la proteína C reactiva (gen PCR); rs1800779 ubicado en la región promotora del gen de la enzima óxido nítrico sintasa-3 (gen NOS3); y la variante intrónica rs2257073 ubicada cercana al gen NSO3 (gen ASB10).
El objetivo del trabajo fue evaluar la frecuencia de parámetros trombofílicos, hipofibrinolíticos, inflamatorios y variantes genéticas en un grupo de pacientes con ACV-i arterial y estudiar la posible asociación de los mismos con algunos de los factores de riesgo vascular estándares y los subtipos etiológicos del evento vascular.
Metodología
Se realizó un estudio observacional y descriptivo de corte transversal a partir de 177 pacientes consecutivos que consultaron en el Departamento de Emergencia del Hospital Maciel, entre los años 2016 y 2018, con diagnóstico clínico-imagenológico sugestivo de ACV-i agudo arterial, basado en el diseño del estudio.
Los criterios de inclusión fueron el presentar un ACV-i de acuerdo a la definición de la OMS 28) con menos de 24 horas de evolución, el tener las muestras de sangre necesarias para el estudio y el haber firmado el paciente o un familiar a cargo el consentimiento informado de participación en el estudio.
Se estudió además un grupo control sin factores de riesgo vascular para evaluar los parámetros inflamatorios (Fg y PCR).
Se contó con un protocolo de recolección de datos con variables afines a la investigación, que incluía datos filiatorios, de la anamnesis, del examen físico, y antecedentes personales y familiares de factores de riesgo vascular estándares.
Se consideraron las siguientes definiciones: HTA y DM según los criterios de la OMS, dislipemia cuando el colesterol es > 5.2 mmol/L o > de 200 mg/dL o cHDL (colesterol de la lipoproteína de alta densidad) < 1.0 mmol/L o < 40mg/dL o triglicéridos > 1.7 mmol/L o 150 mg/dL; tabaquismo el haber fumado como mínimo un cigarrillo al día en los últimos tres meses; arritmia al trastorno de la frecuencia cardíaca debido a fibrilación auricular y ACV previo como la ocurrencia de un ACV previo al episodio que ocasiona el ingreso al estudio.
Para la clasificación etiológica del ACV-i se empleó el criterio Trial of Org 10172 in Acute Stroke Treatment (TOAST), el cual los clasifica en lacunar, aterotrombótico, cardioembólico, inusual o de causa indeterminada.
Las determinaciones analíticas fueron realizadas en un equipo ACL TOP 500 mediante ensayos cromogénicos (AT y PC), coagulométricos (RPCA e IL) e inmunoquímicos (PS libre). Los anticuerpos ACL fueron determinados por método inmunoquímico (ELISA) y la búsqueda de las variantes genéticas factor V Leiden (G1691A) y factor II (G20210A) como la de las variantes inflamatorias PCR, NOS3 y ASB10 fue realizada mediante real-time PCR y analizadas en un equipo StepOne o Rotor-Gene 6000. Los resultados de las variantes genéticas inflamatorias fueron posteriormente analizados usando la interfase de discriminación alélica. La desviación del equilibrio de Hardy-Weinberg (HWE) fue examinada usando un calculador en línea 29.
La Hcis fue determinada por método inmunoquimioluminescente en un equipo Architect i1000; Lp(a) en un equipo BNII por método inmunoquímico; PAI-1 por método inmunoquímico (ELISA); PCR en un equipo Beckman AU 480 por método inmunoquímico y Fg en un equipo ACL TOP 500 por método coagulométrico. Todos estos parámetros fueron evaluados en sangre extraída al ingreso del paciente, excepto para estudios de trombofilia (solo a menores de 45 años) y PAI-1 que fue recolectada lejos del evento agudo.
Se realizó un análisis descriptivo en el que las variables cuantitativas se expresan mediante medidas de tendencia central no paramétricas (mediana), con el rango intercuartílico (RIC) como medida de dispersión. Para el análisis inferencial se utilizaron las pruebas de contraste de hipótesis Chi cuadrado (χ2) o el test exacto de Fisher con un nivel de significancia de p < 0.05 para la búsqueda de asociación entre parámetros hipofibrinolíticos y antiinflamatorios con los factores de riesgo vascular estándares, y para las variantes genéticas inflamatorias con el tipo de ACV-i.
Las variables cuantitativas se dicotomizaron en alteradas y no alteradas, calculando la frecuencia de cada caso con su respectivo intervalo de confianza del 95 % (IC95 %). PCR y Lp(a) alteradas fueron definidas en base al valor que supere aquel para el cual hay bajo riesgo cardiovascular según criterios de la American Heart Association y Canadian Cardiovascular Society (1.5 mg/L y 30 mg/L, respectivamente). El resto de los parámetros en base a que el valor sea mayor o menor según el caso al definido en el kit como valor de referencia, siendo alterados Hcis > 15.4 umoL/L, Fg > 498 mg/dL, PAI-1 > 43 ng/mL; PC < 70 %, PS < 74 % en hombres y < 54.7 % en mujer, AT < 83 %; y presencia de RPCA relación < 2, IL relación > 1.2, ACL > 10 GPL/mL para IgG y > 7 MPL/mL para IgM. Con estos criterios se calcularon las razones de probabilidad (OR) contra el grupo control para Fg y PCR. El análisis estadístico fue realizado con el programa SPSS para Windows de IBM, versión 23.
Con el fin de evaluar si existen diferencias en las frecuencias alélicas y genotípicas entre los pacientes ACV-i con la población normal, se utilizó como referencia la base de datos en línea del proyecto ALFA respecto a la población Latinoamericana 30.
El presente trabajo contó con la aprobación de los Comités de Ética del Hospital Maciel y de la Universidad involucrados, que siguen las normas éticas establecidas en la Declaración de Helsinki.
Resultados
Fueron excluidos 63 pacientes por falta de confirmación de presentar ACV-i o el mismo no ser agudo, por haber sido tratado antes de la toma de muestras, o porque el paciente no dio su consentimiento de participación en el estudio. Los pacientes que cumplieron los criterios de inclusión al estudio fueron 114 entre 25 - 97 años.
El grupo control de estuvo constituido por 60 voluntarios sanos, 13 hombres y 47 mujeres con edades entre 17 - 85 años.
En la tabla 1 se presentan las características de la población estudiada.
Tabla 1: Características de la población estudiada de pacientes con ataque cerebrovascular isquémico. Abreviaturas: RIC- rango intercuartílico, ACV- ataque cerebrovascular, HTA- hipertensión arterial, DM-diabetes mellitus, IC95 % - intervalo de confianza del 95 %.
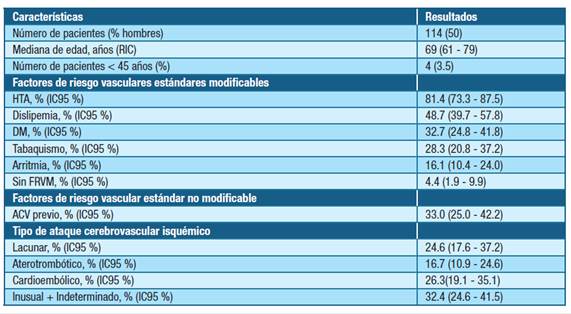
El estudio de trombofilia como factor de riesgo en los pacientes jóvenes se realizó en 3/4 de ellos. Uno resultó ser heterocigoto para el FVL, otro presentó RPCA e IL positivo, y el tercero resultó ser negativo para los parámetros estudiados.
La Tabla 2 muestra la frecuencia de los valores de hipofibrinolisis alterados en los pacientes ACV-i.
Tabla 2: Frecuencia de valores de marcadores hipofibrinolíticos alterados en pacientes con ataque cerebrovascular isquémico. Abreviaturas: Hcis- homocisteína, Lp(a)- lipoproteína (a), PAI-1- inhibidor del activador del plasminógeno-1, IC95 % - intervalo de confianza del 95 %.

Respecto a las Hcis alteradas, todas fueron de un nivel moderado (15 - 30 umol/L) de acuerdo a Kim et al. 18. El 85 % de los pacientes ACV-i con Hcis alterada eran ≥ 60 años. Considerando dicha edad como punto de corte, las medianas de las Hcis alteradas fueron 16.7 umol/L (RIC: 16.1 - 18.0) y 17.5 umol/L (RIC 16.6 - 20.4) para < 60 años y ≥ 60 años respectivamente.
En cuanto al PAI-1, la mediana de los pacientes con resultados no alterados fue de 73 años (RIC: 64.5 - 79.1), mientras que para aquellos con valores alterados fue de 67 años (RIC: 57.5 - 78.0).
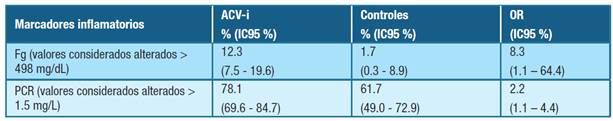
La Tabla 3 muestra la frecuencia de valores alterados de los parámetros inflamatorios en pacientes con ACV-i y en los controles, con su correspondiente comparación.
Tabla 3: Frecuencia de valores de marcadores inflamatorios alterados en pacientes con ataque cerebrovascular isquémico y en el grupo control. Abreviaturas: ACV-i- ataque cerebrovascular isquémico, Fg- fibrinógeno, PCR- proteína C reactiva, IC95 %- intervalo de confianza del 95 %, OR- razón de probabilidad.
No se encontró asociación entre los marcadores inflamatorios e hipofibrinolíticos en función del tipo de ACV-i, (p > 0.05) (datos no mostrados).
En la tabla 4 se muestra la asociación entre los marcadores inflamatorios e hipofibrinolíticos en función de los factores de riesgo vascular estándares. Respecto a la HTA, solo se observó asociación con la PCR y una tendencia con el Fg. En cuanto a la dislipemia, hubo asociación con Lp(a) y una tendencia con PCR. El tabaquismo presentó una tendencia a la asociación con Hcis. La arritmia mostró asociación con Fg e inversa con la Lp(a).
Tabla 4: Análisis estadístico (χ2/Fisher) en búsqueda de asociación entre marcadores hipofibrinolíticos/inflamatorios y los factores de riesgo vascular estándar modificables y no modificables. (* estadísticamente significativo) Abreviaturas: FRVM- factores de riesgo vascular estándares modificables, FRVNM- factores de riesgo vascular estándares no modificables, HTA- hipertensión arterial, DM- diabetes mellitus, ACV- ataque cerebrovascular, Hcis- homocisteína, Lp(a)- lipoproteína (a), PAI-1- inhibidor del activador del plasminógeno-1, Fg- fibrinógeno, PCR- proteína C reactiva.
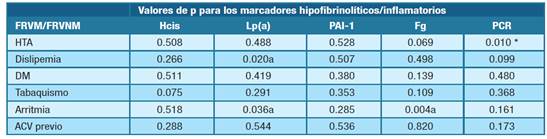
De los 5 pacientes sin factores de riesgo vascular estándares, uno presento valores de PAI-1, Hcis y PCR alterados, mientras que otro presentaba alteración de los valores de Fg y PCR.
Se corroboró que el grupo de pacientes ACV-i se encontraba en HWE para el estudio de las variantes genéticas rs1205 PCR, rs1800779 NOS3 y rs2257073 ASB10.
En las Tabla 5 y Tabla 6 se muestran las frecuencias alélicas y genotípicas, para todos los ACV-i (comparadas a una población de referencia 30) y diferenciados por criterio TOAST, respectivamente.
Tabla 5: Frecuencias alélicas y genotípicas de las variantes genéticas inflamatorias de la población de referencia 30 y de los pacientes ataque cerebrovascular isquémico.Abreviaturas: FA- frecuencias alélicas, FG- frecuencias genotípicas, PR - población de referencia, ACVi- ataque cerebrovascular isquémico, rs1205 PCR- variante del gen PCR, rs18007799 NOS3- variante del gen NOS3, rs225707 ASB10- variante del gen ASB10.
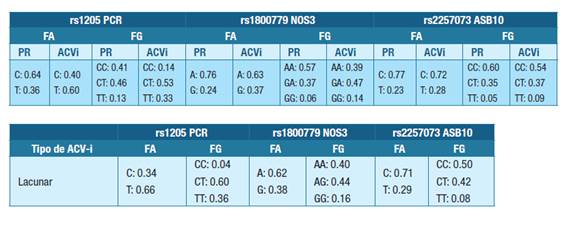
Tabla 6: Frecuencias alélicas y genotípicas de las variantes genéticas inflamatorias discriminadas por tipo de ataque cerebrovascular isquémicoAbreviaturas: FA-frecuencias alélicas, FG-frecuencias genotípicas, ACV-i - ataque cerebrovascular isquémico, rs1205 PCR- variante del gen PCR, rs18007799 NOS3- variante del gen NOS3, rs225707 ASB10- variante del gen ASB10.
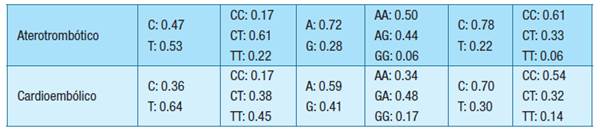
Las frecuencias alélicas y genotípicas encontradas para la variante rs1205 PCR, sin discriminar por tipo de ACV-i, fueron diferentes a la población normal Latinoamericana, con una mayor frecuencia del alelo T en los pacientes con ACV-i. Por tipo de ACV-i, las frecuencias alélicas para esta variante también fueron diferentes a la población de referencia, con una presencia aumentada del alelo T en los 3 tipos de ACV-i.
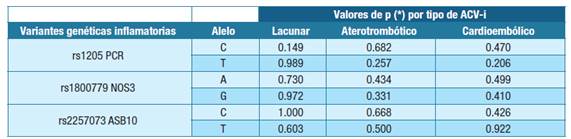
Respecto a las variantes rs1800779 NOS3 y rs2257073 ASB10, las frecuencias fueron similares tanto en general como por tipo de ACV-i. La Tabla 7 muestra el resultado del análisis estadístico de asociación entre las variantes estudiadas y el tipo de ACV-i.
Tabla 7: Análisis estadístico (χ2/Fisher) en búsqueda de asociación entre variantes genéticas inflamatorias y tipo de ataque cerebrovascular isquémica (* estadísticamente significativo)Abreviatura: ACV-i - ataque cerebrovascular isquémico, rs1205 PCR- variante del gen PCR, rs18007799 NOS3- variante del gen NOS3, rs225707 ASB10- variante del gen ASB10
Discusión
El porcentaje de ACV-i en jóvenes del presente estudio (3.5%) fue algo menor a referencias nacionales que reportan 5.6-8% e internacionales de alrededor de 10%, pero considerando ACV en su conjunto, incluso con un punto de corte en 50 años 14,31.
Respecto al estudio de trombofilia de ACV-i en jóvenes, el paciente con FVL tuvo un ACV previo y trombosis a edades tempranas en sitios inusuales, que consolida con la presencia de dicha mutación no previamente estudiada aunque aún existe controversia en la literatura acerca del rol de éste en los ACVi arteriales 14.
El paciente con RPCA e IL positivos en ausencia de FVL indica una condición trombogénica adquirida, que puede haber sido el causante de su ACV ya que carece de todos los factores de riesgo vascular estándares.
El tercer paciente no presentó ningún parámetro positivo de trombofilia, aunque tenía como factor de riesgo solamente el ser tabaquista y el hecho de que utilizó anticonceptivos orales hasta hace un año. Sin embargo, si bien no fue estudiada en el presente trabajo, de la historia clínica surge que era portadora de una variante para el gen trombofílico de la metilentetrahidrofolato reductasa (MTHFR).
El paciente que no pudo ser captado para los estudios de trombofilia era tabaquista, alcohólico y tenía antecedentes familiares directos de ACV, siendo uno de los factores de riesgo de ACV-i más importantes según establece Goldstein et al. 5.
Estos resultados destacan la importancia de considerar a la trombofilia como un factor de riesgo de ACV-i en los jóvenes como refiere M’Barek et al. 11. De todas maneras, cabe remarcar que hay divergencias de si los estudios de trombofilia genéticos y adquiridos deben incluirse en el algoritmo diagnóstico del ACV-i del joven 14.
El estudio de Hcis indicó un aumento de este marcador en pacientes con ACV-i. Para un análisis más pormenorizado de estos resultados, además del punto de corte indicado por el kit, se utilizó el propuesto por Selhub et al. 32, el cual discrimina por sexo y edad. Dichos autores reportaron en la población general mayor o igual de 60 años un aumento de Hcis en 43.2 % en los hombres (IC95 % 40.1 - 46.3) y 46.5 % (IC95 % 43.6 - 49.4) en las mujeres, para un punto de corte de 11. 4 y 10.4 umol/L, respectivamente. Utilizando dichos criterios y el mismo rango etario en la población ACV-i, se observó una frecuencia de Hcis alterada de 65.8 % (IC95 % 49.9 - 78.8) en hombres y 74.5 % (IC95 % 61.1 - 84.5) en mujeres. Este aumento en Hcis apoya la hipótesis de que es factor de riesgo para ACV-i 33.
De todas formas, existe controversia acerca del tratamiento específico de la hiperhomocisteinemia como prevención primaria o secundaria de ACV-i y en general no es recomendada 14.
Como establecieron Kim et al. 18, hay variables confundentes que podrían llevar a su aumento, como las deficiencias de vitamina B12 y ácido fólico, la edad, el ser tabaquista y ciertos medicamentos. Respecto a la edad, no se observó diferencia significativa entre las medianas de hiperhomocisteinemias entre los menores y mayores de 60 años, a pesar de la evidencia existente del aumento normal de Hcis con la edad 34. El ser tabaquista podría excluirse dado que no se encontró asociación con la hiperhomocisteinemia (Tabla 4). Un paciente con riesgo cardiovascular medio a alto según valor Hcis 18) estaba en tratamiento con fenobarbital que le puede haber inducido la hiperhomocisteinemia, por lo cual dicho resultado no podría ser atribuido solamente al ACV-i. Sin embargo, dado que carecía de factores de riesgo vascular estándares, podría existir una asociación entre ese aumento y el desarrollo del ACV-i.
Las deficiencias vitamínicas no pudieron ser analizadas.
Con relación a la Lp(a), no existen datos de la población uruguaya, pero la guía nacional de dislipemias 22 establece que el 20 % de la población general posee valores por encima del punto de corte para riesgo cardiovascular (>30 mg/dL). Nuestros hallazgos indican que el porcentaje de pacientes con ACV-i que exceden ese punto de corte está por encima del de la población general. Esto sugiere que los pacientes con ACV-i tiene un riesgo cardiovascular aumentado que podría ser evaluado a través de la medida de la concentración de Lp(a). Nuevamente, es controversial que el hallar una Lp(a) elevada lleve a tomar medidas específicas de prevención primaria o secundaria 35.
Con respecto al PAI-1, existen varias variables confundentes tales como la inflamación, la edad, la DM, la dislipemia, la HTA, obesidad, infección y fármacos fibrinolíticos 36,37,38,39,40,41. De estos, la inflamación podría alejarse como causa del aumento dado que ningún paciente presento PCR en rango inflamatorio (> 6 mg/L); DM, dislipemia e HTA también pueden excluirse dado que no presentaron asociación con PAI-1 (Tabla 4); y edad también dado que no se observó diferencia entre las medianas de edad de los valores normales y alterados de PAI-1.
La influencia por obesidad y de posibles infecciones, no pudo ser excluida por falta de dicha información. El efecto de fármacos fibrinolíticos se excluye porque ningún paciente tratado con éstos fue incluido en este estudio. Por lo tanto, el PAI-1 alterado podría indicar un estado hipofibrinolítico que contribuye al desarrollo del ACV-i.
Un hecho que quedó demostrado es que la PCR y el Fg eran significativamente más elevados en pacientes con ACV-i comparados al grupo control, corroborando la relevancia de la inflamación en el evento isquémico 25. Además, se encontró asociación entre PCR y Fg en pacientes con ACV-i.
A los efectos de validar el uso de los parámetros hipofibrinolíticos e inflamatorios como nuevos factores de riesgo para ACV-i se buscó la asociación entre estos y los los factores de riesgo vascular estándares.
Según Han et al. (20, era de esperarse encontrar una asociación entre HTA y Hcis, lo que no ocurrió en este estudio; pero la HTA si presentó asociación con la PCR y se observó una tendencia con el Fg. Esta asociación era esperada dado que la HTA afecta a los vasos, mediado por el distrés nitroxidativo que lleva a disfunción endotelial 40. La dislipemia, especialmente la hipercolesterolemia, asoció con la Lp(a) y mostró una tendencia con la PCR. Si bien la Lp(a) es un factor de riesgo independiente para ACV-i, tal asociación parece razonable dado que ésta transporta 30 % de colesterol 23. En cuanto a la PCR, de acuerdo con Libby 25, el estado inflamatorio asociado favorece la oxidación del colesterol inhibiendo así su metabolización, por lo que aumenta su concentración plasmática favoreciendo la formación de la placa de ateroma. El tabaquismo mostró una tendencia de asociación con la Hcis pero no asoció con PAI-1 como mencionan Eliason et al. y Omoike et al. 42,43. Respecto a la arritmia, se asoció con Lp(a) y Fg. La primera, una asociación inversa, fue consistente con lo reportado por Aronis et al. 44) y la segunda con Wu et al. 45,46, que reportó que el aumento del Fg promueve significativamente el tromboembolismo en la fibrilación auricular.
En cuanto a los pacientes sin factores de riesgo vascular estándares se hallaron alteraciones en varios de los parámetros inflamatorios e hipofibrinolíticos analizados (PCR, Fg y PAI-1), demostrando la importancia de su evaluación en este tipo de pacientes. A pesar de este hecho, demostrado en la literatura y en este estudio, no hay consenso en la necesidad de una búsqueda sistemática de estos parámetros en el ACV-i ni que su hallazgo se traduzca en una terapéutica específica de ellos.
La no asociación entre los parámetros relacionados al desbalance hemostático y el tipo de ACV-i podría ser debido al bajo número de pacientes en cada subtipo.
A pesar de que el análisis inferencial de asociación entre las frecuencias alélicas de las variantes genéticas y el tipo de ACV-i dieron valores de p > 0.05, había un aumento en la frecuencia del alelo T de la variante de PCR rs1205 en los 3 tipos de ACV-i. La mayor frecuencia del alelo T en el tipo cardioembólico coincide con lo reportado por Muiño et al. 26, quien estableció que el poseer ese alelo podría aumentar el score de riesgo genético para el mismo.
De la búsqueda de factores de riesgo que pudiesen ser responsables del desarrollo de un ACV-i y en concordancia con la extensa literatura publicada sobre este tema, surge que la trombofilia debería, en ciertos contextos clínicos, ser estudiada para prevenir la recurrencia, dado que los pacientes jóvenes analizados presentaron al menos uno de dichos parámetros alterados, aunque el número de casos evaluados fue bajo.
Las alteraciones en los valores de Hcis, Lp(a), PAI-1, PCR y Fg, parámetros relacionados a la hipofibrinolisis e inflamación, avalan la hipótesis de una fibrinolisis disminuida y un rol relevante en el proceso inflamatorio que pueden contribuir a un ACV-i. Además, la mayor frecuencia alélica observada en una de las variantes genéticas analizadas complementa los hallazgos anteriormente mencionados.
El estudio de correlación mostró que la mayoría de los factores de riesgo vascular estándares tenía al menos una asociación con los nuevos potenciales factores de riesgo propuestos, apoyando su utilidad. Queda por determinar, si dicha coexistencia debería llevar a un control más intensivo de los primeros o a un tratamiento específico de los segundos.
Consideramos como limitaciones del estudio el no haber podido evaluar los parámetros Hcis, Lp(a), PAI-1 y las variantes genéticas asociadas a la inflamación contra una población de referencia propia, así como el no haber podido valorar todas las variables confundentes de algunos de los parámetros analizados debido a un tema de costos. Otra debilidad fue el no haber realizado una técnica de apareamiento con todas las variables del grupo control (edad, sexo y factores confundentes). Además, el número total de pacientes incluidos en el estudio es relativamente bajo, especialmente en la sub población de ACV-i en el joven, como para que los resultados sean determinantes.
Conclusiones
Los resultados hallados, especialmente en los pacientes sin factores de riesgo vascular estándares, apoyan la hipótesis planteada de que tanto la trombofilia en jóvenes, como la hipofibrinolisis y el estado inflamatorio con su contribución genética, pueden predecir el desarrollo de un ACV-i. Dado que esta es un área poco estudiada en nuestro medio, los resultados hallados estimulan la necesidad de continuar el estudio con un diseño optimizado que permita generar un score de riesgo específico analizando factores de riesgo gatilladores no rutinariamente evaluados, y a su vez, dilucidar si éstos son causa o consecuencia del evento.















