Introducción
El síndrome antifosfolípido (SAF) es un trastorno autoinmune sistémico de etiología desconocida, caracterizado por la presencia de trombosis arterial y/o venosa, pérdida fetal recurrente y anticuerpos antifosfolipídicos (aFL): anticuerpo anticardiolipina (AcL), y anti B2 glicoproteína 1 (anti B2GPI) además del inhibidor lúpico (IL). Se presenta con baja frecuencia, predominantemente en mujeres con una relación de 3 a 1 respecto al sexo masculino. La edad de inicio es entre los 15-50 años (85% de los casos).(1, 2)
El SAF es la trombofilia adquirida más frecuente.3) Puede ser primario o secundario, es decir asociado a otras enfermedades autoinmunes sistémicas (EAS)1. La asociación más frecuente es con el Lupus Eritematoso Sistémico (LES). La trombosis venosa profunda (TVP) es la manifestación clínica más frecuente (el SAF provoca del 10 al 15 % de todos los episodios de TVP con o sin embolia pulmonar). También es responsable de un tercio de los accidentes cerebrovasculares nuevos en pacientes menores de 50 años. Es responsable de hasta 10 a 15 % de los casos de pérdidas fetales recurrentes. 1
De acuerdo a la clasificación vigente de Sydney 2006, para el diagnóstico se requiere por lo menos un criterio clínico, dado por trombosis y/o morbilidad obstétrica, y un criterio de laboratorio, dado por la presencia de aFL persistentemente positivos en 2 determinaciones separadas por al menos 12 semanas. 2
En un estudio caso control, se ha demostrado la relación entre la presencia de aFL, en particular el IL, como factor de riesgo mayor para los eventos trombóticos arteriales en mujeres jóvenes, así como la asociación de factores de riesgo cardiovascular como el tabaquismo, que aumenta el riesgo para eventos isquémicos. 4
Los autoanticuerpos asociados con SAF están dirigidos contra una serie de proteínas plasmáticas y proteínas expresadas en la superficie de las células endoteliales y las plaquetas. La expresión y la secreción de varias moléculas son la base para posibles mecanismos por los cuales los aFL pueden desarrollar eventos trombóticos en pacientes con SAF 5. Se describen trastornos que generan una alteración en la inmunidad tanto humoral como celular. Se ha descrito déficit del complemento, asplenia funcional, alteraciones del sistema fagocítico, así como déficit en la actividad de los linfocitos T citotóxicos y alteración en la función de las células T supresoras como parte del proceso de la enfermedad. (6
Los aFL son un grupo heterogéneo de inmunoglobulinas (IgG, M y ocasionalmente A) que interfieren en los procesos de la hemostasia dando lugar a un estado procoagulante y proinflamatorio que incrementa el riesgo de trombosis arteriales, venosas y de pequeño vaso. En la mayoría de los casos, la presencia de estos autoanticuerpos requiere de un desencadenante o un factor de riesgo añadido, como por ejemplo las infecciones (“hipótesis del second hit o de los dos hits”) para dar lugar a las complicaciones trombóticas (1.
La positividad para los aFL es una condición necesaria pero no suficiente para inducir las manifestaciones clínicas del SAF 1.
Dichas manifestaciones pueden ser variadas y cualquier órgano o tejido puede ser potencialmente afectado. Algunas manifestaciones del SAF no están incluidas en la clasificación de Sydney 2006. A este grupo de manifestaciones se las denomina de forma genérica “no criterio”. Dentro de estas se citan: compromiso valvular cardíaco, migraña, livedo reticularis, trombocitopenia, microangiopatía renal y manifestaciones neuropsiquiátricas. 1
Las manifestaciones cutáneas “no criterio” descritas son livedo reticularis, úlceras necróticas, lesiones pseudo vasculíticas, gangrena digital y hemorragias en astilla, entre otras.
En un estudio de 200 pacientes con SAF se detectaron 49 % de manifestaciones cutáneas y fueron síntoma de presentación en el 30% de los casos, con alta frecuencia de livedo reticularis seguida de úlceras necróticas 7). La livedo reticularis (LR) es por lejos la manifestación cutánea más frecuente, reportándose hasta en el 25 % en algunas series 7. Consiste en círculos regulares continuos (livedo reticularis) o círculos irregulares abiertos (livedo racemosa). Es persistente, no reversible con recalentamiento, puede abarcar tronco, miembros superiores e inferiores. La LR es más frecuente en los casos de SAF secundarios a LES y se asocia fuertemente a la presencia de aFL 8. La forma racemosa es un predictor de trombosis multisistémica en el SAF y se asocia con eventos arteriales que incluyen accidentes cerebrovasculares, trombosis arterial, anomalías cardíacas, fenómeno de Raynaud y migraña. El síndrome de Sneddon es una rara condición, severa, que establece la asociación entre livedo reticularis y accidente cerebrovascular isquémico a edades tempranas y frecuentemente en el sexo femenino (8. La LR y sobre todo la racemosa deberían ser particularmente monitoreadas en pacientes con presencia de aFL (9).
En relación con las manifestaciones cardiacas “no criterio”, existen reportes de compromiso miocárdico e isquemia evidenciable con coronarias normales, sugiriendo enfermedad microvascular (10.
La enfermedad valvular en el SAF ocurre en forma de lesiones valvulares como engrosamiento, vegetaciones y/o disfunción valvular en ausencia de fiebre reumática o endocarditis infecciosa 10. Las lesiones cardiacas típicas son el engrosamiento valvular mayor de 3mm localizado en el sector proximal y medio, y la presencia de nódulos irregulares en la válvula mitral y aórtica (10. Aunque el rol de los aFL en las lesiones cardíacas no ha sido probado, existen dos revisiones sistemáticas que asocian la presencia de los mismos con lesiones valvulares 10,11.
La evidencia crece además a favor de la asociación entre HAP (Hipertensión Arterial Pulmonar) y la presencia de aFL. Hay varios mecanismos propuestos a favor de la misma que incluyen: trombosis de pequeño y gran vaso, efectos proinflamatorios de los aFL, enfermedad valvular, tromboembolismo pulmonar crónico y disfunción endotelial. (12
Las manifestaciones del Sistema Nervioso Central (SNC) “no criterio” son múltiples, se presentan a una edad promedio de 30 años y es responsable de una elevada morbimortalidad 13). La variabilidad en su presentación clínica no puede explicarse sólo por el mecanismo trombótico. Se ha revelado que el endotelio cerebral es activado por los aFL, promoviendo así una actividad procoagulante, aunque de igual modo se pueden unir a las células gliales, a la mielina y neuronas, desregulando sus funciones y teniendo un efecto directo sobre las mismas.
El estado protrombótico asociado a aFL es responsable de cambios en la microcirculación, siendo esta también la causa de manifestaciones neuropsiquiátricas descritas en el SAF. (13
En el Euro Phospholipid Project Group study, dentro de las manifestaciones neurológicas, el 19.8 % se presentaron como accidente cerebrovascular y el 11.1% como accidente isquémico transitorio (1).
Sin embargo, la cefalea migrañosa, se observó como la manifestación neurológica “no criterio” más frecuente, con una prevalencia de hasta 30% según la literatura 1).
El corea es descrito como una rara complicación del SAF y constituye el trastorno del movimiento más frecuente asociado, con una prevalencia de 1.3% 1.
Otras manifestaciones neurológicas “no criterio” son la epilepsia, la mielitis transversa y los síndromes esclerosis múltiple “like”. La mielitis transversa presenta una prevalencia del 0 al 4 %14. Varios estudios demuestran asociación entre ésta y la presencia de aFL en pacientes con LES 14,15).
También se han descrito manifestaciones neuropsiquiátricas como demencia, deterioro cognitivo y psicosis. Cervera y col (1, reportaron una prevalencia de 2.5 % de demencia en pacientes con SAF. En un estudio de 60 pacientes con SAF, se evidenció mayor frecuencia de deterioro cognitivo. Además, los casos con LR y lesiones desmielinizantes presentaron un riesgo incrementado de éste. Del mismo modo, se demostró mayor frecuencia de deterioro cognitivo en aquellos pacientes con altos niveles de aFL comparado con los que presentaban niveles moderados 16.
Las alteraciones hematológicas no trombóticas asociadas al SAF, son la trombocitopenia y la anemia hemolítica autoinmune. La trombocitopenia es una de las manifestaciones más frecuentes con una prevalencia entre el 16 y 53 % de los casos de SAF 17). La asociación de trombocitopenia inmune y presencia de aFL aumenta el riesgo de trombosis y puede ser el debut de un SAF y/o LES 18).
El Euro-phospholipid cohort, reportó la presencia de anemia hemolitica autoinmune (AHA) en un 9.7 %.(1 Una revisión y un metanálisis recientes, estudiaron la relación entre aFL y AHA, y observaron una alta prevalencia en los pacientes con LES y SAF, aunque con una menor prevalencia en LES sin aFL y baja en los casos de SAF primario.19
Uno de los hallazgos más importantes es la microangiopatía trombótica, definida por la presencia de trombosis en arteriolas y capilares, comúnmente asociada con trombocitopenia, anemia hemolítica microangiopática e insuficiencia renal. 20
La presentación clínica incluye hipertensión, enfermedad renal crónica, proteinuria y hematuria. (20
Estas manifestaciones clínicas que hemos recorrido, no clasificatorias, sugieren el diagnóstico de SAF y por tanto motivan el abordaje en vistas a esclarecer su rol en el diagnóstico y tratamiento. En nuestro país, no hay estudios epidemiológicos vinculados a las manifestaciones no clasificatorias del SAF, por otro lado, si existen estudios de SAF obstétrico 21,22
El objetivo del presente estudio es analizar las manifestaciones clínicas del SAF, enfatizando en las manifestaciones “no criterio” y su relación con el perfil inmunológico, en una población de pacientes con SAF asistidos en un servicio ambulatorio de enfermedades autoinmunes.
Metodología
Se realizó un estudio observacional de una cohorte histórica de pacientes con SAF. Se incluyeron todos los casos de la consulta ambulatoria del servicio de Enfermedades Autoinmunes Sistémicas entre el 2010 y el 2019 con diagnóstico definitivo o sospecha de SAF. No hubo criterios de exclusión.
Se analizaron las siguientes variables: demográficas (sexo, edad, etnia autorreportada); diagnóstico definitivo de SAF según los criterios de Sidney 2006 2, definido como los que presentan al menos un criterio clínico y un criterio serológico presente en dos determinaciones.
Se definieron las manifestaciones clasificatorias clínicas (trombóticas y antecedentes de morbilidad obstétrica) y de laboratorio según los criterios de Sidney 2006. (22
Dentro de las complicaciones trombóticas se incluyeron las venosas y arteriales, con confirmación por estudio de imagen, dependiendo de su tipo y topografía.
La morbilidad obstétrica se definió como:
-Pérdida fetal tardía: mayor o igual a 1 muerte fetal inexplicada ≥ 10 semanas de gestación, con morfología normal por ecografía prenatal o examen directo postnatal. (22
-Pérdida recurrente del embarazo: mayor o igual a 3 pérdidas de embarazos < a 10 semanas de gestación, consecutivas, no explicadas por causas anatómicas, hormonales o alteraciones cromosómicas maternas o paternas. (23
-Parto pretérmino: mayor o igual a 1 parto pretérmino antes de las 34 semanas, con recién nacido morfológicamente normal, secundario a preeclampsia severa, eclampsia o características consistentes con insuficiencia placentaria. (23
De las variables de laboratorio se incluyeron los aFL en un mínimo de 2 determinaciones:
-IL en plasma, a través de la prolongación de pruebas de coagulación dependiente de fosfolípidos, detectado de acuerdo a la guía de la Sociedad Internacional de Trombosis y Hemostasis. (2
-AcL tipo IgG o IgM presente en plasma o suero, a títulos medios (20 - 39 y > 40) o altos (≥ 40 GPL o MPL, o > al percentil 99), medidos por ELISA estandarizado. (2
-β2GPI tipo IgG o IgM presente en plasma o suero (títulos > percentil 99), medidos por ELISA estandarizado. (2
La variable triple positividad, definida como la positividad para los tres aFL, se registró como variable dicotómica.
Se consignaron las manifestaciones “no criterio” también como variables dicotómicas, a saber:
-Cutáneas: LR, necrosis cutánea, úlceras isquémicas.
-Osteoarticulares: artralgias.
-Cardiopulmonares: insuficiencia o estenosis valvular, miocardiopatía, vegetaciones, disfunción valvular, engrosamiento valvular e hipertensión pulmonar.
-Renales: microangiopatía renal.
-Neurológicas: convulsiones, mielitis transversa, epilepsia, neuritis óptica, migraña, corea, deterioro cognitivo (se define por DSM V como cualquier alteración comparado con el nivel previo de rendimiento en uno o más dominios cognitivos como la atención compleja, función ejecutiva, aprendizaje, memoria, lenguaje, habilidad perceptual motora o cognición social).
-Hematológicas: anemia hemolítica, leucopenia(< 4 × 109/L) y trombocitopenia (70-120 × 109).
Se definieron pacientes con sospecha diagnóstica de SAF aquellos que no cumplían con los criterios diagnósticos definitorios del mismo, pero reunían las siguientes características:
1) clínicas: trombosis no provocadas arteriales o venosas en sujetos menores de 50 años y/o presencia de manifestaciones clínicas no clasificatorias, y/o morbilidad obstétrica de acuerdo a los criterios clasificatorios establecidos
2) serológicas: presencia de una sola determinación positiva de aFL.
Los tipos de SAF se definieron en primario o secundario asociado a EAS.
Se verificó normalidad mediante test de Kolmogorov Smirnov. Las variables cuantitativas se expresaron en media y desvío estándar y las variables cualitativas en frecuencia absoluta y frecuencia relativa porcentual.
Se valoró asociación mediante test de chi cuadrado o test exacto de Fisher, cuando los valores esperados fueron menores de 5. Se consideró un error alfa de 0.05. El procesamiento de los datos se realizó mediante el software estadístico SPSS 22.0 (SPSS Inc.; IBM)
Se preservó la confidencialidad de los datos personales de los participantes, siendo estos manejados solamente por parte de los investigadores respetando en todo momento el uso de los datos sólo para fines estadísticos. El estudio fue aprobado por el Comité de Ética del Hospital Maciel.
Resultados
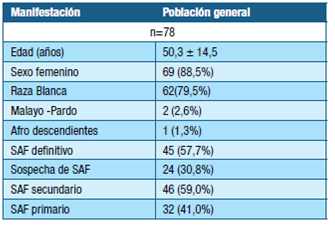
Se estudiaron 78 pacientes. En la tabla 1 se presentan las características epidemiológicas de la población, el diagnóstico de SAF primario y secundario.
El LES fue la enfermedad más frecuentemente asociada con SAF secundario, con 28 (35.9%) pacientes. Las otras asociaciones que siguen en frecuencia fueron artritis reumatoidea con 4 (5.1%) casos, enfermedad mixta del tejido conectivo y esclerosis sistémica con 2 (2.6%) casos cada una.
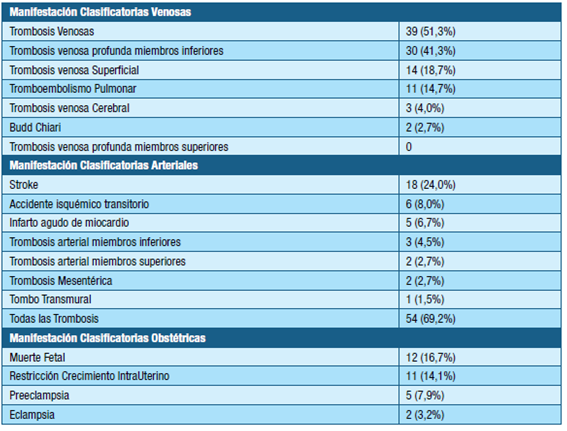
En la tabla 2 se presentan las manifestaciones clínicas clasificatorias. Los principales eventos trombóticos fueron las trombosis venosas en 39 casos (51.3%). Las manifestaciones arteriales fueron 27 casos y las obstétricas 30 casos.
Cincuenta y nueve pacientes (75.6%) presentaron manifestaciones “no criterio” además de las clasificatorias, mientras que 10 (12.8%) presentaron manifestaciones “no criterio” de forma aislada.
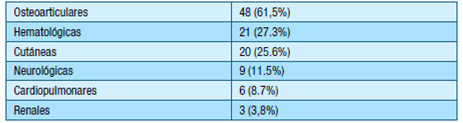
En la tabla 3 se presentan las manifestaciones clínicas “no criterio” encontradas en la población analizada.
Dentro de las manifestaciones cutáneas “no criterio” se encontraron: LR en 19 pacientes (25.0%), y úlceras isquémicas y necrosis cutáneas en 1 paciente (1.3%) cada una.
En cuanto a las manifestaciones cardiopulmonares “no criterio”, se halló HAP e insuficiencia valvular en 2 pacientes (2.6 %) cada manifestación y miocardiopatía y estenosis valvular en 1 paciente (1.3 %) cada una.
En la esfera neurológica “no criterio”, 6 pacientes (7.7%) presentaron migraña, seguido por deterioro cognitivo en 4 (5.1%) y demencia, epilepsia y neuritis óptica en 1 paciente (1.3%) cada uno. No se presentaron casos de mielitis ni corea.
Entre las manifestaciones hematológicas “no criterio”, la trombocitopenia fue la más frecuente en 18 pacientes (23.4%), seguida de leucopenia en 3 pacientes (3.9 %). La trombocitopenia se presentó en el 10.0 % en los SAF primarios y en el 44.8 % en los SAF secundarios a LES No se encontró en la casuística pacientes con anemia hemolítica.
Cuarenta y ocho (61.5%) pacientes se presentaron con artralgias como única manifestación osteoarticular y 3 (3.8%) con microangiopatía renal.
La presencia de al menos un evento trombótico presentó asociación con el IL (p 0.005), el IgM (p 0.009), AcL IgG medio alto (p 0.021), anti B2GP1 IgG (p 0.023) y con triple positividad de anticuerpos (p 0.001).
La trombosis venosa presentó asociación significativa con el IL (p 0.006) y la triple positividad de anticuerpos (p 0.008). Las TVP de miembros inferiores, mostraron asociación con AcL IgM (p 0.007), con IL (p 0.047) y con triple positividad de anticuerpos (p 0.001). El tromboembolismo pulmonar (TEP) se asoció en formasignificativa con la triple positividad de anticuerpos (p 0.041). Con respecto a las trombosis arteriales, se observó asociación entre infarto agudo de miocardio y anti B2GP1 IgG (p 0.056).
En cuanto a la manifestaciones “no criterio”, hubo asociación estadística entre compromiso cutáneo y anti B2GP1 IgM (p 0.024), particularmente entre LR y B2GP1 IgM (p 0.010).
En referencia al resto de las manifestaciones no clasificatorias, la trombocitopenia presentó asociación significativa con al menos un evento trombótico (p 0.007).
La trombocitopenia fue más frecuente en el grupo de SAF secundario a LES en comparación al grupo de SAF primario, con una diferencia estadísticamente significativa (p 0.003).
Discusión
El SAF ha sido un tema de investigación continua a lo largo del tiempo. En ese sentido, dada las dificultades y controversias en los criterios clasificatorios, es difícil homogeneizar las poblaciones para su investigación.
En este trabajo, más de la mitad de los casos fueron SAF secundarios, siendo él LES la enfermedad asociada con mayor frecuencia. Las manifestaciones trombóticas fueron las más frecuentes, dentro de estas la TVP de miembros inferiores, seguidas del infarto cerebrovascular e infarto agudo de miocardio.
Las complicaciones obstétricas por orden fueron muerte fetal, restricción del crecimiento intrauterino, preeclampsia y eclampsia.
Las manifestaciones “no criterio” se presentaron en forma aislada en el presente estudio en 12.8 % de los casos. En un estudio colombiano de 100 pacientes los autores concluyeron que un alto porcentaje de pacientes portadores de SAF presentaron manifestaciones no incluidas en los criterios clasificatorios, con frecuencia similar a la descrita en el presente estudio. (24
En la población analizada, las manifestaciones “no criterio” más observadas fueron las artralgias, LR, trombocitopenia y migraña. Estos hallazgos son similares a los hallados en una revisión colombiana de 40 artículos que encontraron la trombocitopenia como manifestación hematológica predominante y entre las manifestaciones neurológicas: migraña, epilepsia, demencia, además de otras graves como corea y mielitis. (24
Las artralgias fueron el hallazgo más prevalente dentro de las manifestaciones “no criterio”, posiblemente vinculado al contexto de enfermedad autoinmune sistémica.
La LR es uno de los signos frecuentes del SAF. En esta cohorte fue hallada en casi la cuarta parte de los casos, similar al estudio del grupo francés de 200 pacientes (7. Es conocida su relación con determinados perfiles inmunológicos y en particular la asociación con la presencia de AcL. En una cohorte colombiana de 32 pacientes se demostró asociación para AcL tipo IgG y manifestaciones cutáneas 25. La LR se ha correlacionado retrospectivamente con AcL y trombosis arterial, pero no con anti B2GP1, trombosis venosa o morbilidad del embarazo. Sin embargo, en el estudio realizado se encontró una asociación significativa entre LR y la presencia de anti B2GP1, así como también una asociación significativa entre manifestaciones cutáneas en general con anti B2GP1 26.
La trombocitopenia es la manifestación hematológica “no criterio” más frecuente en la población estudiada, en casi la cuarta parte de los casos, coincidiendo con la literatura internacional. La frecuencia en el grupo de SAF secundario a LES fue 44.8 %, mientras que en el grupo de SAF primario fue 10% (p 0.003). Este hallazgo es consistente entre los diferentes estudios, tal como en la cohorte multinacional dirigida por el grupo APS ACTION (AntiPhospholipid Syndrome Alliance for Clinical Trials and InternatiOnal Networking), donde se documentó trombocitopenia hasta un 20 a 40 % de los pacientes con LES. La incidencia de trombocitopenia en los SAF secundario a LES es alta sobre todo en aquellos pacientes con títulos altos de de AcL e IL, especialmente con la positividad de este último 27.
En el presente estudio se observó una asociación estadísticamente significativa entre trombocitopenia y al menos un evento trombótico. En un estudio de 138 pacientes con aFL positivos y trombocitopenia, pero sin criterios clínicos clasificatorios los autores encontraron un alto riesgo para el desarrollo de futuras trombosis en comparación con los pacientes que presentaban recuento de plaquetas normales. (28
En las distintas series se observó además asociaciones significativas entre trombocitopenia y engrosamiento de válvulas cardiacas, epilepsia, corea, artritis, LR y úlceras de piel. Por este motivo, la trombocitopenia podría considerarse un eventual factor de riesgo para el desarrollo de otras manifestaciones asociadas al SAF como las cardíacas, neurológicas y cutáneas, que no fueron encontradas en la serie actual. (28
La frecuencia de trombocitopenia hallada y la referida en la literatura, permite sugerir que podría reconsiderarse su inclusión como criterio clasificatorio.
La cefalea fue la manifestación neurológica más frecuente. Es un síntoma prevalente en los pacientes con SAF como se demostró en la cohorte europea de 1000 pacientes. (1 Sin embargo, la asociación de cefalea y SAF es controversial, con resultados muy variados según las diferentes series. La dificultad en demostrar si hay una verdadera asociación radica en la alta prevalencia de cefalea en la población general y la relativa baja frecuencia de aFL positivos en la misma. (1
La asociación de migrañas y SAF puede ser un predictor de isquemia arterial a forma de accidente cerebrovascular. Una revisión de 162 pacientes con accidente cerebrovascular identificó 10 pacientes con aFL positivos de los cuales 6 habían experimentado una larga historia de migraña. (29
El deterioro cognitivo y la demencia se reportaron en segundo lugar, pero con menor frecuencia que en la literatura internacional. En reiterados estudios de pacientes con y sin LES, se ha demostrado una relación entre deterioro cognitivo y presencia de AcL. La prevalencia global de deterioro cognitivo puede alcanzar el 42% entre los pacientes con criterios clasificatorios de SAF (30).
Los 3 casos de microangiopatía renal fueron hallazgos de biopsias renales en el contexto de nefropatía lúpica, sin una pesquisa dirigida al SAF. El compromiso renal es una complicación bien conocida tanto en el SAF primario como secundario asociado a LES. Sin embargo, es aún incierto si solo las presencias de los aFL están implicados en el desarrollo de la microangiopatía renal o si existen otros factores que sean responsables del proceso inflamatorio - trombótico 31
Dada la prevalencia de manifestaciones “no criterio” aisladas descritas en este estudio y en las distintas series revisadas, se concluye que es importante considerarlas para el planteo diagnóstico, así como para la solicitud de pruebas de laboratorio confirmatorias y la toma de decisiones terapéuticas 32
En la actualidad se encuentran en revisión la inclusión de algunas manifestaciones en los nuevos criterios de clasificación del SAF 33).
El presente trabajo tiene limitaciones, como el sesgo de información por el diseño retrospectivo. Por ejemplo, no se realizó el estudio sistemático con ecocardiograma transtorácico en búsqueda de engrosamiento valvular, que fue un hallazgo frecuente en otras cohortes. En segundo lugar, la falta de estandarización internacional en los resultados de laboratorio pudo influir en la interpretación de los resultados. La técnica de ELISA es la técnica gold standard para la determinación de anticuerpos que permite que los resultados a lo largo de la duración del estudio sean comparables. La automatización de la técnica en los últimos años contribuyó a disminuir la variabilidad entre los laboratorios En tercer lugar, el tamaño pequeño de la muestra probablemente pudo contribuir a que manifestaciones muy poco frecuentes no hayan sido encontradas, si bien el estudio se realizó en una población asistida en una policlínica de referencia a nivel nacional. En cuarto lugar, la asociación enter LR y la variedad IgM de la beta2 glicoproteína una, sin una asociación específica con los títulos podría sobreestimar la asociación observada. Finalmente, en el trabajo se incluyeron pacientes con sospecha de SAF, lo cual podría sobreestimar la frecuencia de los eventos observados.
Dentro de las fortalezas se destaca que en Uruguay no se dispone de estudios similares, por lo que el presente constituye un punto de partida para investigaciones futuras.
Conclusiones
Las manifestaciones “no criterio” del SAF se presentaron con una frecuencia similar a series internacionales. Han adquirido importancia en los últimos años, lo que permite sugerir su posible inclusión dentro de los criterios clasificatorios. Sin perjuicio de lo anterior, es importante que el clínico observe estas manifestaciones y tenga presente esta asociación en el razonamiento diagnóstico. Existe una importante asociación entre algunos fenotipos clínicos y ciertos perfiles serológicos que podrán ser el inicio de nuevas investigaciones.