Introducción
El embarazo es un estado asociado con profundos cambios en el sistema hemostático determinando un estado de hipercoagulabilidad relacionado con un aumento en generación de trombina, y como tal, un factor de riesgo bien establecido de Enfermedad Tromboembólica Venosa 1.
La Enfermedad Tromboembólica Venosa (ETEV) comprende dos fenómenos que son manifestaciones clínicas del mismo proceso fisiopatológico: la trombosis venosa profunda y el tromboembolismo pulmonar 2. Constituye la principal causa de mortalidad materna en los países desarrollados, superando a otras causas bien establecidas como la hemorragia obstétrica y los estados hipertensivos del embarazo 3-5.
Las técnicas existentes para la evaluación de la hemostasis en el laboratorio clínico carecen de la sensibilidad suficiente para detectar estados de hipercoagulabilidad. Es por esto que los cambios que se suceden durante la gestación generando el estado protrombótico, cuyo objetivo fisiológico es preparar a la mujer gestante para la hemorragia del parto, no se ven reflejados en los test de coagulación utilizados de manera estándar tales como el tiempo de protrombina (TP) y el tiempo parcial de tromboplastina activado (TTPa) (6.
El tiempo de protrombina, monitoriza la vía del factor tisular y la vía común de coagulación. El tiempo de tromboplastina parcial activado, monitoriza la vía de contacto y la vía común 7,8. Ni el TP, ni TTPa evalúan la fibrinólisis 9,10.
Bajo condiciones experimentales, el test de generación de trombina puede aportar información en situaciones de hipercoagulabilidad 11. Se trata de una técnica que evalúa el balance entre las fuerzas pro y anticoagulantes y ofrece un enfoque global para la comprensión de la cascada de la coagulación 12. Constituye una evaluación directa de la coagulabilidad del plasma 13 al medir la capacidad del mismo de producir trombina en función del tiempo en ausencia o presencia de plaquetas. Es capaz de evidenciar la influencia de factores anti y procoagulantes endógenos y farmacológicos en la producción de trombina 11.
Si bien la ETEV constituye una importante causa de morbimortalidad materna, el riesgo absoluto de ETEV en el embarazo y puerperio es bajo, por lo que se requiere alguna forma de estratificación de riesgo para determinar en qué mujeres se justifica la tromboprofilaxis farmacológica (14.
El embarazo determina, además de los cambios en el sistema de la coagulación propiamente dichos, alteraciones en los otros dos pilares de la tríada de Virchow: estasis venosa dada por la acción conjunta del factor hormonal sobre las paredes venosas y la compresión por el útero grávido, y la lesión vascular determinando daño endotelial que se presenta en el momento del nacimiento, siendo el parto instrumentado y en mayor medida la cesárea los causantes del mismo 15,16.
El riesgo de ETEV se distribuye uniformemente a lo largo de los tres trimestres del embarazo siendo el periodo de mayor riesgo las primeras 6 semanas posparto donde aumenta 20 veces. Alrededor del 80% de los eventos se producen en las primeras 3 semanas posparto, probablemente vinculado al traumatismo vascular del nacimiento. Dada la mayor injuria quirúrgica, la cesárea implica un riesgo entre cinco y nueve veces superior al parto vaginal 17-19.
Existen guías internacionales avaladas por múltiples estudios y revisiones Cochrane en vistas a la indicación de tromboprofilaxis farmacológica, basadas en su mayoría en la identificación de factores de riesgo clínicos de las pacientes y de la gestación y situación obstétrica 19,20.
Contar con un examen paraclínico que refleja este aumento del riesgo seria de interés como herramienta adicional para identificar pacientes en riesgo de eventos tromboembólicos que se beneficiarían de la tromboprofilaxis farmacológica.
El objetivo de este ensayo es cuantificar y comparar la generación de trombina entre los puerperios de pacientes en las que se realizó parto vaginal y cesárea buscando valorar si esta última se identifica como un evento asociado a mayor generación de trombina en nuestra población.
Metodología
Estudio analítico observacional prospectivo. Las muestras se obtuvieron de pacientes atendidas en el Hospital Pereira Rossell (Montevideo, Uruguay), desde octubre de 2018 a agosto del 2019.
Los criterios de inclusión fueron: mujeres mayores de 18 años, con embarazo a término y producto vivo, sin patologías obstétricas (estados hipertensivos del embarazo, ETEV en este embarazo o previos, síndrome antifosfolipídico, trombofilia) ni médicas (cardiopatías, hipertensión, obesidad mórbida, fumadora) que se encontraban cursando puerperio de 24 a 48hs.
Dentro de las causas de cesárea se incluyeron: por elección materna, macrosómico, presentación podálica, trabajo de parto detenido, sospecha de hipoxia fetal.
Se incluyó las pacientes que aceptaron participar del estudio y firmaron un consentimiento informado.
Los criterios de exclusión fueron las mujeres que presentaban algunas de las patologías obstétricas o médicas descritas o no consintieron a participar.
La muestra de sangre se obtuvo por punción venosa directa. Como anticoagulante se utilizó un quelante de calcio, el citrato sódico a una concentración de 3,2%, en una proporción 9:1 con respecto a la sangre. Se realizó una doble centrifugación (primero de sangre entera y luego del plasma citratado) durante 10 minutos a 3000 rpm, para obtener un plasma pobre en plaquetas (menos de 5000/mm3).
El potencial endógeno de trombina (PET) se midió en plasma pobre en plaquetas usando un ensayo comercialmente disponible (Innovance® ETP, Siemens Healthcare Diagnostics GmbH, Marburg, Alemania). El ensayo de medición del potencial endógeno de trombina se realizó en el analizador de coagulación BCS® XP automatizado (Siemens Healthcare Diagnostics GmbH, Marburg, Alemania). La activación de la coagulación se inició por incubación de plasma con reactivo Dade®Innovin® (factor tisular recombinante humano y fosfolípidos) y cloruro de calcio en ausencia de trombomodulina.
Los valores de referencia se obtuvieron de la literatura internacional 21. El test de generación de trombina se realizó en el Laboratorio de Análisis Clínicos del Hospital de Clínicas.
Las variables cuantitativas fueron: la concentración máxima de generación de trombina y la calculada (ETPB CMAX y ETPB CMAX CAL respectivamente) que refleja la fase de propagación de la coagulación; el área bajo la curva del potencial endógeno de trombina y el calculado (ETP AUC2 ME y ETP AUC2 CAL respectivamente) que representa la cantidad total de trombina activa formada, la edad de la paciente y el número de gestación. Las mismas se resumen mediante medidas de tendencia central, y medidas de dispersión.
Las variables cualitativas fueron las vías de finalización del embarazo, las cuales se resumieron mediante frecuencias absolutas y relativas.
En el Hospital Pereira Rossell se produjeron 6275 nacimientos en el año 2017, de los cuales el 27.9% fueron por cesárea. Teniendo en cuenta el número de nacimientos anual y extrapolando la prevalencia de ETEV en el embarazo desde estudios internacionales de un 5%; con una significación del 95% una imprecisión de 0,02, valorando una proporción de pérdida de vista de 15%, el tamaño muestral sería de 368 pacientes, conformado por 103 cesáreas y 265 partos. Se calcularon los intervalos de confianza al 95 % de las estimaciones correspondientes.
Las variables cualitativas se compararon con el test chi cuadrado. Se contrastó la normalidad de las variables con el Test de Kolmogorov Smirnov. La comparación de las variables cuantitativas se realizó mediante el test de t Student. Se utilizó una significación de 0,05 en los contrastes de hipótesis. El análisis de los datos se realizó mediante el Software R 3.2.2.
Este estudio fue aprobado por el Comité de Ética del Hospital de Clínicas y del Centro Hospitalario Pereira Rossell.
Resultados
Se analizaron 220 embarazadas, 70 conformaron el grupo de cesáreas (C) y las restantes 150 el grupo de parto (P). El n es menor al calculado ya que el presente trabajo expone los resultados preliminares. Se continúa el reclutamiento para alcanzar el total calculado.
En la tabla 1 se describen las características de las embarazadas respecto a la edad y el Índice de Masa Corporal (IMC).
Tabla 1: Características de las embarazadas respecto a edad y IMC de cada uno de los grupos de estudio. Abreviatura- IMC: índice masa corporal, C: cesárea, P: parto, DS: desvío standar
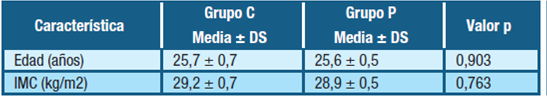
La edad promedio del grupo C fue de 25,7 ± 0,7 años con un mínimo y un máximo en 16,0 y 41,0 años respectivamente. La edad promedio del grupo P fue de 25,6 ± 0,5 años con un mínimo y un máximo en 15,0 y 43,0 años respectivamente. No encontrándose diferencias estadísticamente significativas para la edad entre ambos grupos, valor p = 0,903.
El índice de masa corporal (IMC) promedio, teniendo en cuenta el peso de la embarazada al momento de la extracción de sangre, del grupo C fue de 29,2 ± 0,7 kg/m2 con un mínimo y un máximo en 19,0 y 47,1 respectivamente. El IMC promedio del grupo P fue de 28,9 ± 0,5 kg/m2 con un mínimo y un máximo en 18,9 y 42,3 respectivamente. No encontrándose diferencias estadísticamente significativas para el IMC entre ambos grupos valor p = 0,763.
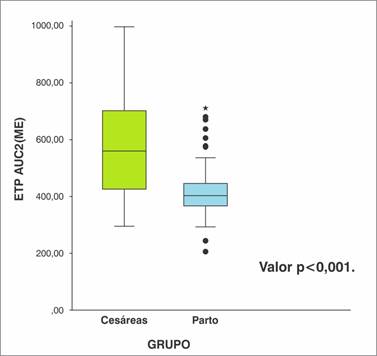
El ETP AUC2 (ME) para el grupo C presentó un promedio de 577,72 ± 20,75 con mínimo y máximo en 297,90 y 995,80 respectivamente. Siendo estadísticamente menor en el grupo P con 419,35 ± 8,02 con mínimo y máximo en 208,30 y 714,00 respectivamente, valor p < 0,001.
En la Gráfica 1 se presenta la distribución ETP AUC2 (ME) en cesáreas y partos. Se observa que en el grupo C el percentil 25 (p25) correspondió a 427.3, el p50 o mediana a 561.3 y el percentil 75 a 703.5, en el grupo P los valores fueron 367.2, 403.6 y 447.2 respectivamente.
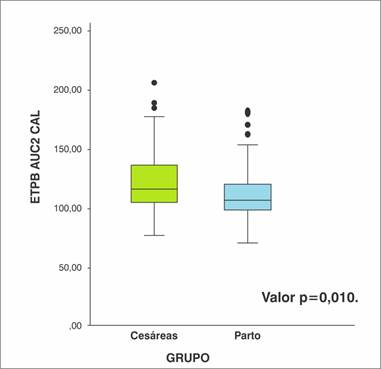
El ETPB AUC2 CAL para el grupo C presentó un promedio de 122,78 ± 3,24 con mínimo y máximo en 76,00 y 206,00 respectivamente. Siendo estadísticamente menor en el grupo P con 113,25 ± 2,02 con mínimo y máximo en 70,00 y 183,00 respectivamente, valor p = 0,010.
En la Gráfica 2 se presenta el ETPB AUC2 CAL en cesáreas y partos. Se observa que en el grupo C el percentil 25 (p25) correspondió a 103.95, el p50 o mediana a 115.6 y el percentil 75 a 135.98, en el grupo P los valores fueron 98.0, 106.0 y 120.5 respectivamente
El ETPB CMAX para el grupo C presentó un promedio de 117,21 ± 3,54 con mínimo y máximo en 11,70 y 234,50 respectivamente. En el grupo P fue de 113,02 ± 1,42 con mínimo y máximo en 70,90 y 157,40 respectivamente, no encontrándose diferencias estadísticamente significativas entre ambos grupos, valor p = 0,197.
El ETPB CAL para el grupo C presentó un promedio de 117,14 ± 2,89 con mínimo y máximo en 81,00 y 216,00 respectivamente. En el grupo P fue de 114,86 ± 1,35 con mínimo y máximo en 83,00 y 160,00 respectivamente, no encontrándose diferencias estadísticamente significativas entre ambos grupos, valor p = 0,419.
Discusión
El embarazo se asocia con cambios significativos en todos los aspectos de la hemostasis determinando cambios protrombóticos que se anticipan al riesgo de sangrado que supondrá la separación placentaria. Rosenkrantz et al en 2008 encontraron la existencia de un estado hipercoagulante en mujeres embarazadas mediante el uso del ensayo de generación de trombina y constataron un aumento de este a medida que progresaba la edad gestacional 22.
Esto marca alguna discrepancia con los hallazgos de Joly y cols en 2013 que encontraron un aumento del potencial de generación de trombina en el embarazo, si bien a diferencia de otros biomarcadores de estado hipercoagulante como el fibrinógeno, los D dimeros y los complejos trombina-antitrombina, este aumentaría en el comienzo de la gestación y se mantendría estable en los subsecuentes trimestres 21.
Recientemente Batsho Mandlebe y cols publicaron un estudio donde realizaron medición de dimeros D y potencial de generación de trombina en embarazadas obesas y no obesas durante el embarazo y en el puerperio. Respecto al potencial de generación de trombina ellos concluyen que no encontraron grandes diferencias en el valor de estos parámetros en diferentes momentos del embarazo y puerperio, además no evidenciaron diferencias entre los grupos obesas y no obesas 23. Por lo tanto, la obesidad no actuaría como una variante confundente en nuestro grupo de pacientes.
La capacidad aumentada de generar trombina, la resistencia adquirida a la proteína C y la activación de la coagulación suponen una ventaja al prevenir la hemorragia materna excesiva 13, pero a su vez pueden manifestarse clínicamente en el aumento en las tasas de ETEV ya mencionadas. Los estudios de valoración global de la coagulación, tales como la tromboelastometria y el estudio del potencial de generación de trombina podrían constituirse en herramientas útiles para evaluar la hipercoagulabilidad asociada con la gestación 24.
Existe evidencia de que la vía de finalización del embarazo influye de manera importante sobre el riesgo de enfermedad tromboembólica, presentando las cesáreas de coordinación un aumento al doble en el riesgo con respecto al parto vaginal, y la cesárea de emergencia otro aumento al doble con respecto a la cesárea electiva 24.
En esta misma línea, el presente estudio plantea evaluar el potencial generador de trombina como una herramienta adicional para estimar ese riesgo.
Las poblaciones analizadas en ambos grupos son similares en cuanto a la edad y el IMC por lo que son comparables. Si bien aún restan reclutar pacientes para que la muestra sea representativa de la población obstétrica que se atiende en el HPR anualmente, con las muestras analizadas hasta el momento, observamos una diferencia estadísticamente significativa cuando comparamos los parámetros de ETP AUC2 (ME), ETPB AUC2 CAL entre los dos grupos, partos vs cesárea, siendo menor para partos. Estos hallazgos se encuentran alineados con lo establecido ampliamente en la literatura con respecto a la mayor hipercoagulabilidad y por ende riesgo de enfermedad tromboembólica luego del nacimiento por cesárea.
Contrastan por otro lado con lo encontrado por Guimicheva y cols en su trabajo de enero 2020 24, en el cual tras analizar muestras provenientes de 99 pacientes con factores de riesgo clínico para ETEV, no encontraron diferencias significativas en la generación de trombina vinculada a la vía del nacimiento. Es posible que esta diferencia en los resultados se deba a las características de las poblaciones estudiadas, al no tener nuestra población marcados factores de riesgo clínicos para ETEV previos al nacimiento, por lo que los cambios protrombóticos producto de la injuria endotelial pudieran ser más evidentes.
Por otro lado, al comparar los parámetros ETPB CMAX, ETPB CAL en el número de muestras que contamos, no se encontraron diferencias estadísticamente significativas.
Como limitaciones del presente estudio detectamos algunas falencias en las variables analizadas: no diferenciamos las cesáreas de coordinación de las de urgencia/emergencia, sabiendo que la cesárea de urgencia/emergencia es considerada un factor de riesgo mayor para ETEV respecto a la de coordinación. En lo que se refiere a las pacientes que tuvieron parto no discriminamos aquellos donde se realizó episiotomía o desgarros, los cuales son generadores de mayor daño tisular y por lo tanto pueden presentar mayor probabilidad de ETEV. Se deberá considerar el análisis más preciso de estas variables en próximas investigaciones.
Conclusiones
Con los datos obtenidos hasta la fecha podemos concluir que las pacientes a las que se les realizó cesárea presentan un ETP AUC2 (ME), ETPB AUC2 CAL (representativos de la cantidad total de trombina formada) significativamente mayor que las pacientes que tuvieron parto vaginal, por lo que decimos que en la población de estudio la cesárea se identificó como un evento generador de trombina probablemente asociado al mayor daño endotelial que la misma produce.