Introducción
La esclerosis sistémica (ES) es una enfermedad autoinmune sistémica compleja, caracterizada por la presencia de fibrosis, vasculopatía de pequeño vaso y compromiso inflamatorio de órganos internos en un contexto de autoinmunidad. Desde el punto de vista fisiopatológico se caracteriza por remodelación de la matriz extracelular, reparación con fibrosis, inflamación, daño microvascular e hipoxia tisular 1,2.
El tratamiento de la ES es particularmente complejo debido a que es una enfermedad con manifestaciones clínicas heterogéneas, con una base patogénica y evolución muy variable de unos pacientes a otros y las opciones terapéuticas suelen ser no curativas (3. El uso de los fármacos inmunosupresores en esta enfermedad ha ido creciendo con el correr de los años en la medida que los trabajos publicados fueron documentando su beneficio. Se ha postulado que inflamación y fibrosis corren en paralelo, por lo que la reducción de la primera podría enlentecer el desarrollo de la segunda.
Como en otras enfermedades autoinmunes sistémicas, el desafío consiste en inducir la remisión o los menores niveles de actividad posibles, de manera rápida y sostenida en el tiempo. Esta remisión debe lograrse de manera precoz y con la menor cantidad de efectos adversos, de forma tal de provocar el menor impacto posible en la calidad de vida del paciente. En general, el tratamiento de la enfermedad consiste en el manejo de las complicaciones de los órganos involucrados 1-3.
Las afecciones que suelen determinar el uso de inmunosupresores son las manifestaciones cutáneas, con la finalidad de evitar o enlentecer la progresión de la rigidez cutánea y las manifestaciones intersticiales pulmonares, con el fin de enlentecer el deterioro de la función pulmonar. El compromiso respiratorio intersticial, la hipertensión arterial pulmonar y el daño cardiovascular se asocian con aumento de la mortalidad en esta enfermedad. La caída de la capacidad vital forzada es de mal pronóstico, relacionándose con aumento de la mortalidad 4.
El tratamiento de las manifestaciones cutáneas en la ES difiere de acuerdo con el síntoma que predomine, pasando desde la esclerosis cutánea establecida hasta la calcinosis cutis, así como el prurito y las telangiectasias. Ningún tratamiento ha demostrado ser curativo y se plantea que el posible beneficio depende del tiempo de inicio de los síntomas y de cuán precoz se realice la introducción de los fármacos. Las alternativas terapéuticas clásicas y también de primera línea para el compromiso cutáneo, son metotrexate (MTX), micofenolato mofetilo (MMF) y ciclofosfamida (CFM) para los casos refractarios 5,6.
A partir del Sclerodema Lung Study II (SLSII) del año 2016, se sugirió un beneficio de micofenolato mofetilo (MMF) para el tratamiento del compromiso pulmonar intersticial (EPI) respecto a la CFM. No obstante, esta última continúa siendo un pilar terapéutico en los casos graves y refractarios, en particular para el tratamiento de inducción a la remisión. En cambio, para el mantenimiento de la remisión, la azatioprina no ha perdido vigencia, si bien el uso de MMF viene ganando terreno 7.
El tratamiento de la ES ha sido objeto de intensa investigación en los últimos años. Se ha intentado abordar el componente inflamatorio, el fibrótico y el vascular. En relación con el primero, se han ensayado inmunosupresores de síntesis química como los mencionados y terapias biológicas. En este último aspecto conviene señalar al menos dos moléculas, Rituximab y Tocilizumab 8,9.
Rituximab (RTX) es un anticuerpo monoclonal quimérico dirigido contra el marcador linfocitario CD-20. El grupo de investigación en esclerodermia de la liga europea contra el reumatismo, denominado EUSTAR ha sugerido un beneficio del RTX tanto en la estabilización de las pruebas de función pulmonar como de la rigidez cutánea.
Recientemente se ha publicado un metaanálisis que analizó la respuesta al tratamiento con RXT en 575 pacientes -83 % de sexo femenino- incluidas en 20 artículos, con una media de edad de 48,8 años, una duración media de la enfermedad de 5,74 años y predominio de formas difusas de la enfermedad. En este metaanálisis se evidencia que a 6 meses existe una mejoría no significativa en la capacidad vital forzada (CVF) y un ascenso estadísticamente significativo, pero clínicamente modesto, de la capacidad de difusión de monóxido de carbono (DLCO) del orden del 3,5%. A 12 meses el impacto es mayor, puesto que se aprecian mejoras estadísticamente significativas tanto en la DLCO como en la CVF. Este beneficio se constata también al comparar con los grupos control a 12 meses en la CVF. Es de destacar que también se observó una mejoría en la rigidez cutánea a 12 meses cuantificada mediante la escala de Rodnan modificada. Los efectos adversos fueron fundamentalmente infecciones respiratorias y reactivación de herpes zóster en pacientes que recibían concomitantemente glucocorticoides. Es de destacar, si bien se toman los recaudos metodológicos necesarios para disminuir los sesgos, este metaanálisis incluye estudios relativamente heterogéneos en cuanto a los tratamientos concomitantes y presentaciones clínicas. Los resultados son alentadores, pero no definitivos 10-13.
Tocilizumab (TCZ) es un anticuerpo monoclonal dirigido contra la interleuquina 6 (IL-6). Se ha postulado que la elevación de este mediador inflamatorio se relaciona con la rigidez cutánea. En un estudio de fase II a 24 semanas se observó una disminución de la rigidez cutánea en el grupo que había recibido TCZ respecto a tratamiento estándar, pero no se alcanzó la significación estadística. Posteriormente se realizó un estudio de fase III a 48 semanas, que incluyó 105 pacientes en la rama TCZ y 107 en la rama placebo. El estudio no alcanzó la significación estadística en lo que respecta a la disminución de la velocidad de progresión de la rigidez cutánea. Sin embargo, se observó un enlentecimiento en la caída de la función pulmonar, que era una variable respuesta secundaria (endpoint secundario). Se trata de resultados promisorios en relación a la preservación de la función pulmonar, pero nuevamente no categóricos 14,15.
Por último, el tratamiento de la fibrosis pulmonar también ha sido objeto de intensa investigación. En el año 2019 se publicó el estudio SENSCIS (seguridad y eficacia de Nintedanib en la Esclerosis Sistémica). Nintedanib es un inhibidor intracelular de la tirosín-quinasa que está aprobado para el tratamiento de la fibrosis pulmonar idiopática. Se trató de un estudio multicéntrico que aleatorizó pacientes con enfermedad intersticial pulmonar confirmada por tomografía de alta resolución, con al menos 10% de fibrosis y con CVF de un 40% y DLCO entre 30-89% del esperado respectivamente. La media de edad fue 54 años, la mitad de los pacientes incluidos presentaron forma difusa y la otra mitad limitada de la ES. El estudio consistió en administrar Nintedanib 150 mg cada 12 horas en la rama intervención (288 pacientes) comparado contra tratamiento estándar (287 pacientes). La variable principal de respuesta fue la tasa de descenso de la CVF a 52 semanas (1 año) de seguimiento. En dicho plazo se objetivó un descenso medio de 50,7 ml en la rama intervención respecto a 95,1 ml en la rama placebo (diferencia 41 ml/año, p=0.04). No hubo diferencias significativas en otras variables secundarias, como la rigidez cutánea o la calidad de vida. En la rama Nintedanib hubo mayor discontinuación del tratamiento por efectos adversos (16 vs. 8,7%). El efecto adverso más frecuente fue la diarrea, reportado en 75% de los pacientes que recibieron el medicamento. También se observó elevación de las enzimas hepáticas en mayor proporción en el grupo Nintedanib (4,9% vs. 0,7%) 16,17.
Por lo tanto, el abordaje terapéutico en general y el tratamiento inmunosupresor en particular continúan siendo un desafío en esta enfermedad, debiendo individualizarse los esquemas terapéuticos para cada paciente.
El objetivo de este trabajo consiste en describir los usos y respuesta terapéutica a los inmunosupresores (IS) en una cohorte de pacientes con ES asistidos en 2 Unidades de Enfermedades Autoinmunes Sistémicas.
Metodología
Se identificaron de nuestros registros los pacientes con ES clasificados según los criterios de EULAR ACR 2013 18, asistidos en dos unidades de Enfermedades Autoinmunes Sistémicas de Montevideo entre enero de 2018 y enero de 2019. Se incluyeron sólo los que recibieron tratamiento IS.
Las variables consideradas fueron: sexo, edad, motivo de inmunosupresión. La respuesta terapéutica en los pacientes con afección respiratoria se evaluó mediante la difusión de monóxido de carbono (DLCO) y la capacidad vital forzada (CVF) pretratamiento (T0) y 6-12 meses postratamiento (T1). El grado de descenso de la CVF se la clasificó en: a) severa: menor que49% del esperado; b) moderada: 50-64% del esperado; leve: mayor que65% del esperado. El grado de descenso de la DLCO se clasificó en: a) levemente descendida: 80-70% del esperado; b) moderadamente descendida: 69 - 50% del esperado; c) severamente descendida: menor o igual de 49% del esperado.
Se revisaron las historias clínicas de los pacientes según formulario precodificado.
Las variables cuantitativas se presentan con mediana y rango intercuartílico (RIC).
Las variables cualitativas se presentan mediante frecuencias absoluta y relativa.
Para la comparación de las variables se emplearon pruebas no paramétricas (distribución no normal) para variables continuas y test de Chi cuadrado para variables categóricas. Se consideró un nivel de significación estadística menor a 0.05. Los datos y gráficos se procesaron en el programa informático SPSS.
El trabajo se desarrolló de acuerdo con la Declaración de Helsinki de la Asociación Médica Mundial en su última enmienda, así como con las recomendaciones del Consejo de Organizaciones Internacionales de Ciencias Médicas de la Organización Mundial de la Salud del año 2016 (CIOMS-2016) 19,20. Se obtuvo autorización de las Direcciones Técnicas de cada institución participante. Los datos de los participantes fueron tratados con absoluta confidencialidad.
Resultados
Se incluyeron 20 pacientes, de los cuales 17 (85%) fueron de sexo femenino. La mediana de edad fue de 64.5 (40-87) años. El motivo de inmunosupresión fue respiratorio en 12 de 20 pacientes (60%) y cutáneo-articular en 8 de 20 (40%).
Recibieron tratamiento de inducción 9 de 12 de los pacientes con compromiso respiratorio y 1 de 8 de los pacientes con compromiso cutáneo-articular, pmenor que0.05. En efecto, es más frecuente el uso de tratamiento de inducción en casos de compromiso respiratorio que articular.
El tratamiento de inducción terapéutica en 1de 9 casos respiratorios se realizó con CFM y en 8 de 9 restantes se realizó con MMF. El único caso con compromiso cutáneo-articular recibió inducción con CFM.
En 7 de 12 de los pacientes con compromiso respiratorio al tratamiento de inducción se asoció un ciclo de pulsos de metilprednisolona (MTP) endovenosa. La dosis acumulada fue menor a 1,5 gramos en cada ciclo.
El tratamiento de mantenimiento de los casos respiratorios se realizó en base a AZA en 5 de 12 y con MMF en 7 de 12.
El tratamiento de mantenimiento en el compromiso cutáneo-articular se realizó en base a AZA en 2 de 8 y MTX en 6 de 8.
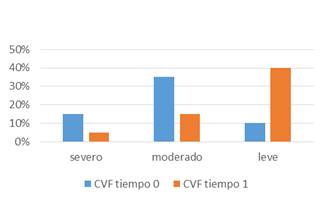
La CVF en T0 estaba descendida en forma severa en 3 de 12 pacientes, moderada en 7 de 12 y leve en 2 de 12. La CVF en T1 se encontraba descendida en forma leve en 8 de 12, moderada en 3 de 12 y severa 1 de 12, p menor que 0.05 (Gráfico 1, Tabla 1). Por lo tanto, se verifica una respuesta terapéutica favorable, evidenciando en T1 una mayor proporción de pacientes con CVF disminuida en grado leve y moderado que en T0 (previo al inicio del tratamiento inmunosupresor).
La DLCO en T0 se presentó levemente descendida en 2 de 12, moderadamente descendida en 5 de 12 y severamente descendida en 5 de 12. Por su parte la DLCO en T1 se encontraba severamente disminuida en 1 de 12, moderadamente descendida en 3 de 12 y levemente descendida en 8 de 12, pmenor que 0.05 (Gráfico 2, Tabla2).
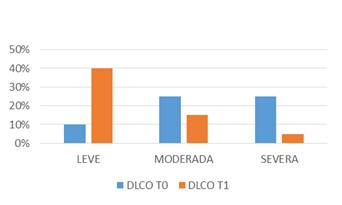
Gráfico 2: Difusión de monóxido de carbono (DLCO) pre-tratamiento (tiempo 0) y post-tratamiento (tiempo 1)
Discusión
Nuestras observaciones son concordantes con las recomendaciones. En efecto, en el compromiso intersticial respiratorio debe realizare un tratamiento de inducción y de mantenimiento enérgico para intentar enlentecer la progresión del daño pulmonar. Al mismo tiempo, el tratamiento precoz y oportuno del compromiso cutáneo podría detener la progresión de la rigidez cutánea 1,21.
En la actualidad no hay evidencia científica sobre la efectividad a largo plazo de ninguno de los fármacos que empleamos para intentar minimizar el depósito cutáneo de fibras de colágeno. No se recomienda el uso de tratamiento sistémico cuando el endurecimiento de la piel se limita a la zona distal de las extremidades, con o sin afección facial. Sin embargo, se puede considerar su uso en pacientes con sospecha de esclerodermia difusa precoz, y rigidez progresiva de la piel. Para ello se recomienda controlar periódicamente al paciente mediante la escala cutánea modificada de Rodnan. En este sentido, el tratamiento puede ser favorable en la fase precoz e inflamatoria, y muy poco eficaz en la fase tardía, con fibrosis y atrofia. Se recomienda iniciar el tratamiento antes de que la esclerosis cutánea alcance el pico máximo, que en la mayoría de los casos ocurre entre los 24 y 36 meses 21,22.
Los pacientes con esclerosis cutánea que progresan rápidamente en sentido proximal, en particular los que tienen anticuerpos anti-topoisomerasa I (en nuestro medio anti-Scl70), deberán ser evaluados por eventual compromiso pulmonar puesto que puede coexistir. Se ha sugerido no utilizar MTX en pacientes con este perfil clínico e inmunológico debido al riesgo potencial de este fármaco de desarrollar complicaciones respiratorias. Se trata de un tema de debate, en particular en el tratamiento de la Artritis Reumatoide (AR), más allá de lo cual MTX es de primera elección en la AR y en la ES con esclerosis cutánea progresiva artritis y o miositis. En línea con estas recomendaciones, en nuestro trabajo MTX fue el fármaco más utilizado para el tratamiento de mantenimiento de los pacientes con compromiso cutáneo-articular, seguido de AZA en menor medida. Se trata de un fármaco seguro, accesible y con amplia experiencia de uso en nuestro medio 4,23.
Por su parte, la CFM es un inmunosupresor que ha demostrado ser efectivo en el tratamiento de la ES. Uno de los estudios más significativos fue el Sclerodema Lung Study I (SLS I) que incluyó 145 pacientes con ES y compromiso cutáneo y afección pulmonar concomitante. Los pacientes recibieron CFM por vía oral durante 12 meses o placebo. El estudio evidenció una mejora significativa en las pruebas de función pulmonar y en la rigidez cutánea. Pero esta mejora sólo se constató en los pacientes con ES difusa respecto al grupo placebo durante el período de tratamiento. Esta diferencia respecto al grupo placebo desapareció a los pocos meses de la finalización del tratamiento con CFM, por lo que su uso quedó acotado a aquellos pacientes refractarios a otros tratamientos previos o con afección de otros órganos. En nuestro trabajo hubo un único paciente con compromiso cutáneo-articular que recibió inducción con CFM siguiendo posteriormente con MTX como tratamiento de mantenimiento 24 - 26.
En nuestra serie se evidencia una razonable mejora de las pruebas de función pulmonar. Es probable que el tiempo de observación reducido magnifique este efecto que luego posiblemente se reducirá. En el mismo sentido, el tipo de muestreo (no probabilístico) hace que sea probable cierto sesgo de selección, habiendo tratado a los que tenían más chance de respuesta y en consecuencia menor compromiso fibrótico.
No obstante, el tratamiento se muestra efectivo a corto plazo, lo cual redunda muy probablemente en una mejora en la calidad de vida de los pacientes.
Otro medicamento que ha aumentado su uso en el tratamiento de esta enfermedad es MMF. Se trata de un inmunosupresor efectivo, con buena tolerabilidad y aceptable perfil de seguridad. Algunos estudios iniciales ya evidenciaban el beneficio de este fármaco en el compromiso cutáneo con mejoras variables en la escala de Rodnan modificada. El SLS II fue un estudio prospectivo doble ciego que incluyó 106 pacientes que fueron aleatorizados a recibir MMF vía oral por 24 meses o CFM vía oral durante 12 meses seguido de placebo los 12 meses siguientes. Se observó que el tratamiento con MMF 3000 mg/d por 24 meses fue comparable a la rama CFM por vía oral, en lo que respecta al control de la esclerosis cutánea y en la estabilización de las pruebas de función pulmonar, aunque con menos efectos adversos y una mayor durabilidad de los cambios producidos 7. Posteriormente, otros trabajos apoyan el beneficio relativo de MMF en la mejora de la esclerosis cutánea, así como en el enlentecimiento en la caída de la CVF y la DLCO en los pacientes con compromiso pulmonar intersticial. La mayoría de los pacientes de nuestro estudio con compromiso pulmonar recibieron inducción con MMF y continuaron con este fármaco como tratamiento de mantenimiento. Sólo 5 pacientes recibieron AZA como tratamiento de mantenimiento, lo cual evidencia que continúa siendo un fármaco alternativo frente a la no disponibilidad o intolerancia al MMF 27-29.
Por último, y como mencionamos más arriba, es necesario recordar el uso cada vez más frecuente de fármacos biológicos en el tratamiento de la afección pulmonar intersticial vinculada a la ES. Por el momento, Rituximab sigue siendo el tratamiento con resultados más interesantes en detener la progresión del deterioro de las pruebas de función respiratoria. Próximamente se conocerán los resultados del estudio RECITAL, que empleó RTX vs. CFM de primera línea en el compromiso intersticial pulmonar de ES, síndrome antisintetasa y enfermedad mixta del tejido conjuntivo (30).
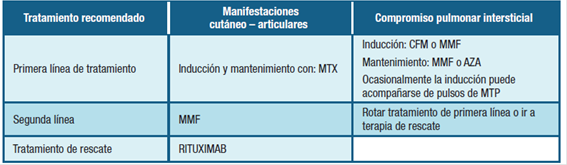
En nuestro trabajo no tuvimos pacientes tratados con RTX por compromiso respiratorio ni cutáneo puesto que su uso en nuestro medio está limitado a otras indicaciones y el acceso a este tratamiento es restringido. La tabla 3 presenta un esquema de los tratamientos habitualmente empleados en nuestro medio, tanto en primera como en segunda línea, como en circunstancias de refractariedad a los tratamientos previos, en las cuales recurrimos a terapias de rescate.
Nuestro trabajo tiene debilidades, derivadas de un análisis de una serie de casos pequeña y de una experiencia limitada. Sin embargo, permite observar el uso de tratamiento inmunosupresor en pacientes con ES. Lo reducido de la muestra, el breve período de seguimiento y el diseño del estudio no permite comparar tratamientos.
Conclusiones
Es necesario enfatizar el tratamiento precoz y enérgico del compromiso intersticial respiratorio y de la rigidez cutánea rápidamente progresiva. Esto requiere pesquisar rápidamente estas complicaciones. Estos tratamientos, correctamente indicados y controlados en grupos especializados son, por el momento, una herramienta casi única en el tratamiento de esta desafiante enfermedad.