Introducción
El Síndrome Antifosfolipídico (SAF), descrito por Hughes, Harris y Gharavi en 1986 es la trombofilia adquirida más frecuente1. Puede ser primario (idiopático) o secundario (en el 95% de los casos a Lupus Eritematoso Sistémico (LES)).
El Síndrome antifosfolipídico obstétrico puede ser causa de importante morbilidad al binomio materno-fetal: trombosis materna, restricción del crecimiento fetal (RCF), abortos recurrentes, complicaciones fetales, entre otros.
La importancia en el conocimiento de esta patología radica en la posibilidad de prevención de las complicaciones con los tratamientos disponibles.
Aún hay puntos controversiales y dificultades con respecto al SAF Obstétrico. Es difícil definir la relación causa-efecto dada la patogenia multifactorial que presenta. Se plantea que algunos efectos en relación con los factores de la coagulación (factores protrombóticos), los efectos contra la Anexina V y activación del complemento actúan como factores etiológicos en la falla de implantación y pérdida recurrente de embarazo (PRE), sin embargo la determinación de muchos de estos factores no están integrados en la práctica clínica habitual. Se discute también el potencial trombogénico de los diferentes anticuerpos en relación a la clínica así como la presencia de anticuerpos antifosfolipídicos (AAF) en mujeres sanas. Por otra parte siempre deben excluirse otras causas de mala historia obstétrica en relación a mal control de enfermedades co-existentes como hipertensión arterial (HTA), enfermedad renal crónica, LES, diabetes e hipotioridismo, entre otras.
Los criterios incluidos como resultados adversos del embarazo potencialmente relacionado al SAF se han definido de diferentes formas por los distintos investigadores, esto ha contribuido a resultados conflictivos en los diferentes estudios. Con la intención de solucionar este problema en 2006 la sociedad internacional de hemostasis y trombosis propone los criterios que definen las morbilidades del embarazo vinculadas al SAF que se enumeran a continuación2:
1) Pérdida fetal tardía (PFT): Mayor o igual a 1 muerte fetal inexplicada ≥ 10 semanas de gestación, con morfología normal por ecografía prenatal o examen directo post-natal. La asociación entre pérdida fetal tardía y SAF se fundamenta en gran parte por estudios retrospectivos. En algunos estudios de pérdida fetal mayor a 10 semanas, ocurre con mayor proporción en mujeres con AAF que en mujeres sin AAF (50 % versus 15% respectivamente)3. Además, más del 80% de las mujeres con AAF tenían al menos una muerte fetal, comparado con menos del 25% de las mujeres sin AAF (p < 001). Existe además una correlación entre los niveles de Ac anticardiolipina (aCL) IgG y el riesgo de pérdida fetal4. Como hemos mencionado previamente, la mayoría de los pacientes con SAF secundarios están vinculados a enfermedades autoinmunes (en su mayoría secundario a LES). Sin embargo, el riesgo de pérdida fetal parece ser independiente, al menos en parte de la enfermedad autoinmune subyacente. En una revisión de 10 estudios que incluyen 554 mujeres con LES, la pérdida fetal era más común en aquellos con AAF (38 a 59% con AAF versus 16 a 20% sin AAF), en aquellas con inhibidor lúpico (IL) (36% con IL versus 13% sin IL) y con aCL (39% con aCL versus 18 % sin aCL)5.
2)Pérdida recurrente de embarazo (PRE): Mayor o igual a 3 pérdidas de embarazos < a 10 semanas de gestación, consecutivas no explicadas por causas anatómicas, hormonales o alteraciones cromosómicas maternas o paternas. La asociación entre pérdida recurrente de embarazo y SAF se basa en su gran mayoría en estudios descriptivos. La mayoría reportan consistentemente que los AAF se detectan en una alta proporción de mujeres con PRE en comparación con los controles (mayor a 20% versus menor del 5%)6-14. Uno de estos estudios, tenía como objetivo determinar la prevalencia del IL y aCL en mujeres con historia de pérdida de embarazo en el primer trimestre. De 243 pacientes 47% tenían historia de 2 abortos y 53 % tenían historia de 3 o más abortos. De las 243 mujeres investigadas, 16.8% tenían resultados patológicos de IL y aCL. En mujeres con historia de 2 abortos, 15% tenían valores patológicos de aCL o IL; comparados con 18.5% de aquellas con 3 o más abortos (no habían diferencias significativas)12. En el estudio de casos y control de Parazzini que evalúa la asociación entre aCL, IL y el riesgo de recurrencia de abortos espontáneo. De 220 mujeres con dos o más abortos espontáneos consecutivos y 193 controles, IL era detectado en 16 de 220 casos (7% IC 95% entre 4-11%) pero en ninguno de los controles13. Niveles mayores de aCL eran demostrados en 19 de 99 casos (19% IC 95% entre 12-31%) y 4 pacientes en los controles (3%). Debe tenerse en cuenta que muchos de los estudios citados no tenían como referencia los niveles de anticuerpos tomados como positivos actualmente (véase: criterios de laboratorio).
3) Parto pretérmino: Mayor o igual a 1 parto pretérmino antes de las 34 semanas, con recién nacido morfológicamente normal, secundario a preeclampsia (Pre-E) severa, eclampsia o características consistentes con insuficiencia placentaria. Se aceptan como insuficiencia placentaria: a) test anormal de valoración de vitalidad fetal (ejemplo NST) sugestivos de hipoxia fetal; b) Doppler placentario anormal (por ejemplo ausencia de flujo diastólico en arteria umbilical) sugestivos de hipoxia fetal, c) oligohidramnios; d) Recién nacido con peso menor al percentil 10 para la edad gestacional, o restricción del crecimiento fetal. Dos revisiones sistemáticas han reportado asociación significativa entre el desarrollo de preeclampsia y aCL y posiblemente IL15,16. En una de las revisiones se incluyeron 12 estudios en el metanalisis; el OR para asociación de aCL con preeclampsia era 2.86 (IC 95% 1.37-5.98) mientras que el OR de aCL con preeclampsia severa era de 11.15 (IC 95% 2.66-46.75). Se concluye en dicho estudio que niveles moderados a altamente elevados de aCL se asocia con preeclampsia16. En la segunda revisión sistemática, el OR para aCL era de 2,73 (IC 95% 1.65-4.51) y para IL 1.45 (IC 95% 0.70-4.61)15. Entre los pacientes con SAF, la frecuencia de RCF era del 30% que era significativamente más alto que en la población general (tasa de RCF en la población general: 10%)17.
4) Enfermedad tromboembólica: Durante el embarazo y el puerperio existe un aumento del riesgo de enfermedad tromboembólica y este riesgo es aún más alto en pacientes con SAF. En estudios prospectivos el riesgo de ETEV durante el embarazo y puerperio era de 12% al 5% entre mujeres con SAF conocido (comparado con 0,025 a 0,10% en la población obstétrica general)17,18. La trombosis venosa es más frecuente que la trombosis arterial. En consecuencia, las mujeres con trombosis asociada a SAF puede tener altas tasas complicaciones en el embarazo y complicaciones fetales que aquellas que sólo tiene complicaciones obstétricas asociadas a SAF 19,20.
¿Cuándo debemos solicitar los AAF?
Deben solicitarse los AAF en mujeres con historia de trombosis arterial o venosa inexplicada y nueva trombosis arterial o venosa durante el embarazo.
Las indicaciones obstétricas para valorar la presencia de AAF incluyen historia de una pérdida fetal tardía y PRE 21. Aunque el comité de expertos (Practice Bulletin The American College of Obstetricians and Gynecologists, 2012) hace referencia a que el parto pretérmino por pre eclampsia e insuficiencia placentaria son criterios clínicos de SAF; actualmente existen datos insuficientes para recomendar el screening en mujeres con estas condiciones dado la pobre evidencia de que los tratamiento actualmente disponibles para estas condiciones mejoren los resultados obstétricos. Esta recomendación es controversial dado que algunos autores aconsejan solicitar los AAF en estas condiciones. Otras manifestaciones asociadas al SAF, como anemia hemolítica, trombocitopenia inmune, amaurosis fugaz, livedo reticularis y LES no son consideradas criterios diagnóstico de SAF por lo que la solicitud de los AAF debe individualizarse y no se aconseja su pedido en la presencia aislada de estas condiciones 22. La solicitud de AAF en pacientes con manifestaciones no vinculadas claramente a SAF puede llevar a situaciones de difícil interpretación y manejo.
Definición de SAF Obstétrico
Se define SAF Obstétrico según los criterios de Sapporo 1999 y revisados en Sydney 2006 (Miyakis et al), debiendo estar presente 1 criterio clínico más 1 de laboratorio 2,23.
Criterios clínicos: Uno o más episodios de trombosis venosa, arterial y/o de pequeño vaso (imagen o evidencia histológica) en cualquier órgano o tejido y/o morbilidad del embarazo: una o más muertes fetales > 10 semanas de feto morfológicamente normal; uno o más pretérminos < 34 semanas secundario a Pre-E severa o Eclampsia (de acuerdo a la definición estándar) o insuficiencia placentaria (RCF <menor a percentil 10 por ecografía), oligohidramnios, hipoxemia fetal sugeridos por ecografía doppler o nonstress Test (NST), de fetos morfológicamente normales; tres o más abortos espontáneos consecutivos inexplicados < de 10 semanas (excluidas otras causas: cromosómicas maternas o paternas, y anatómicas o endocrinas maternas).
Criterios de laboratorio: presencia de AAF en dos o más ocasiones, con una diferencia de 12 semanas como mínimo, según criterios de la Sociedad Internacional de Trombosis y Hemostasis (ISTH): ACA isotipos IgG o IgM > de 40U GPL o MPL o > de percentil 99. Anti ß2 GPI (anti beta 2 glicoproteína I) IgG o IgM >percentil 99. IL positivo.
El punto de corte y el requisito de dos o más determinaciones es importante para descartar falsos positivos, los cuales pueden ser a bajo título y transitorios vinculados a fármacos e infecciones entre otras causas. No es necesario realizar estudio confirmatorio a las 12 semanas en caso de ser negativos. El estudio de otros anticuerpos que pueden estar presentes en el SAF pero su incidencia es menos frecuentes y de dudosa sensibilidad y especificidad (anti Anexina V, anti fosfatidilinositol y anti protrombina) aún no han sido avalados, si bien están en desarrollo importantes estudios de investigación 24.
Tratamiento
El objetivo terapéutico es prevenir complicaciones (morbi-mortalidad) materno-fetal (trombosis maternas y prevenir complicaciones obstétricas). El tratamiento siempre debe ser individualizado según cada caso particular.
A los efectos prácticos, parece lógico razonar cada paciente según las siguientes consideraciones: aquellas pacientes con historia previa de eventos trombóticos y las pacientes sin historia de trombosis previa o actual.
a) SAF trombótico (criterio de laboratorio asociado a trombosis previa)
En este caso en general son pacientes que vienen recibiendo anticoagulación oral (ACO) previo al embarazo. Según las guías del ACCP 2012 21, se sugiere anticoagulación con heparinas de bajo peso molecular (HBPM) a dosis ajustadas al peso materno del inicio del embarazo (o dosis terapéuticas). Las mujeres que reciben ACO deben recibir consejo sobre el potencial riesgo teratogénico de la warfarina, por lo tanto las mujeres con warfarina o anticoagulantes orales de acción directa deben planificarse el cambio a HBPM durante el período de la concepción o una vez quede embarazada antes de las 6 semanas de edad gestacional. La warfarina puede reiniciarse en el postparto.
Se recomienda además asociar dosis bajas de Ácido acetilsalicílico (AAS) (80-100 mg día) a los efectos de disminuir el riesgo de Pre-E desde la semana 12 hasta el parto.
b) SAF trombótico (criterio de laboratorio asociado a trombosis aguda/actual)
Para las pacientes que desarrollan una trombosis durante el embarazo y presenta AAF positivos, según los criterios diagnósticos referidos previamente, debe iniciarse HBPM a dosis ajustadas asociada a AAS a dosis bajas. En cuanto a la anticoagulación se recomienda continuar al menos 6 semanas post parto y como mínimo 3 meses desde el evento trombótico21. Debe valorarse en cada caso anticoagulación en forma indefinida para las pacientes que cumplen los criterios de SAF. Las consideraciones del uso de warfarina en el post parto son las mismas que en el punto anterior. La AAS se mantiene hasta el parto. En otras revisiones se aborda el tratamiento de la enfermedad tromboembólica venosa en el período grávido-puerperal.
c) SAF obstétrico por pérdida fetal tardía o PRE
Se sugiere la combinación de dosis bajas de AAS (80 a 100 mg día) comenzando desde la concepción, y dosis profilácticas de heparina luego de confirmar el embarazo intrauterino. El AAS se mantiene hasta el parto y la HBPM hasta 6 semanas del puerperio para prevención de trombosis materna.
Un metanálisis publicado que incluyó 10 estudios (627 pacientes) que tenían como objetivo valorar los resultados terapéuticos en relación a la PRE y SAF; evidenció que en tres estudios el uso de AAS sola no mostraba una reducción significativa de la pérdida de embarazo (RR 1.05, IC 95% 0.66 y 1.68). El uso de heparina combinada con AAS (dos estudios, 140 pacientes) reducía significativamente la pérdida de embarazo (RR 0.46 IC 95% 0.29-0.71) mientras que el uso de AAS y prednisona resulta en un importante incremento de la prematurez (RR 4.83, IC 2.85-8.21) sin una reducción significativa en la reducción de la pérdida de embarazo (RR 0.85, IC 95% 0.53.1.36)25.
En este estudio se concluye que las pacientes con PRE y anticuerpos antifosfolipidos el uso de heparina y AAS puede reducir la pérdida de embarazo en un 54%25. Se ha reportado que en pacientes con pérdida de embarazo en el 1º trimestre, el uso de heparina y AAS puede reducir el riesgo (OR 0.39, IC 95% 0.24-0.65) e incrementar el número de recién nacidos vivos (RR 1.3, IC 1.04-1.63)26,27. Sin embargo, se debe tener en cuenta varias limitaciones de los estudios, muchos con un número pequeño de pacientes, los tratamientos no eran aleatorizados adecuadamente e incluso los resultados de pacientes que salieron del estudio, y que presentaron efectos adversos no estaban disponibles.
d) SAF obstétrico por parto pretérmino, debido a insuficiencia placentaria
Se sugiere dosis bajas de AAS (80 a 100 mg día) e iniciando a las 12 y a las 28 semanas y continuar hasta el parto 21,22. Algunos autores recomiendan profilaxis con heparina y AAS en caso de fallas con AAS para pacientes que muestran a nivel placentario inflamación decidual, vasculopatía o trombosis, aunque esta recomendación no se basa en ensayos clínicos controlados.
e) Mujeres con AAF sin criterio clínico de SAF
Hay pocos datos que guíen el manejo de las embarazadas sin complicaciones con la presencia de AAF aislados y que por lo tanto no cumplen los criterios de SAF antes mencionados. Más del 50% de tales mujeres tienen embarazos sin complicaciones sin mediar ningún tratamiento farmacológico28,29. Las opciones terapéuticas incluyen: no tratamiento farmacológico, AAS a dosis bajas, heparina profiláctica y AAS a dosis bajas. Algunos autores están a favor de AAS a dosis bajas únicamente, sin embargo en 2015 se publica una revisión sistemática de 154 embarazadas en las que se utilizaba profilaxis primaria para prevenir complicaciones obstétricas de mujeres asintomáticas con ACA en la que no encontró beneficios del uso de AAS30,31.
Otros tratamientos
Aproximadamente un 20 a 30% de las pacientes tratadas con el tratamiento estándar (HBPM+ AAS) presentan complicaciones obstétricas. El tratamiento de este grupo de pacientes, refractarias al tratamiento estándar es objeto de debate32.
Se ha ensayado el uso de Hidroxicloroquina (HCQ), con resultados interesantes, aunque aún no concluyentes. HCQ tiene efecto antitrombótico y anti-inflamatorio, su uso es eficaz y seguro durante el embarazo de pacientes con LES, tanto para la madre como para el feto. El tratamiento con HCQ puede ofrecer también una protección adicional frente a las pérdidas fetales, dado su efecto protector sobre la anexina V placentaria, imprescindible para evitar las trombosis a dicho nivel. Más allá de reportes de casos exitosamente tratados con HCQ, en donde había fallado el tratamiento con HBPM + AAS se están llevando a cabo estudios prospectivos. El estudio multicéntrico “Hypatia”, en curso, incluyó pacientes con AAF. Los pacientes fueron tratados con el tratamiento estándar más HCQ. Es de destacar que no se trata de pacientes en los cuales haya fallado el tratamiento estándar ni de alto riesgo (triple positivos o positivos para inhibidor lúpico). Por su parte, existen series retrospectivas en las cuales el tratamiento con HCQ 400 mg, mostró beneficios adicionales al tratamiento estándar de HBPM + AAS. Si bien existen estudios en curso, aún no hay evidencia concluyente para recomendar su uso en casos de refractariedad de SAF obstétrico. Sin embargo, dada la seguridad del medicamento, podría considerarse su uso en casos de refractariedad33-36.
También se han reportado beneficios con el uso de Pravastatina, una estatina hidrosoluble con prácticamente nula transferencia placentaria, en pacientes con historia de insuficiencia placentaria37.
Una publicación del grupo del St. Thomas’ Hospital exploró el uso de prednisona en dosis no superiores a 10 mg/día, desde el diagnóstico del embarazo hasta la semana 14 de la gestación, en combinación con Aspirina y HBPM en pacientes con SAF obstétrico que habían tenido malos resultados obstétricos con terapia estándar. La tasa de pérdida fetal cayó de 30 % a 9%, resultando en 60% de recién nacidos vivos y en una mejoría de los resultados obstétricos en estas pacientes. Si bien estos resultados son interesantes, no son concluyentes para establecer una recomendación de uso, más aun teniendo en cuenta su conocido perfil de efectos adversos38.
Por último, el uso de Inmunoglobulina se ha probado en el SAF obstétrico refractario, pero hoy en día no existe evidencia que avale su uso con un razonable perfil de eficacia y seguridad39.
Recomendaciones
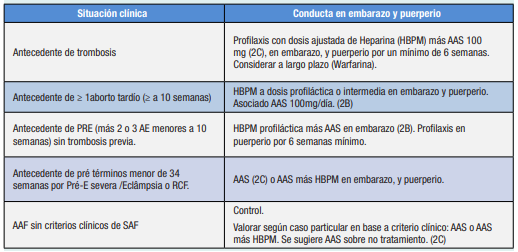
En la Tabla 1 se presentan las recomendaciones.
Las manifestaciones obstétricas vinculadas al SAF se definen como:
1) Mayor o igual a 1 muerte fetal mayor a 10 semanas de gestación con feto morfológicamente normal, con ultrasonido prenatal o examen morfológico postnatal.
2) Mayor o igual a 1 parto pretérmino de un recién nacido normal antes de las 34 semanas debido a Pre-E severa, eclampsia o hallazgos consistentes con insuficiencia placentaria.
3) Mayor o igual a 3 pérdidas fetales menores a 10 semanas de gestación, espontáneas y consecutivas, luego de excluir causas anatómicas, hormonales o cromosómicas.
1- SAF trombótico, dado por criterios de laboratorio e historia de trombosis arterial o venosa, tienen riesgo de recurrencia por lo que habitualmente son tratadas con warfarina en forma indefinida, por lo que deben recibir HBPM a dosis de anticoagulación durante la gestación y reiniciar la warfarina en el posparto (grado de evidencia 2C).
2-SAF Obstétrico, dado por mala historia obstétrica y laboratorio positivo, se recomienda el uso de HBPM y AAS a dosis bajas sobre HBPM sólo (grado de evidencia 2B). En caso de Pérdida fetal tardía o PRE se sugiere dosis bajas de AAS (50 a 100mg día) y dosis profilácticas de HMBP, sobre AAS sólo (grado de evidencia 2B) y continuar este régimen por 6 semanas postparto. En caso de mujeres con ≥ 1 parto pretérmino de un recién nacido normal antes de las 34 semanas, debido a preeclampsia severa, eclampsia o hallazgos consistentes con insuficiencia placentaria se sugiere dosis bajas de AAS. (grado de evidencia 2C). Algunos autores realizan AAS y HBPM en casos de fallo de AAS y en situaciones en que el examen placentario muestre extensa inflamación decidual o vasculopatía o trombosis sin embargo esta conducta no se ha validado mediante ensayos clínicos.
3-Hallazgo incidental de AAF, que no cumplen criterios de SAF, algunos autores sugieren dosis bajas de AAS sobre no tratamiento (grado de evidencia 2C).
Situaciones clínicas particulares
a) Fertilización in vitro en pacientes con AAF sin criterios clínicos de SAF
No existe evidencia de buena calidad que sugiera que las pacientes con AAF sin criterios de SAF/SAF obstétrico que van a ser sometidas a fertilización in viro (FIV) se beneficien de realizar terapia profiláctica40.
Sin embargo, algunos estudios han encontrado un riesgo aumentado de enfermedad tromboembólica venosa (ETEV) durante el primer trimestre en pacientes que se realizaron FIV. Un estudio publicado en el 2013 evidencia un riesgo de embolia pulmonar en primer trimestre (en pacientes con AAF negativos y sin síndrome de hiperestimulación ovárica) 3 cada 10000 vs 0,4 cada 10000 (HR 6.97, 95% CI 2.21 - 21.96) de las que se embarazaron en forma espontánea41. Dada que la evidencia es de baja calidad y conflictiva, la decisión de realizar tromboprofilaxis durante el período de estimulación debe estar basada en el riesgo individual de cada paciente.
En el grupo de pacientes AAF positivos sin criterio clínico de SAF, las opciones terapéuticas durante el embarazo deben considerarse también en forma individual.
Las opciones terapéuticas más utilizadas van desde no tratamiento, tratamiento con AAS 100 mg o AAS 100 mg más HBPM a dosis de tromboprofilaxis. La presencia de AAF por sí solos, no parece afectar negativamente la tasa de éxito de la FIV42,43.
b) Fertilización in vitro en pacientes con SAF
La experiencia en este grupo es extremadamente limitada. La FIV es potencialmente riesgosa en estas pacientes ya que los regímenes de inducción de la ovulación desencadenan un estado protrombótico inducido por estrógenos. En las mujeres con SAF asociado a trombosis previa, se recomienda pasar de su anticoagulante oral habitual a una dosis terapéutica de HBPM que debe mantenerse hasta después de la recuperación de ovocitos. Si no se logra el embarazo, se sugiere mantener la HBPM a través de ciclos repetidos de FIV o volver a anticoagulación oral (en caso de recibirlos) o suspender la anticoagulación si no se planean más ciclos.
La mayoría de las complicaciones trombóticas observadas ocurrieron en ciclos que incluían agonistas GnRH para inducir la ovulación. La utilización de protocolos que incluyan antagonistas GnRH o ciclos naturales disminuye los riesgos de trombosis44.
c) SAF catastrófico obstétrico
El Síndrome antifosfolipídico catastrófico (en adelante CAPS, por su sigla en inglés) es una variante del SAF, de mayor gravedad y rápida progresión. La descripción inicial fue realizada por Asherson et al.45 hace ya más de 20 años. Se caracteriza por la presencia de una serie de fenómenos tromboembólicos sucesivos (tres o más) graves, separados por un breve período de tiempo, comprometiendo característicamente la microvasculatura.
En el año 2003 se establecieron los criterios clasificatorios preliminares, ratificados en 2104, cuya vigencia se mantiene hasta hoy (Tabla 2), definiendo dos grupos de pacientes, aquellos que cumplen la totalidad de los criterios, que son clasificados como CAPS “definido” y aquellos que no cumplen la totalidad, que son clasificados como CAPS “probable”. Nótese que se trata de criterios clasificatorios, cuya presencia puede no coincidir con la gravedad del paciente. Por lo tanto, como suele ocurrir, los criterios clasificatorios no sustituyen al criterio clínico45.
Tabla 2: Criterios clasificatorios para Síndrome Antifosfolipídico Catastrófico (CAPS) (Asherson et al)

De acuerdo con datos del “CAPS registry”, 70% de los casos ocurre en pacientes de sexo femenino y la media de edad de ocurrencia es 38 años. El CAPS ocurre en el 1% de los pacientes con SAF, siendo el embarazo un factor desencadenante identificado en 8% de los casos. Puede ocurrir en pacientes con SAF conocido, pero se ha estimado que puede debutar en el embarazo hasta en la mitad de los casos. Otros desencadenantes descritos son las infecciones graves, las cirugías mayores, el cáncer y el uso de anticonceptivos. Más de la mitad de los casos son primarios, 1/3 están relacionados con Lupus Eritematoso Sistémico y un 15% de los pacientes presentan este cuadro grave como primera manifestación del SAF46.
Además de la presencia de fenómenos trombóticos y AAF, se destaca que dos tercios de los casos presentan trombocitopenia y la presencia de anticuerpos anti-DNA es relativamente frecuente (hasta 1/3 de los casos). De igual modo, pueden observarse esquistocitos, enzimas hepáticas y creatinina elevada, proteinuria y hematuria. Estos hallazgos obligan a descartar otros cuadros clínicos asociados con el embarazo, todos ellos pasibles de presentarse con trombocitopenia y anemia hemolítica microangiopática, como síndrome de Pre-E severa, síndrome urémico-hemolítico, síndrome HELLP, púrpura trombocitopénico trombótico, hígado agudo graso del embarazo47.
El tratamiento del CAPS está basado en evidencia débil, más aún para el caso del CAPS obstétrico. Se acepta que estas pacientes deben recibir una “triple terapia”, con anticoagulantes a dosis terapéuticas, preferentemente heparina no fraccionada intravenosa; glucocorticoides (terapia en pulso con Metilprednisolona) e inmunoglobulinas (0.4 g/kg/día por 3 a 5 días) o plasmaféresis (2-3 litros/día por 3 a 5 días). Además, dada la gravedad del cuadro, las pacientes requerirán tratamiento de soporte de las funciones vitales. Conceptualmente debe tratarse el agente desencadenante, si se identifica. En el caso de la gestación, la interrupción de la gestación debe plantearse en gestaciones mayores a 34 semanas. A menor edad gestacional puede plantearse esperar 24-48 horas la respuesta al tratamiento, controlando estrechamente la salud materna y fetal 45,48.
Se han ensayado otros tratamientos para el CAPS, pero aún no se ha establecido su eficacia, menos aún durante la gestación. Tal es el caso de Hidroxicloroquina, Rituximab y Eculizumab48,49.