Introducción
El embarazo y el puerperio son situaciones asociadas fisiológicamente con un marcado aumento del riesgo de Enfermedad Tromboembólica Venosa (TEV), con una prevalencia estimada de 1 en 1600 1-4. La embolia pulmonar constituye la principal causa de muerte en países desarrollados probablemente en relación a una identificación subóptima de pacientes con riesgo aumentado que se beneficiarían de tromboprofilaxis; baja sospecha por la frecuente superposición de síntomas con los propios del embarazo y el temor del uso de ciertas técnicas diagnósticas por su eventual riesgo sobre el feto 5.
Durante el período grávido puerperal se conjugan los 3 pilares de la tríada de Virchow: hipercoagulabilidad, estasis venosa y daño endotelial. Lo que explica que durante el embarazo el riesgo de TEV se estime entre 7 a 10 veces superior que en mujeres de igual edad y que sea 15-35 veces superior que la población control durante el puerperio y hasta la sexta semana post-parto 6-9.
80% de los eventos trombóticos en este período son venosos y 20% son arteriales. De los eventos trombóticos venosos, 80% de los casos se presentan a forma de Trombosis Venosa Profunda (TVP) y el 20% restante como embolia pulmonar (EP); de estos, el 50% ocurren durante el embarazo y el resto en el postparto.
Durante la gestación, las TVP son más frecuentemente proximales, masivas y en el miembro inferior izquierdo 6,10. La trombosis de las venas pélvicas representa el 10-12% del total de las TVP en el embarazo y la trombosis en extremidades superiores el 2%. Esta última forma de presentación se observa con mayor frecuencia en pacientes sometidas a técnicas de reproducción asistida. El riesgo de TEV durante el embarazo es similar en los 3 trimestres 3,4,10.
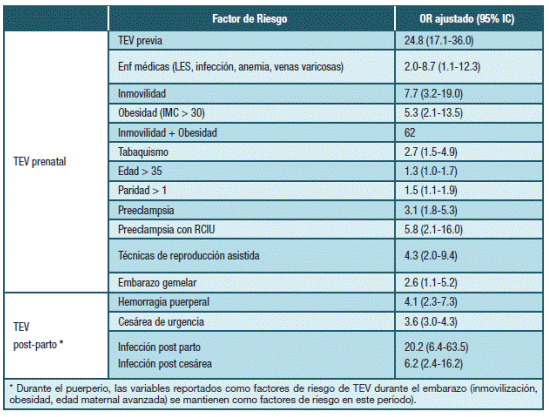
Al estado de hipercoagulabilidad propio del embarazo en ocasiones se suman otros factores de riesgo que aumentan aún más la probabilidad de presentar esta complicación, siendo el más importante el antecedente de TEV previa. El riesgo relativo de diferentes factores de riesgo adicional surge de registros y estudios de caso control y se muestra en la Tabla 1 8,11-13)
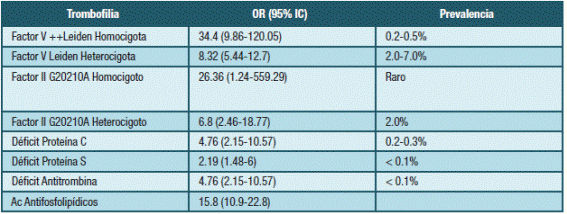
Las trombofilias ocupan un lugar relevante como factores de riesgo de TEV durante el período grávido-puerperal. Se ha reportado que aproximadamente 50% de las pacientes con esta complicación serán portadores de algún tipo de trombofilia; Hereditaria (TH) o Adquirida (TA) 4,14-16. El riesgo de TEV durante el embarazo según tipo de trombofilia e incidencia global se muestran en la Tabla 2.
Diagnóstico
Se requiere un alto nivel de sospecha y un adecuado conocimiento de los factores de riesgo asociados a la hipercoagulabilidad inherente al período grávido-puerperal para lograr un diagnóstico objetivo y precoz que reduzca las posibilidades de complicaciones en las mujeres embarazadas y puérperas.
Varios de los signos y síntomas de la TEV pueden confundirse con los derivados de ciertos cambios fisiológicos del embarazo como edema de miembros inferiores, taquicardia o disnea. Debe tenerse en cuenta que dado que las TVP pueden ser ilíacas, los síntomas pueden ser atípicos como dolor aislado a nivel inguinal, glúteo, flanco o abdomen. Cabe recordar que 30% de los EP asocian TVP silente y el 40% de TVP sintomáticas se acompañan de EP silente.
Es fundamental por tanto la identificación de parámetros que permitan establecer la probabilidad clínica de TEV, teniendo en cuenta que los scores utilizados frecuentemente a estos efectos no se encuentran validados en la población de mujeres embarazadas y puérperas.
En esta población, la herramienta utilizada con mayor frecuencia para la evaluación de la probabilidad clínica constituye la regla LEFt, surgida del resultado de la investigación de Chan WS y col y validada posteriormente por Le Moigne E y col (17,18. Este score considera los siguientes factores como predictores de TVP: edema en pierna izquierda con ≥ 2 cm diferencia en la circunferencia de pantorrilla y presentación en el primer trimestre. El valor predictivo negativo (VPN) para TVP durante el embarazo es 100% (95.8% - 100%) en ausencia de estas 3 variables. A pesar del alto VPN, este score necesita validación en un grupo mayor de pacientes 17,18.
Con respecto a las técnicas diagnósticas, se describen a continuación riesgos y beneficios de las mismas durante el embarazo. En el puerperio se podrán aplicar las técnicas habituales en pacientes no embarazadas.
Técnicas de confirmación diagnóstica de trombosis venosa profunda.
a) Ecodoppler venoso
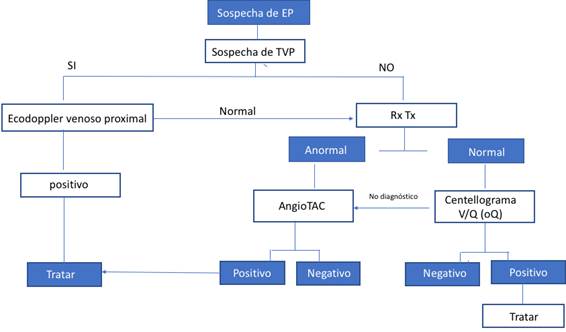
El ecodoppler del sistema venoso proximal se considera el test diagnóstico de primera línea para la confirmación de TVP durante el embarazo. Si el ecodoppler inicial demuestra anomalías en la compresibilidad y el flujo de las venas poplíteas y femorales compatibles con trombosis, se establece el diagnóstico de TVP y debe iniciarse tratamiento anticoagulante. Un resultado normal en una paciente con alta probabilidad clínica de TVP no debe excluir este diagnóstico dada la baja sensibilidad de esta técnica para la detección de TVP del sector venoso distal. En estos casos se recomienda la repetición de este estudio en los siguientes 3 y 7 días 19-22. Cuando este estudio es persistentemente normal su VPN es elevado 20.
b) Venografía por Resonancia Nuclear Magnética
En casos de sospecha de TVP del sector ilíaco debe considerarse como método diagnóstico de elección la venografía por resonacia nuclear magnética (RM) o el ecodoppler venoso en manos de técnicos experimentados en el estudio de este sector anatómico 19,20. La venografía por RM tiene una sensibilidad cercana al 100% para el diagnóstico de TVP pélvica en la población no embarazada, no existiendo datos certeros sobre la misma en este grupo particular de pacientes. De acuerdo a un gran estudio de cohorte de Ontario, Canadá (23 la exposición a la RM en el primer trimestre no se asoció a un riesgo aumentado de daño para el feto o parto pretérmino.
Sin embargo, el uso de Gadolinium como contraste se desaconseja porque podría producir riesgo aumentado de enfermedades reumatológicas inflamatorias, infiltración cutánea, parto pretérmino y muerte neonatal. Por lo tanto, de ser necesario, la Sociedad Americana de Ginecoobstetricia (ACOG) recomienda la revisión caso a caso evaluando el riesgo-beneficio 24.
Técnicas de Confirmación Diagnóstica de Embolia Pulmonar
Clásicamente se ha percibido como una preocupación el uso de técnicas diagnósticas de imagen durante el embarazo por el temor a los potenciales efectos adversos sobre el feto de la irradiación y /o el contraste.
En ocasiones, estos motivos se citan como argumentos para evitar un uso adecuado de estas técnicas, lo que conlleva un riesgo inaceptable de sub-diagnóstico de una patología potencialmente mortal como la EP. Cabe destacar que no existen escores validados para establecer la probabilidad clínica de EP en la población de mujeres embarazadas, y que los estudios no imagenológicos como el electrocardiograma y gasometría arterial son de limitado valor a efectos diagnósticos.
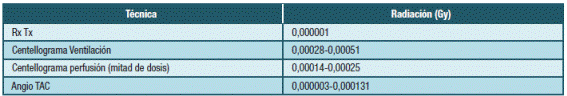
La dosis mínima asociada con riesgo de teratogenicidad en seres humanos no está claramente establecida. Sobre la base de estudios animales se considera que como valor de corte práctico, la dosis de 0,1 Gy. Dosis mayores pueden asociarse con posibles anomalías fetales 25-27. Las técnicas de imagen más frecuentemente utilizadas a estos efectos no se asocian con niveles elevados de exposición fetal a la irradiación por lo que no debe retrasarse su solicitud frente a la sospecha de esta entidad (Tabla 3).
a) Radiografía de Tórax
En pacientes con sospecha de EP que se encuentran hemodinámicamente estables, la radiografía de tórax (RxTx) permite descartar diagnósticos diferenciales tales como neumopatía aguda o neumotórax. Las mujeres embarazadas, por su edad, en general tienen baja tasa de enfermedad pulmonar y la RxTx será normal en más del 50% de los casos. La RxTx puede evidenciar hallazgos no específicos de EP como atelectasia, derrame pleural, opacidad focal, oligohemia o edema pulmonar pero su sensibilidad y especificidad son bajas por lo que su principal utilidad es la valoración de diagnósticos alternativos 25.
b) Angio-TC de Tórax
Constituye el método diagnóstico de elección en pacientes con RxTx anormal 19. Esta técnica conlleva menor exposición del feto a la irradiación que el centellograma ventilación/perfusión (V/Q) durante los 3 trimestres de la gestación 19. Sin embargo, este estudio expone a la madre a una considerable dosis de irradiación que puede alcanzar 20 mGy en tórax y en tejido mamario, el cual durante el embarazo se encuentra en una situación particularmente sensible al efecto de la irradiación. Esto se asocia con un riesgo acumulado incrementado de cáncer de mama (31. La dosis de irradiación sobre este tejido puede reducirse hasta 50% con el uso de protectores mamarios 31.
La angio-TC tiene mayor sensibilidad que el centellograma V/Q para el diagnóstico de EP no masiva y masiva, y permite descartar diagnósticos diferenciales. Este estudio presenta menor sensibilidad que en pacientes no embarazadas dado el estado hiperdinámico asociado a la gestación, siendo su VPN cercano a 98%. Generalmente es una técnica de rápido acceso en la mayoría de los centros de atención terciaria lo que lleva a su uso extendido para el diagnóstico de EP.
c) Centellograma pulmonar de ventilación-perfusión (V/Q)
Método útil en el diagnóstico de EP en pacientes sin alteraciones pulmonares previas. Se asocia con menor exposición a la irradiación del tejido mamario materno, pero con exposición algo mayor sobre el feto. En pacientes con RxTx normal en ocasiones puede omitirse la fase de ventilación, reduciendo así la dosis de irradiación fetal (19.
No constituye la técnica de elección en casos de EP grave, y debe tenerse en cuenta que no en todos los centros se cuenta con fácil y rápido acceso a esta técnica diagnóstica. De encontrarse disponible puede considerarse como la mejor opción diagnóstica dada la menor exposición materna a la irradiación.
En ocasiones y teniendo en cuenta la asociación entre EP y TVP asintomática puede optarse por la realización de un ecodoppler venoso de MMII, que de confirmar la presencia de TVP justifica el inicio de terapia anticoagulante y podría evitar la necesidad de realización de técnicas de imagen ya que ante el diagnóstico de TVP la conducta terapéutica es igual.
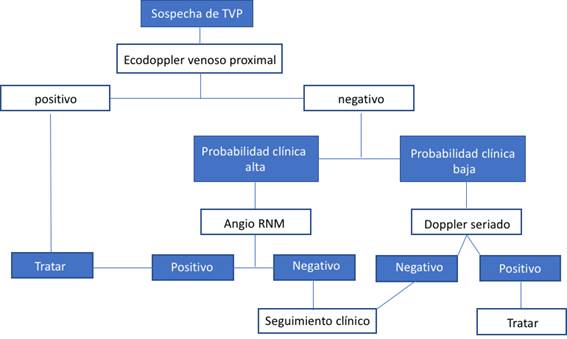
En la Figura 1 y Figura 2 se muestran los algoritmos diagnósticos propuestos en caso de TVP y/o EP.
Tratamiento
El tratamiento de la TEV en el embarazo supone un desafío por diversas dificultades: la escasa evidencia de buena calidad, la elección de la droga anticoagulante, los cambios en la farmacocinética a lo largo del embarazo, los aspectos vinculados a la seguridad y limitación de la anestesia neuroaxial, entre otras. Para la toma de decisiones, ante un evento tromboembólico se debe valorar: el tipo de evento, el momento del embarazo y el riesgo de sangrado.
Anticoagulación farmacológica
a) ¿Con qué fármaco?
La warfarina atraviesa la placenta, es teratogénica y provoca anticoagulación fetal y eventos de hemorragia cerebral, por lo cual no debe utilizarse en el embarazo (excepto situaciones particulares), y especialmente en el primer trimestre.
Las heparinas no atraviesan la placenta ni se excretan en la leche materna, sin embargo tampoco contamos con evidencia de calidad para definir seguridad y eficacia.
En este sentido, se ha publicado una revisión sistemática de Cochrane en el 2014, que tuvo por objetivo comparar eficacia entre Heparina de bajo peso molecular (HBPM), heparina no fraccionada (HNF) y warfarina en TVP en el embarazo, donde se concluyó que no se disponían de estudios controlados randomizados 32. Por ello, el uso de heparinas se sustenta en extrapolaciones de estudios en no embarazadas. No hay estudios randomizados que comparen la eficacia y seguridad de la HNF versus HBPM en el embarazo, pero sí existe vasta evidencia observacional y experiencia clínica que soporta el uso de HBPM.
Una revisión sistemática y meta-análisis publicada en el 2005, mostró que la HBPM es segura y eficaz para el tratamiento y profilaxis en el embarazo 33. Se incluyeron 2777 embarazos en los que se utilizaron diversas HBPM. No se identificaron muertes maternas y 95% fueron nacidos vivos. En el subgrupo de tratamiento hubo baja recurrencia TEV (1.15%), baja frecuencia de sangrado significativo (1.72% y mayormente por causa obstétrica), ningún caso de trombocitopenia inducida por heparina (HIT), ni de fracturas osteoporóticas. Estos datos muestran un mejor perfil de seguridad al reportado con el uso de HNF.
Por tanto, las drogas de elección son las HBPM, y es lo recomendado por las diversas guías (recomendación 1B) 20,34. En nuestro país están disponibles nadroparina y enoxaparina.
Las guías refieren que podría utilizarse HNF de preferencia en situación de alto riesgo de sangrado como la instalación del evento tromboembólico en el periparto, así como en la embolia pulmonar masiva.
Las alternativas en caso de alergia a HBPM son: danaparoide, argatroban, fondaparinux. Tienen diversos perfiles de seguridad pero han sido utilizados con buenos resultados 35.
No hay evidencia suficiente de seguridad y eficacia de los anticoagulantes orales directos, por lo que no están recomendados en el embarazo.
b)¿A qué dosis?
Nuevamente, la evidencia se extrapola de ensayos en pacientes no embarazadas. Es conocido el hecho de que existen cambios farmacocinéticos y del filtrado glomerular a lo largo del embarazo, y está demostrado que la vida media de la enoxaparina aumenta con el curso del embarazo 36.
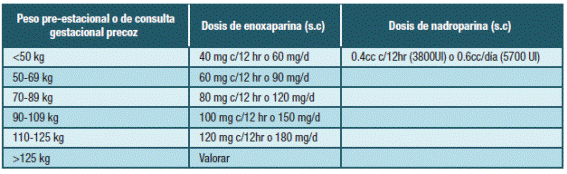
No está claro si la dosis terapéutica debe ser administrada una o dos veces al día (ej, enoxaparina 1.5 mg/kg/día o 1 mg/kg c/12 horas). Evidencia observacional del manejo clínico en la vida real muestra que la mayoría de las pacientes son tratadas con una dosis al día 37. Las guías RCOG no se definen por una pauta en particular. Sí está estandarizado que el peso a utilizar para el cálculo de dosis es el pre-gestacional o el de la consulta precoz de embarazo (Tabla 4). En nuestro medio, debido a la disponibilidad restringida de las presentaciones de HBPM, habitualmente se realiza el esquema dos veces al día.
c) ¿Se debe monitorizar con anti-Xa?
Los mencionados cambios farmacocinéticos han avalado en el pasado el uso de la actividad anti-Xa como parámetro de control de la anticoagulación con HBPM. El esquema de 1 mg/kg cada 12 hr logra medidas estables de anti-Xa. Sin embargo, la amplia variabilidad según el curso del embarazo, según el tipo de ensayo, así como variabilidad inter-laboratorio, sumado a la vasta evidencia observacional del uso seguro de HBPM, hacen desaconsejar el monitoreo sistemático. Las excepciones en las que se recomienda su determinación (pico esperado de 0.5-1.2 U/ml a las 3 horas) son: peso menos de 50 kg o más de 90 kg, insuficiencia renal, recurrencia de TEV bajo anticoagulación 38-40 o situaciones de alto riesgo tromboembólico (ej: válvulas mecánicas).
d)¿Hasta cuándo se mantiene la anticoagulación y con qué droga?
El riesgo tromboembólico persiste durante todo el embarazo y hasta 6 semanas luego del parto, lo que expone a la paciente a un inaceptable riesgo de recurrencia 41. Esto justifica la persistencia del tratamiento durante todo el embarazo y hasta 6 semanas post parto, debiéndose cumplir al menos 3 meses de tratamiento a dosis plenas.
La dosis a la cual se debe continuar en tratamiento, no está aclarada. Evidencia extrapolada de pacientes no embarazadas demuestran que las dosis intermedias o de profilaxis no son adecuadas por la alta tasa de recurrencia. En el embarazo, no existen estudios randomizados comparativos. Una revisión sistemática de estudios en que se utilizaron dosis intermedias, reportan 1 recurrencia en 156 pacientes, sin embargo, los propios autores refieren probable sobreestimación de la efectividad por escasos casos de EP e inclusión de casos de TVP distal 41. Existen otras revisiones que reportan baja tasa de recurrencia con dosis intermedias 33,42. Las guías RCOG sugieren mantener la dosis de anticoagulación por todo el período, dado ausencia de evidencia contundente y buen perfil de seguridad 34.
Al finalizar el puerperio (y una vez completado los 3 meses de tratamiento), se debe evaluar riesgo individual de recurrencia y definir duración de anticoagulación.
La warfarina puede ser dada de manera segura en la lactancia, por lo que es una opción válida, una vez superado el riesgo hemorrágico.
Manejo de anticoagulación periparto
Dado que la finalización del parto tiene alto riesgo de sangrado, se considera la suspensión momentánea de la anticoagulación. Resulta evidente que la mejor conducta será la individualizada, según el balance entre riesgo de recurrencia y riesgo de sangrado.
Se la debe instruir a la paciente de no administrarse la dosis de HBPM en caso de estar empezando el trabajo de parto. En caso de fin de embarazo no programado y que se haya administrado la inyección, es muy bajo el riesgo de sangrado.
Si la TEV se presenta en el período periparto (alto riesgo tromboembólico de suspender la HBPM), el uso de HNF como puente dado su corta vida media puede ser útil. Se inicia con bolo de 80 U/kg, siguiendo con infusión de 18 U/kg/hr para lograr un aptt 1.5 a 2.5 veces superior al normal. Se chequea a las 6 horas de iniciado el bolo y luego cada 4-6 horas hasta lograr rango. Una vez en rango, se puede testar una vez al día.
¿Cuándo usar un filtro cava?
Al igual que en pacientes fuera del embarazo, la colocación de filtros cava están indicados en caso de contraindicación para la anticoagulación o EP recurrente a pesar de correcta anticoagulación.
Puede considerarse el uso de filtro cava en la instalación de una TVP ilíaca periparto para reducir el riesgo de EP.
En todos los casos la colocación de filtros removibles es lo recomendado 43,44, y retirarlo luego de finalizado el puerperio y sin contraindicación para la anticoagulación.
Profilaxis
La utilización de tromboprofilaxis farmacológica durante el embarazo y puerperio es un tema de gran controversia. No hay ensayos clínicos randomizados que evalúan la tromboprofilaxis en el embarazo o puerperio dado que los mismos han sido difíciles de implementar45. La mayoría de las recomendaciones se basan en estudios retrospectivos y en la opinión de expertos y por tanto tienen un nivel de evidencia bajo. Las recomendaciones por las guías clínicas internacionales a menudo varían en cuanto a algunas indicaciones de profilaxis. A pesar de esto, la mayoría de los expertos coinciden que es un escenario de elevado riesgo y que a las pacientes de riesgo alto/intermedio se les debería ofrecer tromboprofilaxis farmacológica.
El riesgo de TEV debe ser evaluado en cada paciente de forma individualizada teniendo en cuenta los diferentes factores de riesgos trombóticos que han sido mencionados previamente. Esta evaluación del riesgo es dinámica, por lo que debe realizarse en distintos momentos durante el embarazo y puerperio. También es necesario valorar el riesgo-beneficio del tratamiento anticoagulante teniendo en cuenta el efecto sobre la madre y el feto y elegir cuál es el fármaco, la pauta de administración y la dosis más adecuada.
La tromboprofilaxis puede ser farmacológica o mecánica. Las estrategias de profilaxis mecánica incluyen la deambulación precoz, medias de compresión venosa graduada y compresión neumática intermitente. Si bien los métodos de compresión neumática intermitente han demostrado prevenir el desarrollo de TEV en pacientes quirúrgicos, hay escasa evidencia de su eficacia en la mujer embarazada y/o puerpera46. El American Congress of Obstetricians and Gynecologists (ACOG) recomienda la utilización de compresión neumática intermitente en todas las pacientes a las que se les realice cesárea y que ya no estén recibiendo tromboprofilaxis farmacológica47.
La tromboprofilaxis farmacológica se puede realizar con HNF o HBPM ya que no cruzan la placenta y son seguras en el embarazo. Las HBPM son los anticoagulantes de elección para realizar profilaxis farmacológica por largo período en el embarazo debido a su buen perfil de seguridad. La HNF es una alternativa válida, pero tiene mayor riesgo de inducción de HIT y osteoporosis con su uso prolongado. Las ventajas de la HNF es su bajo costo y que tiene una vida media corta lo cual puede ser útil para el manejo en el periparto en pacientes de alto riesgo trombótico48.
Los estudios para estimar el riesgo de hemorragia en mujeres embarazadas bajo tromboprofilaxis farmacológica son limitados. La proporción de TEV fatal varía desde 0% a 1.91% con un promedio de 0.68% (IC 95% 0.41% - 0.96%), sin embargo no hay datos suficientes para estimar la tasa de sangrado fatal vinculado directamente a HBPM49. En un meta-análisis que combina los datos de 8 ensayos clínicos randomizados para evaluar el rol de la HBPM a dosis profilácticas en prevenir las complicaciones mediadas por la placenta, el riesgo de sangrado mayor durante el embarazo fue de 0.2% (1 de 470) y el riesgo de sangrado mayor en el post-parto fue de 0.6% (3 de 473)50. Otro meta-análisis publicado por Greer IA et al. evalúo la seguridad de la HBPM en 2777 embarazos y observó que el sangrado mayor durante la gestación fue de 0.43% (95% IC, 0.22% - 0.75%) y en el puerperio de 0.94% (95% IC, 0.61% -1.37%)51.
Nuestra experiencia en el Hospital de Clínicas aplicando las guías de tromboprofilaxis del Royal College of Obstetricians and Gynaecologists (RCOG) 2009 fue de 1 episodio de TEV en 1035 pacientes sin haber registrado eventos hemorrágicos mayores, por lo que hemos observado buen perfil de seguridad con la utilización de HBPM a dosis profilácticas 52.
Los episodios de hemorragia en Estados Unidos son una importante causa de mortalidad maternal y entre 2011 y 2013 corresponden al 11.4% de las causas de muerte materna. Por lo tanto, basándose en datos del riesgo hemorrágico con HBPM de la población no materna, algunos autores asumen que el riesgo de sangrado fatal con profilaxis con HBPM es 2 a 3 veces más común que los episodios de TEV durante el embarazo, por lo que la profilaxis con HBPM tendría que evitar al menos 2 a 3 eventos de TEV más por cada sangrado mayor para proporcionar un beneficio neto 53,54.
En base a estos y otros datos es que algunos expertos consideran que es probable que no haya un beneficio clínico neto para realizar tromboprofilaxis con HBPM cuando el riesgo absoluto de TEV durante el embarazo o puerperio es menor a 1% y es muy probable que exista beneficio clínico neto cuando el riesgo absoluto de TEV es mayor a 3%. Entre 1 y 3% la indicación es aún más discutida 54.
Por todo lo anterior es que, no está recomendada la tromboprofilaxis de rutina en todas las pacientes embarazadas y/o puérperas, y por el contrario, se debe realizar una evaluación cuidadosa de todos los factores de riesgo trombóticos y del riesgo hemorrágico. Para facilitar esta decisión clínica, diferentes sociedades científicas internacionales han publicado guías clínicas haciendo una estimación del riesgo trombótico y guiando la tromboprofilaxis. Dentro de ellas están las guías del The American College of Chest Physicians (ACCP), Royal College of Obstetricians and Gynaecologists (RCOG), American College of Obstetricians and Gynecologists (ACOG), French College of Gynaecologists and Obstetricians (CNGOF), Society of Obstetricians and Gynaecologists of Canada, Sociedad de Obstetricia y Ginecología de Buenos Aires (SOGIBA), entre otras 20,47,55-58. Dada la ausencia de evidencia clínica de calidad es que existen diferencias entre las distintas guías.
En estas guías la tromboprofilaxis está recomendada en mujeres con un riesgo de TEV estimado mayor a 5% y no se recomienda realización de tromboprofilaxis si es riesgo es inferior a 1%. La realización de tromboprofilaxis con un riesgo de TEV estimado entre 1 a 5% es controversial (55, 58).
Las guías del RCOG usan un sistema de score para determinar el riesgo (bajo, intermedio y alto) y guiar la tromboprofilaxis 55.
Nuestra experiencia con la aplicación de las guías del RCOG 2009 ha sido buena. Entre enero de 2014 y Diciembre de 2016 hemos registrado 1035 pacientes embarazadas y puérperas a las que se les ha aplicado el sistema de riesgos de la RCOG 2009 y hemos evaluado que en nuestra población el 3.0% corresponden a pacientes de alto riesgo y 35.4% de riesgo intermedio, por lo que 38.4% de las pacientes de nuestro servicio tenían indicación de recibir tromboprofilaxis farmacológica. La población de pacientes del Hospital de Clínicas tiene una elevada frecuencia de pacientes de alto riesgo obstétrico. Es de destacar que no tuvimos episodios hemorrágicos mayores (52.
Las guías de ACOG usan una estrategia de screening basado en la historia familiar y personal de TEV, la presencia de trombofilia y otros factores de riesgo 49. Las recomendaciones de la ACCP categoriza los factores de riesgo en mayores y menores y se sugiere tromboprofilaxis si tiene un factor de riesgo mayor o al menos 2 menores 20.
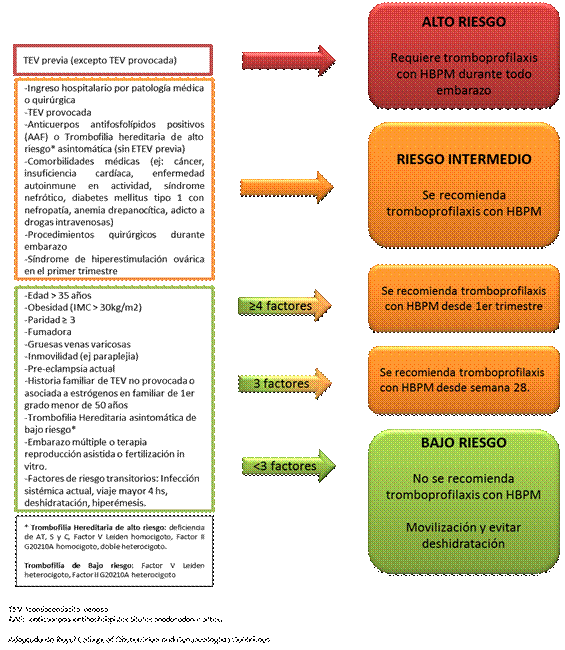
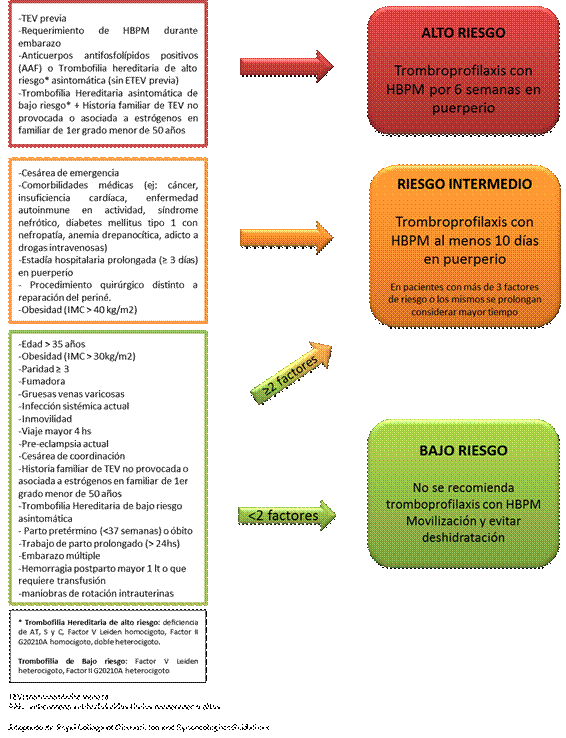
Basado en nuestra experiencia previa con las guías del RCOG 2009 es que nosotros preferimos guiar nuestras recomendaciones basándonos en las guías del RCOG 2015 55. En las mismas se recomienda realizar una evaluación del riesgo trombótico en el primer control del embarazo, frente a los ingresos, en el postparto inmediato y frente a cualquier cambio o patología intercurrente durante la evolución de la paciente (Figura 3 y Figura 4).
Este riesgo se clasificará en alto, intermedio y bajo con lo cual se decide la indicación de tromboprofialxis y la duración de la misma. Las guías del RCOG 2015 han realizado algunas modificaciones con respecto a las guías previas del 2009. Dentro de las más destacadas está el hecho de que durante el embarazo toda paciente que requiera ingreso hospitalario por patología obstétrica, médica o quirúrgica debe considerarse de riesgo intermedio. Asimismo, durante el embarazo dependiendo de cuantos factores de riesgo menores presente la paciente es si la tromboprofilaxis se realiza durante todo el embarazo o solo luego de la semana 28 de gestación. Además, a las pacientes de alto riesgo se sugiere tromboprofilaxis durante todo embarazo y hasta 6 semanas en el puerperio y a las de riesgo intermedio durante embarazo y 10 días en el puerperio 55.
La evaluación del riesgo trombótico debe ser siempre acompañada de una cuidadosa evaluación del riesgo hemorrágico y se desaconseja la realización de tromboprofilaxis frente a las siguientes situaciones: enfermedad hemorrágica conocida (ej.: enfermedad de Von Willebrand, hemofilia u otra coagulopatía), sangrado activo, mujeres en las que se considera alto riesgo hemorrágico (ej.: placenta previa con sangrado), trombocitopenia menor a 50.000/µL, stroke isquémico o hemorrágico en las 4 semanas previas, enfermedad renal crónica con clearence de creatinina menor a 30ml/min), enfermedad hepática severa con várices esofágicas conocidas o alteración del tiempo de protrombina, hipertensión arterial no controlada (mayor a 200mmHg de sistólica y 120mmHg de diastólica)55.
A las pacientes de alto riesgo trombótico con contraindicación de tromboprofilaxis farmacológica se les debe ofrecer tromboprofilaxis mecánica, preferentemente compresión neumática intermitente 54,55.
En cuanto a la dosis de HBPM a ser utilizada se recomienda en forma general para pacientes entre 50 y 90kg (peso inicio embarazo) enoxaparina 40mg s.c/día o nadroparina 0.4mL s.c/día (3800 UI anti Xa). No requiere monitorización con hemograma ni niveles anti-Xa (55. En pacientes con insuficiencia renal se sugiere utilizar dosis menores. En situaciones con pesos por debajo de 50 Kg o superior a 90 Kg se requiere ajuste de dosis (Tabla 5).
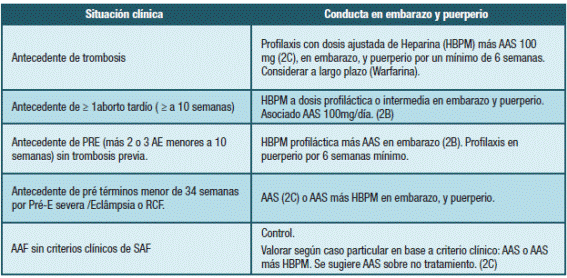
En mujeres con indicación de anticoagulación previo al embarazo (por ej: TEV previa asociada a deficiencia de antitrombina o a Síndrome Antifosfolípidico (SAF) o en aquellas con TEV recurrente) se continúa con HBPM a dosis de anticoagulación (enoxaparina 1mg/kg cada 12 hs o 1,5mg/kg día o dosis equivalentes de otras) durante todo embarazo y puerperio. Hacia el día 5 a 7 del puerperio se superpone la anticoagulación oral con antivitamina K. En caso de deficiencia de AT con antecedentes de TEV algunos autores recomiendan realizar dosis de anticoagulación y realizar monitorización con anti-Xa para ajustar dosis a niveles entre 0,5 y 1 UI/mL55.
Para el caso de factores de riesgos transitorios como la hiperémesis gravídica del primer trimestre, el síndrome de hiperestimulación ovárica, entre otros, la tromboprofilaxis se retira cuando la situación que llevó a la indicación se resolvió 55.
Las mujeres que están recibiendo anticoagulantes orales previo al embarazo, deben ser aconsejadas acerca del riesgo de estos fármacos durante la gestación. Para los anticoagulantes orales directos (ACOD) existe escasa evidencia para hacer recomendaciones actualmente, por lo que se recomienda cambiar a HBPM lo más precozmente posible, con resultado de test de embarazo positivo. En forma similar, en caso de tratamiento con warfarina, se recomienda cambiar a HBPM antes de la semana 6 de gestación por el riesgo de embriopatía 59,60).
Las pacientes que reciben fármacos antitrombóticos durante el embarazo deben ser educadas acerca del manejo de los mismos al final del embarazo. Se debe sugerir que de presentar genitorragia o iniciar el trabajo de parto no deben administrarse la siguiente dosis de HBPM y deben consultar. El manejo de la anestesia regional y cesárea en pacientes que reciben HBPM se discute en la revisión “Anestesia regional en la paciente embarazada antiagregada o antcoagulada”.