Introducción
Las úlceras crónicas son un problema de salud, con importante morbilidad, alteración en la calidad de vida, aumento del ausentismo laboral así como un gran impacto económico sobre el sistema de salud. 1-3
Se estima que esta patología afecta a 6,5 millones de pacientes en Estados Unidos con un costo anual de 7 billones de dólares para el sistema de salud de dicho país mientras que en Europa los gastos anuales oscilan entre 25 a 200 millones de dólares.4) (5
En Uruguay no contamos con datos epidemiológicos sobre la magnitud del problema, si bien los trabajos de Ramos y cols y posteriormente Otero y cols aportan datos sobre su etiología en unidades de referencia de Montevideo.2) (3
La cicatrización de heridas es un proceso dinámico que consta de tres fases superpuestas en el tiempo, ellas son: fase inflamatoria, proliferativa y de remodelación. Éstas involucran la interacción dinámica entre factores de crecimiento, citoquinas, componentes de la matriz extracelular, células residentes y subtipos diferentes de linfocitos. 6
La alteración en alguna de estas fases, generalmente de causa multifactorial, puede conducir a la cronicidad de las heridas. 1
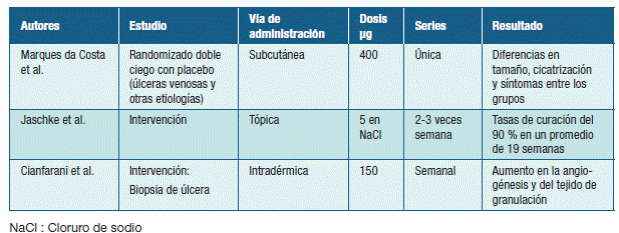
Varios ensayos clínicos han demostrado que en los fluidos de úlceras crónicas los factores de crecimiento se encuentran disminuidos en comparación con las heridas agudas. 7 Esto motivó diversos estudios prospectivos, utilizando factores de crecimiento aplicados en forma local a pacientes con heridas crónicas, obteniendo resultados alentadores con respecto a la cicatrización. 7-9 Los resultados de los mismos se muestran en la Tabla 1.
Dentro de los factores de crecimiento evaluados en éstas heridas se encuentra el factor de crecimiento estimulante de colonias de granulocitos y macrófagos (GM-CSF). Éste es una citoquina multifuncional que actúa regulando la proliferación y diferenciación de células madre y progenitoras hematopoyéticas y endoteliales desde la médula ósea, así como células no hematopoyéticas como fibroblastos, células endoteliales y queratinocitos. 7-9
Cianfarani y cols. evaluaron los efectos del GM-CSF sobre la neo-angiogénesis de úlceras venosas crónicas y la síntesis local de factores pro-angiogénicos. Con este fin, aplicaron GM-CSF intradérmico en cuatro puntos cardinales de la lesión, a una dosis de 150 microgramos (μg), en forma semanal, con un total de cuatro a nueve dosis. Como conclusión destacan el aumento de la angiogénesis y del tejido de granulación en la herida, vinculado a un aumento local de factores angiogénicos, como el factor de crecimiento endotelial vascular (VEGF). 9
Posteriormente, diversos autores comenzaron a utilizar factor de crecimiento estimulante de colonias de granulocitos (G-CSF), primero en modelo animal y luego en pacientes con pie diabético infectado.10-15
El G-CSF, al igual que el GM-CSF, es un factor endógeno hematopoyético movilizador de células madre y progenitores hematopoyéticos de la médula ósea hacia la sangre periférica, los cuales pueden ser cuantificados mediante la determinación de células CD34+ en sangre periférica. 10,12
A nivel sistémico actúa regulando la supervivencia, proliferación y diferenciación terminal de las células precursoras de neutrófilos desde la médula a la sangre. 16
A su vez, estimula la función de neutrófilos maduros favoreciendo la quimiotaxis de éstos y mejorando su capacidad fagocítica. 10) (12) (17
Por otro lado, induce la proliferación de células endoteliales promoviendo la angiogénesis. 10
La eficacia del G-CSF ha sido evaluada en varios ensayos clínicos en pie diabético infectado, observándose mejoría en los parámetros de infección, así como disminución en la incidencia de amputación y de estadía hospitalaria en estos pacientes. 12-14
En contra posición a esto, Yönet y cols. no lograron demostrar efectos beneficiosos de significancia con la administración subcutánea de G-CSF, aunque si evidenciaron aumento en el número absoluto de neutrófilos y la eficacia en su función. 15
La dosis utilizada, así como el intervalo de aplicación fue variable entre los distintos trabajos, oscilando entre 5 a 10 μg/kg de G-CSF aplicados en forma diaria durante un periodo de tres a veintiún días.12-15
Se reportó buena tolerancia con escasos efectos adversos, aunque Kästenbauer y cols. reportaron alteraciones hepáticas en dos pacientes del grupo tratado con G-CSF por lo que se debió suspender su administración.13
En una revisión de Cochrane, Cruciane y cols. Evaluaron los efectos in vivo sobre las tasas de infección y cicatrización del tratamiento complementario con G-CSF comparado con placebo en pacientes con pie diabético infectado. Los autores sugieren que la aplicación de G-CSF no mejoraría la cicatrización ni aumentaría la probabilidad de resolución de infecciones. Sin embargo, refieren una disminución en la necesidad de amputación y en el tiempo de internación. Concluyen por tanto que éste tratamiento podría ser incorporado a las pautas de tratamiento habitual del pie diabético infectado, sobre todo en aquellas infecciones que pongan en riesgo la viabilidad de la extremidad. 17
Por otra parte, en úlceras de otras etiologías, Sugiyama y cols. realizaron un estudio en modelo animal de heridas producidas por radiación. Para ello utilizaron una combinación de factores de crecimiento entre los cuales se encuentra el G-CSF, factor estimulante de colonias de macrófagos (M-GCS) y un inhibidor del factor de crecimiento transformante β -1(TGF-β1). Estos autores observaronun aumento en la resistencia a la ruptura de la piel y de la formación de fibras de colágeno en la histopatología y concluyeron que la combinación de factores podría ser prometedor para el tratamiento de heridas producidas por radiación. 18
Fine y cols. en un ensayo clínico piloto con siete pacientes utilizaron G-CSF en forma sub cutánea en heridas de epidermólisis ampollar a una dosis de 10 μg/kg/díapor siete días. Observaron una reducción del 75,5% en el tamaño de las lesiones y del 36,6 % en el recuento de erosiones y ampollas al finalizar la serie. 19
Basándonos en la evidencia presentada, se planteó la utilización de G-CSF (Filgen®) en dos pacientes con heridas crónicas de diferente etiología, las cuales mantenían su cronicidad a pesar de los esfuerzos clínicos para estimular la correcta cicatrización.
Este producto se presenta en jeringas pre llenadas de 300 micro gramos (μgrs) por mililitro (ml). (Filgrastim - Filgen ®) La técnica que se utilizó para la aplicación del G-CSF en ambos casos, consistió en la división de la herida en cuatro cuadrantes, inyectando 0,25 ml intradérmicos a 0,5 cm del borde en cada cuadrante. A su vez, se realizó extracción de sangre para cuantificación de células CD34+ por citometría de flujo, previo a la primera inyección y a la semana, no evidenciándose efectos sistémicos del G-CSF sobre dicho marcador en ninguno de los casos.
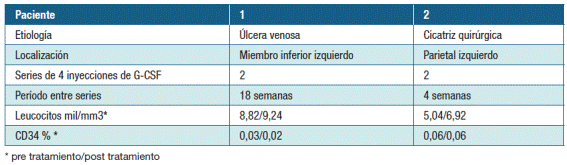
Los dos pacientes recibieron un total de cuatro aplicaciones semanales divididas en dos series. El período entre las series fue de dieciocho semanas para el caso uno y cuatro semanas en el caso dos.
El protocolo de utilización del G- CSF como tratamiento complementario de úlceras venosas crónicas fue aprobado por el Comité de Ética del Hospital de Clínicas. Ambos pacientes recibieron información del procedimiento previo al mismo y dieron su consentimiento informado para realizar dicho tratamiento.
Caso clínico 1
Hombre de 76 años, con antecedentes de hipertensión, diabetes tipo II, dislipemia, hiper-uricemia. Al momento de la consulta, presentaba una úlcera venosa crónica de miembro inferior izquierdo de veinte años de evolución que habiendo recibidomúltiples tratamientos, entre ellos injerto de piel y terapia con oxigeno hiperbárico, sólo se obtuvo una respuesta parcial. Los datos clínicos se detallan en la Tabla 2.
Debido a la falta de progresión en el proceso cicatrización, se decidió realizar, como técnica complementaria, la aplicación de G-CSF a nivel local (Figura 1). No se evidenció efectos adversos de relevancia durante el procedimiento.
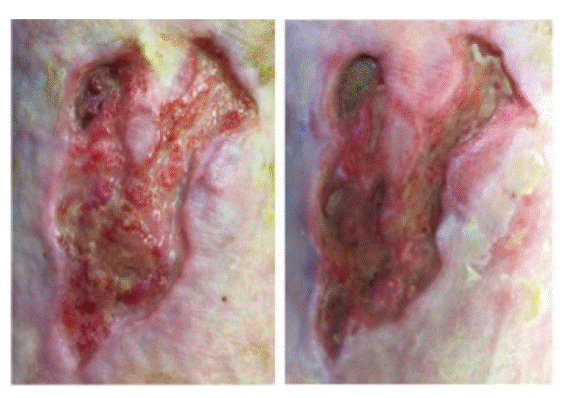
Figura 1: A la izquierda la lesión pre- tratamiento con G-SCF. A la derecha la lesión luego de ocho sesiones de G-CSF
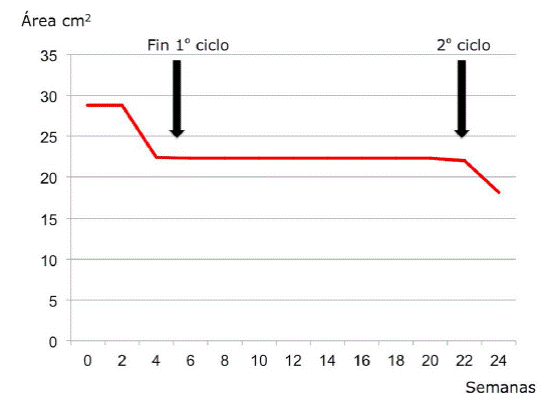
Durante veintiséis semanas de seguimiento se observó una reducción porcentual del área del 37%. (Tabla 3 y Figura 2)
Caso clínico 2
Hombre de 59 años con antecedente de tumor cerebral en la infancia tratado con cirugía y radioterapia en esa oportunidad. Un año previo a la consulta, presentó un carcinoma basocelular en región parietal izquierda de cuero cabelludo en área previamente irradiada, recibiendo tratamiento quirúrgico de dicha lesión. El estudio anátomo - patológico confirmó el diagnóstico planteado inicialmente, estando los márgenes libres de tumor.
Se realizó reconstrucción del defecto quirúrgico por colgajo de avance, el cual sufrió necrosis parcial, requiriendo, posteriormente, cura avanzada de heridas con apósito hidrocoloide. Durante el seguimiento presentó una tórpida evolución en la cicatrización con exposición de material óseo. Dado que se trataba de un hueso irradiado, lo que dificultaba la posibilidad de un injerto, se planteó la realización de inyección de G-CSF. (Figura 3)
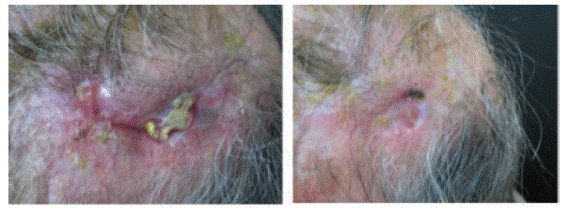
Figura 3 A la izquierda la lesión pre tratamiento con G-CSF. A la derecha lesión luego de ocho sesiones de G-CSF
Los datos clínicos y evaluación paraclínica se detallan en la tabla 2.
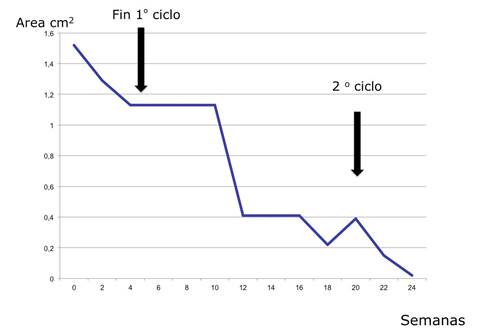
Durante las veinticuatro semanas de seguimiento se observó una reducción porcentual del área del 100%. (Tabla 3 y Figura 4).
Discusión
Las heridas crónicas nos enfrentan a un desafío terapéutico sin alcanzar en ocasiones, una cicatrización óptima.
La literatura citada previamente apoya las propiedades del uso del G-CSF en lo referente a infección y cicatrización de heridas en pacientes diabéticos. 12-14,17 Sin embargo, hasta la fecha, no hemos encontrado estudios publicados realizados in vivo en heridas crónicas de etiología venosa, que avalen la eficacia y seguridad del G-CSF en pacientes con úlceras venosas crónicas de miembros inferiores, así como tampoco en heridas crónicas en áreas de radiodermitis.
La metodología utilizada enla aplicación del G-CSF se realizó en forma similar al protocolo de Cianfarani y cols. 9, si bien no se ha establecidoun acuerdo en cuanto al intervalo de aplicación (diaria, semanal o quincenal), así como tampoco en el número de aplicaciones a administrar, pudiendo oscilar entre tres a veintiuna dosis aplicadas diariamente.
Con respecto a la dosis, optamos por aplicar 300 μg semanales intradérmicas en los dos pacientes, aunque en la literatura la misma oscila entre5 - 10 μg/kg por inyección.
Con relación al porcentaje de cicatrización de úlcera venosa nuestros resultados fueron similares a los resultados obtenidos por Marques da Costa y Cianfarani, quienes reportan tasas globales de reducción a los tres meses de tratamiento de 27 a 73 % para úlceras venosas con GM-CSF.7,9 El intervalo entre la primera y segunda serie en el caso clínico 1 fue más largo que lo reportado en la literatura, por motivos personales del paciente.
En heridas causadas por radioterapia se debe tener en cuenta el potencial carcinogénico de este producto. 20 En el caso clínico 2 se descartó previamente la persistencia de patología oncológica con el informe anátomo - patológico, el cual evidenció márgenes libres de lesión. A pesar de esto, es recomendable continuar con un seguimiento clínico del paciente.
En cuanto al beneficio de G-CSF vinculado a la cicatrización, se observó el cierre completo en el caso del paciente con radiodermitis; mientras que en el paciente portador de úlcera venosa crónica, se obtuvo una reducción al finalizar las dos series de tratamiento del 37,1 %.
En lo referente a los efectos adversos locales nuestros resultados son similares a los mencionados por otros autores, 7,12 destacándose en ambos casos leve dolor al momento de la inyección. En nuestros pacientes no se evidenciaron efectos adversos sistémicos, así como tampoco cambios en la paraclínica como hemograma y recuento de células CD34+.
Cianfarani y cols. reportan efectos adversos vinculados a la utilización con GM-CSF, como dolor a nivel dorsal compatible con radiculitis por lo que debió ser suspendida la aplicación del factor.9
Por otra parte, en nuestro país el costo de cada inyección de Filgen® es de 1500 pesos uruguayos 21, lo que es comparable al precio de algunos apósitos utilizados en curación avanzada de heridas.
Es por este motivo que consideramos que aquellas estrategias terapéuticas que logren disminuir los tiempos de cicatrización, como el G-CSF, con costos accesibles para los sistemas sanitarios, impactarán positivamente en el gasto destinado para su tratamiento.
Conclusiones
Ambos pacientes presentaron un beneficio en la cicatrización de sus heridas con la utilización de G-CSF, sin bien se requieren de más estudios para establecer el rol de este fármaco en la cicatrización de heridas.
Quedan algunas interrogantes planteadas como ser la dosis, intervalo y número total de aplicaciones a administrar, ya que no existe uniformidad en la literatura sobre este punto.
Los resultados obtenidos nos llevan a continuar con este estudio mediante el diseño de ensayos clínicos con la finalidad de validar esta herramienta terapéutica en el tratamiento de los pacientes con heridas crónicas de diversas etiologías. Para esto nuestro grupo de trabajo se encuentra desarrollando un estudio prospectivo randomizado que permita dar respuesta a algunas de estas interrogantes.