Introducción
La enfermedad cardiovascular (ECV)principalmente la cardiopatía isquémica y la enfermedad cerebrovascular, es la principal causa de muerte a nivel mundial 1.A modo de ejemplo, en el continente europeo da cuenta de más de 4 millones de muertes anuales2.Por otro lado, cada vez más pacientes sobreviven un primer evento cardiovascular y tienen alto riesgo de recurrencias(3, 4).El aumento de los niveles sanguíneos de lipoproteínas aterogénicas,en particular el LDL colesterol (LDLc), juega un rol central en el desarrollo de la enfermedad cardiovascular aterosclerótica. Este hecho está bien demostrado en una multiplicidad de estudios de carácter observacional, epidemiológicos y ecológicos. Asimismo, la reducción de los niveles de colesterol se asocia con una disminución en el número de eventos ateroscleróticos cardiovasculares5.
El presente trabajo busca revisar y resumir los aspectos más importantes aportados porlas guías de práctica clínica del American College of Cardiology y la American Heart Association (ACC/AHA) publicada en 2013 y su actualización realizada en 2016, así como de la guía de la Sociedad Europea de Cardiología (ESC) publicada este mismo año. Se pretende además realizar una revisión crítica de las mismas, especialmente en aquellas situaciones en las cuales el nivel de evidencia es menor.
Guía ACC/AHA 2013
La guía ACC/AHA 2013 realiza recomendaciones orientadas al tratamiento de los niveles de colesterol con la finalidad dedisminuir el riesgo de ECV aterosclerótica, entendida como enfermedad coronaria (EC), ataque cerebrovascular (ACV) y/o enfermedad arterial periférica de presumible origen aterosclerótico. Estas recomendaciones seaplican en prevención primaria y secundaria de hombres y mujeres mayores de 21 años(5). La guía ACC/AHA 2013 no busca ser una guía para la detección, evaluación y/o tratamiento de las dislipemias en su conjunto, sino que se limita a analizar el uso de estatinas para disminuir el riesgo de eventos cardiovasculares ateroscleróticos.
Para la realización de la guía se siguieron las recomendaciones realizadas por el National Institute of Medicine.Se plantearon preguntas críticas y se realizó una búsqueda sistemática de los trabajos con la mayor calidad metodológica disponible. Es así que para formular recomendaciones se toma en cuenta únicamente la evidencia originada en ensayos clínicos aleatorizados (ECAs), revisiones sistemáticas y meta-análisis 5.
Existe un extenso cuerpo de evidencia que avala el uso de estatinas,para la prevención primaria y secundaria, de eventos vasculares fatales y no fatales, en hombres y mujeres mayores de 21 años.La utilización de estatinas logra beneficio neto en personas con riesgo cardiovascular (CV) aumentado. Esto significa que el beneficio del tratamiento supera claramente el riesgo de efectos adversos. Este efecto se mantiene para un amplio rango de valores de LDLc(5, 6).
La reducción del riesgo relativo de eventos CV ateroscleróticos es proporcional a la magnitud de la reducción de los valores de LDLc respecto a su valor basal. Lareducción del riesgo absoluto de eventos CV ateroscleróticos es proporcional a la reducción de riesgo relativo pero también al riesgo CV absoluto de base, es decir, que aquellos individuos con mayor riesgo CV basal se benefician en mayor medida del uso de estatinas (7.Por lo tanto, la guía plantea la necesidad de identificar aquellos grupos de pacientes que tienen mayor probabilidad de beneficiarse del tratamiento con estatinas (grupos de riesgo).
La evidencia disponible apoya una estrategia basada en el uso de dosis fijas de estatinas para disminuir el número de eventos CV ateroscleróticos en pacientes con riesgo CV alto. El grupo de trabajo no encontró evidencia que apoyara el tratar de lograr un valor determinado de colesterol LDL o no-HDL en sangre.Esta estrategia se aparta del paradigma previo de tratamiento hipolipemiante propuesto por ATP III y apoyado como veremos luego por la pauta ESC 2016(4, 8).
La guía clasifica la intensidad del tratamiento con estatinas en tres categorías: alta, moderada y baja. Estas categorías se definen en función del grado de disminución de la concentración de LDLc promedio observado. El tratamiento de intensidad alta es aquel que logra un descenso del LDLc igual o mayor al 50%. El tratamiento de intensidad moderada es el que genera reducción de concentración de LDLc entre 30-50% del valor basal. Por último el tratamiento de intensidad baja provoca una disminución de la concentración de LDLc menor al 30%(5, 9).Estos son los descensos promedios de concentración de LDLc observados en los estudiosanalizados en el meta análisis de los Cholesterol Treatment Trialists Collaboration del 2010 que emplearon varios tipos y dosis de estatinas.La guía plantea incorporar grados de disminución del LDLc como objetivo en el seguimiento de los pacientes en vistas a disminuir el riesgo de eventos CV ateroscleróticos.
Los fármacos y dosis utilizados para alcanzar esos objetivos se muestran en la Tabla 1.

Tabla 1:Fármacos y dosis utilizados en el tratamiento de las dislipemias. En negrita se muestran los fármacos disponibles en nuestro medio. Se prefieren las dosis que no se muestran entre paréntesis. Atorvastatina a dosis de 40 mg se utilizó en 1 solo ECA, en pacientes que no toleraron dosis mayores. Simvastatina 80 mg no se recomienda por la FDA por presentar mayor riesgo de miopatía y rabdomiólisis 5).
Hasta elmomento de la publicación de las guías 2013, no se encontró evidencia que apoyarael usode otros fármacos hipolipemiantes distintos de las estatinas 10. Algunos estudios más recientes que arrojaron resultados positivos con terapias hipolipemiantes combinadas serán analizados más adelante.
El tratamiento con estatinas logra una disminución del riesgo de eventos cardiovasculares en prevención primaria en la mayoría de los pacientes de alto riesgo. En cuanto a la prevención secundaria, la guía encuentra beneficio en todos los pacientes a excepción de aquellos con insuficiencia cardíaca (IC) sintomática CF II-IV y aquellos con enfermedad renal crónica (ERC) en hemodiálisis, hecho que será analizado más adelante.El beneficio se observa de forma consistente para todos los niveles de LDL ≥ 70 mg/dL.
De lo dicho hasta aquí se sigue que existen grupos de pacientes con mayor probabilidad de beneficiarse del tratamiento con estatinas. La guíaidentifica 4 grupos principales en quienes el beneficio de tratar supera ampliamente los riesgos de efectos adversos.
Estos son:
1) Pacientes con enfermedad cardiovascular aterosclerótica clínica (sindrome coronario agudo, IAM, ángor estable, revascularización coronaria / arterial, ACV, AIT, enfermedad arterial periférica presumiblemente aterosclerótica).
2) Personas con LDLc ≥ 190 mg/dL.
3) Pacientes con diabetes mellitus (DM), edad 40-75 años, LDL 70-190 mg/dL, sin enfermedad cardiovascular aterosclerótica clínica.
4) Personas con riesgo CV a 10 años ≥ 7.5%, no DM, edad 40-75 años, LDL 70-190 mg/dL, sin enfermedad aterosclerótica clínica. (Riesgo CV a 10 años = riesgo de IAM no fatal, muerte por enfermedad coronaria, ACV fatal o no fatal).
El calculador de riesgo utilizado (Pooled Cohort Equations) se basa en la extrapolación de resultados de estudios epidemiológicos. Se desarrolló a partir de 5 cohortes poblacionales de hombres y mujeres afro-americanas y caucásicas.Dichas cohortes fueron: ARIC (Atherosclerotic Risk in Communities) (11, CHS (Cardiovascular Health Study) (12, CARDIA (Coronary Artery Risk Development in Young Adults)13, Framingham14 y sus cohortes descendientes15.Las ecuaciones utilizadas para el diseño del calculador lo hacen aplicable a población no hispánica, con LDLc entre 70 y 189 mg/dL, de 40 a 79 años de edad.
Recomendaciones realizadas por la guía
Grupo 1 - Prevención secundaria: Los pacientes que sobreviven a eventos vasculares ateroscleróticos presentan alto riesgo de recurrencias y muerte de causa CV. La evidencia a favor del uso de estatinas a dosis altas es contundente. Hay una reducción notoria de eventos coronarios fatales y no fatales, ACV y muerte de causa CV asociada al uso de estatinas16-24.
Considerando la evidencia disponible, el grupo de trabajo de la guía recomienda tratamiento de alta intensidad con estatinas en este grupo. La guía sugieretratamiento con dosis moderadas en sujetos con factores de riesgo para el desarrollo de eventos adversos por estatinas incluyendopacientes mayores de 75 años. Las recomendaciones se resumen en la Tabla 2.

Tabla 2. Recomendaciones para el tratamiento con estatinas en prevención secundaria según la pauta ACC/AHA 2013 5).
Grupo 2 - Prevención primaria. LDL ≥ 190 mg/dL.: En aquellos pacientes con LDL ≥ 190 mg/dL o triglicéridos (TG) ≥ 500 mg/dL se debebuscar causas secundarias de hipercolesterolemiaprevio al inicio del tratamiento, con el objetivo de evitar la administración crónica innecesaria de estatinas (Tabla 3).
Una vez descartadas las causas secundarias se deberá considerar la presencia de una hipercolesterolemia familiar, que exige un diagnóstico precoz, tratamiento adecuado y realización de screening familiar para la detección de otros casos que se beneficien detratamiento9).
Los pacientes con cifras de LDL ≥ 190 mg/dL deberían ser tratados con estatinas a dosis altas, por presentar alto riesgo vital de enfermedad CV aterosclerótica. Hay que destacar que no se han realizado ECAs en pacientes con LDL > 190 mg/dL debido a que no es admisible dejar sin tratamiento a estos pacientes. Sin embargo, hay evidencia que muestra que cada 39 mg/dL de disminución del LDLchay una reducción de eventos vasculares de 20-25%por lo que el tratamiento estatínico parece plenamente justificado(25, 26). En este grupo de individuos el descenso de LDLc puede ser difícil de conseguir por lo que se puede considerar el uso de fármacos noestatínicos(5, 9, 27). Las recomendaciones para el tratamiento de pacientes con LDL ≥ 190 mg/dL se resumen en la Tabla 4.
Grupo 3 - Prevención primaria. DM, edad 40-75 años, LDL 70-190 mg/dL.: La DM se asocia con un alto riesgo vascular y determina mayor morbi-mortalidad secundaria a los eventos CV ateroscleróticos. Existe un alto nivel de evidencia que demuestra beneficio del tratamiento con estatinas en diabéticos (25, 28. 31).La guía propone ajustar la intensidad del tratamiento según el cálculo del riesgo CV a 10 años. Si el mismo supera el 7.5%se sugiere indicar tratamiento de alta intensidad y si es menor a dicho valor tratamiento de intensidad moderada. Las recomendaciones para el tratamiento de este grupo se resumen en la Tabla 5.

Tabla 5: Recomendaciones para el tratamiento con estatinas en pacientes diabéticos según la pauta ACC/AHA 2013 5).
Grupo 4 - Prevención primaria. Riesgo CV a 10 años ≥ 7.5%, no DM, edad 40-75 años, LDL 70-190 mg/dL.: El beneficio del tratamiento con estatinas en prevención primaria está bien establecido, siendo similar para ambos sexos, etnias y para un amplio espectro de valores de LDLc en individuos con riesgo CV elevado32-46.La pauta plantea el inicio del tratamiento a aquellos pacientes con elevado riesgo CV a 10 años estimado con el calculador de riesgo pooled cohort risk equation. Las recomendaciones se resumen en la Tabla 6.

Tabla 6: Recomendaciones para el tratamiento con estatinas en pacientes no diabéticos con riesgo CV a 10 años elevado según la pauta ACC/AHA 2013 5).
Pacientes que no pertenecen a los grupos con claro beneficio: Si bien la guía no establece claramente qué estrategia se debería seguir en aquellos casos que no pertenecen a ninguno de los grupos previamente citados, se plantea que se debería tomar en cuenta diversas variables a la hora de decidir el inicio del tratamiento.
Entre otros factores que influyen en el riesgo de eventos vasculares ateroscleróticos la guía cita: LDL ≥ 160 mg/dL, dislipemias hereditarias, familiares de primer grado con enfermedad CV a edades tempranas (< 55 años hombres, < 65 años mujeres), PCR de alta sensibilidad ≥ 2mg/L, CAC (calcificación arterial coronaria) ≥ 300 unidades Agatston o ≥ percentil 75, índice tobillo-brazo < 0.9, riesgo de enfermedad CV aterosclerótica a largo plazo (30 años o de por vida) elevado.
En todos los casos se debe tomar en consideración el riesgo de efectos adversos o interacciones medicamentosas y las preferencias del paciente para iniciar o mantener el tratamiento. Se deja bien establecido en la pauta que el juicio clínico es insustituible, y debe primar a la hora de decidir la mejor conducta para cada paciente dado 5.
Consenso de expertos ACC 2016
Los autores de la guía ACC/AHA 2013 no encontraron evidencia que avalara el uso de fármacos no-estatínicos para la reducción de eventos CV ateroscleróticos por lo que sus recomendaciones se limitaron en forma exclusiva al uso de estatinas.
En el 2016 el ACC realiza una actualización basada en nueva evidencia que apoya el uso de algunos fármacos noestatínicos, modificando así las recomendaciones previamente realizadas, y acercándose a las recomendaciones realizadas por la ESC, que se discuten más adelante.
Además, se revisa el concepto de objetivos terapéuticos. Se reconoce que aquellos pacientes que logran mayor beneficio del tratamiento con estatinas no solamente logran determinadas reducciones del valor de LDLc basal en términos porcentuales, sino que también alcanzan valores absolutos de LDLc que caen promedialmente en un rango determinado. Se postula por tanto que quienes no alcancen dichos valores absolutos de LDLc podrían no lograr el máximo beneficio posible del tratamiento con estatinas. Se reconocepues la importancia de considerar valores absolutos de LDLc en el seguimiento de los pacientes para tomar decisiones terapéuticas como aumentar la intensidad del tratamiento o agregar fármacos no-estatínicos9.
El documento de la ACC de 2016 sugiere que para decidir la conveniencia del uso de un fármaco hipolipemiante no estatínico es conveniente analizar subgrupos dentro de los cuatro grupos de beneficio demostrado con estatinas analizados previamente. Se insiste además en el uso mandatorio de dosis máximas toleradas de estatinas antes de indicar otro tipo de hipolipemiantes.
Fármacos hipolipemiantes distintos de las estatinas
Niacina: La evidencia disponible hasta ahora demuestra que la adición de niacina al tratamiento hipolipemiante de sujetos con alto riesgo CV no logra mejoría de los resultados CV. Además, se puede ver un aumento de eventos adversos como síntomas cutáneos, gastrointestinales, musculares, descompensación metabólica en diabéticos, tendencia a infecciones y sangrados.
El estudio HPS2-THRIVE incluyó 25.673 sujetos con enfermedad vascular tratados con simvastatina 40 mg por día aleatorizados a niacina asociada a laropiprant (antagonista prostaglandínico) versus placebo seguidos durante una media de 3.9 años. La adición de niacina no demostró mejoría en los eventos primarios de IAM no fatal, muerte de causa coronaria, ACV y revascularización arterial. La adición de niacina logró una disminución promedio de LDLc de tan solo 10 mg/dL. Se objetivó mayor incidencia de eventos adversos con niacina47.
Ezetimibe: Nueva evidencia proveniente del estudio IMPROVE-IT demuestra un beneficio clínicamentemodesto,pero estadísticamente significativo delagregado de ezetimibe al tratamiento con estatinas. Este ensayo incluyó 18.144 pacientes con SCA previo y LDLc entre 50-100 mg/dLque fueron aleatorizados a simvastatina 40 mg/día asociada aezetimibe 10 mg/díaosimvastatina en monoterapia.El seguimiento medio fue de 7 años. El grupo asignado a tratamiento combinado mostró una disminución adicional de LDLc de 24%, logrando una reducción del riesgo absoluto de 2% del objetivo primariocompuesto de muerte CV, IAM no fatal, angina inestable, revascularización, ACV no fatal (HR 0.938, IC 95% 0.89-0.99; P=0.016). No hubo diferencias significativas en los objetivos de seguridad19.
Secuestrantes de ácidos biliares: El grupo de trabajo del ACC considera el uso de estos fármacos como agentes de segunda línea en intolerantes a ezetimibe, principalmente diabéticos, basado en evidencia reciente derivada de un meta-análisis de 8 ensayos clínicos y 1.038 pacientes, que demostró una disminución significativa de los niveles de LDLc, glicemia de ayuno y HbA1c con el uso de colesevelam en relación a placebo. También se pudo objetivar un aumento significativo de los niveles de TG, por lo cual se contraindica su uso con hipertrigliceridemia ≥ 300 mg/dL. El perfil de seguridad decolesevelam fue bueno. Aunasí, no hay evidencia categórica del beneficiodel uso de secuestrantes de ácidos biliares en los resultados CV48.
Anticuerpos monoclonales: Recientemente la Food and Drug Administration (FDA ) y la European Medicines Agency(EMA) han aprobado el uso de los anticuerpos monoclonales alirocumab y evolocumab para el tratamiento de la hipercolesterolemia familiar heterocigota (evolocumab también se aprobó para la hipercolesterolemia familiar homocigota) y los pacientes con muy alto riesgo CV4,9. Estos fármacos inhiben la unión de una molécula llamada proproteina convertasa subtilisina-kexina tipo 9 (PCSK9) al receptor de LDLc.La PCSK9 se une al receptor de LDLcy favorece su fagocitosis y degradación a nivel lisosomal. Al inhibir la acción de la PCSK9, el receptor de LDLc es reciclado intacto tras ser fagocitado, permitiendo que cada receptor elimine varias partículas de LDLc del plasma.Como consecuencia aumenta la densidad de receptores de LDLc en la superficie celular hepática y el aclaramiento de partículas de LDLc del plasma(27, 49, 50). Estudios en fase III han demostrado la eficacia de estos fármacos en la reducción de los niveles plasmáticos de LDLc. A modo de ejemplo:
-En el estudio ODYSSEY LONG TERM, 2.341 pacientes con alto riesgo CV bajo tratamiento con dosis máximas toleradas de estatinas fueronasignaron en forma aleatoria a alirocumab 150 mg s/c cada 2 semanas versus placebo por un total de 78 semanas. A la semana 24 el valor de LDLc se redujo en un 62% con alirocumab en relación a placebo.Además, se objetivó una reducción del colesterol no-HDL de 52 puntos porcentuales. A destacar, se alcanzó un LDLc< 70 mg/dL en el 79.3% de sujetos asignados a alirocumab, mientras que en sujetos asignados a placebo solamente 8% logró dichos valores. Dentro de los efectos adversos se observó mayor incidencia de reacciones en el sitio de inyección, mialgias, trastornos neurocognitivos (principalmente mnésicos) y oftalmológicos con alirocumab. Un análisis pos-hoc mostró menor incidencia de eventos CV en este grupo, aunque los ensayos clínicos para evaluar el impacto sobre eventos CV adversos están todavía en marcha51.
-El estudio OSLER incluyó 4.454 pacientes que fueron aleatorizados a evolocumab 140 mg sc cada 2 semanas o 420 mg sc mensuales más tratamiento estándar o sólo tratamiento estándar. La mediana de seguimiento fue de 11 meses. Evolocumab redujo la concentración de LDLc un 61% (IC 95%, 59 a 63; p<0.001). Se observaron alteraciones neurocognitivas en menos del 1% de ambos grupos, peroéstas fueron más frecuentes en el grupo tratado con evolocumab. En un análisis exploratorio pre especificado hubo una reducción significativa de eventos cardiovasculares adversos totales al cabo de 1 año en el grupo asignado evolocumab más tratamiento estándar que en el de tratamiento estándar aislado (2.18% versus 0.95%; HR 0.47, IC 95% 0.28-0.98, p=0.003)52.
Uso de fármacos no estatínicos
Antes de agregar terapia no estatínica al plan terapéutico se debe asegurar la adherencia al tratamiento farmacológico, a los cambios en el estilo de vida y optimizar el control de otros FRCV 9. Por otra parte, el paciente debe estar con las dosis máximas de estatinas que tolere. Se deben considerar los objetivos terapéuticos deseables (porcentaje de reducción de LDLc y/o valores absolutos del mismo) y decidir en conjunto con el paciente la eventual adición de un hipolipemiante no estatínico teniendo en cuenta los riesgos y beneficios así como las preferencias del paciente9.
Para racionalizar el uso de fármacos no estatínicos el ACC realiza un análisis por subgrupos tomando como referencia los 4 grupos de riesgo originales.
Grupo 1 -Pacientes con enfermedad CV aterosclerótica clínica: El ACC identifica elementos que, de estar presentes ensombrecen el pronóstico CV en este grupo. Es así que se identifican 3 subgrupos:
1. Con comorbilidades- entendidas como la presencia de: DM, evento CV aterosclerótico reciente (<3 meses) o bajo estatinas,otros FRCV no controlados, elevación Lp(a), ERC que no esté en hemodiálisis.
2. Sin comorbilidades ni LDLc ≥ 190 mg/dL.
3. Con LDL ≥ 190 mg/dL sin causas secundarias.
Para los primeros dos subgrupos la sugerencia inicial es la adición de ezetimibe 10 mg/día al tratamiento con dosis máximas toleradas de estatinas. De no lograrse los objetivos terapéuticos se puede considerar el uso de anticuerpos monoclonales (combinados con los anteriores). Los secuestrantes de ácidos biliares se reservan para aquellos pacientes intolerantes a ezetimibe, aunque como ya fue mencionado no hay evidencia que mejoren los resultados CV(9, 19, 52).
Los objetivos terapéuticos son diferentes en estos dos subgrupos. La presencia de comorbilidades supone mayor riesgo CV, por lo cual el ACC sugiere alcanzar un valor absoluto de LDLc< 70 mg/dL. También se considera el uso de colesterol no-HDL como objetivo principalmente en diabéticos, en quienes el uso de LDLc como único valor de referencia puede no reflejar el potencial aterogénico de estos pacientes. Se sugiere utilizar un valor de colesterol no-HDL < 100 mg/dL como un segundo objetivo en estos sujetos.Cuando el paciente no presenta comorbilidades ni LDLc muy elevado, se puede considerar un valor de LDL < 100 mg/dL como objetivo terapéutico 9.
El tercer subgrupo engloba los sujetos con enfermedad clínica y LDLc ≥ 190 mg/dL. Estas personas presentan un riesgo CV muy elevado, y se debe aplicar las mismas consideraciones mencionadas anteriormente para el diagnóstico de dislipemias hereditarias5. La diferencia a la hora de considerar terapias noestatínicas radica en que los anticuerpos monoclonales son consideradosde primera elección en este subgrupo, ya que son más eficaces para disminuir el LDLc, relegando el ezetimibe a un segundo lugar. Además, algunos pacientes portadores de hipercolesterolemia familiar serán candidatos a terapias específicas como aféresisde lípidos 53y otros fármacos hipolipemiantes como mipomersen y lomitapide. Estos últimos presentan la característica de no influir en la densidad de receptores de LDLcde la superficie celular como sí lo hacen los otros grupos de hipolipemiantes considerados. La disminucióndel LDLcse logra a través de la inhibición de la síntesis de apolipoproteína B (mipomersen) o de VLDLc (lomitapide) (54.
En cuanto al valor objetivo de LDL, al situarse también en un grupo de mayor riesgo CV, el ACC considera un LDL < 70 mg/dL para lograr el máximo beneficio en este subgrupo9. Las recomendaciones terapéuticas para el tratamiento de estos subgrupos se resumen en las Figuras 1,Figura 2yFigura 3.
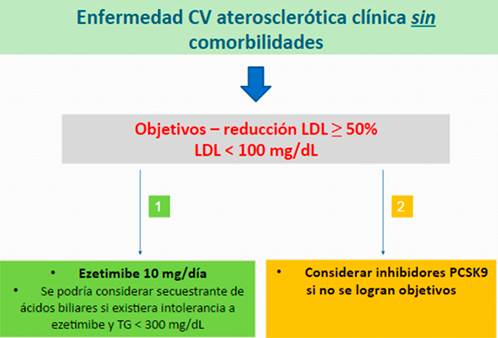
Figura 1 Algoritmo para el tratamiento no-estatínico en sujetos con enfermedad CV aterosclerótica clínica sin otras comorbilidades según el ACC 9.
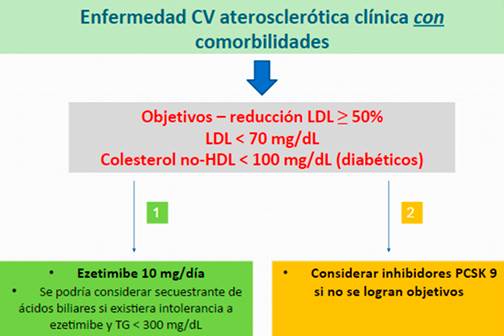
Figura 2 Algoritmo para el tratamiento no-estatínico en sujetos con enfermedad CV aterosclerótica clínica asociada a otras condiciones comórbidas según el ACC 9.
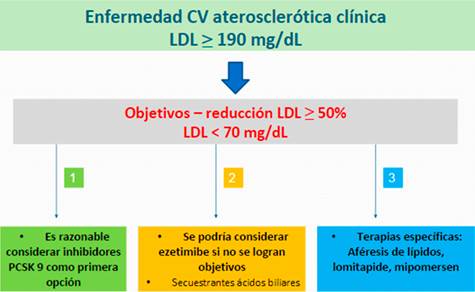
Figura 3: Algoritmo para el tratamiento no-estatínico en sujetos con enfermedad CV aterosclerótica clínica asociada a LDL ≥ mg/dL según el ACC 9.
Grupo 2 -Sujetos con LDL ≥ 190 mg/dL sin enfermedad clínica: Este grupo presenta menor respuesta a tratamientos no farmacológicos y a los principales grupos farmacológicos utilizados en la práctica clínica habitual. Por lo tanto, es frecuentemente necesaria la terapia combinada para lograr los objetivos terapéuticos.
El ACC recomienda el uso de ezetimibe y/o anticuerpos monoclonales, aunque en prevención primaria no define una preferencia clara entre estas dos opciones. También en este grupo se deben considerar las terapias específicas, en interconsulta con especialistas en dislipemias.
A la hora de considerar los objetivos de tratamiento, además de la reducción en términos de porcentaje del LDLc (terapia de alta intensidad, reducción esperada ≥ 50%), se debe tener en cuenta que estos pacientes habitualmente no logran reducciones muy marcadas en los valores absolutos de LDLc.
Es así que se debe considerar la presencia de otros FRCV y/o marcadores de riesgo (antecedentes familiares de enfermedad CV a edad temprana, ERC, evidencia de enfermedad aterosclerótica sub-clínica, elevación Lp(a) o hs-PCR). En ausencia de dichos factores el objetivo de LDL podrá ser más laxo, considerando valores absolutos < 130 mg/dL. La presencia de elementos de mayor riesgo CV supone un riesgo sobreañadido, por lo cual el ACC considera un LDL < 100 mg/dL en estos sujetos, considerando el valor de colesterol no-HDL < 130 mg/dL en diabéticos9. Las recomendaciones para el tratamiento de estos subgrupos se resumen en la Figura 4.
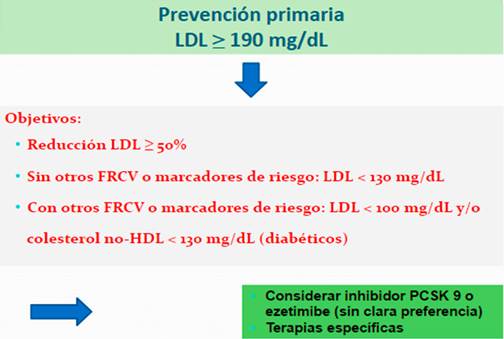
Figura 4: Recomendaciones para el tratamiento no-estatínico en sujetos con niveles de LDL ≥ 190 mg/dL según el ACC 9).
Grupo 3 -Pacientes con DM en prevención primaria: El documento de la ACC de 2016 reconoce el valor de laretinopatía, la albuminuria, la ERC, la elevación de Lp(a) y la aterosclerosis subclínica como indicadores de alto riesgo en los diabéticos, acercándose a las recomendaciones de la ESC(4, 9).
El ACC considera 2 subgrupos:
1. Riesgo CV a 10 años < 7,5%, sin evidencia de elementos de alto riesgo.
2. Riesgo CV a 10 años ≥ 7,5% y/o elementos de alto riesgo.
El primer subgrupo se beneficia del tratamiento con estatinas a dosis moderadas (reducción LDLc 30-50%). También se puede considerar un objetivo de LDLc< 100 mg/dL o de colesterol no-HDL < 130 mg/dL. Si no se logran estos objetivos el primer paso debe ser aumentar la intensidad del tratamiento con estatinas (reducción LDLc ≥ 50%). Si aun así no se logran los objetivos terapéuticos se puede considerar el agregado de ezetimibe. Los inhibidores PCSK9 no tienen lugar en sujetos sin enfermedad ateromatosa clínica o LDLcmuy alto ≥ 190 mg/dL.
En individuos con riesgo CV a 10 años ≥ 7,5% y/o elementos de alto riesgo, la intensidad del tratamiento con estatinas debe ser alta desde el inicio, actuando de forma similar en el resto de los aspectos descriptos para el primer subgrupo(5, 9). Las recomendaciones para el tratamiento de los diabéticos se resumen en las Figura 5 y Figura 6.

Figura 5: Recomendaciones para el tratamiento de pacientes diabéticos con bajo riesgo CV y ausencia de elementos de alto riesgo según el ACC 9).

Figura 6: Recomendaciones para el tratamiento de pacientes diabéticos con alto riesgo CV y/o presencia de elementos de alto riesgo según el ACC 9).
Grupo 4 -Sujetos en prevención primaria con riesgo CV a 10 años ≥ 7,5%: De forma similar al grupo anterior, se deben considerar elementos de mayor riesgo CV a la hora de decidir la intensidad del tratamiento con estatinas.
Aquellos sujetos con elementos de alto riesgo (riesgo CV a 10 años ≥ 20%, LDL ≥ 160 mg/dL, otros FRCV mal controlados, antecedentes familiares de enfermedad CV precoz, elevación de Lp(a) o hs-PCR, aterosclerosis subclínica, otras comorbilidades -VIH, enfermedades inflamatorias crónicas, ERC-), y/o quienes no presenten respuesta suficiente a dosis moderadas de estatinas son candidatos a recibir ezetimibe previa optimización del tratamiento estatínico con dosis máximas toleradas. También se puede considerar un valor absoluto de LDL < 100 mg/dL como objetivo en estos sujetos.
Si el riesgo CV a años es < 7,5%, el ACC recomienda no considerar agentes noestatínicos9). Las recomendaciones en estos subgrupos se resumen en la Figura 7.
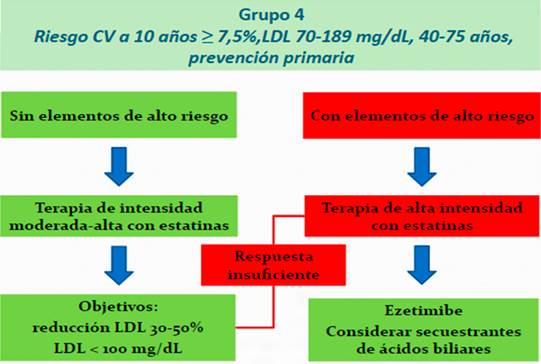
Figura 7: Recomendaciones para el tratamiento de sujetos en prevención primaria con alto riesgo CV a 10 años según el ACC 9).
Guía ESC 2016
Tanto laguía ACC/AHA como la de las ESC abordan el tratamientodelahipercolesterolemia a partir de la valoración del riesgo CV, identificando sujetos con mayor probabilidad de beneficio neto con el tratamiento hipolipemiante.
La pauta de la ESC consideraque quienes presenten enfermedad CV documentada, DM 1 o 2, niveles muy altos de algún FRCV individual, ERC o hipercolesterolemia familiar, tienen un riesgo CV lo suficientemente elevado como para justificar el inicio del tratamiento hipolipemiante.
Todos los demás individuos deberían ser evaluados con algún calculador de riesgo. La ESC recomienda el sistema SCORE, que utiliza la edad (traducción del tiempo de exposición a un factor de riesgo), el sexo, la PA sistólica, el valor de colesterol total y el tabaquismo. SCORE estima el riesgo CV a 10 años de eventos ateroscleróticos fatales (para calcular eventos totales fatales y no fatales se multiplica x 3 en hombres y x 4 en mujeres). SCORE permite ajustar el cálculo del riesgo CV según el riesgo poblacional en cada país europeo (alto o bajo riesgo, basado en las tasas de mortalidad por enfermedad CV) (55).
Es importante destacar que los distintos calculadores de riesgo disponibles son poco confiables al ser aplicados a poblaciones con características distintas a las analizadas en los estudios epidemiológicos a partir de los cuales surgen los mismos56.No hay calculadores basados en poblaciones latinoamericanas, debiéndose asumir algún grado de similitud con poblaciones de origen europeo, si bien esto puede llevar a errores en la estimación.
La guía de la ESC propone la categorización de los pacientes en grupos de riesgo, definidos como:
1-Riesgo muy alto:
-Enfermedad CV documentada clínicamente: IAM, SCA, revascularización coronaria, CRVM, otros procedimientos de revascularización arterial, ACV, AIT, enfermedad arterial periférica.
-Enfermedad CV documentada por imagen: hallazgos que predispongan a eventos clínicos, ej. placas carotídeas.
-DM con daño en órgano blanco como albuminuria o algún FRCVmayor.
-ERC severa con FG < 30 ml/min.
-SCORE ≥ 10 %.
2-Riesgo alto:
-Elevación marcada de un FRCV (colesterol total> 310 mg/dL, PA ≥ 180/110 mmHg).
-DM sin daño de órgano blanco.
-ERC moderada con FG 30-60 ml/min.
-SCORE 5-10%.
3-Riesgo moderado:
-SCORE 1-5%.
4-Riesgo bajo:
-SCORE < 1%.
Como puede versetanto lapauta americana como la europea consideran a los individuos con enfermedad clínica establecida como un grupo de alto riesgo CV en el cual el tratamiento hipolipemiante está plenamente justificado. La guía europea y el documento del ACC de 2016 analizado previamente concuerdanen elmayor riesgo CV en individuos con DM (principalmente con daño de órgano blanco), o con ERC o con enfermedad aterosclerótica subclínica (CAC ≥ 300 unidades Agatston o ≥ P75 para edad y sexo, índice tobillo-brazo < 0,9, enfermedad coronaria por TC -estenosis única > 60% o múltiples > 30%-, placas carotídeas o periféricas). Estos pacientes también se benefician del tratamiento intensivo hipolipemiante (4, 9).
Cuando se estima el riesgo CV en individuos asintomáticos se deben considerar factores que, si bien no se incluyen en los calculadores disponibles, influyen en el riesgo (reclasificación de riesgo). Es así que en personas con riesgo moderado-bajo se deben considerar elementos como: otras patologías (sindrome de apnea del sueño, VIH, enfermedades inflamatorias crónicas, enfermedades psiquiátricas, IMC, HVI), nivel socio-económico y los niveles de ApoB, TG, Lp(a) y hs-PCR(4, 57).
Una vez establecido el nivel de riesgo CV y los valores de LDLc se puede definir quienes presentan indicación de tratamiento 4:
-Riesgo muy alto: Si el LDLc ≥ 70 mg/dLse sugiere tratamiento farmacológico. Si el LDLc< 70 mg/dL se sugiere considerar tratamiento farmacológico.
-Riesgo alto: Si el LDLc ≥ 100 mg/dL se sugiere tratamiento farmacológico. Si el LDLc está entre 70 y100 mg/dL se sugiere considerar tratamiento. Si el LDLc< 70 mg/dL no se aconseja intervención farmacológica.
-Riesgo moderado: Si elLDLc ≥ 100 mg/dLse sugiere considerar tratamiento farmacológico y no tratar si el LDLc< 100 mg/dL.
-Riesgo bajo: Considerar tratamiento solamente si LDLc ≥ 190 mg/dL.
Luego de identificar a los sujetos con indicación de tratamiento farmacológico la pauta ESC 2016 plantea identificar los objetivos terapéuticos, en vistas a lograr una mejor individualización del tratamiento estableciendo metas concretas en base a valores absolutos de LDLc y al porcentaje de reducción necesario para conseguirlos.
Objetivos primarios 4:
-Riesgo muy alto-LDLc< 70 mg/dLo reducción del 50% si LDLc basal está entre 70 y 135 mg/dL.
-Riesgo alto-LDLc< 100 mg/dLo reducción del 50% si LDLc basal es de 100 a 200 mg/dL.
-Riesgo bajo o moderado -LDL < 115 mg/dL.
Objetivos secundarios4:
-Colesterol no-HDL: Riesgo muy alto < 100 mg/dL, riesgo alto < 130 mg/dL, riesgo moderado < 145 mg/dL.
-ApoB: riesgo muy alto < 80 mg/dL, riesgo alto < 100 mg/dL.
-Otros objetivos con menor nivel de evidencia: HDLc> 40 mg/dL en hombres o > 48 mg/dL en mujeres, TG < 150 mg/dL.
Cuando se considera un punto de corte para los objetivos de LDLc se debe tener en cuenta que cualquiera sea el valor elegido, este es arbitrario. El riesgo CV y los valores de LDLc presentan una relación continua. Aún más, no se estableció ningún límite de LDLc a partir del cual el riesgo de tratar supere al beneficio obtenido, y hay nueva evidencia que muestra que inclusoniveles muy bajos de LDLc se asocian a menor riesgo CV(6, 7, 31, 58).
El uso exclusivo de ECAs, revisiones sistemáticas y meta-análisis propuesto en 2013 por el ACC/AHA, si bien permite establecer recomendaciones con alto nivel de evidencia, presenta algunas debilidades. En primer lugar, existe un sesgo de selección dado por los criterios de inclusión y exclusión de los ECAs, lo cual aleja dicha población de los pacientes de la práctica clínica habitual (o sea, la validez externa delos estudios es menor).En segundo lugar, existen períodos de “run-in”, en los cuales los potenciales candidatos a formar parte del estudio se exponen a los fármacos empleados, siendo posteriormente incluidos sólo aquellos sujetos que no presenten intolerancia a los mismos (inclusión de quienes toleran el fármaco) y quienes cumplen correctamente la indicación terapéutica. En tercer lugar, los ECAs de estatinas habitualmente presentan períodos de seguimientos cortos, que raramente superan los 4-5 años, por lo cual las recomendaciones de eficacia y seguridad pierden sustento para el uso a largo plazo.Finalmente se debe destacar que ningún ECA usó objetivos de porcentaje de disminución de LDLc como los propuestos por la AHA. Es así que la pauta ESC 2016 entiende importante incorporar evidencia disponible proveniente de estudios con menor calidad metodológica a la hora de implementar una estrategia de tratamiento individualizada (4, 59).
Una vez identificados los candidatos a tratamiento y los objetivos terapéuticos, la guía ESC 2016 plantea como recomendaciones terapéuticas:
-Tratamiento de primera línea con estatinas a dosis máximas recomendadas o toleradas (nivel de evidencia I, A).
-En casos de personas intolerantes a estatinas se sugiere considerar el uso de ezetimibe y/o secuestrantes de ácidos biliares (nivel de evidencia IIa, C).
-Si no se logran objetivos se sugiere considerar terapia combinada con ezetimibe (nivel de evidencia IIa, B).
-Si no se logran objetivos, se podría considerar terapia combinada con secuestrantes de ácidos biliares (nivel de evidencia IIb, C).
-Se podría considerar un inhibidor PCSK9 en sujetos de muy alto riesgo con LDLc elevado a pesar de tratamiento a dosis máximas con estatinas combinado con ezetimibe o en intolerantes a estatinas (nivel de evidencia IIb, C).
Estas recomendaciones aparecen como similares a las realizadas por el ACC, con posturas parecidas principalmente para los pacientes de mayor riesgo CV. Las recomendaciones pueden resumirse de la siguiente forma4:
1. Evaluar el riesgo CV total del paciente.
2. Involucrar al paciente en las decisiones sobre la gestión del riesgo CV.
3. Identificar el objetivo de LDLc para el nivel de riesgo y calcular el porcentaje de reducción necesario para conseguirlo.
4. Elegir una estatina y una dosis que, en promedio, pueda proporcionar esta reducción.
5. La respuesta al tratamiento con estatinas es variable y por lo tanto puede ser necesario el ajuste de dosis.
6. Si la dosis máxima tolerada de estatinas no alcanza el objetivo terapéutico puedeasociarse otros fármacos hipolipemiantes.
Aspectos relevantes de seguridad
Un alto número de pacientes que reciben estatinas toleran bien el tratamiento. Pero hay personas que desarrollan efectos adversos significativos. La intolerancia a estatinas puede definirse como un sindrome clínico que se caracteriza por la incapacidad de realizar un tratamiento a largo plazo con estas drogas debido a la aparición de síntomas o alteraciones en biomarcadores que se pueden atribuir al inicio o aumento de dosis de estatinas y que no son explicadas por otras causas.La intolerancia puede ser total (intolerancia a todas las estatinas a cualquier dosis) o parcial (intolerancia a algunas estatinas o algunas dosis)60. Si bien la toxicidad muscular es el evento adverso más relevante, existen otras causas de intolerancia a estatinas.
Miopatía
La prevalencia de la toxicidad muscular por estatinas es controvertida. En la práctica clínica, entre 10-25% de los sujetos pueden experimentar estos efectos adversos, que constituyen una de las principales causas de discontinuación del tratamiento. La prevalencia reportada en los ECAs es mucho menor, siendo de aproximadamente 0.5 casos por mil cada 5 años para casos leves y 0.1 casos por mil cada 5 años para formas severas como rabdomiólisis.Esta discordancia podría explicarse por sesgos metodológicos como los períodos de “run-in” mencionados anteriormente. El inicio de los síntomas puede ocurrir en cualquier momento, aunque de forma más frecuente sucede luego de semanas o meses de iniciado el tratamiento. En dos tercios de los casos aparecen en los primeros 6 meses de tratamiento61.
Para homogeneizar conceptos se citan las definiciones aportadas por el National Lipid Association Statin Muscle Safety Task Force en 2014 62:
-Mialgia: disconfort muscular inexplicado; incluye dolor, rigidez, hipersensibilidad, calambres relacionados con el ejercicio, fatiga. Los niveles de creatinkinasa (CK) sonnormales.
-Miopatía: debilidad muscular (que no depende de dolor), con o sin elevación de CK.
-Miositis: inflamación muscular.
-Mionecrosis: elevación de CK en relación a nivel basal o por encima del límite superior normal (LSN) para edad, raza y sexo. Esta puede ser leve: elevación entre 3 y 10 veces por encima del LSN, moderada: elevación entre 10 y 50 veces por encima del LSN, o severa: elevación superior a 50 veces por encima del LSN.
-Rabdomiólisis: Mionecrosis asociada a mioglobinuria y/o falla renal aguda (aumento de creatinina ≥ 0,5 mg/dL).
Existen distintos factores de riesgo de afectación muscular que deben ser tenidos en cuenta al indicar una terapia con estatinas.
En primer lugar, el tipo de estatina puede influir en su perfil de seguridad muscular. Las estatinas hidrofílicas (pravastatina, rosuvastatina) tienen menor toxicidad muscular, probablemente en relación a una menor penetración muscular, que las estatinas más lipofílicas (simvastatina, atorvastatina)63.La FDA desaconseja el uso de simvastatina a dosis altas (80 mg) debido al aumento en la incidencia de toxicidad muscularbasado en los resultados del estudio SEARCH22.
En segundo lugar, los sujetos portadores de enfermedades musculares previas presentan mayor predisposición a toxicidad muscular y aparición de nuevas manifestaciones por su patología. Ocurre algo similar en pacientes con esclerosis lateral amiotrófica64.
Otros factores de riesgo que aumentan la incidencia de toxicidad muscular por estatinas son: hipotiroidismo, ERC, enfermedad hepática, factores genéticos, etnia, sexo femenino, añosos (> 80 años) y adultos mayores frágiles, deficiencia de vitamina D e historia de intolerancia a estatinas(4, 5, 62)
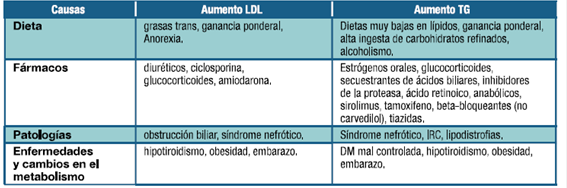
Otro aspecto importante a valorar es el uso de fármacos que interaccionan con el metabolismo de las estatinas, aumentando el riesgo de toxicidad. Los inhibidores de la CYP3A4 como ciclosporina, macrólidos, azoles, inhibidores de la proteasa, antagonistas cálcicos y amiodarona disminuyen la metabolización hepática de estatinas. El gemfibrozil también aumenta el riesgo de toxicidad por estatinas y no debe administrarse junto con ellas. También se debe considerar la posibilidad de toxicidad muscular secundaria a otros fármacos (ej. miopatía esteroidea)(4, 62, 65).
Todos estos factores deben ser tenidos en cuenta a la hora de tomar una decisión para iniciar un tratamiento con estatinas. En individuos con alto riesgo de eventos adversos musculares se puede considerar dosificar CK previo al inicio del tratamiento, según ambas pautas analizadas anteriormente.Si la CK supera más de 4 veces el LSN, se debe reconsiderar el inicio de estatinas. No se sugiere realizar dosificación de CK de rutina. Durante el tratamiento se sugiere solicitarla en caso de presentarse síntomas musculares (dolor, debilidad, calambres, rigidez, fatiga)(4, 5).
En individuos que presenten síntomas musculares severos se debe suspender el tratamiento y descartar formas severas de toxicidad muscular como rabdomiólisis (dosificación de CK, valoración de la función renal, y búsqueda de mioglobinuria). Ante la presencia de síntomas leves a moderados se debe suspender el tratamiento (principalmente ante elevaciones marcadas de la CK por encima de 10 veces su valor normal) y descartar otras causas de miopatía (otros fármacos, hipotiroidismo, enfermedades reumatológicas como polimialgia reumática, deficiencia de vitamina D).(4, 5, 62)
La suspensión del tratamiento (período “wash-out”) se debe realizar durante al menos 2 a 4 semanas. Se valorará entonces la remisión de los síntomas. Una vez resueltos, se podrá reintroducir la misma estatina u otra estatina a dosis bajas (la pauta ACC/AHA recomienda la reintroducción de la misma estatina para establecer un vínculo causal) (4, 5, 60).Si reaparecen los síntomas se puede considerar un plan terapéutico con administración una o dos veces por semana de dosis bajas a moderadas de estatinas de alta eficacia y vida media larga como rosuvastatina (5-10 mg) o atorvastatina (5-10 mg), ya que hay evidencia que muestra una reducción significativa de los valores de LDLc(59, 60, 66, 67).Si bien suele ser mejor tolerado, este plan puede llevar a la reaparición de síntomas en algunos casos.En estos casos se debe considerar el inicio de terapia no-estatínica luego de mejorados los síntomas (60.
Efectos hepáticos
Un porcentaje pequeño de los sujetos en tratamiento con estatinas pueden ver aumentado los valores de enzimas hepáticas (ALAT principalmente), aunque el desarrollo de hepatitis clínicamente significativa es raro. El momento de inicio de los síntomas es en general 3-4 meses luego de iniciado el tratamiento. Suele haber una mejoría rápida luego de la suspensión del fármaco y puede haber recidiva al reintroducir la droga. La atorvastatina y la simvastatina son los fármacos más comúnmente implicados. Se considera seguro el uso de estatinas en pacientes con enfermedad hepática compensada, que no representa entonces una contraindicación para su utilización(62, 68). Las guías recomiendan la dosificación de enzimas hepáticas previo al inicio del tratamiento, o ante la aparición de síntomas sugestivos de toxicidad hepática.Se sugiere no repetir estas dosificaciones de forma rutinaria. La elevación superior a 3 veces de la ALAT determina la necesidad de suspensión transitoria de tratamiento y reinstalación progresiva para evaluar tolerancia (4, 5).
Diabetes mellitus
El riesgo de desarrollar DM de novo aumenta en forma modesta con el uso de estatinas (0.1 casos / 100 personassometidas 1 año a tratamiento de intensidad moderada y 0.2 casos /100 personassometidas 1 año a tratamiento de alta intensidad).Este riesgo es mayor en sujetos con factores de riesgo previos para desarrollar DM. En el estudio JUPITER los sujetos con más de un FR para desarrollarDM(sindrome metabólico, glicemia de ayuno alterada, aumento del IMC, aumento de la HbA1c)presentaron un aumento del riesgo de diabetesde 28% en relación a los no tratados; en cambio, los individuos sin factores de riesgo para DM no tuvieron unaumento de incidencia de la misma(40, 62). Se recomienda screening de DM en sujetos con predisposición para esta enfermedad que reciban estatinas.Sin embargo, en pacientes con indicación clara de estatinas, el beneficio CV del tratamiento con estos fármacos supera ampliamente el potencial riesgo secundario a la DM.Parece por tanto apropiadoiniciar tratamiento antidiabético sin suspender las estatinas en quienesdesarrollen DM (4, 5, 62).
Trastornos cognitivos
Hay reportes de casos y series de casos de trastornos mnésicos y confusión vinculados a estatinas, aunque su presencia no se ha documentado en ensayos clínicos grandes. Estos efectos son menores y responden bien a la suspensión del fármaco, o en su defecto, el cambio por una estatina hidrofílica como rosuvastatina. Ante la presencia de síndrome confusional debe descartarse causas sistémicas, neuropsiquiátricas y farmacológicas(5, 62, 69, 70)
Hemorragia cerebral
La pauta ACC/AHA plantea reparos a la hora de iniciar un tratamiento de alta intensidad con estatinas en individuos con antecedentes ACV hemorrágico 5. Un análisis post-hoc del estudio SPARCL (sujetos con ACV o AIT previo aleatorizados a atorvastatina 80 mg día o placebo) encontró que el tratamiento con atorvastatina se asoció de forma independiente a un aumento del riesgo de ACV hemorrágico (HR 1.66, IC 95% 1.08 a 2.55)23. Sin embargo, un meta-análisis publicado en 2012 que incluyó 31 ECAs con más de 180.000 sujetos no encontró diferencias en la incidencia de ACV hemorrágico entre los grupos activo y control (ya sea con estatinas a dosis altas versus dosis bajas,o estatinas versus placebo) (71.
Otros efectos adversos a tener en cuenta son los gastrointestinales (meteorismo, diarrea, náuseas, vómitos) pudiendo estar presentes y ser causa de suspensión del tratamiento en hasta el 5% de los casos62.
Poblaciones especiales y aspectos controvertidos
Papel de los cambios en el estilo de vida
El beneficio de los cambios en el estilo de vida en la reduccióndel riesgo CV es ampliamente aceptado, si bien la evidencia disponible proviene sobre todo de estudios de menor calidad metodológica (poblacionales, epidemiológicos, observacionales)(4, 55, 72).El énfasis desmedido en el uso de estatinas puede llevar a una medicalización inapropiada de la población. Se debería tener en cuenta que un grupo de sujetos con alto riesgo CV estimado podría lograr una disminución del mismo sin necesidad de tratamiento farmacológico, principalmente individuos altamente motivados con factores de riesgo corregibles. Por lo tanto, aquellos pacientes en prevención primaria sin elementos de alto riesgo podrían intentar reducir su nivel de riesgo mediante el control de otros FRCV y la adopción de hábitos de vida saludables. Quienes luego de un plazo prudencial de 3 a 6 meses no logran dicho objetivo, deberían considerarse como candidatos para el inicio de tratamiento farmacológico59.
Estatinas en pacientes diabéticos
ECA. CARDS es el único ECA realizado en forma exclusiva en diabéticos en prevención primaria.Incluyó2.838 pacientes entre 40 y 75 años de edad que se asignaron en forma aleatoria a atorvastatina 10 mg día o placebo. Los criterios de inclusión eran además del rango etario señalado los siguientes: LDL ≤ 160 mg/dL, TG ≤ 590 mg/dL, y una o más de las siguientes condiciones: HTA, retinopatía, micro o macroalbuminuria o tabaquismo.La mediana de seguimiento fue 3.9 años.El objetivo primario fue el tiempo al primero de cualquiera de estos eventos: SCA, revascularización coronaria o ACV. El grupo asignado a atorvastatina mostró una reducción del mismo de 37% (IC 95% -52 a -17, p=0.001).Hubo una reducción de 36% en la tasa de eventos coronarios agudos, 31% en la necesidad de nueva revascularización y 48% en la tasa de ACV. Se observó además una tendencia a disminuciónde la mortalidad de 27%. 28
Dos estudios de prevención primaria ASCOT-LLA y HPS incluyeron un subgrupo significativo de diabéticos tipo 2.
En la rama de tratamiento hipolipemiante del estudio ASCOT (ASCOT-LLA)73se incluyó 10.305 pacientes hipertensos que además tenían al menos otros 3 FRCV y con concentraciones de LDLc plasmático ≤ 6.5 mmol/L. Los pacientes fueron asignados a recibiratorvastatina 10 mg día o placebo. En el subgrupo de diabéticos tipo 2 (n=2.532) latasa de eventos cardiovasculares mayores o procedimientos fue significativamente menor en los asignados a atorvastatina que en aquellos asignados a placebo (HR 0.77, IC 95% 0.61-0.98; P=0.036). El número de eventos de cada uno de los componentes individuales de este objetivo compuesto fue baja y por tanto, si bien hubo una reducción de eventos coronarios y de ACV en el grupo tratado con atorvastatina, esta reducción no alcanzó significación estadística74.
El estudio HPS75 incluyó personas con edad entre 40 y 80 años, niveles de colesterol total ≥ 135 mg/dL, y que además eran diabéticos (5.963) o portadores de enfermedad arterial oclusiva, sin diagnóstico previo de diabetes (14.573).Los pacientes fueron asignados a simvastatina 40 mg por día o placebo. El objetivo primario fue el primer evento coronario mayor (IM no fatal o muerte coronaria) y el primer evento vascular mayor (evento coronario mayor, ACV o revascularización). Tanto en los diabéticos como en los no diabéticos el grupo asignado a simvastatina mostró reducciones altamente significativas en torno al 25% en las tasas de primer evento coronario mayor, ACV y revascularización. Entre los diabéticos, la incidencia de cualquiera de estos eventos vasculares mayores se redujo un 22% (IC 95% 13-30, p<0.0001) similar a la observada en otros sujetos de alto riesgo estudiados. Hubo también una reducción altamente significativa de 33% en el objetivo primario en los 2.912 participantes diabéticos sin enfermedad arterial oclusiva al ingresar en el estudio (IC 95% 17-46, p=0.0003) 21.
No hay estudios de prevención primaria que comparen dosis altas versus dosis bajas de estatinas en diabéticos.
Meta-análisis. Un meta-análisis delos CTTCincluyó datos individuales de participantes en 14 ECAs.Hubo 18.686 diabéticos tipos 1 y 2 que fueron comparados con más de 71.000 no diabéticos. Por cada mmol/L (39 mg/dL) de reducción del LDLc se objetivó una reducción de la mortalidad vascular de 23%, una reducción de eventos vasculares mayores de un 21%, una reducción de IAM o muerte coronaria de 22%, una reducción de las tasas de revascularización coronaria de 25% y de ACV de 21%. Los efectos fueron similares en diabéticos y no diabéticos.Entre los diabéticos no hubo diferencia según tipo de DM, edad, sexo, nivel de LDLc, HTA, IMC, tabaquismo, filtrado glomerular (ERC) o enfermedad aterosclerótica previa (prevenciónprimaria o secundaria)76.
Si se analiza la evidencia disponible parece claro el beneficio del tratamiento con estatinas en los resultados CV delossujetos diabéticos.
Críticas. - El aumento en la morbi-mortalidad CV en sujetos diabéticos está bien establecido. La DM se asocia con el doble de riesgo de enfermedad coronaria o ACV, y aumenta de 2 a 4 veces la mortalidad por dichos eventos. Más del 65% de los pacientes diabéticos fallecen por causas CV (4, 77). Sin embargo, la noción que la DM tiene un riesgo CV equivalente a la enfermedad coronaria establecida ha sido cuestionada. Algunos estudios en sujetos diabéticos sin IAM previo encuentran que el riesgo de eventos CV totales es un 43% menor que en sujetos no diabéticos con IAM previo 77. Por ende, no necesariamente todos los diabéticos en prevención primaria deberían recibir el mismo tratamiento que los pacientes en prevención secundaria (59, 77).
Por otro lado, los estudios que incluyeron diabéticos en prevención primaria reclutaron pacientes con riesgo CV alto, en promedio mayor a 20% a 10 años. Sin embargo, en estudios poblacionales el riesgo de eventos coronarios fatales o no fatales a 10 años en diabéticos es menor y de aproximadamente 11%59).Esto cuestiona la extrapolación de los ECAs a todos los diabéticos en general y sugiere que podrían existir diabéticos de riesgo no alto (jóvenes, con corto tiempo de evolución, con estilo de vida optimizado y otros factores de riesgo controlados).
Dislipemia aterogénica. -La dislipemia diabética es un conjunto de alteraciones en las lipoproteínas y lípidos del plasma, caracterizado por la presencia de remanentes aterogénicos (quilomicrones, VLDL), LDL pequeñas y densas y partículas HDL ricas en TG. El perfil lipídico se caracteriza por la combinación de valores de LDLc normales o cercanos a la normalidad, HDLc bajo y TG altos. Es por esto que el colesterol no-HDL aparece como mejor parámetro para estimar el riesgo CV en los diabéticos(4, 59, 78). La terapia con fibratos en combinación con estatinas en diabéticos con hipertrigliceridemia no ha demostrado, sin embargo, beneficio CV claro. En el estudio ACCORD 5.518 pacientes DM con alto riesgo CV (aproximadamente 30% eventos coronarios previos, tabaquismo, obesidad, HTA), bajo tratamiento con estatinas, se asignaron en forma aleatoria a fenofibrato o placebo. No se observó diferencias en el objetivo primario de eventos CV fatales, IAM no fatal y ACV no fatal. En un análisis por subgrupos se vio que el grupo con TG > 204 mg/dLy HDL < 34 mg/dL mostró tendencia a menores eventos CV adversos con el agregado de fenofibrato, aunque la misma no fue estadísticamente significativa (p=0.06)79.
Por lo tanto, en diabéticos, aún en presencia de hipertrigliceridemia, el tratamiento de primera línea con vistas a mejorar los resultados CV son las estatinas, pudiendo considerarse otros fármacos hipolipemiantes en caso de no conseguir los objetivos terapéuticos80.
La hipertrigliceridemia (TG > 150 mg/dL) puede clasificarse en leve (TG 150-199 mg/dL), moderada (TG 200-999 mg/dL), severa (1000-1999 mg/dL) y muy severa (TG > 2000 mg/dL). Con niveles de TG en rango de severidad aumenta el riesgo de pancreatitis, por lo queel plan terapéutico debe incluir un fibrato. Puede usarse fenofibrato o ciprofibrato asociado a estatinas (4, 81).
Insuficiencia cardíaca sintomática - Clase Funcional II-IV de la NYHA
Tanto la guía ACC/AHA 2013 como la guía europea del 2016 consideran insuficiente la evidencia para recomendar el uso sistemático de estatinas en sujetos con IC CF II-IV, si bien plantean mantener dicho tratamiento en caso de recibirlo previamente y ser bien tolerado (4, 5).
Pocos ECAs estudiaron el efecto de las estatinas en pacientes con insuficiencia cardíaca.El estudio CORONA incluyó 5.011 sujetos con edad ≥ 60 años e IC CF II-IV de etiología isquémica y con disfunción sistólica del VI(FEVI ≤ 40%). Estos pacientes fueron asignados a rosuvastatina 10 mg día o placebo. No hubo diferencias significativas en el objetivo final compuesto de muerte de causa CV, IAM no fatal o ACV no fatal. Tampoco hubo diferencias en la mortalidad global o CV. Se comprobó en cambio una reducción significativa en el número de hospitalizaciones por causa CV. No hubo aumento de eventos adversos con rosuvastatina82.
En el estudio GISSI-HF se aleatorizaron 4.574 pacientes con IC CF II-IVindependientemente de la etiología o el valor de la FEVI a rosuvastatina 10 mg día o placebo. No hubo diferencias significativas en ninguno de los dos objetivos primarios de mortalidad CV ni de mortalidad CV/ingreso hospitalario de causa CV83.
Un meta-análisis reciente que engloba ambos estudios demostró una reducción estadísticamente significativa del riesgo de IAM de 19% en sujetos con IC de etiología isquémica tratados con rosuvastatina84. Se podría sugerir entonces el inicio de estatinas en sujetos con IC sintomática de etiología isquémica si tienen una expectativa de vida razonable(por ejemplo, mayor a 2 años, con mayor posibilidad de nuevos eventos vasculares oclusivos).(82, 83)No existe evidencia que apoye el inicio de tratamiento con estatinas en sujetos con IC de causa no isquémica en ausencia de otras indicaciones. Tampoco hay evidencia que avale el uso de agentes no-estatínicos en estos casos.
Enfermedad Renal Crónica
La presencia de ERC supone mayor riesgo CV en la población adulta principalmente con FG < 60 ml/min/1,73m2 (estadios 3 o superior) (.Lasguías de la ESC y del ACC 2016 incluyen estos pacientes dentro de los grupos con alto o muy alto riesgo CV(4, 9). Típicamente estos pacientes presentan anomalías cuantitativas y cualitativas en el perfil lipídico, habitualmente con dislipemias mixtas altamente aterogénicas, si bien el valor de LDL puede, en algunas etapas de la enfermedad renal, situarse en valores cercanos a la normalidad 9.
El uso de estatinas en personas con ERC sin requerimiento dialítico en prevención primaria tiene efectos beneficiosos, con una disminución de la tasa de muerte, eventos CV mayores, muerte de causa CV e IAM en un 20 a 25% aproximadamente, hecho que se muestra en un meta-análisis de 50 ECAs (47 valoraron estatinas vs placebo y 3 distintas dosis de estatinas) que involucró 45.285 pacientes. Los efectos del tratamiento sobre la tasa de ACV o progresión de la ERC fueron inciertos. Cabe destacar que el riesgo de sesgo en los estudios fue elevado (86.
En el estudio SHARP se aleatorizaron 9.270 pacientes (3.023 en hemodiálisis) a recibir simvastatina 20 mg más ezetimibe 10 mg o placebo. Luego de una media de seguimiento de 4.9 años, el grupo bajo tratamiento con simvastatina y ezetimibe presentó una reducción de eventos CV mayores de 17%, dependiente sobre todo de una reducción en las tasas de ACV y procedimientos de revascularización. Se encontró menor incidencia de IAM o muerte coronaria, si bien no se alcanzó la significancia estadística87.SHARP no tuvo suficiente poder estadístico para compararla tasa de eventos vasculares adversos en pacientes con y sin sustitución de la función renal.
En contraste con lo dicho hasta acá, no se ha demostrado beneficio con el uso de estatinas en pacientes con insuficiencia renal terminal que requieren sustitución de la función renal. Los estudios 4D88 y AURORA (89 realizados en sujetos en hemodiálisis no mostraron beneficio CV luego del inicio del tratamiento con estatinas. Por tanto, en sujetos en diálisis que no recibían estatinas en forma previa no hay evidencia que apoye el inicio del tratamiento en esta etapa de la ERC. En aquellos que ya recibían estatinas y que presentan buena tolerancia se debería continuar el tratamiento (88 - 90).
Una posible explicación de la falta de efectividad de las estatinas en la ERC terminales que, si bien el riesgo de enfermedad CV aumenta de forma proporcional con el avance de la enfermedad renal, el patrón de enfermedad CV se altera, con un aumento de eventos arrítmicos e IC. Esto se debe a un aumento en la rigidez y calcificación arterial, con remodelación estructural cardíaca e hiperactividad simpática, principalmente con FG < 30 ml/min/1,73m 2(88,89) .
Las guías KDIGO 2013 sugieren iniciar tratamiento con estatinas en adultos mayores de 50 años con ERC, particularmente en quienes tienen un FG < 60 ml/min/1,73m2 y no se encuentran en etapa de sustitución de la función renal. Esta recomendación se realiza tanto para ERC proteinúrica o no proteinúrica. Además, las guías KDIGO recomiendan en contra de la estrategia de tratar para lograr objetivos absolutos de LDLc. Los argumentos son la falta de ECAs y el mayor riesgo de efectos adversos con dosis altas de estatinas en esta población. Por lo tanto, se deberían utilizar dosis bajas-moderadas de estatinas sin necesidad de alcanzar valores absolutos de LDLc predefinidos. En sujetos jóvenes entre 18-49 años, el tratamiento con estatinas debería iniciarse si existe enfermedad arterial coronaria, ACV isquémico, DM o riesgo CV a 10 años elevado (90).
Trasplante renal y cardíaco
A pesar de los avances en el tratamiento inmunosupresor y de la disminución de las tasas de rechazo, los trasplantados renales presentan una expectativa de vida significativamente menor que el resto de la población, sobre todo por el aumento de eventos CVprematuros, principal causa de muerte en sujetos con trasplante renal funcionante91.Aúnmás, muchos trasplantados presentan enfermedad CV previa, y el tratamiento inmunosupresor se asocia con peor control o aparición de nuevos factores de riesgo vasculares. La tasa de mortalidad CV en este grupo es al menos 2 veces mayor que en la población general, y la incidencia de enfermedad CV es 3 a 5 veces mayor, aún si se corrige por edad y sexo92.
En el estudio ALERT se aleatorizaron 2.102 trasplantados renales a recibir fluvastatina o placebo. Luego de una media de seguimiento de 5.1 años no hubo una reducción significativa en la tasa de eventos adversos cardiovasculares mayores, aunque sí se vio una reducción en torno al 35% de las tasas de IAM no fatal y muerte de causa CV93.
De forma similar, el tratamiento con estatinas se asoció a mayor supervivencia y menores tasas de vasculopatía del injerto en trasplantados cardíacos, por lo que se recomienda el inicio de estatinas en este grupo de pacientes sin importar los valores de LDLc. Es aconsejable el uso de dosis bajas-moderadas de estatinas debido al mayor riesgo de interacciones medicamentosas (ej. ciclosporina) 59.
Pacientes con LDL < 100 mg/dL
La guía ACC/AHA 2013 sugiere el inicio de tratamiento con estatinas en prevención primaria en todos los individuos con edad entre 40-75 años, con LDLc entre 70 y 190 mg/dL,con un riesgoCV a 10 años ≥ 7,5%5.Como la edad es uno de los factores utilizados en la ecuación de riesgo, esta recomendación puede llevar a la estatinización de la población añosa, principalmente mayores de 65 años, aún con valores bajos de LDLc. Se calcula que en Estados Unidos la aplicación de esta pauta llevaría al tratamiento de 13 millones de personas más que aplicando las pautas anteriores del ATP III 94.La evidencia disponible muestra que en los estudios en prevención primaria, la mayor parte de los sujetos presentaban valores de LDL > 130 mg/dL, con una media entre 150 y 192 mg/dL al inicio de los mismos (33, 59, 94).Dentro de la justificación propuesta por el grupo de trabajo de la AHA se encuentra un meta-análisis del CTTC de 27 ECAs95 que mostró una reducción significativa del riesgo de eventos vasculares mayores entodos los grupos de riesgo, incluidos las categorías de menor riesgo vascular; sin importar edad, sexo, LDLc basal o enfermedad vascular previa. Sin embrago, en un análisis por subgrupos se puede ver que en individuos con enfermedad coronaria previa no se demostró beneficio estadísticamente significativo del uso de estatinas en aquellos que presentaron LDL < 77 mg/dL(7, 59). Otros estudios como el JUPITER y el ASCOT-LLA enrolaron sujetos con otros elementos de mayor riesgo vascular (elevación hs-PCR, presencia de múltiples FRCV). Aúnmás, un análisis por subgrupos muestra que en el estudio JUPITER aquellos con LDL < 90 mg/dL no mostraron beneficio con el tratamiento con altas dosis de estatinas(29, 40, 59).
Se concluye que existe menor nivel de evidencia que justifique el tratamiento con estatinas en sujetos con valores basales de LDL < 100 mg/dL, sobre todo en ausencia de marcadores de mayor riesgo como la presencia de enfermedad vascular previa (prevención secundaria), aterosclerosis sub-clínica o hs-PCR elevada 59.
Mayores de 75 años
En individuos mayores de 75 años la utilidad del tratamiento con estatinas tiene menor nivel de evidencia, a pesar que el uso del calculador de riesgo determina alto riesgo CV en la mayoría de los sujetos59. Existen meta-análisis que muestran una reducción en el riesgo de eventos vasculares mayores con el tratamiento estatínico, aunque incluyen principalmente individuos en prevención secundaria6. Sin embargo, en sujetos añosos los niveles elevados de colesterol invierten su relación con la morbi-mortalidad, ya que niveles bajos de colesterol total o LDLc se asocian a desnutrición, infecciones crónicas y enfermedades sub-clínicas. A la inversa, niveles elevados de colesterol total se asocian a mayor IMC, mayores niveles de hemoglobina y mayor fuerza muscular. En un seguimiento de una cohorte de 800 sujetos entre 60-85 años se vio una asociación entre mayor mortalidad con niveles de colesterol total < 170 mg/dL(59, 96). Por lo tanto, en prevención primaria el beneficio del tratamiento con estatinas es menos claro, existen pocos estudios que incluyan sujetos > 75 años y no se demostró claro beneficio (59. Es así que se recomienda el tratamiento con estatinas en prevención secundaria, aunque se prefieren dosis bajas o moderadas para mejorar el perfil de seguridad 5; en prevención primaria el beneficio no es claro, por lo cual se debería individualizar la indicación. Cabe destacar que en sujetos mayores de 80 años la evidencia disponible es aún menor59.
Menores de 40 años
A diferencia de lo que ocurre en los añosos, el uso de calculadores de riesgo en sujetos menores de 40 años difícilmente resulte en un riesgo CV a 10 años significativo. La guía ESC 2016 propone utilizar el riesgo relativo en este grupo y no el riesgo absoluto, ya que puede demostrar la necesidad de adoptar cambios en el estilo de vida y control de FRCV. Aún más, se puede calcular la “edad de riesgo CV” a través del uso del SCORE. La “edad de riesgo CV” de una persona joven con cargados FRCV equivale a la edad de una persona con el mismo nivel deriesgo pero con niveles ideales de los FRCV (no tabaquista, PAS 120 mmHg, colesterol total de 155 mg/dL); es así que un sujeto de 40 años de edad puede tener una “edad de riesgo CV” de 60 años, evidenciando así el acortamiento en la expectativa de vida4. Por otra parte, se pueden utilizar calculadores de riesgo a 30 años o de por vida, aunque no está bien pautado qué conducta se debe tomar en cuanto al inicio de estatinas, ya que hay poca evidencia sobre la seguridad y eficacia del uso a muy largo plazo del tratamiento con estos fármacos59. Los cambios en el estilo de vida ocupan un lugar predominante en este grupo.Se puede considerar el tratamiento farmacológico con estatinas a dosis bajas-moderadas en sujetos con LDL > 100 mg/dL especialmente ante la presencia de niveles de LDLc> 160 mg/dL, colesterol no-HDL > 190 mg/dL, riesgo CV a 30 años > 30% o antecedentes familiares de enfermedad CV a edades precoces 59.
Mención particular en este grupo etario merece aquellas pacientes embarazadas o planificando un embarazo. Se desaconseja el uso de estatinasa pesar que diversos estudios observacionales no han demostrado asociación con daño fetal. En aquellas mujeres tratadas con estatinas se prefiere un intervalo libre del fármaco de 3 meses antes de la concepción, y en quienes se embarazan tomando estatinas se aconseja la suspensión inmediata del fármaco. Se debe optimizar el tratamiento no farmacológico monitorizando el perfil lipídico, aunque se debe tener en cuenta que en el embarazo puede haber un aumento fisiológico de los niveles de TG y LDLc.(9, 97)
Enfermedades autoinmunes sistémicas
Las enfermedades autoinmunes, principalmente artritis reumatoidea (AR), lupus eritematoso sistémico (LES), sindrome antifosfolipídico (SAF) y otras como artritis psoriásica y espondilitis anquilosante se asocian con mayor morbi-mortalidad CV. Esta relación parece depender de un aumento de la prevalencia de los FRCV clásicos y al estado de inflamación sistémica crónica que presentan estos pacientes (4, 59, 98) Se debería realizar un cálculo del riesgo CV al menos anualmente y repetirla ante cambios en el tratamiento. Además, los modelos de riesgo se deberían adaptar agregando un factor multiplicador de 1.5 en sujetos que presenten al menos 2 de los siguientes: duración de la enfermedad > 10 años, factor reumatoideo o anticuerpos anti-péptidos citrulinados cíclicos positivos o manifestaciones extra-articulares98.
Si bien no hay evidencia que avale el uso de estatinas solamente en base a la presencia de enfermedades autoinmunes sistémicas, se recomienda el tratamiento con estatinas para prevención primaria en quienes presenten un riesgo CV a 10 años > 5% o a 30 años > 20%, particularmente si los valores de LDLc son mayores a 100-130 mg/dLo si el colesterol no-HDL > 130-160 mg/dL. Se debe tener en cuenta que el control de otros FRCV es importante, y que, para lograr una reducción significativa del riesgo CV se debe lograr un adecuado control de la enfermedad sistémica subyacente (59, 98).
VIH
Los pacientes infectados por VIH presentan un riesgo CV significativamente mayor que sujetos VIH-negativos 99. La infección por VIH ocasiona típicamente un aumento en los niveles de TG con disminución de HDLc, LDLc y colesterol total. El tratamiento anti-retroviral (TARV), sobre todocon fármacos de primera generación (inhibidores de la proteasa como lopinavir o inhibidores no-nucleosídicos de la transcriptasa reversa como efavirenz) se asocia con aumentos marcados de los niveles de colesterol total, LDLc y TG, mientras el HDLc permanece bajo. Además el TARV causa un aumento marcado de partículas de LDLc pequeñas y densas altamente aterogénicas.(4, 99) El TARV también se asocia a cambios en la distribución de la grasa corporal con lipodistrofia, que consiste en lipoatrofia de la cara y miembros asociada con lipohipertrofia de la grasa visceral, hígado, músculo o en topografías ectópicas (cuello, jiba de búfalo). Todo lo anterior lleva a una duplicación del riesgo CV en sujetos que reciben TARV de primera generación (4, 99).
El aumento del riesgo CV en estos pacientes depende no solo de cambios en la composición de los lípidos plasmáticos sino también a la asociación que presentan los sujetos con CD4 < 200/mm3 y/o lipodistrofia con el desarrollo de insulino-resistencia y DM, y un estado inflamatorio crónico, con niveles elevados de IL-6, hs-PCR y D-dímeros 99.
Si bien existe mayor riesgo CV asociado a TARV, el mismo es moderado, y el beneficio del TARV está ampliamente demostrado. El primer paso en el control del riesgo CV es el control de la infección dadoque la mejora en el estado inmune genera mejoríaen el estado de inflamación y disfunción endotelial crónicos que asocian estos pacientes, con el consiguiente beneficio CV99. El uso de estatinas aparece seguro en estos casos, si bien se deben tener en cuenta las posibles interacciones con inhibidores de la proteasa y el efavirenz. La pravastatina (no disponible en nuestro medio) no se metaboliza por la vía de la CYP, lo que permite considerarla como una de las estatinas de elección en estos casos. La simvastatina es la estatina con mayor riesgo de interacciones, mientras que la atorvastatina y la rosuvastatina son opciones aceptables en este grupo de alto riesgo CV, debiendo ser iniciadas a dosis bajas para minimizar el riesgo de interacciones (4, 59, 99).Se discute cuándo debe iniciarse el tratamiento hipolipemiante. En general se sugiere emplearlo en sujetos con riesgo CV a 10 años mayor a 5% o a 30 años superior a 20%, particularmente si el LDLc es mayor a 130 mg/dLo elcolesterol no-HDL supera los 160 mg/dL59.
Conclusiones
Esta revisión intenta resumir las principales recomendaciones formuladas por las guías internacionales recientes.Se analizan además aquellas situaciones más difíciles de resolver en la práctica clínica habitual. La determinación del riesgo CV ocupa un lugar central para definir el inicio y la intensidad del tratamiento hipolipemiante.Se acepta que las personas con mayor riesgo CV absoluto de base son los que más se benefician en términos de reducción del riesgo de eventos vasculares mayores. Las estatinas constituyen el tratamiento de elección en la mayoría de los casos, con una evidencia abrumadora de efectividad y seguridad.A la luz de estudios recientes otros fármacos demuestran beneficio en los resultados cardiovasculares a través de la disminución de los niveles de LDLc.Se debe seleccionar juiciosamente los candidatos a dichos tratamientos para lograr una optimización de los resultados y una reducción eficaz en el riesgo de morbi-mortalidad cardiovascular.