Introducción
El sobrepeso y la obesidad son considerados actualmente una pandemia. Impactan directamente sobre el desarrollo de múltiples patologías y se asocian fuertemente a un incremento en la mortalidad principalmente de causa cardiovascular. En lo que refiere al desarrollo y progresión de la enfermedad renal, el sobrepeso y la obesidad tienen un fuerte impacto. Su influencia está dada de forma directa a través de múltiples mecanismos endócrinos o de forma indirecta a través del desarrollo de factores de riesgo para enfermedad renal de los cuales sobrepeso y obesidad son directamente responsables: hipertensión arterial, diabetes mellitus, dislipemia, hiperuricemia entre otros. Este trabajo revisa algunos datos sobre la epidemiología del sobrepeso y la obesidad, los mecanismos mediante los cuáles determinanenfermedad renal y la influencia global del sobrepeso y la obesidad sobre la morbimortalidad de causa renal.
La Obesidad es una epidemia mundial y Uruguay no está fuera delproblema.
En Estados Unidos en el periodo 1999-2004, 32.2% del total de adultos eran obesos (IMC>30 kg/m2). La prevalencia de obesidad extrema (IMC>40 kg/m2) en 2003-2004 fue de 2.8% en hombres y 6.9% en mujeres.1La realidad de Latinoamérica y El Caribe es también preocupante. La tendencia del sobrepeso y la obesidad en menores de 5 años ha mostrado un constante incremento en los países de la región. Entre 1990 y 2015 la prevalencia mundial de sobrepeso y obesidad en menores de 5 años paso de 4,8% a 6,2%, es decir que aumentó en un 30%. Estimaciones para los mismos años muestran que en América Latina y el Caribe la prevalencia de niños menores de 5 años con sobrepeso pasó de 6,6% (3,7 millones) a 7,2% (3,9 millones), de los cuales 2,5 millones de niños se encuentran en Sudamérica, 1,1 millones en Mesoamérica y 200.000 en El Caribe. El sobrepeso y la obesidad en el embarazo aumentan el riesgo de obesidad en el niño y su persistencia en la adolescencia y la edad adulta.2 Estimaciones realizadas en 2008 sobre la prevalencia de sobrepeso y obesidad en mujeres de entre 20 y 49 años de America Latina y El Caribe indican que 55,4% tenían sobrepeso y 25% obesidad. Entre 1980 y 2008 la prevalencia de sobrepeso y obesidad aumentó un 70% en la región.2 La obesidad y sobrepeso en adultos mantiene una presencia preocupantemente alta en la región. Se estima que el 58% (360 millones) de la población tiene sobrepeso y que la obesidad afecta al 23% (140 millones). Así en la mayoría de los países de America Latina y El Caribe el sobrepeso afecta a más de la mitad de la población adulta. La proporción de mujeres con obesidad supera a la de los hombres y en más de 20 países la diferencia es mayor de 10 puntos porcentuales.(2,3)Uruguay no está ajeno a esta realidad. En el año 2006 se realizó la segunda encuesta Nacional de sobrepeso y obesidad (ENSO 2) en adultos mayores de 18 años.4 Consistió en un estudio observacional y transversal. La muestra se obtuvo de la población urbana (91% de la población nacional) identificada mediante información del censo de 1996. 40 encuestadores entrenados entrevistaron 900 personas mayores de 18 años (450 de Montevideo y otras 450 del resto del país en ciudades con más de 10.000 habitantes). Se pesó y talló a los encuestados, se les clasificó por el índice de masa corporal (IMC) en grupos de acuerdo a recomendaciones de la International Obesity Task Force: IMC19-25: normopeso, IMC 25-29,9: sobrepeso, IMC 30-34,5: obesidad I, IMC>35: obesidad II e IMC>40 obesidad III. Se midió cintura abdominal y se recabaron datos sobre la presencia de diabetes mellitus, cardiopatía isquémica, tabaquismo, dislipemia e hiperuricemia. Se estimó el nivel socioeconómico según la escala de ingresos, se valoró la presencia de sedentarismo y se estratificó según recomendaciones del Centro de control de enfermedades norteamericano (CDC) y del Colegio americano de deportes.Del total de la población, 46% se encontraba en normopeso (IMC19-25 Kg/m2), 34% presentaba sobrepeso (IMC 25-29,9 kg/m2) y 20% obesidad (IMC>30 kg/m2). 1.2% de la población tenía obesidad tipo II y tipo III. Las mujeres tienen mayor obesidad (IMC>30 kg/m2) que los hombres luego de los 55 años, y en la década 55-65 años 34% de las mujeres tienen un índice de masa corporal aumentado contra 20% de los hombres. El sobrepeso y la obesidad aumentaron linealmente con la edad presentando un notorio incremento por encima de los 35 años y alcanzando niveles muy altos en los mayores de 45 años. El incremento en la medida de la cintura abdominal mostró el mismo comportamiento incrementándose abruptamente por encima de los 35 años y alcanzando valores altos por encima de los 45 años con un predominio significativo en la mujer. El rango de sobrepeso fue igual en todos los estratos económicos, sin embargo la obesidad fue 12.2% en los estratos medio y alto vs 18 y 23.2% en los estratos medio-bajo y bajo respectivamente. Existió relación inversa entre el nivel educacional y el IMC. Individuos con educación primaria presentaron 49,3% de normopeso mientras que en individuos con educación terciaria se objetivó normopeso en 52,2%. El sobrepeso estuvo presente en 38,5% de individuos con educación primaria frente a 29,8% de los que tenían educación terciaria. La obesidad sin embargo fue más frecuente entre los que tenían educación terciaria 18% vs 12,2% entre los que tenían primaria completa. El 66% de la población encuestada era absolutamente sedentaria (entre 0 y 60 minutos de actividad física recreativa por semana). La relación entre horas diarias de televisión y ganancia grasa mostró que individuos en normopeso miraban un promedio de 2 horas 40 minutos diarios de televisión mientras que aquellos con obesidad miraban 3 horas, 35 minutos diarios.Los antecedentes familiares de obesidad tuvieron peso en el desarrollo de obesidad de la descendencia. Entre las personas en normopeso 26% tenía madre obesa mientras que entre las personas obesas 52% relataba el antecedente de obesidad materna.En la totalidad de la muestra encuestada se objetivó alto consumo diario de galletas (50%), bizcochos (24%), bebidas refrescantes azucaradas (29%), carne roja (35%), manteca y margarinas (25%).La totalidad de comorbilidades aumentó de forma lineal con el aumento del IMC.El 24% de los encuestados tenía hipertensión arterial (HTA). La frecuencia de HTA aumentó linealmente con el IMC (9% en normopeso, 30% en sobrepeso, 48% en obesidad grado I y 51% en obesidad grado II). El 13% de los encuestados tenía una Dislipemia conocida, existiendo relación positiva entre su presencia y el incremento del IMC (8% en normopeso, 17% en sobrepeso, 20% en obesidad grado I y 17% en obesidad grado II). La misma correlación se observó con la hiperuricemia (4% normopeso, 8% sobrepeso, 9% obesidad). El 5.4% de los encuestados eran diabéticos conocidos (3% tomaban medicación y 1.9% se controlaban con dieta). Hubo correlación positiva entre la presencia de diabetes y el incremento del IMC: 6% en normopeso, 8% en sobrepeso, 9% en obesos y 11% en obesos de riesgo. Del total de la población 9% tenían enfermedad coronaria demostrada (5% normopeso, 11% sobrepeso, 13% obesidad grado I y 18% obesidad grado II). Dentro de los entrevistados el 1.5% de los normopeso tenían antecedente de accidente cerebrovascular mientras que entre los que tenían sobrepeso se duplicó el porcentaje a 3.3%. La presencia de una “cintura de riesgo” (≥ 80 cm para la mujer adulta y ≥ 94 cm para el hombre adulto) incrementó la presencia de diabetes en 3,3 veces, HTA en 4,8 veces y enfermedad coronaria en 2 veces comparado con una cintura normal.Los datos de esta encuesta nacional son elocuentes: uno de cada dos uruguayos presenta sobrepeso u obesidad y uno de cada cinco uruguayos es obeso4.
En la segunda encuesta nacional de Factores de Riesgo de Enfermedades cónicas no trasmisibles (ENFRECNT)(5) realizada en 2013 el Ministerio de Salud Pública se propuso conocer la situación nacional de éstos factores de riesgo. En ésta se objetivó una prevalencia de sobrepeso y obesidad de 64,9% en adultos entre 25 y 64 años. Esta prevalencia se incrementó 8.1 puntos porcentuales (56,6% a 64,9%)desde 2006, momento en que se realizó la primera encuesta nacional de factores de riesgo.También seregistraron diferencias significativas entre la prevalencia de sobrepeso y obesidad entre jóvenes y adultos: 37,7% entre los jóvenes respecto a 68,3% entre los adultos.En referencia a la prevalencia de sobrepeso y obesidad según edad, existe una tendencia de a mayor edad, mayor sobrepeso y obesidad. Entre los tramos de edad de los extremos (el de 15 a 24 con el de 55 a 64 años) las diferencias son significativas: el grupo etario de mayor edad registra más del doble de prevalencia de sobrepeso y obesidad que los más jóvenes y son los que tienen la mayor prevalencia en la comparación con los demás grupos etarios. Cuando se comparó la prevalencia de sobrepeso y obesidad en función del género se objetivó que para el grupo etario entre 15 y 24 años la prevalencia fue 37,7% en hombres y 39,1% en mujeres, y para el grupo entre 25 y 64 años la prevalencia fue de 68,3% en hombres y 61,8% en mujeres. En resumen, se objetivó un incremento en la prevalencia de sobrepeso y obesidad en el conjunto de la población respecto a la encuesta previa. Esta prevalencia es mayor en la población adulta respecto a los jóvenes y en las mujeres jóvenes respecto a los hombres del mismo grupo de edad.5
La obesidad se vincula al desarrollo y progresión de la enfermedad renal.
La obesidad es un factor de riesgo independiente para el desarrollo de enfermedad renal. Adicionalmente se asocia a la presencia de factores de riesgo mayores para el desarrollo de enfermedad renal como lo son la hipertensión arterial, diabetes, dislipemia e hiperuricemia entre otros (Figura 1).
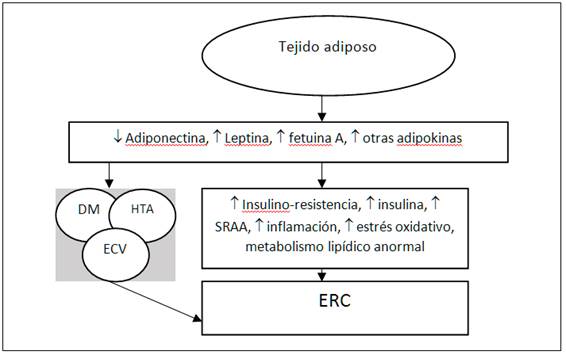
Figura 1: Mecanismo producción ERC en pacientes obesos. Tomado de: Kovesdy CP, Furth SL, Zoccali C, Tao Li PK, Garcia-Garcia G, Benghanem-Gharbi M, et al. Obesity and kidney disease: hidden consequences of the epidemic. Kidney Int ENT#091;InternetENT#093;;. 2017 Feb ENT#091;cited 2017 Mar 1ENT#093;;91(2):260-2. Available from: http://www.ncbi.nlm.nih.gov/pubmed/28010887
Múltiples estudios objetivan el vínculo entre obesidad y enfermedad renal una vez corregidos los factores de confusión. En el seguimiento de una cohorte de 5897 hipertensos adultos participantes del Hypertension Detection and Follow-Up Program en los que ninguno tenía enfermedad renal al ingresar al estudio, la incidencia de enfermedad renal crónica (ERC) a los 5 años de seguimiento fue 28% en normopeso, 31% en el grupo con IMC 25-30 y 34% en el grupo con obesidad (IMC>30). El riesgo de desarrollo de ERC en sobrepeso y obesidad persistió luego de excluir a los pacientes con diabetes mellitus.6 Hallazgos similares surgen de un análisis del estudio Framingham donde se objetiva que los individuos obesos tienen un incremento de 68% en el riesgo de desarrollar ERC estadio 3 o superior.7La obesidad se vincula además a la progresión de la ERC una vez que está instaurada. Othman y cols encuentran que la frecuencia de progresión de la ERC es significativamente mayor entre los individuos obesos comparado con no obesos, corregidos los factores de confusión.8La obesidad es también prevalente en pacientes que inician sustitución permanente de la función renal. En un estudio realizado en EEUU se observa que la pendiente de la media de IMC al momento del inicio de diálisis durante un periodo de seguimiento de 8 años fue dos veces mayor en la población con ERC extrema (ERCE) en comparación con la población general para todos los grupos de edad.9 Además en la población incidente con ERCE un mayor IMC siguió siendo un factor de riesgo independiente para enfermedad renal terminal después de ajustados factores de confusión como edad, sexo, raza, nivel educativo, tabaquismo, cardiopatía isquémica, dislipemia, proteinuria, nivel de creatinina, HTA y diabetes.En un reciente metanálisis10que incluyó 39 estudios bien diseñados se concluye que la obesidad es un predictor independiente de desarrollo de ERC. Los estudios seleccionados fueron divididos en 9 categorías basados en tres predictores (obesidad, sobrepeso e IMC) y tres outcomes (bajo filtrado glomerular (FG) aislado, albuminuria aislada y ERC definida según lo establecido en las guías). Cuando se consideró como predictor la obesidad, 13 estudios reportaron riesgo de bajo FG, 7 estudios riesgo de albuminuria aislada y 3 estudios riesgo de ERC. Cuando se consideró como predictor al sobrepeso, 8 estudios reportaron riesgo de bajo FG y 2 estudios riesgo de desarrollar albuminuria. El IMC como variable continua se vinculó en 13 estudios a riesgo de bajo FG, en 2 estudios a riesgo de desarrollar albuminuria y en 3 estudios a riesgo de desarrollar ERC. Durante una media de seguimiento de 8.5 años presentaron bajo filtrado glomerular de novo 9.4% de participantes (31164 de 330139). En 3 estudios la ocurrencia de desarrollo de bajo FG de novo durante el seguimiento (media 5.2 años) fue reportada en forma separada para obesos (12.3%) y no obesos (4.2%). La obesidad se asoció con un riesgo relativo (RR) de desarrollar bajo FG de 1.28 (95% IC, 1.09-1.28). El desarrollo de albuminuria se objetivó en 9.8% de los participantes (23840 de 143610) durante una media de seguimiento de 9.4 años. La obesidad se asoció el desarrollo de albuminuria de novo, determinando un RR1.51 (95% IC, 1.36-1.67). Cuando se combinaron todos los outcomes de daño renal, el RR de desarrollo de los mismos vinculado a la obesidad fue 1.36(95% IC, 1.18-1.56). Un análisis adicional se realizó valorando el riesgo de desarrollar ERC en 5 estudios de pacientes obesos sanos (sin otras comorbilidades) y 5 estudios de pacientes obesos no sanos. En ambos grupos de estudios la obesidad se asoció a un riesgo significativo de desarrollar ERC con un RR de 1.30 (95% IC, 1.12-1.52) y 1.63 (95% IC, 1.32-2.03) respectivamente. Hubo una asociación positiva significativa entre el IMC (variable continua) y la incidencia de bajo FG (RR por cada 1 kg/m2 de incremento: 1.02 -95% IC, 1.01-1.02)10.
En un estudio nacional con datos obtenidos de la población que acudió a realizarse el Carné de Salud de Uruguay (MSP-Clínicas Preventivas),la prevalencia de ERC etapa III (FG menor 60 ml/min) en pacientes con sobrepeso/obesidad fue 2.5% vs 1.7% en individuos con normopeso (RR 1.79 (95% IC 1.49 a 2.01). Asimismo presentaron proteinuria ≥ 1+ (300 mg/l) el 4.4% de los individuos con sobrepeso vs 3.8% en los normopeso (RR 1.15 p=0.067 (NS).11
En Uruguay la prevalencia de Sobrepeso/Obesidad en 19.070 pacientes entre 25 y 64 años registrados en el Programa de Salud Renal (2004-2017) fue 77.9%, significativamente mayor que la prevalencia registrada en el mismo grupo etario en la Encuesta Nacional de Factores de Riesgo de 2013 (68.3%). No se encontró una variación de la incidencia de Sobrepeso/Obesidad en diferentes épocas del programa.12
La obesidad se vincula al desarrollo de dañoglomerular.
Este vínculo ya descrito desde los resultados iniciales del estudio Framingham7 ha sido objetivado en múltiples cohortes seguidas en el tiempo. En un estudio observacional sobre 2500 individuos sanos se encontró una fuerte asociación entre la presencia de diferentes grados de sobrepeso y obesidad y el desarrollo de albuminuria.13 En el estudio The Prevention of Renal and Vascular End stage Disease (PREVEND) se objetivó que la prevalencia de albuminuria significativa y de descenso del filtrado glomerular se incrementó con el aumento del IMC y la obesidad centroabdominal una vez corregidos los factores de confusión.14La presencia de elevado volumen de tejido adiposo visceral medido por tomografía se asoció al desarrollo de albuminuria15. El hallazgo histológico predominante es la glomerulomegalia y la glomeruloesclerosis focal y segmentaria (GEFS) secundaria16. Estos hallazgos histológicos en general muestran un patrón diferencial con la GEFS idiopática, mostrando menor fusión podocitaria y mayor glomerulosclerosis.17En un estudio en el que se analizó la biopsia renal de pacientes con obesidad mórbida (IMC>50 kg/m2) se objetivó la presencia de glomerulomegalia, engrosamiento de la membrana basal glomerular y fusión podocitaria.18 En biopsias de pacientes obesos con enfermedad glomerular el grado de proteinuria se correlacionó con una disminución en la densidad podocitaria, número de podocitos ydecremento de pedicelos. Adicionalmente la disminución en número y densidad de podocitos se correlacionó con el incremento de marcadores de resistencia a la insulina.19El mecanismo patogénico postulado para explicar el daño glomerular se centra en la hiperfiltración e hipertrofia glomerular que ocurren secundarias al incremento del IMC.20La teoría de la hiperfiltración, propuesta inicialmente por Brenner, surgió de la observación de que la nefrectomía unilateral podía determinar el desarrollo de proteinuria, glomeruloesclerosis e insuficiencia renal progresiva en modelos experimentales.21Luego de la ablación renal los glomérulos residuales generan adaptaciones hemodinámicas que incluyen vasodilatación de la arteriola aferente, vasoconstricción de la eferente e incremento de la fracción de filtración como consecuencia. La hiperfiltración compensatoria que contribuye a preservar el filtrado glomerular es acompañada de expansión del volumen glomerular, incremento en los componentes de la matriz glomerular y aumento en el número de células endoteliales y mesangiales.Sin embargo los podocitos adultos no son capaces de proliferar y se generan espacios en la membrana basal glomerular predisponiendo al desarrollo de proteinuria.22El aumento de la presión en el capilar glomerular determina un incremento en el filtrado glomerular determinando hiperfiltración.23 Algunos modelos experimentales demuestran una falla en la autoregulación glomerular con vasodilatación en la arteriola eferente lo que determina diferencia en la presión hidrostática entre el flujo sanguíneo y el espacio urinario.24
El acúmulo ectópico de lípidos25y el depósitode grasa enel seno renal26,27, situación denominada “riñón graso”,se han vinculado al desarrollo de hipertensión glomerular e incremento en la permeabilidad glomerular determinando hiperfiltración28 y posteriormente glomerulomegalia29 con el consiguiente desarrollo de esclerohialinosis segmentaria y focal. La incidencia de la llamada “glomerulopatía asociada a la obesidad” se incrementó en 10 veces entre 1986 y 200017.
El sobrepeso y la obesidad se han vinculado el desarrollo de nefrolitiasis.
La presencia de un elevado IMC se asoció positivamente en múltiples estudios con un incremento en la prevalencia30e incidencia 31,32de nefrolitiasis. Adicionalmente la ganancia gradual de peso en el tiempo y un incremento en la medida de la circunferencia abdominal son factores asociados a aumento de la incidencia de nefrolitiasis.32Múltiples factores se vinculan al desarrollo de nefrolitiasis en el paciente con sobrepeso u obesidad. El sobrepeso se asocia con un pH urinario descendido33 y un incremento en la oxaluria34, uricosuria, natriuria y fosfaturia.35 Las dietas ricas en proteínas y sodio generan a menudo mayor acidez urinaria y descenso de la citraturia lo que contribuye adicionalmente a la litogénesis en esta población. La insulinoresistencia que acompaña al sobrepeso predispone a la nefrolitiasis36dado que impacta en el intercambiador Na-H tubular37 y en la amoniogénesis38promoviendo el desarrollo de un medio ácido. Un aspecto adicional, que a menudo complica el manejo clínico de los pacientes con obesidad, es que las terapias dirigidas al descenso de peso corporal aumentan significativamente la litogénesis dado que muchas veces se trata de dietas hiperproteicas. Asimismo el tratamiento quirúrgico de la obesidad (cirugía gástrica) puede determinar un aumento significativo de la absorción intestinal de oxalatos con la consiguiente hiperoxaluriaresultante.39
El riesgo de desarrollar neoplasias renales se incrementa con la obesidad.
La obesidad se ha vinculado al desarrollo de múltiples neoplasias, particularmente el cáncer de riñón. En un estudio poblacional desarrollado en Reino Unido, un aumento de 5k/m2 de IMC se asoció con un incremento de 25% en el riesgo de desarrollar cáncer de riñón, atribuyéndose el desarrollo del 10% de los cánceres renales a la obesidad.40En otro estudio se estimó que 17 a 26% del total de cáncer renal, en hombres y mujeres respectivamente, son atribuibles al exceso de peso.41En un metanálisis que incluyó 221 estudios se encontró una correlación consistente entre el desarrollo de cáncer renal tanto en hombres como en mujeres y la obesidad.42 En este metanálisis el cáncer de riñón triplicó su prevalencia en presencia de obesidad, por cada incremento de 5 Kg/m2 en el IMC el RR de desarrollo de cáncer renal fue 1.24 (95% IC, 1.20-1.28). Los mecanismos por los que la obesidad incrementa el riesgo de cáncer renal no están bien clarificados. Se conoce que la hiperinsulinemia secundaria a la insulinoresistencia determina un incremento en los niveles circulantes de factores de crecimiento derivados de la insulina los que se han vinculado al crecimiento de diferentes tipos de células tumorales.43 Explicaciones adicionales se vinculan a funciones endócrinas del tejido adiposo44 que determinan alteraciones de la inmunidad45y generan un estado inflamatorio mantenido46 que puede influir en el desarrollo de neoplasias.
Sobrepeso y la obesidad se vinculan a mayor frecuencia y severidad de injuria renal aguda (IRA) en pacientes hospitalizados.
La frecuencia de IRA se ve incrementada en función del aumento del IMC en pacientes hospitalizados en cuidados críticos. En un estudio reciente la incidencia de IRA en cuidados críticos fue 18.6% en normopeso, 20.6% en pacientes con sobrepeso, 22.5% en obesidad estadio 1, 24.3% en obesidad estadio 2 y 24% en obesidad estadio 3. El odds ratio (IC 95%) ajustado para cada grupo fue 1.8, 1.35, 1.47 y 1.59 respectivamente. Cada incremento de 5 kg/m2 en el IMCse asoció con un aumento del 10% en el riesgo de desarrollar IRA.47
El desarrollo de hígado graso como consecuencia de la obesidad es un factor de riesgo emergente para el desarrollo de ERC.
El hígado graso no alcohólico (HGNA) consecuencia del depósito hepático de lípidos es una causa creciente de cirrosis, enfermedad hepática terminal y hepatocarcinoma. Se ha convertido en la enfermedad hepática crónica más frecuente en los países con altos ingresos afectando hasta un tercio de la población general adulta, y ha tomado una trayectoria que seguramente la convierta en la causa más común de ingreso a lista de trasplante hepático en Estados Unidos.48 El HGNA y la ERC comparten múltiples factores de riesgo (obesidad abdominal, resistencia a la insulina, dislipemia aterogénica, hipertensión) y vías patogénicas. Múltiples estudios transversales han demostrado de forma consistente que la presencia de HGNA diagnosticado por imagen o histología está asociada con un incremento en la prevalencia de ERC49. En estos estudios la prevalencia de ERC en pacientes con HGNA varió entre 20 y 55% comparado con poblaciones con factores de riesgo similares pero sin HGNA en que la prevalencia de ERC fue entre 5 y 30%. La asociación entre HGNA y ERC fue, en estos trabajos, independiente de los factores de riesgo cardiorenales comunes.En un estudio de cohorte que incluyo 8400 hombres no hipertensos con funciónrenalnormal y sin proteinuria al momento del ingreso, seguidos durante una media de 3.2 años, el HGNA (diagnosticado por ecografía) se asoció con una mayor incidencia de ERC (IC 95%, HR 1.60, 1.3 - 2.0). Este hallazgo se mantuvo después de ajustar factores de riesgo como IMC, hipertensión arterial, resistencia a la insulina, niveles de proteína C reactiva en plasma, filtrado glomerular basal y otros posibles factores de confusión.50 En el estudio Valpolicella Heart Diabetes Study, 1760 pacientes con diabetes tipo 2 y función renal preservada fueron seguidos durante un periodo de 6.5 años. Los pacientes con HGNA mostraron una mayor incidencia de ERC (IC 95%, HR 1.69, 1.3 - 2.6). Este hallazgo estuvo presente después del ajuste por edad, sexo, IMC, circunferencia de la cintura, presión arterial, hemoglobina glucosilada, lípidos, filtrado glomerular basal, microalbuminuria y uso de antihipertensivos e hipoglucemiantes.51Una revisión sistemática con metanálisis que incluyó 33 estudios (20 estudios transversales y 13 estudios longitudinales con un total de 64.000 individuos) examinaron la asociación entre HGNA y ERC. La presencia de HGNA se asoció con el doble de prevalencia de desarrollar ERC (IC 95%, OR 2.12, 1.7-2.7) y con un aumento de casi dos veces en la incidencia (IC 95%, HR 1.79, 1.7 - 1.9) en los estudios transversales y longitudinales respectivamente.52Múltiples factores pueden explicar el vínculo patogénico entre HGNA y ERC entre los que se ha citado a la presencia de nutrientes como la fructosa y el ácido úrico aumentados, el descenso en los niveles de vitamina D, descenso en los niveles de adiponectina, incremento en los niveles de hormonas como la fetuina-A, incremento de citokinas y sus receptores, alteraciones en la microbiota intestinal y alteraciones en transportadores de la glucosa entre otros.49
La obesidad incrementa significativamente el riesgo de ERC extrema en los donantes de riñón.
En un reciente estudio tendiente a evaluar el riesgo de desarrollar ERC extrema (ERCE) entre pacientes adultos donantes de riñón, se incluyó 119.769 donantes con un seguimiento máximo de 20 años. Los donantes obesos (IMC > 30) fueron mayoritariamente varones, afroamericanos y con cifras tensionales más elevadas que los no obesos. El riesgo estimado de desarrollar ERCE 20 años después de la donación fue de 93,3 por 10.000 en los pacientes con obesidad al momento de ser donantes vs 39.7 por 10.000 en los pacientes no obesos. Los donantes obesos tuvieron un aumento significativo del 86% en el riesgo de ERCE comparados con sus homólogos no obesos (IC 95%, RR 1.86, 1.05-3.30). Por cada unidad de aumento en el IMC por encima de 27 Kg/m2 hubo un aumento significativo asociado de 7% en el riesgo de desarrollar ERCE. El impacto de la obesidad en el riesgo de ERCE fue similar para los donantes masculinos y femeninos, afroamericanos y caucásicos.51
Múltiples y variados mecanismos subyacen al daño renal en la obesidad.
Los mecanismos exactos mediante los cuales la obesidad determina el desarrollo o la progresión de enfermedad renal no están totalmente aclarados. La mayoría de los obesos no desarrollará enfermedad renal, este hecho sumado a la observación de que casi un 25% de obesos se comportan como “metabólicamente sanos” sugiere que el solo incremento de peso no es suficiente para generar lesión renal.53Algunos de los efectos deletéreos de la obesidad sobre el riñón están vinculados a comorbilidades determinadas por la misma, principalmente diabetes mellitus e hipertensión arterial. Sin embargo, un conjunto importante de mediadores metabólicos vinculados al tejido adiposo, son capaces de generar lesión renal. Es conocido que el tejido adiposo es un órgano endócrino. Las hormonas quesecreta son denominadas en su conjunto adipokinas y tienen acción sistémica.
La adiponectina es una proteína producida predominantemente por el tejido adiposo. Tiene un elevado peso molecular y es capaz de circular como monómero o multímeros. Se han encontrado niveles bajos de adiponectina en pacientes con obesidad, y estos bajos niveles se han vinculado a un incremento en la mortalidad de causa cardiovascular.54,55,56Se ha encontrado a nivel renal al menos dos receptores capaces de ligar adiponectina: adipo R1 y adipo R2. 57,58 El receptor adipo R2 está ubicado mayoritariamente a nivel podocitario y es activado a través de la vía de las kinasas frente a la presencia de adiponectina.59,60Cambios moleculares vinculados a la activación del receptor podocitario de adiponectina determinan una menor permeabilidad a la albúmina por el diafragma de filtración61 por lo que se ha planteado que la adiponectina puede tener un rol protector a nivel podocitario. Se ha encontrado una correlación entre la hipoadiponectinemia y la presencia de albuminuria en pacientes con hipertensión arterial y obesidad.62,63A nivel experimental el déficit de adiponectina se ha asociado a alteraciones pedicelares podocitarias en presencia de un endotelio sin lesiones. En ausencia de adiponectina se observó fusión pedicelar y reducción en el número de pedicelos.59El incremento en los niveles de adiponectina tanto exógena como endógena se ha vinculado a normalización en la morfología podocitaria y disminución de la albuminuria en pacientes con obesidad de reciente diagnóstico y enfermedad renal.59Bajos niveles de adiponectina determinan cambios en la isoforma de la enzima NAPDH oxidasa generándose incremento en especies reactivas de oxígeno y daño vascular.64Se ha encontrado que la hipoadiponectinemia se vincula a progresión de la enfermedad renal en pacientes con diabetes tipo 2.65La presencia de adiponectina tiene al parecer un rol protector a nivel tubular. Se hanhallado receptores para adiponectina en las células tubulares humanas.66Se ha postulado que la presencia de adiponectina es capaz de mitigar parte del efecto de la angiotensina-II a nivel tubular. La angiotensina-II induce a ese nivel la activación del NF-kB que es un mediador de la respuesta inflamatoria celular y que a nivel de las células tubulares media la producción de fibronectina y matriz extracelular capaces de determinar injuria tubular.67
La fetuina-A (alfa-2-Heremans Schmid glicoproteína), es una glicoproteína circulante, miembro de la familia de los inhibidores de la cisteína proteasa.68,69 Es sintetizada por los hepatocitos y está presente en todos los fluidos extracelulares.70Su presencia induce insulino-resistencia en el musculo esquelético y en el hígado mediante la inhibición de una tirosinquinasa del receptor de insulina.71,72Altos niveles de fetuina-A se han asociado con obesidad e insulino-resistencia en pacientes con ERC.73
La leptina es una proteína secretada por los adipocitos y vinculada a la familia de receptores de citokina clase I. Circula bajo cinco isoformas y se une a dos tipos diferentes de receptor. El rol primario de la leptina es actuar a nivel del sistema nervioso central (hipotálamo) en centro de saciedad, limitando la ingesta alimentaria como forma de regular el balance entre apetito e ingesta calórica.74La mayor parte de los efectos de la leptina están mediados por la unión al receptor Ob-Rb que se expresa a nivel central mayoritariamente en el hipotálamo. El balance entre apetito ygasto calórico se obtiene mediante la activación de la propiomelanocortina (POMC). La POMC determina la producción de hormona estimulante-alfa de los melanocitos que una vez unida a los receptores 3 y 4 de la melanocortina reduce el apetito y estimula el gasto energético.75,76En individuos magros, el ayuno disminuye la concentración de leptina mientras que la hiperalimentación aumenta sus niveles. Por el contrario, en los pacientes obesos este mecanismo fisiológico se ve afectado.77 Esta observación sugiere una resistencia a la leptina a nivel del hipotálamo y de los órganos metabólicos, en esta población.Los niveles circulantes de leptina son proporcionales a la cantidad de tejido adiposo y se incrementan con la obesidad. La leptina es filtrada y eliminada a nivel renal por lo que sus niveles se incrementan en la ERC, siendo uno de los mediadores que se ha vinculado al ambiente aterogénico de la misma.78
Leptina y proteinuria.Las células renales expresan mayoritariamente una isoforma corta del receptor Ob-Ra.79 La exposición por corto tiempo a la leptina es capaz de inducir la síntesis de factor de crecimiento alfa-1, el que determina proliferación endotelial a nivel glomerular.80 Sin embargo la exposición por tiempo prolongado se ha vinculado a regulación en menos de la expresión glomerular de colágeno tipo I y tipo IV en células mesangiales y del endotelio glomerular, con depósito de matriz extracelular, glomeruloesclerosis y un incremento significativo de la proteinuria independiente de los incrementos de la presión arterial.81A nivel de las células endoteliales glomerulares, la leptina estimula la proliferación celular e incrementa la síntesis de colágeno tipo IV. En las células mesangiales incrementa la síntesis de colágeno tipo I.80,82 Estos cambios estructurales pueden vincularse al desarrollo de enfermedad glomerular en el contexto de la obesidad.
Leptina y daño tubular. A nivel experimental la exposición prolongada a leptina induce apoptosis en células tubulares renales in vitro83a través de un incremento en la expresión de prostaglandina E2 mediada por cicloxigenasa-2.
El factor de necrosis tumoral alfa (TNF-(), una citokina inflamatoria, se encuentra elevado a nivel sistémico en pacientes obesos y juega un rol fundamental en la insulinoresistencia derivada de la obesidad.Niveles elevados de receptor de TNF-( se han asociado con un descenso en el filtrado glomerular en pacientes con diabetes tipo 2 e IMC>30 Kg/m2.84A nivel experimental se encontró que los niveles elevados de TNF-( determinan cambios en el citoesqueleto podocitario y en la membrana basal glomerular.85 Junto con la presencia de macrófagos y niveles elevados de interleukina 1, el TNF-( es capaz de suprimir la actividad del gen promotor de la nefrina86 pudiendo por este mecanismo explicarse la alteración podocitaria que ocurre cuando se elevan sus niveles en la obesidad.
La interleukina 6 (IL-6) es otra molécula inflamatoria que se encuentra elevada en pacientes obesos y que se ha relacionado a la presencia de insulinoresistencia.87 En pacientes con ERC el incremento de la masa grasa se acompaña de un aumento en los niveles circulantes de IL-6.88 Asimismo sus niveles plasmáticos guardan correlación inversa con los niveles circulantes de adiponectina plasmática.89 Si bien el mecanismo por el que determina lesión renal permanece aún desconocido estos cambios metabólicos vinculados a su fisiología posiblemente están involucrados.
La expresión de moléculas de adhesión a nivel de las células endoteliales está incrementada en pacientes con insulinoresistencia y enfermedad renal. A nivel experimental se ha observado que la expresión de moléculas de adhesión endotelial como ICAM-1 juegan un rol central en la infiltración glomerular por macrófagos en la nefropatía diabética.90 Los niveles séricos de moléculas como ICAM-1, VCAM-1, P-selectina y E-selectina están incrementados en pacientes obesos y con nefropatía diabética.91Se estima que estas moléculas en el contexto de la obesidad generan cambios morfológicos y funcionales renales secundarios a la infiltración macrofágica.
El sistema renina-angiotensina-aldosterona (RAA)también participa en el desarrollo de enfermedad renal en el contexto de la obesidad.Múltiples estudios han identificado un sistema RAA nativo a nivel del tejido adiposo visceral de pacientes con obesidad.92,93La disminución en el peso corporal (de al menos 5%) se ha correlacionado con disminución en los niveles plasmáticos de angiotensinógeno, renina y aldosterona en pacientes obesos, con disminución de la actividad de la enzima conversora de angiotensina y la expresión de angiotensinógeno a nivel de la grasa visceral.89 Adicionalmente el tejido adiposo segrega factores secretantes de mineralocorticoides, los que determinan la producción de angiotensina II a nivel suprarrenal de forma independiente.94 Además de los conocidos efectos vinculados a la aldosterona, esta hormona es capaz de disminuir la expresión de nefrina y podocina a nivel podocitario determinando así daño glomerular.95
La insulinoresistencia vinculada a la obesidad es una importante vía vinculada al daño renal en este contexto. La insulinoresistencia es un potente factor asociado al desarrollo de albuminuria en pacientes no diabéticos.96 Incluso la hiperinsulinemia por sí sola se ha asociado al desarrollo de albuminuria en pacientes sanos97 y en diabéticos tipo 2.98Los podocitos expresan transportadores de glucosa GLUT-1 y GLUT-4.99La fosforilación de alguna de las moléculas vinculadas a estos transportadores se ha vinculado a insulinoresistencia a nivel renal y determina que los podocitos respondan a la insulina lo que incrementa la susceptibilidad al daño celular a ese nivel.100 La insulinoresistencia renal también se ha asociado a una regulación en menos en la expresión de la nefrina, con los cambios estructurales a nivel podocitario que de ello se derivan. La insulina asimismo determina afectación directa de canales de calcio vinculados a los podocitos101 lo que altera la red de actina podocitaria con cambios estructurales a dicho nivel.102
El estrés oxidativo vinculado a la obesidad se ha asociado a daño renal.El síndrome metabólico se ha vinculado a la producción de radicales libres por acción de enzimas de la familia NADPH oxidasa. A nivel experimental se asoció la obesidad con un incremento significativo de especies reactivas de oxígeno (ERO) a nivel de la corteza renal. Estos niveles de ERO se asociaron con un incremento en los lípidos plasmáticos, niveles de insulina, proteína C reactiva, creatininemia y albuminuria. Asimismo determinaron mayor expresión de moléculas proinflamatorias a nivel cortical.103
Es necesario realizar intervenciones para reducir el sobrepeso-obesidad y la enfermedad renal dependiente del mismo.
El primer paso dirigido a desarrollar intervenciones en salud es detectar a los pacientes con sobrepeso-obesidad, particularmente aquellos con riesgo elevado de desarrollar ERC (hipertensos, diabéticos), para informarlos del riesgo potencial al que están expuestos. Existen múltiples experiencias en intervenciones de atención primaria dirigidas a identificar e informar a esta población. Asimismo múltiples programas de vigilancia dirigidos a monitorizar la detección de pacientes en riesgo y la evolución de los mismos han demostrado ser costo-efectivos.3
En pacientes diabéticos con sobrepeso u obesidad una intervención en el estilo de vida, que incluyó restricción calórica y aumento de la actividad física en comparación con un seguimiento estándar que incluyó medidas educativas y tratamiento de la diabetes, mostró una reducción del 30% en el desarrollo de ERC incidente.104 Sin embargo estos cambios no redundaron en un descenso significativo de eventos cardiovasculares. En un metanálisis que incluyó pacientes con ERC obesos en los que se realizó intervenciones dirigidas a reducir el peso corporal, éstas se asociaron a reducción de la presión arterial, de la hiperplasia glomerular y de laproteinuria.105El descenso de peso es una intervención que ha demostrado mejorar la hiperfiltración y la proteinuria asociada a la obesidad.106Existe una correlación positiva entre el grado de descenso de peso y la reducción de la proteinuria despistados otros factores de confusión.107Asimismo la mejoría en el estilo de vida con disminución de peso y ejercicio físico incrementan los niveles de adiponectina y generan un perfil de adipokinas más favorable.108
Una revisión que incluye estudios dirigidos a valorar el impacto de la reducción de peso mediante diferentes estrategias (dieta, ejercicio, fármacos para el tratamiento de la obesidad y cirugía bariátrica) sobre diferentes parámetros de daño y función renal, concluye que por cada kilogramo de pérdida de peso intencional la proteinuria disminuye en promedio 110 mg (IC 95%, 60-160 mg, p<.001) y la albuminuria desciende 1.1 mg (IC 95%, 0.5-2.4 mg, p<0.11). Descensos significativos en el filtrado glomerular o clearence de creatinina luego de la pérdida de peso se observaron en el conjunto de individuos sometidos a cirugía bariátrica. Este grupo tenía con más frecuencia obesidad mórbida, con un clearence de creatinina previo a la intervención significativamente mayor que otros grupos (140.2 vs 88 ml/minuto). Si bien los descensos en el clearence de creatinina no fueron significativos en el grupo en los que no se realizó cirugía bariátrica, el filtrado glomerular estimado y el clearence de creatinina se redujo globalmente 17% comparado con los valores basales (IC 95%, 8-26%).109
La inhibición del eje renina-angiotensina-aldosterona se ha mostrado beneficiosa en esta población.125
El tratamiento con IECA disminuye los niveles de proteinuria en pacientes con enfermedad renal vinculada a la obesidad de forma similar a la que lo hace el descenso de peso.107 Sin embargo en un análisis post-hoc del estudio REIN se demostró que el efecto protector de la inhibición de la enzima conversora de angiotensina en pacientes con ERC proteinúrica era máximo en pacientes obesos y más atenuado en pacientes con IMC normal o bajo.110Los inhibidores de la enzima conversora de angiotensina (IECA) por tanto continúan siendo la primera opción antihipertensiva para la hipertensión arterial asociada a la obesidad.111Los antagonistas de la aldosterona demostraron adicionalmente incrementar los niveles de adiponectina y disminuir la expresión del receptor de angiotensina-II. 112).
En la Tabla 1 se presentan las conclusiones de múltiples trabajos que vinculan sobrepeso y obesidad con el desarrollo de enfermedad renal.
| Estudio | Pacientes | Variables sobrepeso/obesidad | Variables enfermedad renal | Resultados |
| Prevention of Renal and Vascular End-Stage Disease (PREVEND) Study14 | 7.676 pacientes sin diabetes | -IMC elevado (sobrepeso y obesidad*) -distribución central de la grasa (índice cintura/cadera) | -Presencia de albuminuria (30-300 mg en 24 horas) -Aumento o disminución del FG | -Obesidad (+) / distribución central de la grasa (+): alto riesgo de albuminuria -Obesidad (+) / distribución central de la grasa (+/-): alto riesgo de aumento del FG -Distribución central de la grasa (+) / obesidad (+/-): asociación con disminución del FG. |
| Multinational study of hypertensive outpatients113 | 20.828 pacientes de 26 países | -IMC elevado -Circunferencia abdominal | -Prevalencia de albuminuria buscada con tira de orina | -Elevada circunferencia abdominal se asoció con el desarrollo de albuminuria independientemente del IMC. |
| FraminghamMulti-Detector ComputedTomography (MDCT) cohort15 | 3.099 pacientes | -Búsqueda de tejido adiposo visceral y tejido adiposo subcutaneo | -Prevalencia de albU/crU> 25 mg/g en mujeres y > 17 mg/g en hombres | -La presencia de tejido adiposo visceral se asoció con incremento de albU/crU en hombres pero no en mujeres |
| CARDIA (CoronaryArteryRiskDevelopment in Young Adults) study114 | 2.354 pacientes con función renal normal, entre 28 y 40 años de edad | -Obesidad* -Dieta y estilo de vida declarados en el estudio | -Microalbuminuria incidente | -La obesidad (OR 1.9) y una dieta no saludable (OR 2) se asociaron con albuminuria incidente |
| HypertensionDetection and Follow-Up Program6 | 5.897 pacientes adultos con HTA | -Sobrepeso y obesidad* vs IMC normal | -ERC incidente (proteinuria 1 + o mayor y/o FG < 60 ml/min/1.73 m2) | -Sobrepeso (OR 1.12) y obesidad (OR 1.40) se asociaron con ERC incidente |
| FraminghamOffspringStudy115 | 2.676 pacientes libres de ERC estadio 3 | -IMC alto vs IMC normal* | -ERC estadio 3 incidente -Proteinuria incidente | -Elevado IMC no se asoció con el desarrollo de ERC estadio 3 -Elevado IMC se asoció con el desarrollo de proteinuria incidente |
| Physicians’ HealthStudy116 | 11.104 hombres jóvenes sanos | -IMC dividido en quintiles -Incremento del IMC en el tiempo vs IMC estable en el tiempo | -Descenso del FG (< 60 ml/min/1.73 m2) incidente | -Elevado IMC de base e incremento del IMC en el tiempo se asociaron a incremento en el riesgo de ERC incidente |
| Nation-wide US Veterans Administration cohort117 | 3.376.187 adultos con FG de base ≥ 60 ml/min/1.73 m2 | -Categorías de IMC desde <20 a >50 Kg/m2 | -Declinación rápida de la función renal (pendiente negativa del FG > 5 ml/min/1.73 m2) | -IMC >30 Kg/m2 se asocia con pérdida rápida de la función renal |
| Nation-widepopulation-basedstudyfromSweden118 | 926 pacientes con ERC moderada/avanzada comparados con 998 controles | -IMC ≥25 vs IMC <25 Kg/m2 | -ERC vs no-ERC | -Elevado IMC se asoció con un riesgo 3 veces mayor de ERC |
| Nation-widepopulationbasedstudy in Israel119 | 1.194.704 adolescentes varones y mujeres examinados para el servicio militar | -IMC elevado (sobrepeso y obesidad) vs. IMC normal* | -ERCE incidente | -Sobrepeso (HR 3) y obesidad (HR 6.89) se asociaron con alto riesgo de ERCE |
| The Nord-Trøndelag HealthStudy(HUNT-1)120 | 74.986 adultos | -Categorías de IMC* | -Incidencia de ERCE o muerte de causa renal | -IMC >30 kg/m2 se asoció con peores resultados |
| Community-basedscreening in Okinawa, Japan121 | 100.753 pacientes > 20 años | -Cuartiles de IMC | -Incidencia de ERCE | -Elevado IMC se asoció con incremento del riesgo de desarrollar ERCE en hombres pero no en mujeres |
| Nation-wide US VeteransAdministrationcohort122 | 453.946 adultos con FG de base <60/ml/min/1.73m2 | -Categorías de IMC desde <20 a >50 Kg/m2 | -Incidencia de ERCE -Duplicación de valores de reatinina sérica -Pendientes de FG | -Obesidad moderada y severa se asoció con peores resultados renales |
| Kaiser Permanente NorthernCalifornia123 | 320.252 adultos con y sin ERC de base | -Sobrepeso clase I , II y obesidad extrema vs. IMC normal* | -Incidencia de ERCE | -Existió alto riesgo lineal de ERCE con las diferentes categorías de IMC elevado |
| REGARDS (ReasonsforGeographic and Racial Differences in Stroke) Study124 | 30.239 pacientes | -Circunferencia abdominal o IMC elevados | Incidencia de ERCE | -IMC por encima de lo normal no se asoció con ERCE luego de ajustarlo por la circunferencia abdominal -Elevada circunferencia abdominal se asoció con ERCE |
| IMC: índice de masa corporal. * peso normal = IMC 18.5-24.9 Kg/m2, sobrepeso = IMC 25-29.9 Kg/m2, obesidad clase I = IMC 30-34.9 Kg/m2, obesidad clase II = IMC 35-39.9 Kg/m2, obesidad clase III = IMC>40 Kg/m2.FG: filtrado glomerular. albU/crU: cociente albuminuria/creatininuria en orina aislada. OR: Odds Ratio. HR: Hazart ratio. HTA: hipertensión arterial. ERC: enfermedad renal crónica. ERCE: enfermedad renal crónica extrema. |
Tabla 1: Estudios que vinculan sobrepeso y obesidad con el desarrollo de enfermedad renal
En la Tabla 2 se resumen resultados de estudios dirigidos a evaluar el impacto del descenso de peso mediante restricción calórica o cirugía bariátrica sobre la proteinuria, el filtrado glomerular y el clearence de creatinina.
| Estudio | intervención | Participantes (n) | Seguimiento (semanas) | ( IMC ó( peso corporal | Media ( proteinuria | Media ( albuminuria | Media (ClCr ml/min | Media FG ml/min |
| Chagnac126 | CB | 8 | 52 | -48.8 kg | -49.6 mg/24h | -35 | ||
| Navarro-Diaz127 | CB | 61 | 104 | -58 kg | -0.03 g/24h | -10.8 g/24h | -21.5 | |
| Morales 128 | RC | 20 | 20 | -3.6 Kg | -0.9 g/24h | -1.1 | ||
| Praga 129 | RC | 9 | 52 | -4.5 Kg/m2 | -2.5 g/24h | -4 | ||
| Saiki130 | RC | 22 | 4 | -6.2 kg | -1.77 g/24h | +5 | ||
| Cubeddu131 | RC | 18 | 52 | -9.5 kg | -8.9 mg/24h | -11 | ||
| Solerte 132 | RC | 24 | 24 | -7.3 Kg/m2 | -0.66 g/24h | -332 mg/24h | +12 | +15 |
Tabla 2: Trabajos dirigidos a evaluar el impacto del descenso de peso sobre la proteinuria, filtrado glomerular y clearence de creatinina.
Mensajes para llevar:
-El sobrepeso y la obesidad son una epidemia de la que Uruguay no está exento. Uno de cada dos uruguayos presenta sobrepeso u obesidad y uno de cada cinco uruguayos es obeso.
-La obesidad se vincula al desarrollo y progresión de la enfermedad renal. Este vínculo es consecuencia directa de la obesidad así como de la presencia de comorbilidades derivadas de esta, principalmente diabetes mellitus, hipertensión arterial, dislipemia e hiperuricemia.
-La obesidad se vincula al desarrollo de lesión glomerular secundaria a factores hemodinámicos que determinan hiperfiltración por una mayor demanda metabólica y por la presencia de la entidad denominada “riñón graso”.
-La obesidad y algunas de sus consecuencias (síndrome metabólico, hiperuricemia) determinan el desarrollo de nefrolitiasis y las repercusiones que ésta determina a nivel renal.
-El sobrepeso y la obesidad se vinculan fuertemente con el desarrollo de neoplasias, dentro de las que el neoplasma de riñón es una de las más prevalentes.
-La obesidad se ha vinculado a incremento en el riesgo de desarrollar injuria renal aguda en pacientes hospitalizados y a mayor severidad de la misma una vez que está instalada.
-El hígado graso no alcohólico como consecuencia de la obesidad es un factor de riesgo emergente para el desarrollo de ERC.
-El tejido graso se comporta como un órgano endócrino y múltiples mediadores vinculados a la obesidad (adiponectina, fetuina-A, leptina), a la inflamación (interleukina-6, factor de necrosis tumoral alfa), al endotelio (moléculas de adhesión endotelial) y al estrés oxidativo se vinculan a efectos directos de la obesidad sobre el desarrollo de la enfermedad renal.
-El descenso de peso, los cambios en el estilo de vida y el bloqueo del eje renina-angiotensina-aldosterona han mostrado contrarrestar en parte los efectos nocivos de la obesidad sobre la enfermedad renal.














