Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Medicina Interna
Print version ISSN 2393-6797On-line version ISSN 2393-6797
Rev. Urug. Med. Int. vol.1 no.3 Montevideo Dec. 2016
Caso clínico
Sarcoidosis pulmonar: actualización y reporte de casos
Pulmonary sarcoidosis: case report and update
Dr. Mauricio Amaral
Internista. Neumólogo. Ex Asistente de Clínica Médica. Ex Asistente de Neumología.
Departamento e Institución responsables: Cátedra de Neumología. Facultad de Medicina. Universidad de la República. Hospital Maciel. Montevideo - Uruguay.
Correspondencia: Dr. Mauricio Amaral. Av Islas Canarias 4189. Montevideo. Uruguay. Email: mauricioamaralh@gmail.com
Recibido: 1/6/16 - Aceptado: 18/10/16
RESUMEN
Introducción: La sarcoidosis es una enfermedad multisistémica, granulomatosa, de etiología desconocida, con presentación clínica y curso evolutivo variable. El pulmón es el órgano más afectado (90% casos). Si bien el diagnóstico es anátomo-patológico, en situaciones particulares puede plantearse el mismo en base a hallazgos clínicos-radiológicos. El tratamiento está indicado en el paciente sintomático y/o en aquel paciente en el que se demuestra un compromiso funcional respiratorio. Se presenta el análisis de 7 casos de sarcoidosis de un centro de referencia nacional en intersticiopatías, según las manifestaciones clínicas, radiológicas, laboratorio respiratorio y la respuesta al tratamiento.
Resultados: 7 pacientes (5 mujeres, 2 hombres) con edad promedio 47 años al momento del diagnóstico, tiempo promedio de seguimiento 9,7 años. 6/7 estaban sintomáticos al momento del diagnóstico. El funcional respiratorio era normal en 4 y en los 3 restantes tenía un patrón obstructivo. La difusión de monóxido de carbono fue normal en todos al momento del diagnóstico. Todos recibieron tratamiento con corticoides. De la re-evaluación se destaca que todos estaban asintomáticos y que la difusión de monóxido de carbono se mantuvo normal sólo en 4 de ellos.
Discusión: Si bien se trata de una serie de pocos casos, presentaron una buena evolución clínica y funcional ante el tratamiento realizado como se observa en otros estudios publicados. No siendo así los resultados de la evolución radiológica
Palabras claves: sarcoidosis pulmonar
ABSTRACT
Introduction: Sarcoidosis is a multisystem granulomatous disease of unknown etiology, clinical presentation and variable course. The lung is the most affected organ (90% cases). While the diagnosis is anatomopathological, in particular situations may arise based on the same clinical and radiological findings. Treatment is indicated in the symptomatic patient and / or one patient who demonstrated a respiratory functional compromise. analysis of 7 cases of sarcoidosis of a national reference center in intersticiopatías is presented, according to the clinical, radiologic, and laboratory respiratory response to treatment.
Results: 7 patients (5 women, 2 men) with a mean age 47 years at diagnosis, 9.7 years average follow-up time. 6/7 were symptomatic at diagnosis. Respiratory function was normal in 4 and the remaining 3 had an obstructive pattern. Diffusion of carbon monoxide was normal in all at diagnosis. All were treated with corticosteroids. The re-evaluation stresses that all were asymptomatic and the diffusion of carbon monoxide remained normal in only 4 of them.
Discussion: Although it is a series of a few cases, showed good clinical and functional evolution with the treatment performed as seen in other published studies evolution. Not being thus the results of radiology evolution.
Key words: pulmonary sarcoidosis
Introducción
La sarcoidosis es una enfermedad multisistémica granulomatosa de etiología desconocida, que se caracteriza por una presentación clínica y un curso evolutivo variable. Afecta predominantemente a adultos jóvenes y en la edad media de la vida.
Puede comprometer prácticamente cualquier sector del organismo, siendo el pulmón el órgano afectado con mayor frecuencia, hasta en un 90% de los casos. La severidad de esta afectación es muy variable tanto anatómica como funcionalmente.
Epidemiología
La sarcoidosis es una enfermedad ampliamente distribuida en todo el mundo, con tasas de incidencia y prevalencia que varían para cada región considerada. Es más frecuente en países de clima templado y particularmente en la población negra de EEUU, especialmente en mujeres (1).
Se han comunicado tasas de prevalencia tan variables como 28 casos por 100.000 habitantes en países nórdicos, 3 por 100.000 en Japón y 213 por 100.000 en mujeres irlandesas en edad fértil. En cuanto a la incidencia, en EEUU la tasa es de 5.9 por 100000 personas-año para los varones y 6.3 por 100000 personas-año para las mujeres (2).
Aunque puede presentarse a cualquier edad, más del 50% de los pacientes tienen entre 20 y 40 años (3).
La forma de presentación y la severidad de la enfermedad tienen diferencias de acuerdo al grupo étnico estudiado. Varios estudios sugieren que se presenta con mayor severidad en raza negra. La frecuencia de ciertas manifestaciones extratorácicas es también variable: el eritema nodoso es más frecuente en europeos, la uveítis crónica es más frecuente en pacientes de raza negra de EEUU (4).
Etiología
Aunque la causa de la sarcoidosis es desconocida, la hipótesis actual es que esta enfermedad se produce por una respuesta inmunológica particular frente a ciertos antígenos medioambientales específicos, en personas genéticamente predispuestas. La distribución geográfica amplia de esta enfermedad y las presentaciones clínicas dispares sugieren la participación de múltiples factores (5).
Se han analizado numerosos factores epidemiológicos que podrían contribuir en el desarrollo de sarcoidosis, pero ninguno ha demostrado por sí mismo una correlación estrecha con la enfermedad (6). Se han evocado como responsables diversos microorganismos, fundamentalmente las micobacterias. Las evidencias de la relación entre infección por micobacterias y sarcoidosis incluyen la similitud histológica de ambas lesiones y el hallazgo de ADN micobacteriano en el interior de lesiones sarcoideas detectado por reacción en cadena de polimerasa (PCR) (7).
Se ha propuesto que existe una predisposición genética, lo cual estaría evidenciado por las variaciones epidemiológicas raciales y en grupos familiares. Esta predisposición estaría en relación con el sistema HLA (6).
Patogenia
La sarcoidosis es el prototipo de respuesta inmunitaria compartimentalizada. Se observa una intensificación de la inmunidad celular a nivel pulmonar y en otros sitios de afectación sarcoidótica. En contraste, se observa inmunidad celular deprimida a nivel de circulación periférica (5).
Las respuestas inflamatorias del pulmón sarcoideo están reguladas por una compleja red de citocinas interrelacionadas (TNF, IL-1, IL-6, IL-12, entre muchas otras). La importancia del TNF (factor de necrosis tumoral) en su patogenia es apoyada por estudios que demostraron la eficacia de las terapias biológicas con antiTNF en el tratamiento de algunos pacientes (8).
Anatomía patológica
El granuloma epitelioide es la lesión característica de la sarcoidosis.
El granuloma es una pequeña formación nodular que está constituida por la agregación de células inflamatorias mononucleares o macrófagos modificados que se asemejan a células epiteliales, rodeado por un borde de linfocitos, y que a menudo presenta células gigantes multinucleadas. Algunos granulomas contienen también eosinófilos y células plasmáticas, y es común hallar algún grado de fibrosis alrededor de la lesión (9).
En la sarcoidosis los granulomas pueden mostrar diferentes etapas de evolución en la misma muestra de tejido, de manera tal que pueden encontrarse granulomas celulares activos cerca de lesiones fibróticas. La distribución es perivascular con frecuente compromiso de vasos sanguíneos (1).
Clínica
El cuadro clínico es proteiforme, con manifestaciones predominantemente respiratorias. Las manifestaciones pulmonares afectan al 90% de los pacientes con sarcoidosis.
Entre un 12 y un 50% de los pacientes con sarcoidosis se encuentran asintomáticos al diagnóstico.
Entre un 15-40% se presentan con síntomas respiratorios, siendo los más frecuentes la tos y la disnea. (5) El compromiso pleural es poco frecuente
Los hallazgos físicos generalmente están ausentes. Los estertores crepitantes están presentes en menos del 20% de los casos. El hipocratismo digital es poco habitual.
Los síntomas constitucionales como adelgazamiento, astenia, adinamia, malestar general se asocian habitualmente a afectación multisistémica y aparecen en 1/3 de los pacientes (10).
Manifestaciones extrapulmonares
Respecto a las manifestaciones de compromiso multisistémico prácticamente cualquier órgano puede verse afectado por esta enfermedad. Los compromisos más frecuentes y relevantes son los siguientes: entre un 10-35% presentan lesiones cutáneas, 10-25% compromiso ocular, 5-17% compromiso articular, aproximadamente un 5% presenta afectación cardíaca y otro 5% compromiso neurológico (5).
La neurosarcoidosis y la sarcoidosis cardíaca son consideradas graves y de mal pronóstico.
-
Compromiso cutáneo
Se destacan 2 manifestaciones predominantes:
-
Eritema nodoso: es marcador de sarcoidosis aguda, generalmente remite en 6 a 8 semanas, es más frecuente en mujeres
-
Lupus pernio: constituye una forma crónica de sarcoidosis. Se presenta como nódulos de color púrpura, ligeramente elevados, localizados en cara, cuello, hombros y/o dedos (10).
Otras lesiones cutáneas incluyen: nódulos subcutáneos, alopecia, placas, lesiones hipo o hiperpigmentadas (9).
-
Compromiso ocular
Es más frecuente en mujeres en edad reproductiva. La lesión característica es la uveítis. Los pacientes de raza negra desarrollan más frecuentemente uveítis anterior, mientras que en raza blanca es más frecuente la uveítis posterior.
También puede ocurrir afectación de la conjuntiva, esclerótica, retina y cristalino, produciendo cataratas o glaucoma. También se puede presentar edema de papila, conjuntivitis bilateral inespecífica, queratoconjuntivitis seca y compromiso de la glándula lacrimal. (10)
-
Compromiso articular
Se han descrito fundamentalmente tres formas de afectación articular en la sarcoidosis: episodios simples o recurrentes de artritis mono o poliarticular que no deja deformaciones, artritis persistente, o poliartritis migratoria que pueden presentarse en el contexto de un síndrome de Lofgren (3).
-
Sarcoidosis cardíaca
Puede haber compromiso del sistema de conducción que aumenta el riesgo de arritmias y muerte súbita. El miocardio puede afectarse, de tal manera que el ecocardiograma puede mostrar disquinesia del ventrículo izquierdo, disminución de la fracción de eyección del ventrículo izquierdo, así como hipertrofia ventricular derecha por hipertensión pulmonar, siendo todos estos hallazgos inespecíficos. (10, 11)
La resonancia nuclear magnética provee información de compromiso cardíaco con alta sensibilidad y la tomografía por emisión de positrones (PET) se ha ganado un lugar importante en la evaluación de estos pacientes al mostrar un patrón característico de afectación sarcoidotica miocárdica. (12)
-
Neurosarcoidosis
La afectación más común es la mononeuritis múltiple. Los pares craneanos más afectados son el séptimo y el segundo. El compromiso meníngeo es un hallazgo frecuente en la autopsia.
Diagnóstico
El diagnóstico de sarcoidosis es habitualmente tardío. Los pacientes suelen estar con manifestaciones clínicas durante más de 3 meses antes de la confirmación diagnóstica de la enfermedad. (8)
La mayoría de los casos requerirán un estudio anatomopatológico para confirmar el diagnóstico.
En situaciones particulares puede plantearse el diagnóstico en base a los hallazgos clínico radiográficos. Esto incluye las siguientes presentaciones: (13)
-
Adenopatías hiliares bilaterales y simétricas en la radiografía de un paciente asintomático
-
Síndrome de Lofgren: eritema nodoso, adenopatías hiliares, fiebre y artritis (14)
-
Síndrome de Heerfordt´s: uveítis, parotiditis y fiebre.
El resto de las presentaciones de esta enfermedad, que constituye la enorme mayoría de los casos, requerirán una biopsia confirmatoria que demuestre la presencia de granulomas epitelioides no caseificantes.
Esta biopsia podrá ser extraída del pulmón, de adenopatías hiliares, de la piel o de cualquier otro sector comprometido.
Cuando la afectación fundamental es pulmonar, la biopsia transbrónquica (BTB) mediante fibrobroncoscopia es el procedimiento recomendado. Entre los pacientes con radiografía patológica el rendimiento diagnóstico para éste método se ha reportado entre 85 – 90%. (10)
Cuando la BTB no es diagnóstica y no existen otros sitios identificados de fácil acceso para biopsiar, la biopsia pulmonar quirúrgica puede estar indicada.
La presencia de adenopatías mediastinales planteará la posibilidad de biopsia ganglionar mediante mediastinoscopía. El rendimiento diagnóstico de este procedimiento es cercano al 90% (10)
En los últimos años el uso del ultrasonido endobronquial (EBUS) ha colaborado en el diagnóstico de sarcoidosis, al incrementar la capacidad diagnóstica de la fibrobroncoscopía, permitiendo acceder a una muestra citológica ganglionar prescindiendo de la cirugía. Además, esta técnica puede tener acceso a grupos ganglionares a los que no se llega mediante mediastinoscopía. (8)
En un ensayo aleatorizado, Tremblay y cols. compararon el rendimiento de la punción aspirativa transbronquial convencional vs. la guiada por EBUS para el diagnóstico de sarcoidosis. Los autores encontraron que el rendimiento de la punción citológica mejoró significativamente mediante el uso del ultrasonido endobronquial (Convencional=73%, EBUS=96%) (15)
Es muy probable que la extensión del uso del EBUS en los servicios de endoscopía respiratoria facilite el diagnóstico de sarcoidosis en un futuro cercano.
Se ha sugerido que el lavado bronquiolo-alveolar (LBA) podría aportar al diagnóstico de sarcoidosis. Este estudio muestra en estos pacientes un incremento del número de linfocitos T helper (CD4) y de la relación CD4/CD8, con aumento de los macrófagos alveolares activados y la presencia de linfocinas y marcadores bioquímicos. Sin embargo, el aumento de la relación CD4/CD8 y los marcadores bioquímicos no han demostrado ser lo suficientemente específicos como para distinguir sarcoidosis de otras intersticiopatías pulmonares. (10)
-
Imagenología
La radiografía de tórax es la técnica de imagen más común para evaluar a los pacientes con sarcoidosis pulmonar. Es patológica en más del 90% de los pacientes portadores de sarcoidosis
El hallazgo más característico son las adenopatías hiliares bilaterales, a menudo con adenopatías paratraqueales derechas en forma concomitante. El aumento del tamaño de los ganglios linfáticos está presente en un 50 a 85% de los casos. (10)
Los infiltrados parenquimatosos con o sin adenopatías hiliares se presentan en un 25 a 50% de casos. Son infiltrados frecuentemente bilaterales y simétricos y comprometen los lóbulos superiores, particularmente segmentos apicales y posteriores. Pueden ser opacidades reticulonodulares u opacidades alveolares confluentes con consolidación o nódulos pulmonares bien circunscriptos.
En etapas avanzadas la radiografía de tórax puede mostrar alteraciones tales como distorsión de la arquitectura pulmonar, reducción volumétrica de los lóbulos superiores, ascenso hiliar con retracción y presencia de cavidades. (3)
En la década de 1960, Scadding propuso un sistema de clasificación de la radiografía de tórax del paciente con sarcoidosis (16). En la tabla I se presenta la modificación del sistema de clasificación original que es el usado actualmente.

La gran mayoría de los pacientes (55-90%) se encuentran en estadio I o II al momento del diagnóstico (8).
En la descripción original de esta clasificación se observó que los pacientes en estadio I tenían una probabilidad superior a 90% de resolución de los hallazgos radiográficos dentro de 2 años, mientras que aquellos con estadio III resolvieron las alteraciones en menos de un tercio de los casos a los 2 años (17).
Se ha demostrado que el estadio radiológico se correlaciona en forma débil con el nivel de disnea (18)
La tomografía computada (TC) de tórax es más sensible y específica que la radiografía de tórax en el estudio del parénquima pulmonar y las estructuras hiliomediastinales.
La TC de alta resolución (TCAR) de tórax ha ganado un lugar de suma importancia en el estudio de esta y otras patologías intersticiales del pulmón al aportar mejores imágenes, que permiten discriminar entre alveolitis y fibrosis, entre muchas otras ventajas. (10)
La imagen más característica de sarcoidosis en la TCAR consiste en pequeños nódulos en una distribución perilinfática, visibles en relación a las regiones peribroncovasculares, las cisuras, las regiones costales subpleurales, los septos interlobulillares y las regiones centrolobulillares. Sin embargo, el grado al cual esas estructuras están afectadas varía considerablemente dependiendo del paciente. (19)
Las anomalías parenquimatosas predominan en lóbulos superiores y en las regiones peribroncovasculares.
Menos frecuentes son: opacidades en vidrio deslustrado, grandes nódulos o consolidación, hallazgos compatibles con fibrosis incluyendo panal de abeja y bronquiectasias por tracción. (19)
Se ha sugerido que la presencia de áreas de atenuación en vidrio deslustrado en la TCAR puede guardar relación con un estado inflamatorio que probablemente responda al tratamiento. (8)
La tomografía por emisión de positrones (PET) ha tomado relevancia en los últimos años. Su importancia radica en que es un estudio capaz de objetivar la presencia de actividad sarcoidótica en áreas presumiblemente afectadas.
De esta manera el PET puede ser útil para identificar los sitios más adecuados para la biopsia diagnóstica. Este fue el procedimiento utilizado en un gran estudio prospectivo realizado por Teirstein y cols (20) que demostró un significativo aumento del rendimiento diagnóstico de las biopsias guiadas por PET.
El PET también puede objetivar la presencia de sarcoidosis en órganos relativamente inaccesibles como el corazón. Respecto a la sarcoidosis cardíaca, se ha demostrado que el PET tiene un patrón característico de afectación. (12)
-
Estudios funcionales respiratorios
En pacientes con sarcoidosis pulmonar en estadio I sólo un 20% presentan alteraciones en el estudio de la función pulmonar. En estadios II, III y IV las alteraciones están presentes en el 40 a 70% de los pacientes. (10)
Cuando existe compromiso intersticial la sarcoidosis suele presentar un patrón restrictivo, manifestado por la disminución de los volúmenes pulmonares, y anomalías del intercambio gaseoso, medido por la capacidad pulmonar de difusión del monóxido de carbono (DLCO)
Las alteraciones obstructivas están presentes en 1/3 o más de los pacientes con compromiso parenquimatoso pulmonar. Se ha informado correlación entre la obstrucción de la vía aérea y la presencia de síntomas respiratorios, incremento de la morbilidad y riesgo de muerte. (21)
El hecho de que algunos pacientes con estadio radiológico 0 ó I presenten patrón funcional restrictivo, sugiere que las pruebas de función pulmonar son más sensibles que la radiografía de tórax para detectar neumopatia parenquimatosa. Se considera al aumento de la diferencia alveoloarterial de oxigeno el parámetro más sensible para detectarla, seguido por la DLCO y la capacidad vital. (8)
La reducción de la DLCO puede estar presente en etapas tempranas de la enfermedad. (10)
El test de marcha de los seis minutos (TM6M) es un estudio útil en la valoración funcional de estos pacientes. Se ha demostrado una correlación significativa entre el nivel de disnea y el resultado del TM6M (8)
La hipoxemia en reposo es de aparición tardía y puede observarse en etapas avanzadas. (3)
-
Hipertensión pulmonar
La hipertensión pulmonar (HP) es una complicación común de la sarcoidosis pulmonar avanzada y su presencia se asocia con un aumento de la mortalidad. Si bien algunos casos de HP se deben a la disfunción ventricular izquierda, la gran mayoría son causados por hipertensión pulmonar precapilar. Los pacientes con hipertensión pulmonar precapilar tienen peor pronóstico que aquellos con HP poscapilar (22)
La HP en estos pacientes puede tener un origen multifactorial: Por enfermedad del ventrículo izquierdo (HP grupo II), por hipoxemia crónica secundaria a patología intersticial (HP Grupo III), y/o por infiltración granulomatosa perivascular (HP grupo V).
-
Alteraciones bioquímicas
Hipercalcemia: Su incidencia varía del 2 al 63% según los diferentes autores. Los macrófagos alveolares son capaces de producir calcitriol, el cual incrementa la absorción de calcio a nivel intestinal. En la sarcoidosis esta sustancia se produciría en sitios de actividad lesional y en los granulomas donde se encuentran macrófagos activados. Cuando la hipercalcemia es persistente puede traer complicaciones, tales como arritmias, nefrolitiasis, etc.,y constituir una indicación de tratamiento con corticoides. (23)
Enzima conversora de angiotensina (ECA): Esta enzima es producida por las células epitelioides de los granulomas y por los macrófagos alveolares. El aumento de la ECA se considera un marcador de la presencia de granulomas. Altos niveles de la misma han sido encontrados en la enfermedad activa y generalizada. Cambios en los niveles séricos de ECA tienen una alta sensibilidad para predecir recaída de la enfermedad, mayor que las pruebas funcionales o la radiografía de tórax. (23)
Tratamiento
El tratamiento medicamentoso de la sarcoidosis está indicado en el paciente sintomático, y/o en aquel paciente en el que se demuestra un compromiso funcional respiratorio.
La proporción de pacientes que necesitan tratamiento varía ampliamente en las diferentes series, entre un 20% a un 80%. Se ha observado que casi la mitad de los pacientes continuará necesitando terapia sistémica 5 años después del diagnóstico inicial. (24)
El encare de tratamiento para la sarcoidosis tiene actualmente un enfoque escalonado.
La mitad de los pacientes con sarcoidosis no necesitan terapia inicial. Aquellos pacientes que no necesitan la terapia sistémica en los primeros 6 meses tienen una probabilidad tan sólo del 10% de necesitarla a largo plazo durante el curso de su enfermedad. (24)
Los glucocorticoides orales como la prednisona son el primer escalón del tratamiento. La dosis diaria inicial es de 20 a 40 mg. Esta dosis se reduce posteriormente cada 2-3 meses según la respuesta al tratamiento y la presencia de efectos secundarios o adversos.
Si bajo el tratamiento corticoideo el paciente tiene progresión de la enfermedad o efectos adversos debe considerarse la utilización de otros fármacos como metotrexate, azatioprina, leflunomida o micofenolato mofetil. (24)
Si la terapia con prednisona y/o fármacos de segunda línea no controlan la enfermedad, actualmente se considera como siguiente paso la elección de un anti-TNF (factor de necrosis tumoral). (25,26)
Hasta el momento, el infliximab es el anti-TNF más estudiado, con dos ensayos controlados aleatorizados (27,28) que ponen de manifiesto su eficacia.
El rituximab puede ser considerado una opción terapéutica ya que ha sido reportado como eficaz para el tratamiento de sarcoidosis (29,30). Su mecanismo de acción es incierto.
Pronóstico
La mayoría de los pacientes con sarcoidosis tiene buen pronóstico. En 2/3 de los casos la enfermedad se resuelve espontáneamente con secuelas mínimas o nulas. Esta remisión se produce generalmente en los primeros 6 meses luego del diagnóstico, aunque se han visto remisiones en los siguientes 2 a 5 años. (31)
Alrededor de 1/3 de los pacientes desarrollan enfermedad crónica progresiva, siendo la fibrosis crónica progresiva la causa más común de muerte. (32)
La probabilidad de remisión varía de acuerdo al estadio de la enfermedad, presentando el estadio I un 60 a 80% de remisión espontánea, el estadio II un 50 a 70% de remisiones (generalmente bajo tratamiento). La remisión es de un 30% en el estadio III. La probabilidad de remisión en estadio IV es nula. (33)
Se han descripto múltiples marcadores de mal pronóstico: raza negra, presentación insidiosa, radiografía de tórax en estadio III o IV, enfermedad pulmonar progresiva, afectación del tracto respiratorio superior, el lupus pernio, la uveítis crónica y el compromiso óseo. (5) Entre estos se destacan por su especial severidad: la hipertensión pulmonar, la neurosarcoidosis y la sarcoidosis cardíaca.
Con el objetivo de valorar la evolución clínica, radiológica, del laboratorio respiratorio y la respuesta al tratamiento de pacientes con sarcoidosis pulmonar se presentan el siguiente reporte de casos.
Metodología
Se trata de un estudio descriptivo retrospectivo-prospectivo. Se realizó un análisis retrospectivo de los pacientes con diagnóstico de sarcoidosis pulmonar confirmado por biopsia o cuadro clínico típico que están en seguimiento actual en la policlínica de intersticiopatía, y que contaran con estudios del laboratorio respiratorio (espirometría, DLCO, TM6M) y radiografía de tórax al momento del diagnóstico de la enfermedad. Los casos incluidos fueron re-evaluados mediante anamnesis, espirometría, DLCO, TM6M y radiografía de tórax para el presente informe (abril 2016).
El equipo utilizado para la espirometría y DLCO fue un Easy One Pro, y se realizó según protocolos de ATS.
El TM6M se realizó según procedimiento estandarizado por las guías de ATS.
Resultados
Fueron incluidos 7 pacientes (5 mujeres y 2 hombres). La edad promedio al momento del diagnóstico fue de 47 años (17-56) y el tiempo promedio de seguimiento fue de 9,7 años, con un rango de 2 a 17 años.
Todos los pacientes tuvieron diagnóstico de sarcoidosis confirmado por biopsia a excepción de uno que se presentó como un síndrome de Löfgren y no requirió biopsia confirmatoria.
4 pacientes son no fumadores, 2 son ex fumadores con un índice paquete año (IPA) de 8 y 15 respectivamente, y 1 paciente es fumador activo con IPA de 12.
Presentación clínica: 6/7 pacientes estaban sintomáticos al momento del diagnóstico, siendo el síntoma predominante la disnea, presente en todos los casos (disnea de esfuerzo grado 2 o 3 de la mMRC). En 1 paciente se llegó al diagnóstico a partir de un hallazgo radiológico, sin traducción clínica.
Al momento de la re-evaluación, 5/7 estaban asintomáticos, y 2 presentaban disnea (grado 1 y 3 de la mMRC).
4/7 pacientes presentaron compromiso extra- pulmonar al momento del diagnóstico, todos ellos a forma de lesiones cutáneas.
Al momento de la re-evaluación estos 4 pacientes mostraron regresión de las lesiones cutáneas iniciales. Otro paciente presentó en la evolución una lesión interpretada como lupus discoide.
Radiología: en los gráficos 1 y 2 se presentan los hallazgos radiológicos al inicio y al momento de la re-evaluación.
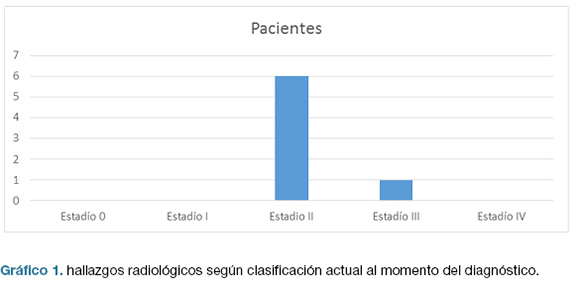
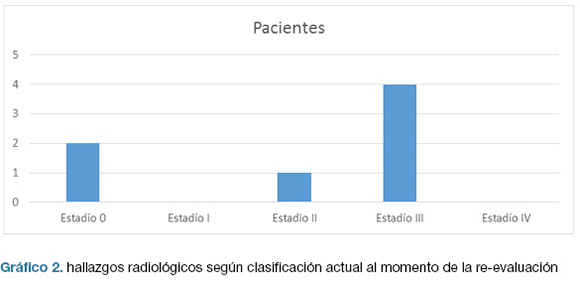
2 pacientes mostraron regresión radiológica y 3 de ellos experimentaron progresión.
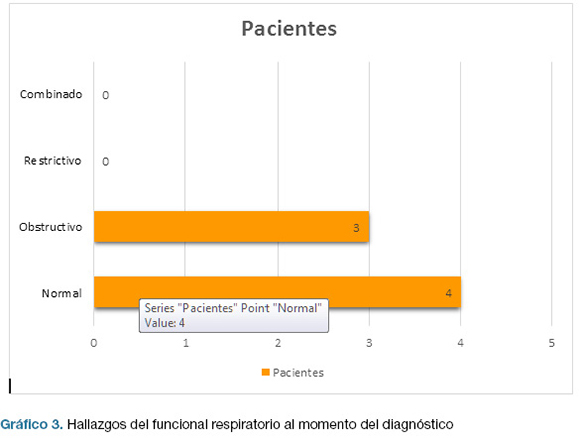
Laboratorio respiratorio: en el gráfico 3 se presentan los resultados del funcional respiratorio al momento del diagnóstico. El patrón obstructivo al momento del diagnóstico era leve (VEF1 72) en un paciente, moderado (VEF 1 62) en otro y moderadamente severo en el otro (VEF 1 58).
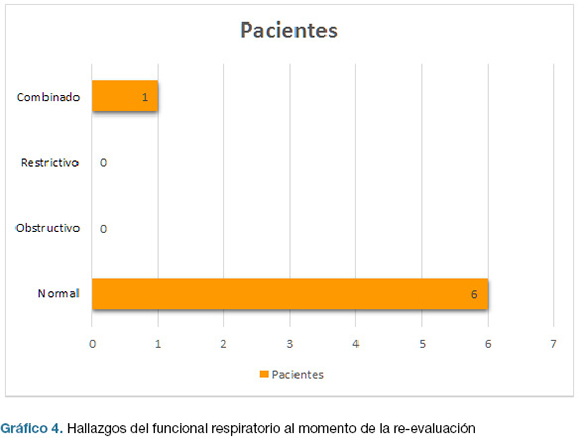
En la gráfica 4 se presentan los resultados del funcional respiratorio al momento de la re-evaluación. Solo un paciente tuvo un patrón obstructivo severo con restricción asociada, coincidiendo con que continúa fumando y no cumple con el tratamiento broncodilatador.
La DLCO de todos los pacientes fue normal al momento del diagnóstico.
Al momento de la reevaluación dos pacientes presentaron una DLCO levemente alterada (65% y 63%). Cuatro pacientes mantuvieron una DLCO normal. El paciente que continúa fumando y con mala adherencia al tratamiento no pudo realizar maniobras adecuadas para el cálculo de la DLCO.
En cuanto al TM6M al momento del diagnóstico mostraba una distancia recorrida normal para todos los pacientes. 2/7 desaturaron en forma significativa.
Al momento de la re-evaluación se mantuvo iguales resultados que al diagnóstico.
Todos los pacientes fueron evaluados con ecocardiograma doppler transtorácico dentro del último año de seguimiento, y ninguno de ellos evidenció la existencia de signos ecocardiográficos de hipertensión pulmonar.
Tratamiento: Todos los pacientes recibieron corticoides en plazos variables según el paciente y su respuesta, con un tiempo promedio de 3 años.
Al momento de la re-evaluación, 6/7 se encontraban sin tratamiento corticoideo. Solo una paciente presentó recaída de la enfermedad la cual reinició el tratamiento con prednisona 20 mg/día en los 6 meses previos a la re-evaluación. Un paciente recibió azatioprina como ahorrador de corticoides 4 años previo a la re-evaluación. Ningún paciente recibió metotrexate, leflunomida, micofenolato o terapias biológicas. No se presentaron efectos secundarios significativos del tratamiento.
Discusión
La edad de presentación de esta enfermedad en nuestro grupo es similar a los reportes internacionales (3)
A diferencia de lo referido en la literatura donde hasta el 50% de los pacientes se encuentran sintomáticos al momento del diagnóstico, en nuestra serie 6/7 presentaban manifestaciones clínicas, correspondiendo a disnea en todos los casos, que es sin duda el más prevalente (5).
4/7 pacientes presentaron compromiso extra- pulmonar al momento del diagnóstico, todos ellos a forma de lesiones cutáneas, siendo ésta una de las más frecuentes de encontrar (5).
Tal cual lo referido en la literatura la radiografía de tórax fue patológica en todos nuestros pacientes al momento del diagnóstico (10), en 6 pacientes se constató el estadio II y uno tenía el estadio III de la clasificación radiológica actual. Estos hechos coinciden con los reportes bibliográficos, donde la gran mayoría de los pacientes se encuentran en los estadios I o II (8) al momento del diagnóstico; siendo la presencia de adenopatías mediastinales el hallazgo más característico presente hasta en un 85% de los casos (10)
El funcional respiratorio estaba alterado en 3/7 pacientes analizados, correspondiendo en todos los casos a un patrón obstructivo. Encontramos una diferencia respecto a los datos de la bibliografía donde se plantea que éste patrón se observa en el 30% de los casos (21)
La presencia de DLCO normal en todos los casos al momento del diagnóstico nos hace plantear que ningún paciente presentaba compromiso intersticial, hecho que también se ve apoyado por las alteraciones encontradas en el funcional respiratorio.
Llama la atención que 6/7 pacientes estaban sintomáticos con disnea pero presentaban un TM6M normal al momento del diagnóstico, ya que según lo referido en la literatura éste tiene una correlación significativa con el nivel de disnea que presenta el paciente (8)
Todos los pacientes tuvieron indicación de tratamiento con corticoides dado que se encontraban sintomáticos (6/7) o tenían compromiso del funcional respiratorio (3/7) al momento del diagnóstico, hecho un poco superior a los datos de la bibliografía que reporta la necesidad de tratamiento variable en las distintas series, pero que llega hasta un 80% (24); en cuanto al tiempo promedio que lo recibieron es similar a lo reportado en otras series.
Sólo un paciente requirió el uso de inmunosupresores (azatioprina) con el objetivo de disminuir la dosis de corticoides y evitar efectos adversos.
En cuanto a la evolución de esta serie de pacientes encontramos que clínicamente se asistió a una mejoría, ya que 5/7 estaban asintomáticos en lo respiratorio y solo 1/7 presentaba una manifestación extrapulmonar (cutánea).
Sin embargo 5/7 pacientes presentaban alteraciones radiológicas, correspondiendo en su mayoría a estadio III lo que evidencia una progresión de las mismas respecto al momento del diagnóstico. Estos hallazgos no son los reportados habitualmente por la bibliografía, que hacen referencia a un grado de reversión con el tratamiento que llega al 50% aproximadamente (33).
Pese a esta peoría radiológica el funcional respiratorio sólo fue patológico en 1/7 pacientes correspondiendo a un patrón asociado (obstructivo y restrictivo) coincidiendo con la persistencia del hábito tabáquico y la no adherencia al tratamiento, lo que nos puede hacer plantear la co-existencia de otras patologías respiratorias vinculadas al tóxico.
La re-evaluación de la DLCO fue patológica en 2/6 pacientes en que se realizó lo que es concordante con la evolución de la enfermedad, ya que se considera al DLCO un marcador precoz de afección (10), manteniéndose hallazgos similares que en el diagnóstico para el TM6M.
Ningún paciente desarrolló durante el seguimiento hipertensión pulmonar (hallazgo ecocardiográfico), siendo éste un hecho llamativo ya que esta es una complicación frecuente de encontrar en esta patología (22).
Conclusiones
Los casos analizados se comportan en forma similar que los reportados en la literatura en cuanto a edad, forma clínica y radiológica de presentación. Sin embargo la evolución no coincide con lo reportado, existiendo una disociación clínico- radiológica.
Asistimos a una clara mejoría clínica y del funcional respiratorio de los pacientes pero con peoría de la radiología, considerando éste el dato más relevante del estudio de nuestra serie de casos.
Bibliografía
1. Selman M. Sarcoidosis. En: Selman M, ed. Neumopatías intersticiales difusas. México: Panamericana;1996. pp. 143-158.
2. Hosoda Y, Yamaguchi M, Hiraga Y. Global epidemiology of sarcoidosis. Clin Chest Med 1997; 18: 681-694.
3. Infiltrative and interstitial lung diseases. Sarcoidosis. En: Murray J, Nadel J. Textbook of respiratory medicine. 3°ed.Philadephia: Elsevier; 2000. pp. 1717-1732.
4. Statement on sarcoidosis. Joint Statement of the American Thoracic Society (ATS), the European Respiratory Society (ERS) and the World Association of Sarcoidosis and Other Granulomatous Disorders (WASOG) adopted by the ATS Board of Directors and by the ERS Executive Committee, February 1999. Am J Respir Crit Care Med 1999; 160:736-755.
5. Lynn T, Elias J. Sarcoidosis sistemica. En: Neumología Baum´s. Madrid: Marban; 2007. pp. 559-582.
6. Sarcoidosis. In: Schwarz M, King T, editors. Interstitial disease. 4th. London: BC Decker; 2003. pp. 332-386.
7. Baughman RP. Can tuberculosis cause sarcoidosis? New techniques try to answer an old question. Chest. 1998; 114: 363-364.
8. Baughman RP, Culver DA, Judson MA. A concise review of pulmonary sarcoidosis. Am J Respir Crit Care Med. 2011;183(5): 573-581.
9. Sheffield EA. Pathology of sarcoidosis. Clin Chest Med 1997; 18:741-754.
10. Mussetti A, Vignoli L, Curbelo P, Meerovich E. Sarcoidosis pulmonar. Neumol. cir. tórax. 2006; 65: 36-46.
11. Chandra M, Silverman M. Diagnosis of cardiac sarcoidosis aided by MRI. Chest 1996; 110:562-565
12. Uemura A, Morimoto S, Hiramitsu S, Kato Y, Ito T, Hishida H. Histologic diagnostic rate of cardiac sarcoidosis: evaluation of endomyocardial biopsies. Am Heart J 1999; 138: 299-302.
13. Judson MA. The diagnosis of sarcoidosis. Clin Chest Med 2008;29: 415-427.
14. Pérez G, Facal J. Sarcoidosis aguda. Variante de Síndrome de Löfgren sin eritema nodoso. Arch Med Interna 2014; 36(2):79-83
15. Tremblay A, Stather DR, Maceachern P, M Khalil, Campo SK. A randomized controlled trial of standard vs endobronchial ultrasonography-guided transbronchial needle aspiration in pacients with suspected sarcoidosis. Chest 2009;136:340-346
16. Scadding JG. Prognosis of intrathoracic sarcoidosis in England. BMJ 1961; 4: 1165-1172.
17. Yeager H, Rossman MD, Baughman RP, Teirstein AS, Judson MA, Rabin DL, et al. Pulmonary and psychosocial findings at enrollment in the ACCESS study. Saroidosis Vasc Diffuse Lung Dis 2005; 22:147-153.
18. Remy-Jardin M, Giraud F, Remy J, Wattinne L, Wallaert B, Duhamel A. Pulmonary sarcoidosis: role of CT in the evaluation of disease activity and functional impairment and prognosis assessment. Radiology 1994; 191: 675-680.
19. Sarcoidosis. En: Webb WR, Muller NL, Naidich DP. Alta Resolución en TC de Pulmón. 3a ed. Madrid: Marbán; 2003. pp.288-303.
20. Teirstein AS, Machac J, Almeida O, Lu P, Padilla ML, Ianuzzi MC. Results of 188 whole-body flurdeoxyglucose positrón emission tomography scans in 137 patients with sarcoidosis. Chest. 2007; 132: 1949-1953.
21. Lavergne F, Clerici C, Sadoun D, Brauner M, Battesti JP, Valeyre D. Airway obstruction in bronchial sarcoidosis. Chest. 1999; 116: 1194-1199.
22. Baughman RP, Engel PJ, Taylor L, Lower EE. Survival in sarcoidosis-associated pulmonary hypertension: the importance of hemodynamic evaluation. Chest 2010; 138: 1078–1085
23. Costabel U, Teschler H. Biochemical changes in sarcoidosis. Cl Chest Med 1997;18(4):843-851
24. Baughman RP, Grutters JC. New treatment strategies for pulmonary sarcoidosis: antimetabolites, biological drugs, and other treatment approaches. Lancet Respir Med 2015; 3: 813–822
25. Drent M, Cremers JP, Jansen TL, Baughman RP. Practical eminence and experience-based recommendations for use of TNF-α inhibitors in sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis. 2014; 31: 91–107.
26. Crommelin HA, Vorselaars AD, van Moorsel CH, Korenromp IH, Deneer VH, Grutters JC. Anti-TNF therapeutics for the treatment of sarcoidosis. Immunotherapy 2014; 6: 1127–43.
27. Baughman RP, Drent M, Kavuru M, Judson MA, Costabel U, du Bois R, et al; The Sarcoidosis Investigators. Infliximab therapy in patients with chronic sarcoidosis and pulmonary involvement. Am J Respir Crit Care Med 2006; 174: 795–802.
28. Rossman MD, Newman LS, Baughman RP, Teirstein A, Weinberger SE, Miller W Jr, et al. A double-blinded, randomized, placebo-controlled trial of infliximab in subjects with active pulmonary sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis. 2006; 23: 201–208.
29. Lower EE, Baughman RP, Kaufman AH. Rituximab for refractory granulomatous eye disease. Clin Ophthalmol 2012; 6: 1613–1618.
30. Sweiss NJ, Lower EE, Mirsaeidi M, Dudek S, Garcia JG, Perkins D, et al. Rituximab in the treatment of refractory pulmonary sarcoidosis. Eur Respir J 2014; 43: 1525–1528.
31. Judson M. An approach to the treatment of pulmonary sarcoidosis with corticosteroids: The six phases of treatment. Chest. 1999; 115(4):1158-1165
32. Morgenthau AS, Iannuzzi MC. Recent advances in sarcoidosis. Chest. 2011; 139(1):174-182.
33. Miller A. Of time and experience: Sarcoidosis revisted. Chest. 2002: 121 (1):3-5.














