Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Medicina Interna
Print version ISSN 2393-6797On-line version ISSN 2393-6797
Rev. Urug. Med. Int. vol.1 no.3 Montevideo Dec. 2016
Caso clínico
Craniectomía decompresiva en el ACV isquémico:
Reporte de 8 casos.
Decompressive craniectomy in ischemic ACV:
Report of 8 cases.
Dra. Alejandra Jaume
Residente de Neurocirugía
Dr. Ignacio Aramburu
Residente de Neurocirugía
Dr. Gabriel Castelluccio
Residente de Neurocirugía
Dra. Maria Cabrera
Residente de Neurocirugía
Dra. Verónica Bentancourt
Residente de Neurocirugía
Dr. Pablo Díaz
Residente de Neurocirugía
Dra. Mariana Romero
Residente de Neurocirugía
Dr. Carlos Aboal
Profesor Agregado Neurocirugía
Departamento e Institución responsables: Servicio de Neurocirugía. Hospital de Clínicas. Facultad de Medicina. Universidad de la República. Montevideo – Uruguay.
Correspondencia: Dra. Alejandra Jaume. Cátedra de Neurocirugía. Piso 2. Hospital de Clínicas. Av Italia s/n. Montevideo-Uruguay.
Recibido: 21/9/16 - Aceptado: 16/11/16
RESUMEN
Introducción: El accidente cerebrovascular es la patología más costosa que existe, siendo la segunda causa de muerte y la primera causa de discapacidad. El aumento de la expectativa de vida en la población en general, ha determinado un incremento en la prevalencia de factores de riesgo para el desarrollo de esta enfermedad. En el año 2012, murieron 2.542 uruguayos por esta patología, o sea, 7 personas por día.
Métodos: Se realizo un análisis retrospectivo, en el Hospital de Clínicas, de todos los pacientes que ingresaron con el planteo de accidente cerebrovascular isquémico, desde agosto del 2014, hasta el mismo mes del 2015 (un año de periodo). De un total de 139 pacientes a los cuales se les diagnostico accidente cerebrovascular isquémico, 8 casos (5,8%) requirieron craniectomía decompresiva, que son los que se analizan en el presente trabajo.
Resultados: Se trata de 6 hombres y 2 mujeres. La edad promedio fue de 54,8 años (rango 36-71 años). El motivo de consulta fue variado, y un 75 % presento más de 16 puntos en la escala del National Institutes of Health Stroke Scale al momento del ingreso. Al 50% de los pacientes incluidos se les realizo factor activador del plasminógeno recombinante (rTPA) intravenoso. Ningún paciente se completo con estudio vascular de manera precoz. Solo 5 pacientes ingresaron a la unidad de accidente cerebrovascular. En el 75% de los casos se realizo la craniectomía decompresiva a menos de 48 horas de instalado el ictus. El 37,5% de los pacientes fallecieron antes de los 15 días del episodio, y el 62,5% sobrevivieron con una escala de Rankin modificada (mRS) igual o mayor a 3.
Conclusiones: Los pacientes con accidente cerebrovascular isquémico deben ser atendidos por un equipo multidisciplinario, con todas las herramientas necesarias y demostradas como nivel de evidencia clase 1A (unidad de accidente cerebrovascular; factor activador del plasminógeno recombinante intravenoso, y tratamiento endovascular) para brindarle al paciente el tratamiento más eficaz que permita una adecuada y precoz rehabilitación. La craniectomía decompresiva tiene indicación (nivel de evidencia clase 1B) en aquellos pacientes menores de 60 años, con accidente cerebrovascular maligno que no respondieron al tratamiento anteriormente mencionado.
Palabras claves: stroke isquémico, trombolíticos, endovascular, cirugía decompresiva, pronostico del accidente cerebrovascular.
ABSTRACT
Introduction: The stroke is the most expensive disease that exist, being the second leading cause of death and the leading cause of disability. Increased life expectancy has determinated an increase of risk factors for this disease. 2542 uruguayans or seven people per day died from stroke in 2012.
Methods: A retrospective analysis was performed with all patients admitted at Hospital de Clinicas with diagnosis of ischemic stroke, from August 2014 to the same month of 2015. 139 patients had diagnosis of stroke, 8 (5,8%) of them needed decompressive craniectomy.
Results: Six men and 2 women. 54,8 was the average age (36 – 71). 75% present with NHISS of 16 or more. 50% of patients were treated with rTPA iv. None patient had an early vascular study. Only 5 patients were admitted at stroke units. In 75% of cases, a decompressive craniectomy was performed in the first 48 hours. 37,5% of patients died in the first 15 days from the onset of symptoms. 62,5% of patients were alive with a mRS of 3 or more.
Conclusion: Patients with ischemic stroke should be treated by a multidisciplinary team with all the necessary tools (stroke unit; rTPA iv, and endovascular treatment) to give the patient the best chance of a diagnosis, effective treatment and early rehabilitation. Patients under 60 years, with a malignant stroke and a negative evolution in spite of the treatment previously mentioned, benefit from a decompressive craniectomy.
Key words: ischemic stroke, trombolytic, endovascular, decompressive craniectomy, stroke prognosis
Introducción
El Accidente Cerebrovascular (ACV) es la patología más costosa que existe, consumiendo del 2 al 4% de los recursos de la salud a nivel mundial 1. Según datos de la Organización Mundial de la Salud (OMS) es la segunda causa de muerte y la primer causa de discapacidad 2, 3. A pesar del surgimiento de los centros de ACV a nivel mundial, se prevé un aumento del número de ACV en el futuro (2005 al 2030 de 16 a 23 millones con una mortalidad que pasara de 5,7 a 7,8 millones anuales) 4.
Debido a que la prevención del ACV es mucho menos eficaz que el infarto agudo de miocardio (IAM), en algunas regiones del mundo ya hoy los ACV causan más muertes que los IAM 5. Existen alrededor de 16 millones de nuevos casos anualmente con 5,7 millones de muertos, dentro de los cuales la incidencia de los ACV isquémicos es alrededor de 345 casos cada 100.000 habitantes por año 6.
Si tomamos la epidemiología basado en la etiopatogenia, se evidencia que la mayor proporción de pacientes con ACV caen dentro de causas indeterminadas.
El aumento de la expectativa de vida en la población en general, así como en nuestro país, ha determinado un incremento en la prevalencia de factores de riesgo para el desarrollo de esta enfermedad. Desde hace varios años la mayor causa de mortalidad cardiovascular corresponde al grupo de enfermedades cerebrovasculares. En el año 2012, murieron 2.542 uruguayos por ACV, o sea 7 personas por día 7.
El objetivo del presente trabajo es reportar los ochos casos de craniectomía decompresiva en pacientes con ACV isquémico, realizados en el Hospital de Clínicas (centro de referencia para esta patología en el Uruguay).
Metodología
Se realizo un análisis retrospectivo, en el Hospital de Clínicas, de todos los pacientes que ingresaron con el planteo de ACV isquémico, entre agosto del 2014 a agosto 2015. De un total de 139 pacientes a los cuales se les diagnostico ACV isquémico, mediante Tomografía Computada (TC) o Resonancia Nuclear Magnética (RNM), e ingresaron a la unidad de ACV, se incluyeron en el presente trabajo 8 casos (5,8%), que requirieron craniectomía decompresiva.
De los mismos se valoro: edad, manifestaciones clínicas, estudios solicitados, tratamiento realizado y evolución post-tratamiento.
Se realizo una revisión bibliográfica enfocada en el ACV isquémico, en las bases Pubmed, (http://www.ncbi.nlm.nih.gov/pubmed/), y en las dos publicaciones neurológicas con mayor impacto: Interventional Neuroradiology y Stroke. También se revisaron protocolos y guías de recomendación utilizados en diferentes centros de referencia mundial (actualización 2015 de las guías canadienses del manejo del stroke hiperagudo, y American Heart Association/American Stroke Association), con el objetivo de actualizar las indicaciones del tratamiento de dicha patología.
Resultados
De los 8 pacientes incluidos en el trabajo, 6 fueron hombres y 2 mujeres. El promedio de edad fue de 54,8 años (rango 36-71 años). El motivo de consulta fue variado, pero todos los casos presentaron un déficit focal neurológico de instalación brusca, un 75 % de ellos presento un National Institutes of Health Stroke Scale (NIHSS) mayor de 16 al momento del ingreso. Al 50% de los pacientes incluidos se les realizo rTPA i/v porque cumplían con los criterios de inclusión del protocolo de ACV del Hospital de Clínicas. En ningún paciente se realizo un estudio vascular de manera precoz. Solo 5 pacientes ingresaron a la unidad de ACV. En el 75% de los casos se realizo craniectomía decompresiva en menos de 48 horas de instalado el ictus. El 37,5% de los pacientes fallecieron antes de los 15 días del ACV, y el 62,5% sobrevivieron con un mRS igual o mayor a 3.
A continuación se presentan alguno de los casos a modo de ejemplo.
Caso clínico 1
Hombre, 58 años, con antecedentes personales de hipertensión arterial (HTA) sin tratamiento ni control, fumador, obeso. 5 horas antes de la consulta instala déficit motor de hemicuerpo derecho y alteraciones del leguaje. Al ingreso se destaca paciente vigil cumple órdenes simples, mutismo afásico y hemiplejia de hemicuerpo derecho. Escala coma Glasgow (CGS): 11. NIHSS: 18.
Se realizo TC de cráneo, que confirma área de isquemia en territorio de la arteria cerebral media (ACM) y arteria cerebral anterior (ACA) izquierda. (Figura 1). No se realizó fibrinolíticos intravenosos por encontrarse fuera de los plazos de tiempo. A las 17 horas de la evolución deprime conciencia, constatándose apertura ocular al llamado, no cumple órdenes, mutismo afásico, CGS: 9. Se reitera TC de cráneo que evidenció un aumento extenso del área de infarto de la ACM, y ACA, con efecto de masa dado severo. (Figura 2)
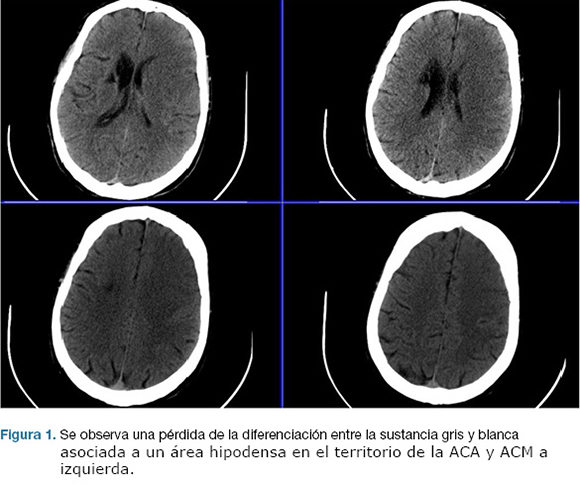
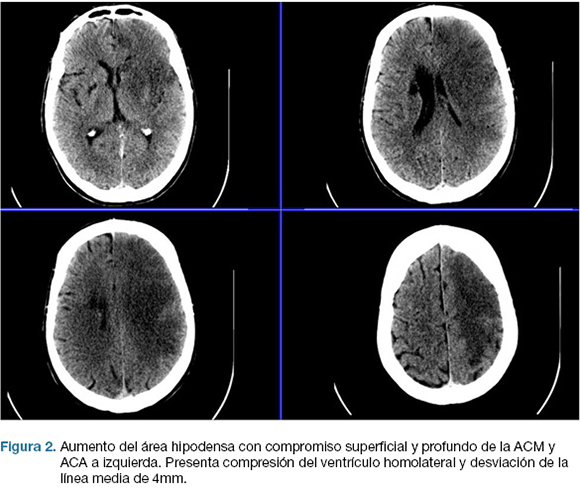
Se realizo una hemicraniectomía decompresiva de emergencia. En el post operatorio ingreso a centro de terapia intensiva (CTI), con intubación orotraqueal (IOT), en asistencia respiratoria mecánica (ARM), sin apertura ocular al llamado, sin gestos, localizando con miembro superior izquierdo; CGS 7. Las cifras de presión intracraneanas (PIC) fueron menores a 20 mmHg en las primeras 24 horas, y luego ascendieron hasta 40 mmHg, instalando midriasis a izquierda. TC de control evidencio infarto configurado de todo el territorio de la arteria carótida interna izquierda (Figura 3).
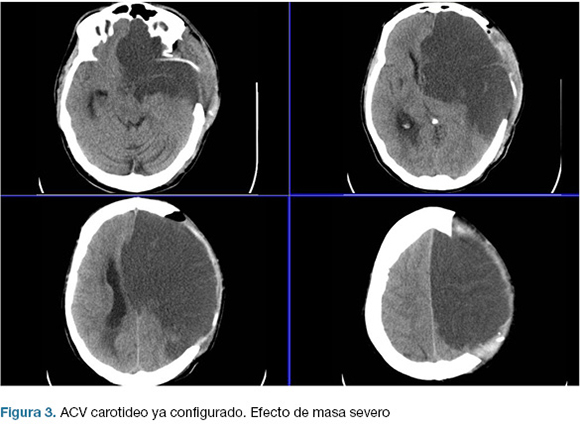
Pese al enérgico tratamiento médico neuro-intensivo, el paciente falleció al 6to día del ACV. Escala mRS: 6.
Caso clínico 2
Hombre, 36 años. La noche previa al ingreso presentó trastorno en el lenguaje y alteración motora en MID, transitoria que revierte a la media hora, quedando asintomático. 2 horas previo al ingreso en la mañana instala en forma brusca afasia y déficit motor hemicuerpo derecho. Al ingreso se destaca paciente vigil, cumple órdenes simples, mutismo, hemiplejia derecha. CGS: 12. NIHSS: 26.
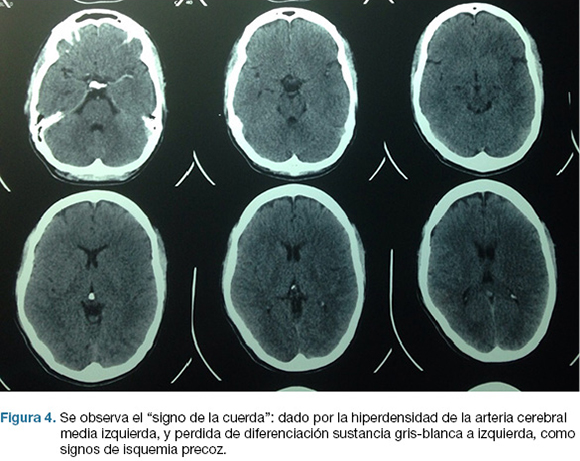
Se realiza TC de cráneo (Figura 4) y rTPA i/v. TC cráneo de control a las 24 hs sin cambios. A las 48 hs instala agravación del nivel de conciencia, apertura ocular al llamado, CGS: 9. Se repite TC cráneo (Figura 5), realizándose hemicraniectomía decompresiva de urgencia. En el post operatorio ingreso a CTI, IOT, en ARM, sin apertura ocular al llamado, gestos, localizando con miembro superior izquierdo. CGS: 8.
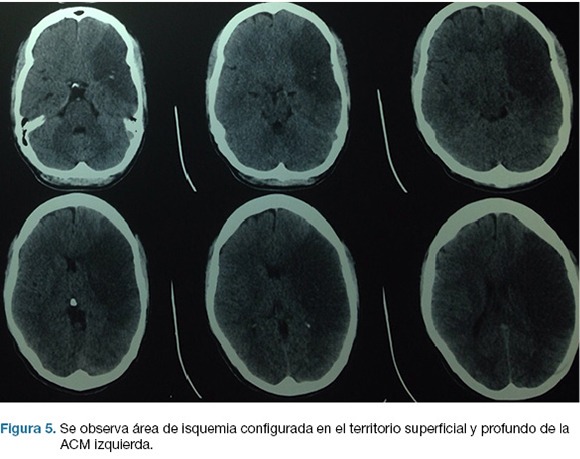
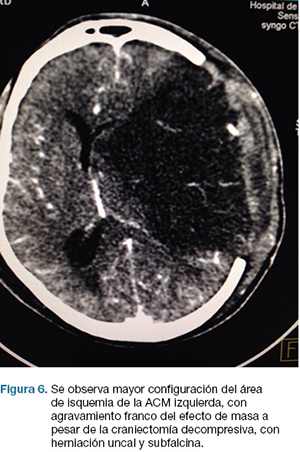
En la evolución agrega anisocoria izquierda que revierte con tratamiento médico. TC cráneo de control (Figura 6) evidencia agravación, por lo que se re-interviene realizándose lobectomía temporal izquierda reglada. De la evolución post-operatoria en CTI presenta CGS: 9, cifras de PIC menores de 20 mmHg, pupilas simétricas y reactivas, buena evolución. En sala paciente con mejoría de déficit motor, y de su afasia, emite palabras. Se recoloca hueso al mes de cirugía. Escala mRS al alta: 3.
Caso clínico 3
Hombre, 58 años. Con antecedentes personales de HTA, fumador, portador de enfermedad pulmonar obstructiva crónica (EPOC). 2 horas previas al ingreso instala de forma brusca síndrome hemisférico izquierdo. Al ingreso se destaca paciente vigil, afasia, hemiplejia derecha. CGS: 12. NIHSS: 24.
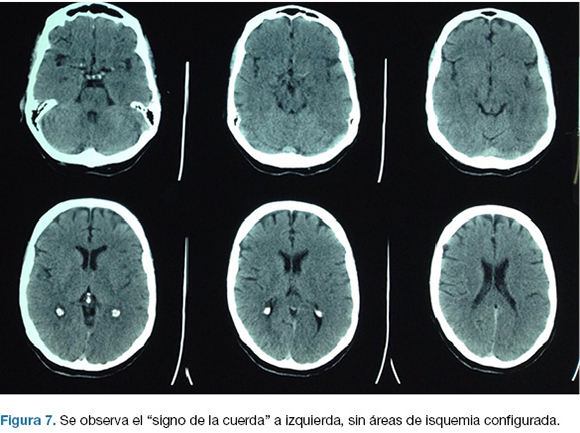
Se realiza TC de cráneo (Figura 7) y rTPA i/v. Ingresa a la unidad de ACV y a las 30 horas del inicio de los síntomas en forma brusca deprime conciencia e instala anisocoria a izquierda. Nueva TC de cráneo (Figura 8), surgiendo la indicación de intervención de emergencia.
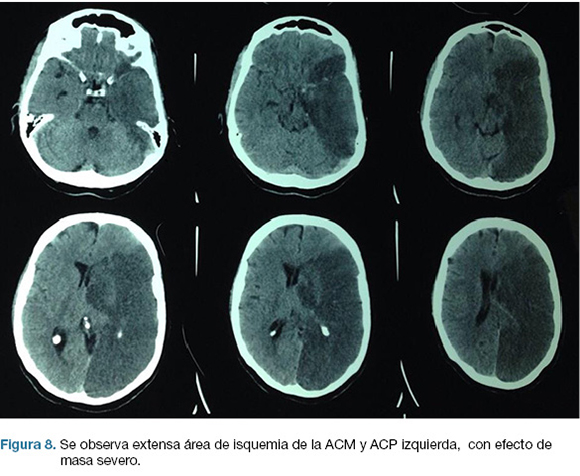
En el post operatorio ingreso a CTI, IOT, en ARM, sin apertura ocular al llamado, gestos, flexión inapropiada de MSD. CGS: 6. De la evolución persiste con hemiplejia derecha y afasia severa. Escala mRS al alta: 5.
Discusión
Los ACV constituyen una verdadera “PLAGA” en términos de salud pública, a pesar de los extraordinarios avances que se produjeron en neurología vascular durante los últimos 40 años, tanto en el diagnóstico (TC, RNM, ultrasonido, nuevos angiógrafos), como a nivel terapéutico (unidades de ACV, trombolisis, antitrombóticos, antihipertensivos, estatinas, cirugía carotidea, cirugía cerebral, y endovascular) 8.
El ictus isquémico representa aprox. el 80% de los ACV 9; y es considerado una constelación de patologías, ya que a pesar de completar los estudios adecuados en cada paciente, en el 35 al 40 % de los casos, no encuentran una causa que lo explique (citogenéticas) 10.
La clasificación más utilizada: “TOAST classification” 10, divide a los ACV isquémicos según su etiopatogenia, en 5 subtipos:
1) Ateroesclerosis de gran calibre (20%)
2) Cardioembolismo (20%)
3) oclusión de pequeño vaso (25%)
4) Stroke de otras causas (5%)
5) causa Indeterminada (30%)
Hasta el 2015 solo existían dos tratamientos que disminuían la morbimortalidad en la fase aguda del ACV isquémico con nivel de evidencia 1A: las unidades de ACV 11 y la trombolisis intravenosa con activador tisular recombinante del plasminógeno (r-TPA), con una ventana terapéutica de tres horas desde el inicio de los síntomas en base al estudio NINDS-2 12 y de 4.5 hs en base al estudio ECASS III 13.
Las unidades de ACV son destinadas a todos los pacientes que instalan un accidente isquémico transitorio (AIT) o un ACV, pero el uso de los trombolíticos i/v es solo para un porcentaje de pacientes de aproximadamente el 10%14.
En Febrero 2016, se presentaron en una sesión plenaria de la Conferencia Internacional de Stroke en Nashville, 5 nuevos estudios con nivel de evidencia clase 1A: MR.CLEAN 15, ESCAPE 16, EXTEND-IA 17, SWIFT PRIME 18 y REVASCAT 19, que cambiaron los paradigmas en cuanto al tratamiento del ACV isquémico. Estos trabajos demostraron claros beneficios del tratamiento endovascular en pacientes con ACV isquémico de menos de 6 horas de evolución, con oclusión de grandes vasos del sector anterior arterial.
Es así, que con los últimos grandes avances en el tratamiento del ACV isquémico se cambió el encare “standard” de esta entidad, estando en las ultimas guías de mayor relevancia de esta patología a nivel mundial: guías de Canadá 2015 20 y guías de la American Heart Association/American Stroke Association (AHA) 2015 21, incluidos los tres tratamientos con nivel de evidencia 1A: unidad de ACV, r-TPA i/v y trombectomía mecánica. La cirugía (hemicraniectomía decompresiva) ha quedado relegada para aquellos pacientes con ACV maligno que no respondieron al tratamiento mencionado anteriormente (nivel de evidencia 1B).
Analizando lo expuesto y viendo la casuística de nuestros pacientes que requirieron cirugía, debemos mencionar que existió un tratamiento incompleto, dado que en ninguno de ellos se realizo estudio vascular (angio-TC o angio-RNM) como se mencionan en las guías (nivel de evidencia 1A) 20,21, para poder diagnosticar oclusión de gran vaso, y continuar con el tratamiento endovascular en caso de haber estado indicado (siguiendo los protocolos expuestos en las guías anteriormente mencionadas).
Los 8 pacientes contaban con los criterios de inclusión de los trabajos randomizados expuestos: la edad, tiempo de inclusión (menos de 6 horas), NIHSS (mayor 6), así como TC cráneo inicial (ASPECT mayor a 7).
Todos los pacientes desarrollaron en la evolución un ACV isquémico maligno, definiendo el mismo como todo infarto isquémico que presente los criterios clínicos, evolutivos e imagenológicos, utilizados en los tres trabajos randomizados realizados hasta el momento actual en Europa: DESTINY 22, DECIMAL 23 y HAMLET 24.
Criterios clínicos: instalación brusca de síntomas en el territorio de la ACM, así como sintomatología neurológica vinculada a otros territorios vasculares cerebrales.
Criterio evolutivo: descenso en el nivel de conciencia progresivo desde el inicio de los síntomas, pudiendo observarse hasta el quinto día, con mayor frecuencia en los primeros tres, con un NIHSS mayor de 16.
Criterios imagenológicos: aparición de signos que sugieran una isquemia de por lo menos el 50% del territorio de la ACM, ASPECT menor de 7, o un volumen del ACV mayor a 145 cc3 en la difusión 22,25,26. Estos criterios no están presentes en la TC inicial cuando se hace el diagnóstico de ACV.
El 100% de nuestros pacientes presentaron los criterios imagenológicos en la evolución, los cuales estuvieron acompañados de una franca peoría clínica, con descenso del CGS en las primeras 24 horas post ictus. El 75% de los pacientes presentaban un NIHSS mayor de 16 al momento del diagnostico.
En Uruguay aproximadamente el 5% de los ACV tienen un comportamiento maligno 27, y como vimos el porcentaje de pacientes que requirió cirugía fue bajo (5,8%), comparable con la literatura internacional. Sin embargo debemos recalcar que si en este porcentaje de pacientes se hubiera completado el diagnostico de oclusión de gran vaso y el eventual tratamiento endovascular, se podría haber disminuido el número de pacientes que fueron sometidos a cirugía.
En cuanto a la indicación de cirugía (hemicraniectomía decompresiva), dado la elevada morbi-mortalidad que presentan estos pacientes, es un punto controversial la indicación de la misma, con el objetivo no solo de mejorar la mortalidad, sino de “salvar la función cerebral”, mejorando la calidad de vida. Los únicos tres ensayos clínicos controlados realizados hasta el momento actual mencionados anteriormente (DESTINY, DECIMAL y HAMLET), han demostrado de manera estadísticamente significativa los beneficios de la craniectomía decompresiva en el tratamiento del ACV maligno, en pacientes menores de 60 años.
Analizando dichos trabajos se demostró una reducción significativa en la mortalidad del 70% (tratamiento conservador) vs. 20% (craniectomía decompresiva) 28,29. También se tuvo un impacto positivo en el pronóstico funcional, medido por el mRS, comprobando un aumento del 30% en los pacientes operados con mRS 4 (no autoválido) y un 10% en los pacientes con mRS 2 y 3 (autoválidos), sin modificación significativa en el porcentaje de pacientes con mRS 5 (dependencia total) 28,29.
A su vez, a diferencia de lo que se pensaba antiguamente, la evidencia demuestra el claro beneficio del tratamiento quirúrgico independientemente del hemisferio cerebral involucrado22 -24,28. Es importante realizar un tratamiento precoz, ya que la cirugía es más beneficiosa para estos pacientes (aproximadamente menos de 48hs). Aquellos pacientes que hayan recibido fibrinolíticos intravenosos o intra-arteriales, no tienen contraindicada la cirugía, ya que se demostró que no aumentan el riesgo de complicaciones hemorrágicas intra o post craniectomía decompresiva, aun cuando esta se realiza en la primeras 24 hs luego de la administración de estos fármacos 30 -32.
En el caso de los pacientes entre 61 y 70 años, los estudios demuestran que debería tenerse en cuenta el tratamiento quirúrgico analizando cada caso en particular 33 - 35. De los pacientes descritos en el presente trabajo: uno tenía más de 70 años, dos entre 60-70 y cinco menos de 60 años.
En cuanto a la táctica quirúrgica, lo descrito es una hemicraniectomia decompresiva, con resección ósea de entre 12 y 14 cm de diámetro antero-posterior, y una amplia resección de hueso temporal hasta llegar a la base, teniendo como objetivo disminuir la presión en el interior del cráneo (compartimiento inextensible). Otra táctica quirúrgica mencionada en la literatura es la resección del parénquima cerebral isquémico, con mejoría en el pronóstico funcional, sin cambios significativos en el pronóstico vital; aunque algunos autores no están a favor de dicha táctica, dada la posibilidad de lesionar áreas de penumbra afectando en forma negativa la evolución funcional de los pacientes 36,37.
Hasta el momento no hay trabajos randomizados que demuestren de manera significativa la eficacia de un tratamiento quirúrgico con respecto al otro.
De los pacientes incluidos en el trabajo, solo en un caso (caso 2) se realizo decompresiva lateral izquierda, con posterior lobectomía temporal, presentado un mRS al alta de 3, en comparación con el resto de los pacientes, cuyo mRS fue mayor. De todas maneras nuestra casuística es muy pequeña como para sacar conclusiones estadísticamente significativas.
Independientemente de la táctica quirúrgica utilizada los factores pronósticos protectores en los pacientes operados son: edad menor a 60 años, CGS mayor a 6, ausencia de cambios pupilares, tiempo de evolución de los síntomas, volumen del ACV menor a 200 cc3 en la TC, y mejoría del efecto de masa (desviación de línea media menor a 10mm) luego de la craniectomía decompresiva 38,39.
A modo de finalizar, es importante destacar que independientemente del tratamiento instaurado, “el tiempo es cerebro ": se estima que por cada minuto de retraso en el tratamiento de un ACV isquémico 1.9 millones de células cerebrales mueren, 13.8 mil millones de sinapsis, y 12 kilómetros de fibras axonales se pierden; así como también cada hora sin tratamiento, el cerebro pierde tantas neuronas como lo haría en casi 3 a 6 años de envejecimiento normal 20. Es por esto que nos vemos obligados a afrontar este desafío para modificar la morbimortalidad de los pacientes que sufren esta enfermedad devastadora a nivel mundial; sabiendo que nuestro país no escapa a esta regla.
Conclusiones
Los pacientes con ACV isquémico deben ser atendidos por un equipo multidisciplinario: neurólogo, neuro-intervencionista endovascular, neurocirujano, neuro-intensivista, fisioterapia y enfermería entrenada y formada en esta patología, contando con todas las herramientas necesarias y demostradas como nivel de evidencia 1A (unidad de ACV, r-TPA i/v, y tratamiento endovascular) para brindarle al paciente la mejor posibilidad de una diagnostico y tratamiento eficaz, así como una rehabilitación precoz. La craniectomía decompresiva tiene indicación claramente demostrada (nivel de evidencia 1B) en aquellos pacientes menores de 60 años, con ACV maligno que no respondieron al tratamiento mencionado anteriormente.
Bibliografía
1. Donnan GA, Fisher M, Macleod M, Davis SM. Stroke. Lancet. 2008;371(9624):1612-23.
2. Murray C, Lopez A. Mortality by cause for eight regions of the world: Global Burden of Disease Study. Lancet. 1997; 349 (9061):1269–1276.
3. World Health Organization. The 10 leading causes of death in the world, 2000 and 2012 (on line). Fact Sheet N° 310. Updated May 2014 (consulted: 01/09/2016). Available in www.who.int/mediacentre/factsheets/fs310/en/
4. Strong K, Mathers C, Bonita R. Preventing stroke: saving lives around the world. Lancet Neurol 2007; 6 (2):182-7
5. Rothwell PM. Incidence, risk factors and prognosis of stroke and TIA: the need for high-quality, large-scale epidemiological studies and meta-analyses. Cerebrovasc Dis. 2003;16 Suppl 3:2-10.
6. Bousser MG, Mas JL. Accidents vasculaires cerebraux. Rueil-Malmaison : Doin, c2009.
7. Uruguay. Comisión Honoraria para la Salud Cardiovascular. Área de Epidemiología y Estadística. Mortalidad por enfermedades cardiovasculares en el Uruguay 2012. Montevideo: CHSC, 2012.
8. European Stroke Organisation (ESO) Executive Committee; ESO Writing Committee. Guidelines for management of ischaemic stroke and transient ischaemic attack 2008. Cerebrovasc Dis. 2008;25(5):457-507.
9. Castillo J, Zarranz JJ, Larracoechea J. Enfermedades vasculares cerebrales. En: Zarranz JJ. Neurología. 3 ed. Madrid: Elsevier Science, 2004:357-435.
10. Adams HP, Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL, Marsh EE: Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke. 1993 Jan;24(1):35-41.
11. Govan L, Langhorne P, Weir CJ. Stroke Unit Trialists Collaboration. Does the prevention of complications explain the survival benefit of organized inpatient (stroke unit) care?: further analysis of a systematic review. Stroke 2007; 38(9):2536-40.
12. The National Institute of Neurological Disorders, Stroke rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke. N Engl J Med 1995; 333(24):1581-7.
13. Hacke W, Kaste M, Bluhmki E, Brozman M, Dávalos A, Guidetti D, et al.Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med 2008; 359(13):1317-29.
14. de Los Ríos la Rosa F, Khoury J, Kissela BM, Flaherty ML, Alwell K, Moomaw CJ, et al. Flaherty: Eligibility for Intravenous Recombinant Tissue-Type Plasminogen Activator Within a Population: The Effect of the European Cooperative Acute Stroke Study. Stroke. 2012;43(6):1591-5.
15. Berkhemer OA, Fransen PS, Beumer D, van den Berg LA, Lingsma HF, Yoo AJ, et al. A randomized trial of intraarterial treatment for acute ischemic stroke. N Engl J Med. 2015;372(1):11-20
16. Goyal M, Demchuk AM, Menon BK, Eesa M, Rempel JL, Thornton J, et al. Randomized Assessmento of Rapid Endovascular Treatment of Ischemic Stroke (ESCAPE). N Engl J Med. 2015;372(11):1019-30.
17. Campbell BC, Mitchell PJ, Kleinig TJ, Dewey HM, Churilov L, Yassi N, et al. Endovascular therapy for ischemic stroke with perfusion-imaging selection. N Engl J Med. 2015;372(11):1009-18.
18. Saver JL, Goyal M, Bonafe A, Diener HC, Levy EI, Pereira VM, et al. Levy: Stent-Retriever Thrombectomy alter Intravenous t-PA vs. t-PA Alone in Stroke (SWIFT PRIME). N Engl J Med. 2015;372(24):2285-95.
19. Jovin TG, Chamorro A, Cobo E, de Miquel MA, Molina CA, Rovira A, et al. Thrombectomy within 8 Hours after Symptom Onset in Ischemic Stroke (REVASCAT). N Engl J Med. 2015;372(24):2296-306.
20. Casaubon LK, Boulanger JM, Blacquiere D, Boucher S, Brown K, Goddard T, et al . Canadian Stroke Best Practice Recommendations: Hyperacute Stroke Care Guidelines, Update 2015. Int J Stroke. 2015;10(6):924-40.
21. Powers WJ, Derdeyn CP, Biller J, Coffey CS, Hoh BL, Jauch EC, et al. 2015 American Heart Association/American Stroke Association Focused Update of the 2013 Guidelines for the Early Management of Patients With Acute Ischemic Stroke Regarding Endovascular Treatment: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2015 Oct;46(10):3020-35.
22. Jüttler E, Schwab S, Schmiedek P, Unterberg A, Hennerici M, Woitzik J, et al. Decompressive Surgery for the Treatment of Malignant Infarction of the Middle Cerebral Artery (DESTINY). A randomized, Controllled Trial. Stroke; 2007; 38: 2518-2525
23. Vahedi K, Vicaut E, Mateo J, Kurtz A, Orabi M, Guichard JP, et al. Sequential-Design, Multicenter, Randomized, Controlled Trial of Early Decompressive Craniectomy in Malignant Middle Cerebral Artery Infarction (DECIMAL Trial). Stroke; 2007; 38: 2506-2517.
24. Hofmeijer J, Kappelle LJ, Algra A, Amelink GJ, van Gijn J, van der Worp HB. Surgical decompression for space-occupying cerebral infarction (the hemicraniectomy after middle cerebral artery infarction with life-threatening edema trial (HAMLET): a multicentre, open, randomized trial. Lancet Neurol. 2009; 8: 326-333.
25. Flechsenhar J, Woitzik J, Zweckberger K, Amiri H, Hacke W, Jüttler E. Hemicraniectomy in the management of space-occupying ischemic stroke. J Clin Neurosci. 2013; 20: 6-12.
26. Hofmeijer J, Amelink GJ, Algra A, van Gijn J, Macleod MR, Kappelle LJ, et al. Hemicraniectomy after middle cerebral artery infarction with life-threatening Edema Trial (HAMLET). Protocol for a randomised controlled trial of decompressive surgery in space-occupying hemispheric infarction. Trials. 2006; 7: 29- 35.
27. Brunet F, Camejo C, Gaye A, Castro L, Puppo C, et al. Ataque cerebrovascular isquémico en Uruguay: comunicación de los primeros 34 casos trombolizados en el Hospital de Clínicas. Rev. Med. Urug. 2014; 30 (1): 31-48.
28. Flechsenhar J, Woitzik J, Zweckberger K, Amiri H, Hacke W, Jüttler E. Hemicraniectomy in the management of space-occupying ischemic stroke. J Clin Neurosci. 2013; 20: 6-12.
29. Vahedi K, Hofmeijer J, Juettler E, Vicaut E, George B, Algra A, et al. Early decompressive surgery in malignant infarction of the middle cerebral artery: a pooled analysis of three randomised controlled trials. Lancet Neurol. 2007; 6: 215-222.
30. Fischer U, Taussky P, Gralla J, Arnold M, Brekenfeld C, Reinert M, et al. Decompressive craniectomy after intra-arterial thrombolysis: safety and outcome. J. Neurol. Neurosurg. Psychiatry. 2012; 82 (8): 885-887.
31. Ozdemir O, Ozbek Z, Vural M, Durmaz R, Cosan E, Arslantas A, et al. Early decompressive surgery after combined intra-venous thrombolysis and endovascular stroke treatment. Clinical Neurology and Neurosurgery. 2014; 122: 66-69.
32. Takeuchi S, Wada K, Nawashiro H, Arimoto H, Ohkawa H, et al. Decompressive craniectomy after intravenous tissue plasminogen activator administration for stroke. Clin Neurol Neurosurg. 2012;114(10):1312-5.
33. Inamasu J, Kaito T, Watabe T, Ganaha T, Yamada Y, Tanaka T , et al. Decompressive hemicraniectomy for malignant hemispheric stroke in the elderly: Comparison of outcomes between individuals 61 – 70 and >70 years of age. J Stroke Cerebrovasc Dis. 2013 Nov;22(8):1350-4.
34. Jüttler E, Unterberg A, Woitzik J, Bösel J, Amiri H, Sakowitz OW, et al. Hemicraniectomy in older patients with extensive middle cerebral artery stroke. N. Engl. J. Med. 2014; 370: 1091-1100.
35. Yao Y, Liu W, Yang X, Hu W, Li G. Is decompressive craniectomy for malignant middle cerebral artery territory infarction of any benefit for elderly patients? Surg Neurol. 2005; 64: 165-169.
36. Henderson G. Management of Massive Cerebral Infarct. Curr Neurol Neurosci Rep. 2004;4(6):497-504.
37. Kostov DB, Singleton RH, Panczykowski D, Kanaan HA, Horowitz MB, Jovin T,et al. Decompressive hemicraniectomy, strokectomy, or both in the treatment of Malignant Middle Cerebral artery syndrome. World Neurosurg. 2012;78(5):480-6.
38. Gupta R, Connolly ES, Mayer S, Elkind MS. Hemicraniectomy for Massive Middle Cerebral Artery Territory Infarction. A Systematic Review. Stroke. 2004; 35: 539-543.
39. Hacke W, Schwab S, Horn M, Spranger M, De Georgia M, von Kummer R. Malignant middle cerebral artery territory infarction: clinical course and prognostic signs. Arch Neurol. 1996; 53: 309-315.














