Services on Demand
Journal
Article
Related links
Share
Revista Uruguaya de Medicina Interna
Print version ISSN 2393-6797On-line version ISSN 2393-6797
Rev. Urug. Med. Int. vol.1 no.3 Montevideo Dec. 2016
Revisión
La Hipertensión Arterial es factor de riesgo para el desarrollo y progresión de la Enfermedad Renal Crónica
Arterial Hypertension is a risk factor for the development and progression of Chronic Kidney Disease
Dra. Lucía Araújo
Residente de Clínica Médica
Dra. Boris Betancourt
Postgrado de Clínica Médica
Dra. Gabriela Dos Santos
Residente de Clínica Médica
Dr. Valentín González
Asistente de Clínica Médica
Dra. Limay Vasques
Residente de Clínica Médica
Dr. Washington Vignolo
Especialista en Medicina Interna y Cardiología. Profesor Agregado de Clínica Médica
Dr. Leonardo Sosa
Especialista en Medicina Interna. Profesor Director de Clínica Médica
Dr. Ricardo Silvariño
Especialista en Medicina Interna y Nefrología. Profesor Adjunto de Clínica Médica.
Departamento e Institución responsables: Clínica Médica B. Hospital de Clínicas - Dr. Manuel Quíntela. Facultad de Medicina. Universidad de la República. Montevideo. Uruguay.
Correspondencia: Dr. Ricardo Silvariño. Clínica Médica B. Hospital de Clínicas. Av Italia 2870. Piso 12. Montevideo – Uruguay. Phone/Fax (+598) 2480 9326. E-mail: rsilvarino@gmail.com / rsilvarino@hc.edu.uy .
Recibido: 2/10/16 – Aceptado: 20/11/16
RESUMEN
El vínculo entre Hipertensión Arterial (HTA) y Enfermedad Renal Crónica (ERC) es recíproco y complejo. La HTA es un factor de riesgo reconocido para el desarrollo de ERC, y la incidencia de enfermedad renal se incrementa conforme aumenta la severidad de la HTA. Adicionalmente la presencia de HTA se vincula a progresión de la ERC desde etapas tempranas hasta el desarrollo de ERC-extrema. La presencia de HTA enmascarada, HTA de túnica blanca y la pérdida del patrón dipping nocturno se vinculan a desarrollo y progresión de enfermedad renal. El tamizaje de ERC es recomendado para pacientes con HTA en riesgo de desarrollar la enfermedad. Es más discutido si debe realizarse tamizaje en individuos con bajo riesgo de desarrollar ERC. Las cifras objetivo de presión arterial en este grupo de pacientes son sugeridas por las guías KDIGO. Múltiples estudios han buscado identificar si el control intensivo de presión arterial disminuye la incidencia de ERC y su progresión pero los resultados no son concluyentes. El presente trabajo revisa el vínculo entre HTA y desarrollo y progresión de la ERC. Se puntualiza sobre la población con HTA que se beneficia del tamizaje de ERC y los valores objetivo de presión arterial en este grupo.
Palabras clave: Hipertensión arterial. Enfermedad renal crónica. Monitoreo ambulatorio de la presión arterial. Tamizaje de enfermedad renal crónica.
ABSTRACT
The link between Arterial Hypertension (AHT) and Chronic Renal Disease (CKD) is reciprocal and complex. HBP is a recognized risk factor for the development of CKD, and the incidence of renal disease increases as the severity of hypertension increases. Additionally, the presence of hypertension is linked to progression of CKD from early stages to the development of extreme-ERC. The presence of masked HTA, white tunica HTA and loss of nocturnal dipping pattern are associated with development and progression of renal disease. Screening for CKD is recommended for patients with hypertension at risk of developing the disease. It is more controversial whether screening should be done in individuals at low risk of developing CKD. The target blood pressure figures in this group of patients are suggested by the KDIGO guidelines. Multiple studies have sought to identify whether intensive blood pressure control decreases the incidence of CKD and its progression but the results are inconclusive. This paper reviews the link between hypertension and development and progression of CKD. It is pointed out the population with hypertension that benefits from CKD screening and target blood pressure values in this group.
Key words: Hypertension. Chronic kidney disease. Outpatient monitoring of blood pressure. Screening for chronic kidney disease.
Introducción
El vínculo entre Hipertensión Arterial (HTA) y Enfermedad Renal Crónica (ERC) tiene particularidades con consecuencias diagnósticas, terapéuticas y pronosticas.
La HTA es un conocido factor de riesgo para el desarrollo y progresión de la ERC. Como contrapartida la ERC es causa de HTA (secundaria). Esta relación frecuente HTA-ERC determina en la práctica clínica una elevada prevalencia de HTA entre quienes tienen ERC conocida.
El objetivo de la presente revisión es analizar el rol de la HTA como factor de riesgo para el desarrollo y progresión de la ERC. Se hace referencia a patrones de HTA que se han vinculado con mayor prevalencia de ERC. Se puntualiza sobre el tamizaje de ERC en pacientes con HTA y los valores objetivos de presión arterial en los pacientes con ERC conocida. El abordaje sobre la HTA secundaria a ERC así como el tratamiento de la HTA en este grupo de pacientes es objeto de otra revisión.
El camino hasta la identificación de los factores de riesgo
La epidemiología como ciencia estudia la distribución y frecuencia de las enfermedades y sus determinantes en la población (1).
En los años cincuenta múltiples estudios se pusieron en marcha para determinar las causas de la enfermedad cardiovascular aterosclérótica. El ícono de estos estudios clínicos es la cohorte Framingham Heart Study (2). Al acuñar la expresión “factor de riesgo”, el Framingham Heart Study facilitó un cambio en el ejercicio de la medicina. Asociar un factor de riesgo potencial al desarrollo de una enfermedad real, habitualmente implica un camino de investigación (3). Esta sucesión de estudios debe poder demostrar cómo un factor ambiental/estilo de vida (ejemplo: sedentarismo, dieta inadecuada) en un individuo con susceptibilidad genética (ejemplo: enfermedad cardiovascular precoz en la familia), determina la presencia de marcadores bioquímicos/fisiológicos (ejemplo: elevación del LDL plasmática) asociados inicialmente a enfermedad subclínica (ejemplo: disfunción endotelial, alteración de relación íntima/media carotidea) y luego a enfermedad clínica establecida (ejemplo: accidente cerebrovascular) (3).
Este ejercicio de identificar factores de riesgo fue más tardío para la ERC cuando se compara con otras enfermedades prevalentes. Ejemplo de ello es que, de las decenas de estudios derivados de la cohorte Framingham Heart Study (iniciada en 1948), hasta el año 2008 ninguno se centra en la identificación de factores de riesgo para el desarrollo de ERC (3). Afortunadamente en la última década múltiples estudios bien diseñados describen factores de riesgo para el desarrollo y progresión de la ERC.
La Hipertensión Arterial es factor de riesgo para el desarrollo de Enfermedad Renal Crónica
Klag y cols (4) estudian de forma prospectiva el desarrollo de enfermedad renal vinculado a diferentes niveles de HTA en 332.544 hombres enrolados en el estudio MRFIT (MultipleRisk Factor Intervention Trial) entre 1973 y 1975, y seguidos durante 16 años. En ese periodo de seguimiento 816 individuos desarrollaron ERC-extrema (15.6 casos/100.000 personas/año de observación). Encontraron una fuerte asociación entre el grado de HTA sistólica y diastólica y el desarrollo de ERC-extrema, independientemente de la edad, raza, uso de medicación para diabetes mellitus, historia de infarto de miocardio, concentraciones de colesterol sérico y tabaquismo.
Cuando se comparó hombres bajo valores óptimos de presión arterial (PAS < 120 y PAD < 80 mmHg), con aquellos con valores de HTA moderada-severa (PAS > 210 y PAD > 120), éstos últimos presentaron un riesgo relativo de desarrollar ERC-extrema de 22.1 (p<0.001).
El riesgo estimado de desarrollar ERC-extrema asociado con HTA-sistólica fue mayor que el vinculado con HTA-diastólica cuando ambas variables fueron consideradas juntas (4).
En un estudio prospectivo observacional, Hauroun y cols. (5) analizan la asociación entre hipertensión arterial y el riesgo de desarrollar ERC de una población de 23.534 hombres y mujeres de Maryland (condado de Washington) seguidos durante 20 años. El riesgo ajustado de desarrollar ERC en mujeres durante el seguimiento (intervalo de confianza 95%) comparado con individuos con cifras de presión arterial óptimas fue 3 (0.6 a 14.4) en quienes tenían presión arterial normal-alta (JNC-VI), 3,8 (0.8 a 17.2) en HTA grado uno (JNC-VI), 6.3 (1.3 a 29) en HTA grado dos (JNC-VI) y 8.8 (1.8 a 43) en HTA grados tres y cuatro (JNC-VI). En hombres la relación fue similar mostrando los siguientes riesgos relativos ajustados por grupo: 3.3 (0.4 a 25.6), 3.0 (0.4 a 22.2), 5.7 (0.8 a 43) y 9.7 (1.2 a 75.6)(5).
En un estudio más reciente, prospectivo y observacional, Yamagata y cols.(6) valoraron la incidencia de ERC de una cohorte de 123.764 (41.012 hombres y 82.752 mujeres) mayores de 40 años. En un periodo de 10 años de seguimiento 4.307 (2048 hombres y 2259 mujeres) desarrolló ERC estadio I o II, y 19.411 (4.257 hombres y 15.154 mujeres) desarrolló ERC estadios III o más. La presencia de HTA (PAS > 160, PAD > 100 mmHg) duplicó el riesgo relativo de desarrollar ERC en hombres. La presencia de HTA incrementó 39% y 20% el riesgo de desarrollar ERC en hombres y mujeres respectivamente (6).
Cao y cols. (7) valoran el riesgo de desarrollo de ERC en adultos sanos y su vínculo con cifras de presión arterial catalogadas como de “pre-hipertensión arterial” (JNV VII). Siguen 1.703 adultos durante 54 meses mediante examen anual. Durante el seguimiento 194 individuos desarrollan ERC. Cuando se compara con individuos normotensos, el riesgo de desarrollo de ERC (intervalo de confianza de 95%) es 1.25 (1.02 a 1.85) en el grupo de pre-hipertensión (JNC-VII), 1.62 (1.07 a 2.79) en aquellos que tenían HTA no diagnosticada (HTA-enmascarada) y 1.98 (1.15 a 3.96) en quienes tenían diagnóstico de HTA previamente. Las curvas de Kaplan-Meier muestran una diferencia significativa en la incidencia acumulativa de ERC entre los diferentes estadios de HTA (log-rank test, p<0.001) (7).
Tozawa y cols.(8) valoraron de forma prospectiva el desarrollo de ERC-extrema con necesidad de tratamiento sustitutivo de la función renal en una población de 98.759 individuos (46.881 hombres y 51.878 mujeres). En un periodo de 17 años 400 individuos (231 hombres y 169 mejeres) desarrollaron ERC-extrema. Cuando se comparó el riesgo relativo de desarrollo de ERC-extrema entre aquellos con cifras de normotensión y aquellos con diferentes grados de HTA objetivaron que el mismo se incrementaba acorde aumentaba el estadío de HTA. Por cada incremento de 10 mmHg de PAS el riesgo relativo aumento 1.22 (1.14 a 1.30) en hombres y 1.02 (1.01 a 1.03) en mujeres (intervalo de confianza 95%) y por cada incremento de 10 mmHg de PAD el riesgo relativo aumentó 1.03 (1.02 a 1.04) en hombres y 1.47 (1.30 a 1.67) en mujeres (intervalo de confianza 95%) (8).
La evidencia aportada sustenta el vínculo entre la presencia de HTA y el desarrollo de ERC. La incidencia de ERC se incrementa no solo con la presencia de HTA sino con el estadio de HTA (a mayor valor de HTA, mayor incidencia de ERC). Asimismo la presencia de pre-hipertensión incrementa el riesgo de desarrollar ERC cuando se compara con la población normotensa.
La Hipertensión Arterial es un factor de progresión de la Enfermedad Renal Crónica
En el modelo conceptual sugerido para comprender la historia natural de la ERC (9) (Figura 1) se identifican:
-
Factores que incrementan el riesgo de desarrollar ERC (edad avanzada, historia familiar de ERC, masa renal disminuida, bajo peso al nacer, raza negra, diabetes mellitus, obesidad e hipertensión arterial entre otros)
-
Factores iniciadores del daño renal (enfermedades autoinmunes, infecciones sistémicas, infecciones urinaria, litiasis renal, obstrucción de la vía urinaria, nefrotóxicos, diabetes mellitus e hipertensión arterial)
-
Factores de progresión de la ERC los que empeoran el daño y aceleran el deterioro funcional renal (proteinuria persistente, diabetes mellitus mal controlada, tabaquismo, dislipemia, anemia, obesidad, enfermedad cardiovascular asociada, acidosis metabólica e hipertensión arterial mal controlada)
-
Factores que incrementan la morbimortalidad en situación de ERC (baja dosis de diálisis, angioacceso temporal para hemodiálisis, anemia, hipoalbuminemia e hipertensión arterial no controlada)
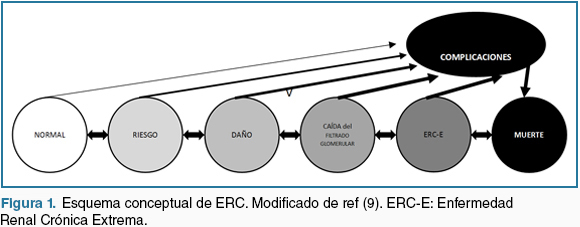
Figura 1: Esquema conceptual de ERC. Modificado de ref (9). ERC-E: Enfermedad Renal Crónica Extrema.
Como se puede objetivar, la HTA participa como factor de riesgo en todas las etapas de este modelo conceptual. Esto tiene consecuencias diagnósticas, terapéuticas y pronosticas, ya que el esfuerzo por diagnosticar HTA, perseguir los valores objetivos trazados para cada etapa y establecer un adecuado tratamiento debe permanecer independientemente de la etapa de ERC en que se encuentre el paciente.
La progresión de la ERC se define por el descenso mantenido del filtrado glomerular mayor a igual a 5 ml/minuto/1.73m2 de superficie corporal en un periodo de un año, o por la progresión en la cuantía de la albuminuria siempre que se acompañe del descenso progresivo del filtrado glomerular en el mismo periodo de tiempo (9).
La HTA es un factor de riesgo identificado para la progresión de ERC (10).
Halbesma y cols. (11) valoran la presencia de factores de riesgo predictores del deterioro de la función renal en 5651 pacientes seguidos prospectivamente durante un periodo de 6.5 años en el contexto del estudio PREVEND (Prevention of Renal and Vascular Endstage Disease). Durante el seguimiento se valoró a cada paciente en tres oportunidades mediante entrevista, examen clínico, y analítica de laboratorio. En los hombres la presencia de HTA, albuminuria y dislipemia se vincularon a pérdida de la función renal, independientemente de otros factores de riesgo. Los autores reafirman adicionalmente la importancia de realizar tamizaje de factores de riesgo vinculados a deterioro de la función renal en las poblaciones susceptibles (11).
Chang y cols. (12) analizaron la presencia de factores de riesgo predictores de progresión de la ERC en hombres y mujeres con ERC de reciente diagnóstico. Enrolan en el estudio pacientes mayores de 18 años provenientes de la consulta ambulatoria de 8 hospitales de Taiwan en el periodo agosto 2008 a setiembre 2014. Se incluyen en el análisis 1530 pacientes y se define progresión de la ERC como un deterioro del filtrado glomerular mayor o igual al 25% por debajo del valor basal. Presentan ERC 100 hombres y 84 mujeres. Luego de realizado el análisis mediante regresión logística para identificar el peso de cada factor de riesgo sobre la progresión de la ERC (intervalo de confianza 95%), objetivan que en hombres los factores predictores fueron la presencia de proteinuria (OR 2.20 – 1.26 a 3.84-), edad (OR 1.04 – 1.02 a 1.06-), anemia (OR 2.75 – 1.20 a 6.30-) y pobre control de cifras tensionales (OR 1.84 – 1.05 a 3.22-). En mujeres los factores predictores de progresión de ERC (intervalo de confianza 95%) fueron el pobre control glicémico (OR 2.51 – 1.22 a 4.25 -) y el pobre control de cifras tensionales (OR 1.93 – 1.06 a 3.50-). Este estudio demuestra como el pobre control tensional en pacientes con ERC es un factor vinculado a la progresión de la misma (12)
En el estudio MRFIT (Multiple Risk Factor Intervention Trial) (4), previamente analizado, Klag y cols. estratifican a los individuos según la severidad de la HTA (JNC-V) desde PA óptima (PAS ≤120 o PAD ≤ 80 mmHg) hasta HTA estadio 4 (PAS ≥ 210 o PAD ≥ 120 mmHg). Objetivan una asociación significativa entre el desarrollo de ERC y la presencia de HTA. El riesgo de ERC se incrementa acorde lo hace el estadio de HTA en que se halla el paciente (estadio 1: 2.8 / estadio 2: 5 / estadio 3: 8.4 / estadio 4: 12.4). Este estudio tiene el valor adicional de identificar la asociación entre el grado de HTA y el riesgo progresivo de desarrollar ERC. Específicamente, cuando la HTA es analizada como una variable continua, la elevación de la PAS o la PAD un desvío estándar por encima de lo normal se asocia con un incremento de riesgo de 1.7 de desarrollar ERC. Esencialmente, pequeños ascensos tensionales progresivos se asocian con un incremento en el riesgo de progresar a ERC-extrema (4).
Los datos aportados sustentan el vínculo entre la presencia de HTA y la progresión de la ERC.
Si bien esta relación positiva entre HTA y progresión de la ERC está demostrada, la evidencia es débil en poder demostrar que el control estricto de presión arterial previene la progresión de la ERC en pacientes con enfermedad renal conocida como será analizado en otro apartado de esta revisión. Es posible que sean necesarios más estudios para poder concluir al respecto.
Algunos patrones de Hipertensión Arterial se vincularon a mayor desarrollo y progresión de Enfermedad Renal Crónica
Terawaki y cols. (13) evalúan de forma prospectiva la incidencia de ERC en pacientes con hipertensión enmascarada. Enrolan 1365 pacientes a los que indican automedida de presión arterial en domicilio y controlan cifras de presión arterial en consultorio. En función de los hallazgos clasifican a los individuos en cuatro grupos: presión arterial normal definida (60.3%), HTA de túnica blanca (14.9%), HTA enmascarada (12.8%), HTA definida (12%). El filtrado glomerular estimado para cada grupo fue 61.7 ml/min, 61.8 ml/min, 59.6 ml/min y 57.3 ml/min respectivamente. Presentaron proteinuria significativa por grupos 4.2%, 8.9%, 10.3% y 12.8% respectivamente. Presentaron proteinuria y un filtrado glomerular por debajo de 60 ml/min: 2.3%, 3%, 6.3% y 9.8% respectivamente. Cuando se compara el grupo de pacientes con presión arterial normal definida con los grupos de HTA enmascarada e HTA definida, los parámetros que evidencian presencia de ERC son significativamente diferentes (p< 0.05 para la comparación entre cada grupo). El riesgo relativo ajustado de desarrollar ERC cuando se comparó con el grupo de presión arterial normal definida (referencia) fue 2.56 para HTA enmascarada y 3.60 para HTA definida (13).
Este estudio sugiere que la presencia de HTA enmascarada se vincula al desarrollo de ERC.
Mc Mullan y cols. (14) evalúan la utilidad del monitoreo ambulatorio de la presión arterial (MAPA) en identificar patrones tensionales predictores de desarrollar ERC. Realizan un estudio prospectivo de cohorte en el que participan 603 individuos con función renal normal al inicio del mismo. Se les realiza MAPA a cada uno de ellos al inicio del estudio y se los sigue una media de 8.1 años. Analizan la asociación entre la presencia de dipping nocturno y ascenso tensional matinal con el desarrollo de ERC incidente. Adicionalmente analizan la relacion entre ERC incidente e HTA nocturna, diurna, de túnica blanca y enmascarada. Encuentran que un 10% de incremento del dipping nocturno se asocio con un decremento en el riesgo de ERC incidente (OR 0.55, intervalo de confianza 95%). La presencia de HTA matinal no se asoció con un incremento en la ERC incidente. La presencia de HTA nocturna aislada y el incremento de la PAD durante el sueño mostraron asociación con ERC incidente pero la misma no fue significativa. Concluyen que la pérdida del dipping nocturno se asocia con el desarrollo de ERC incidente (14).
En un estudio reciente, Kanno y cols. (15) intentan poner en evidencia la relación entre la presencia de HTA-enmascarada e HTA de túnica blanca con el desarrollo de ERC. Realizan monitoreo ambulatorio de la presión arterial (AMPA) y búsqueda de ERC mediante estudio de la creatinina plasmática y examen de orina en 1023 individuos japoneses. En función de los datos del registro tensional establecen cuatro gurpos: presión arterial normal definida (60%), HTA de túnica blanca (15.4%), HTA-enmascarada (15%) e HTA definida (9.6%). Se utilizó un modelo de regresión logística para estimar el riesgo relativo (RR) de desarrollo de ERC. Comparado con el grupo de presión arterial normal definida (referencia) el RR de desarrollar ERC fue significativamente mayor en HTA definida (OR 2.81, p=0.0001), HTA-enmascarada (OR 2.29, p=0.0004) e HTA de túnica blanca (OR 1.67, p=0.0368). Concluyen que la HTA de túnica blanca se asocia con el desarrollo de ERC (15).
A la luz de lo analizado, la evidencia sugiere que la pérdida del patrón dipping nocturna, así como la presencia de HTA enmascarada se vinculan al desarrollo de ERC. Reciente evidencia sugiere que la HTA de túnica blanca también muestra correlación con el desarrollo de ERC futura.
Este último aspecto resulta controversial, dado que en la práctica clínica la HTA de túnica blanca no es universalmente considerada como enfermedad hipertensiva. Es necesaria más evidencia para que el hallazgo de HTA de túnica blanca derive en intervenciones clínicas específicas.
La noción de que la pérdida del dipping nocturno se asocia al desarrollo de ERC puede derivar de futuro en cambios en la toma de desición terapéutica frente al paciente individual.
El tamizaje en busca de Enfermedad Renal Crónica es recomendado en pacientes con Hipertensión Arterial
Las pruebas de tamizaje separan un grupo de individuos que probablemente tengan una enfermedad determinada, de otro grupo que probablemente no la tenga. No tienen un fin diagnóstico en sí mismo, y aquellos individuos con hallazgos positivos deben ser referidos para completar la etapa diagnóstica y ser sometidos a una terapéutica específica si así lo requieren (16).
Justifica realizar pruebas de tamizaje cuando el problema de salud es prevalente y tiene consecuencias individuales y poblacionales relevantes. Es requisito para realizarlas conocer la historia natural de la enfermedad y el hecho de que la patología que se busca transite por una etapa latente o asintomática (17).
Las pruebas de tamizaje deben ser sensibles y específicas, sencillas de realizar y económicas, seguras y fiables. Debe existir por último un tratamiento accesible y efectivo que justifique su realización (18).
La ERC cumple los requisitos necesarios para ser buscada activamente en poblaciones de riesgo. Tiene elevada prevalencia a nivel mundial y nacional. Esta prevalencia es marcadamente menor en individuos menores de 50 años y en quienes no tienen factores de riesgo para su desarrollo. Tiene una considerable vinculación con disminución de la calidad de vida, morbilidad y mortalidad, y adicionalmente determina altos costos en salud (19).
Más del 90% de los pacientes con ERC se encuentran en estadíos tempranos 1-3 al momento de su detección, y la mayoría son asintomáticos (20). El tamizaje de ERC intenta por tanto identificar tempranamente a los individuos con ERC asintomáticos con el fin de prevenir o retrasar la progresión a estadíos más avanzados de la enfermedad (21). El hallazgo de alteraciones en los test de tamizaje implica un seguimiento con pruebas diagnósticas más específicas e instauración posterior de tratamiento si es requerido, por lo que no se constituye un fin en sí mismo (16).
Tamizaje de ERC: ¿A quiénes?
Se recomienda la búsqueda activa de ERC en pacientes con factores de riesgo para desarrollar la enfermedad: HTA, diabetes mellitus, presencia de enfermedad cardiovascular, infección por el virus de la inmunodeficiencia humana, infección por el virus de la hepatitis C e historia familiar de ERC (19).
Dado el vínculo recíproco entre HTA, enfermedad cardiovascular y ERC, la presencia de las primeras debe sugerir fuertemente la existencia de una ERC no diagnosticada (20).
Es controvertida la búsqueda de ERC en pacientes asintomáticos y sin factores de riesgo para su desarrollo. La Sociedad Americana de Nefrología recomienda el tamizaje de ERC en pacientes con y sin factores de riesgo alegando la potencial prevención y enlentecimiento de la enfermedad en el caso de ser diagnosticada, con la contrapartida de que se utilizan para el tamizaje pruebas de bajo costo (20).
En el otro extremo, una reciente guía de práctica clínica del American College of Physicians no recomienda el tamizaje de ERC en individuos asintomáticos y sin factores de riesgo (21). Esta recomendación la basa en la ausencia de estudios controlados y randomizados que evalúen los beneficios o daños del tamizaje de ERC (21).
En la misma línea algunos autores refieren que determinar la albuminuria en una única muestra en la población general sin factores de riesgo para ERC puede asociarse con un porcentaje de falsos positivos estimado en 13%-18% lo que determinaría un sobre-diagnóstico de ERC y eventuales tratamientos innecesarios (22).
Posiblemente entre ambos extremos exista una posición intermedia, que incluya la realización de tamizaje en individuos con riesgo de ERC y eventualmente en individuos asintomáticos y de riesgo bajo seleccionados.
Tamizaje de ERC: ¿Cómo?
Se sugiere para tamizaje de ERC la medición sistemática de la presión arterial, medición de la creatinina sérica y a partir de su valor la estimación del filtrado glomerular mediante fórmulas validadas y realización de una tira de orina para evaluar la presencia de proteinuria (18,19,21).
La mayoría de las guías recomiendan realizar tamizaje de ERC con albuminuria (en vez de proteinuria) ya que es usualmente una manifestación más temprana de ERC en hipertensos y diabéticos, además de ser un marcador conocido de riesgo cardiovascular (19).
La tirilla de orina que detecta proteinuria tiene un costo bastante menor pero es menos sensible y específica que la determinación de albuminuria. Dado que igualmente se ha demostrado la eficacia de la proteinuria en predecir ERC y muerte cardiovascular, la elección por una u otra tira de orina deberá supeditarse a la realidad de costos de cada población.
En un estudio nacional Ríos y cols. (23) evalúan el resultado del tamizaje de ERC en una población ambulatoria de una clínica preventiva. Se trató de un estudio observacional y prospectivo en el que se realizó una tira de orina para determinar la presencia de proteinuria y la determinación de creatinina plasmática para estimar el filtrado glomerular mediante fórmula CKD-EPI. Se estudió 83.912 adultos asintomáticos que acudieron a realizar consulta preventiva obligatoria (Carné de Salud). Se consideró presencia de ERC frente al hallazgo de proteinuria > a 1 cruz que equivale a ≥ 0,3 g/l y/o la presencia de un filtrado glomerular ≤ 60 ml/minuto. La prevalencia global de proteinuria fue 6% (5.5% en individuos sin factores de riesgo para ERC, 6.7% en pacientes con HTA sin diabetes, 9.2% en pacientes con diabetes sin HTA y 13,6% en pacientes con HTA y diabetes). La prevalencia global de un filtrado glomerular ≤ 60 ml/minuto fue 1.8%, siendo la edad y la presencia de HTA factores de riesgo independientes para presentar un filtrado glomerular descendido. Considerados en conjunto la presencia de proteinuria y filtrado glomerular ≤ 60 ml/minuto, la prevalencia de ERC alcanzó 9.2%. La presencia de factores de riesgo aumento la frecuencia de ERC probable (p<0.05). Concluyen que el tamizaje en la población que se realiza estudios preventivos (Carne de Salud obligatorio) es útil para detectar ERC temprana (23).
Los datos aportados ratifican la utilidad del tamizaje de ERC en pacientes con factores de riesgo. Más controvertido es el tamizaje en poblaciones sin factores de riesgo para ERC, por lo que en ausencia de evidencia al respecto es el juicio clínico el que debe determinar la necesidad de realizarlo en el paciente individual.
En busca del valor objetivo de presión arterial en los pacientes con Enfermedad Renal Crónica
Este aspecto de controversia carece de evidencia contundente.
En un estudio realizado 20 años atrás Klahr y cols. (24) establecieron dos grupos de pacientes: grupo 1 con 585 pacientes con filtrado glomerular entre 55 y 25 ml/minuto, y grupo 2 con 255 pacientes con filtrado glomerular entre 24 y 13 ml/minuto. Al grupo 1 le asignaron una dieta baja en proteínas (0.58 g/k/dia) versus una dieta normoproteica (1.3 g/k/día), y control de presión arterial usual (PA media 107 mmHg) versus control estricto de presión arterial (PA media 92 mmHg). Al grupo 2 le asignaron una dieta baja en proteínas (0.58 g/k/dia) versus una dieta muy baja en proteínas (0.28 g/k/dia), y control usual (PA media 107 mmHg) versus control estricto de presión arterial (PA media 92 mmHg). La media de seguimiento de ambos grupos fue 2.2 años. En ninguno de los grupos la exposición a un control tensional estricto vs valores objetivo standard de presión arterial demostraron influir de manera distinta en la caída del filtrado glomerular durante el periodo de seguimiento (24).
En un estudio publicado por el grupo colaborativo AASK (African-American Study of Kidney Disease and Hypertension) encabezado por Appel (25) se randomizó 1094 pacientes de raza negra con ERC secundaria a HTA a recibir en una fase inicial control standard de cifras tensionales (PA media 102 a 107 mmHg - < 140/90 mmHg-) vs control intensivo (PA media 92 mmHg o menor - < 130/80 mmHg-). En una segunda fase se inició un estudio de cohorte donde se siguó a la población por un periodo máximo de 12.2 años mediante controles periódicos y medición semestralde creatinina plasmática. Se consideró progresión de la ERC a la duplicación en los valores de creatinina basal o el desarrollo de ERC-extrema. La duplicación en los valores de creatinina ocurrió en 328 pacientes en la fase inicial y en 239 pacientes en la segunda fase del estudio. No encontró diferencia en la progresión de la ERC entre los pacientes asignados al grupo de control standard de presión arterial y los asignados al grupo de control intensivo. Sin embargo si hubo diferencias significativas a favor del control intensivo de presiór arterial en los individuos que tenian proteinuria respecto a los que no, concluyendo que para aquellos pacientes con proteinuria/creatininuria≥ 0.22 el control mas estricto de la presiór arterial se vinculó a menor progresión de la ERC (25).
En el estudio REIN-2 (Ramipril Efficacy in Nephropathy 2), Ruggenenti y cols. (26) valoran si el control tensional estricto por debajo de los valores objetivo habitual previene la progresión de la ERC en pacientes no diabéticos con nefropatía proteinúrica. Incluyen 338 pacientes y los asignan a un grupo de control convencional (PAD < 90 mmHg) a 169 pacientes y a control intensivo (PAS < 130 y PAD <80 mmHg) a 169 pacientes. La totalidad de pacientes recibió tratamiento con ramipril (2.5 a 5 mg dia). Para alcanzar objetivo de control intensivo se asoció bloqueantes de los canales de calcio (felodipina 5 a 10 mg/dia). En un seguimiento a 19 meses 38 de 167 pacientes (23%) (dos excluidos del estudio) asignados al grupo de control estricto y 34 de 168 (20%) (uno excluído del estudio) asignados al grupo control convencional progresaron a ERC-extrema (hazart ratio 1, intervalo de confianza 95%, p=0.99). Concluyen que el control estricto de presión arterial versus el control convencional no modifica la progresión a ERC-extrema en pacientes no diabéticos con nefropatía proteinúrica (26).
En base a estos estudios, entre otros, las guías KDIGO (Kidney Disease: Improving Global Outcomes) (27) sugiere valores de presión arterial objetivo en diferentes escenarios de pacientes con ERC no diabéticos:
-
Adultos con enfermedad renal crónica, no diabéticos, con albuminuria menor a 30mg/día, KDIGO recomienda con moderada evidencia presión arterial objetivo ≤140/90mmHg.
-
Adultos con enfermedad renal crónica, no diabéticos, con albuminuria entre 30 y 300mg/día, KDIGO sugiere con evidencia muy baja presión arterial objetivo ≤130/80mmHg.
-
Adultos con enfermedad renal crónica, no diabéticos, con albuminuria mayor a 300mg/día, KDIGO sugiere con baja evidencia presión arterial objetivo ≤130/80mmHg.
Posterior a la publicación de las guias KDIGO algunos estudios han revelado nueva evidencia sobre las cifras objetivo de presión arterial en pacientes con ERC.
Una revisión sistemática y metanálisis realizado por Lv y cols. (28) reunió estudios que evaluaron los efectos renales y cardiovasculares vinculados al control intensivo de cifras tensionales en pacientes con ERC. Identificaron 11 estudios que en total reunían 9287 pacientes con ERC y 1264 eventos renales (definidos como la duplicación de los valores de creatinina plasmática y el deterioro del filtrado glomerular de 50% o mayor, o el desarrollo de ERC-extrema). Comparado con regimenes tensionales standard, una estrategia de control tensional intensiva se vinculó a disminución del riesgo de desarrollo de eventos renales (hazard ratio 0.82 con intervalo de confianza de 95% para la combinacion de eventos duplicación de creatinina plasmática y disminución del filtrado glomerular ≤ 50%, y hazart ratio 0.79 con intervalo de confianza de 95% para el evento ERC-extrema). No fue claro el efecto del control intensivo de la presión arterial sobre el desarrollo de eventos cardiovasculares (28).
Xie y cols. (29) realizan recientemente una revisión sistemática y metanálisis en busca de objetivar la eficacia y la seguridad de las estrategias de control intensivo de presión arterial. Identifican 19 estudios que incluyen en conjunto 44.989 participantes, en los cuales se identificño 2496 eventos cardiovasculares mayores en una media de seguimiento de 3.8 años. Los pacientes fueron sometidos a una estrategia de disminución de presión arterial intensiva (media 133/76 mmHg) o a una estrategia de control de presión arterial menos intensiva (media 140/81 mmHg). El grupo con control intensivo alcanzó una disminución en el riesgo relativo de eventos cardiovasculares mayores (14%, 4 a 22, intervalo de confianza 95%), infarto de miocardio (13%, 0 a 24, intervalo de confianza 95%), accidente cerebrovascular (22%, 10 a 32, intervalo de confianza 95%), albuminuria (10%, 3 a 16, intervalo de confianza 95%) y progresión de la retinopatía (19%, 0 a 34, intervalo de confianza 95%). Sin embargo el control más intensivo de las cifras tensionales no mostró claro beneficio sobre el riesgo de desarrollar insuficiencia cardiaca (15%, - 11 a 34, intervalo de confianza 95%), muerte cardiovascular (9%, - 11 a 26, intervalo de confianza 95%), mortalidad global (9%, - 3 a 9, intervalo de confianza 95%) o ERC-extrema (10%, - 6 a 23, intervalo de confianza 95%). El beneficio del control intensivo fue superior en aquellos estudios que incluyeron pacientes con enfermedad vascular, enfermedad renal o diabetes. Eventos adversos graves asociados con el descenso tensional fueron hallados en seis estudios con un rango de 1.2%/año en el grupo bajo control intensivo y 0.9% en el grupo con control menos intensivo (RR 1.35, 0.93 a 1.97, intervalo de confianza 95%). La presencia de hipotensión severa fue más frecuente en el grupo bajo tratamiento intensivo (RR 2.68, 1.21 a 5.89, p=0.015) (29).
La evidencia es en algunos aspectos contrapuesta. En este escenario y hasta que existan nuevos datos que permitan tomar desiciones basadas en ellos parece razonable ajustarse a los objetivos de presión arerial sugeridos por las guías KDIGO (27).
Bibliografía
1. Kindig DA. Understanding population health terminology. (online).2007 (consulted: 04/04/2016); 85(1):139-61. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2690307/pdf/milq0085-0139.pdf
2. Dawber TR, Meadors GF, Moore FE. Epidemiological Approaches to Heart Disease: The Framingham Study . Am J Public Heal Nations Heal (online). 1951 (consulted: 04/04/2016);41(3):279–86. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1525365/
3. O’Donnell CJ, Elosua R. Factores de riesgo cardiovascular. Perspectivas derivadas del Framingham Heart Study. Rev Española Cardiol (online). 2008 (consulted 19/04/2016);61(3):299–310. Available from: http://www.revespcardiol.org/es/factores-riesgo-cardiovascular-perspectivas-derivadas/articulo/13116658/
4. Klag MJ, Whelton PK, Randall BL, Neaton JD, Brancati FL, Ford CE, et al. Blood Pressure and End-Stage Renal Disease in Men. N Engl J Med (online). 1996(consulted 04/09/2016);334(1):13–8. Available from: http://dx.doi.org/10.1056/NEJM199601043340103
5. Haroun MK, Jaar BG, Hoffman SC, Comstock GW, Klag MJ, Coresh J. Risk factors for chronic kidney disease: a prospective study of 23,534 men and women in Washington County, Maryland. J Am Soc Nephrol (online). 2003 (consulted 20/09/2016);14(11):2934–41. Available from: http://www.ncbi.nlm.nih.gov/pubmed/14569104
6. Yamagata K, Ishida K, Sairenchi T, Takahashi H, Ohba S, Shiigai T, et al. Risk factors for chronic kidney disease in a community-based population: a 10-year follow-up study. Kidney Int (online). 2007 (consulted 20/09/2016);71(2):159–66. Available from: http://www.ncbi.nlm.nih.gov/pubmed/17136030
7. Cao X, Xie X, Zhou J, Yuan H, Chen Z. Relationship between prehypertension and incidence of chronic kidney disease in a general population: a prospective analysis in central south China. Int Urol Nephrol (online). 2014 (consulted 20/09/2016);46(11):2183–9. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25134942
8. Tozawa M, Iseki K, Iseki C, Kinjo K, Ikemiya Y, Takishita S. Blood pressure predicts risk of developing end-stage renal disease in men and women. Hypertens (Dallas, Tex 1979) (online). 2003 (consulted 20/09/2016);41(6):1341–5. Available from: http://www.ncbi.nlm.nih.gov/pubmed/12707291
9. National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis (online). 2002 Feb (consulted 20/09/2016);39(2 Suppl 1):S1-266. Available from: http://www.ncbi.nlm.nih.gov/pubmed/11904577
10. Parving H-H, Brenner BM, McMurray JJ, de Zeeuw D, Haffner SM, Solomon SD, et al. Cardiorenal end points in a trial of aliskiren for type 2 diabetes. N Engl J Med (online). 2012 (consulted 20/09/2016);367(23):2204–13. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23121378
11. Halbesma N, Jansen DF, Stolk RP, De Jong PE, Gansevoort RT, PREVEND Study group. Changes in renal risk factors versus renal function outcome during follow-up in a population-based cohort study. Nephrol Dial Transplant (online). 2010 Jun (consulted 20/09/2016);25(6):1846–53. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20054026
12. Chang P-Y, Chien L-N, Lin Y-F, Wu M-S, Chiu W-T, Chiou H-Y. Risk factors of gender for renal progression in patients with early chronic kidney disease. Medicine (Baltimore) (online). 2016 Jul (consulted 20/09/2016);95(30):e4203. Available from: http://www.ncbi.nlm.nih.gov/pubmed/27472690
13. Terawaki H, Metoki H, Nakayama M, Ohkubo T, Kikuya M, Asayama K, et al. Masked hypertension determined by self-measured blood pressure at home and chronic kidney disease in the Japanese general population: the Ohasama study. Hypertens Res (online). 2008(consulted 20/09/2016);31(12):2129–35. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19139602
14. McMullan CJ, Hickson DA, Taylor HA, Forman JP. Prospective analysis of the association of ambulatory blood pressure characteristics with incident chronic kidney disease. J Hypertens (online). 2015 (consulted 20/09/2016);33(9):1939–46; discussion 1946. Available from: http://www.ncbi.nlm.nih.gov/pubmed/26066645
15. Kanno A, Metoki H, Kikuya M, Terawaki H, Hara A, Hashimoto T, et al. Usefulness of assessing masked and white-coat hypertension by ambulatory blood pressure monitoring for determining prevalent risk of chronic kidney disease: the Ohasama study. Hypertens Res (online). 2010 (consulted 20/09/2016);33(11):1192–8. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20703228
16. Hallan SI, Dahl K, Oien CM, Grootendorst DC, Aasberg A, Holmen J, et al. Screening strategies for chronic kidney disease in the general population: follow-up of cross sectional health survey. BMJ (online). 2006 (consulted 20/09/2016);333(7577):1047. Available from: http://www.ncbi.nlm.nih.gov/pubmed/17062598
17. Berns JS. Routine screening for CKD should be done in asymptomatic adults... selectively. Clin J Am Soc Nephrol (online). 2014 (consulted 20/09/2016);9(11):1988–92. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25237073
18. Powe NR, Boulware LE. Population-based screening for CKD. Am J Kidney Dis (online). 2009 (consulted 20/09/2016);53(3 Suppl 3):S64-70. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19231763
19. Komenda P, Ferguson TW, Macdonald K, Rigatto C, Koolage C, Sood MM, et al. Cost-effectiveness of primary screening for CKD: a systematic review. Am J Kidney Dis (online). 2014 (consulted 20/09/2016);63(5):789–97. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24529536
20. Qaseem A, Wilt TJ, Cooke M, Denberg TD. The paucity of evidence supporting screening for stages 1-3 CKD in asymptomatic patients with or without risk factors. Clin J Am Soc Nephrol (online). 2014 (consulted 20/09/2016);9(11):1993–5. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25237074
21. Komenda P, Rigatto C, Tangri N. Screening Strategies for Unrecognized CKD. Clin J Am Soc Nephrol (online). 2016 (consulted 20/09/2016);11(6):925–7. Available from: http://www.ncbi.nlm.nih.gov/pubmed/27197906
22. McClellan WM, Ramirez SPB, Jurkovitz C. Screening for chronic kidney disease: unresolved issues. J Am Soc Nephrol (online). 2003 (consulted 20/09/2016);14(7 Suppl 2):S81-7. Available from: http://www.ncbi.nlm.nih.gov/pubmed/12819308
23. Rios Bruno P, Schwedt E, Solá Schnir L, Gadola L, de Souza N, Lamadrid V. Importancia del examen médico preventivo para el diagnóstico precoz de enfermedad renal en Uruguay. Programa Nacional de Salud Renal. Arch Med Interna. 2015;37(3):114–21.
24. Klahr S, Levey AS, Beck GJ, Caggiula AW, Hunsicker L, Kusek JW, et al. The effects of dietary protein restriction and blood-pressure control on the progression of chronic renal disease. Modification of Diet in Renal Disease Study Group. N Engl J Med (online). 1994 (consulted 20/09/2016);330(13):877–84. Available from: http://www.ncbi.nlm.nih.gov/pubmed/8114857
25. Appel LJ, Wright JT, Greene T, Agodoa LY, Astor BC, Bakris GL, et al. Intensive blood-pressure control in hypertensive chronic kidney disease. N Engl J Med (online). 2010 (consulted 20/09/2016);363(10):918–29. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20818902
26. Ruggenenti P, Perna A, Loriga G, Ganeva M, Ene-Iordache B, Turturro M, et al. Blood-pressure control for renoprotection in patients with non-diabetic chronic renal disease (REIN-2): multicentre, randomised controlled trial. Lancet (online). (consulted 22/09/2016);365(9463):939–46. Available from: http://www.ncbi.nlm.nih.gov/pubmed/15766995
27. Wheeler DC, Becker GJ. Summary of KDIGO guideline. What do we really know about management of blood pressure in patients with chronic kidney disease? Kidney Int (online). 2013 (consulted 22/09/2016);83(3):377–83. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23325075
28. Lv J, Ehteshami P, Sarnak MJ, Tighiouart H, Jun M, Ninomiya T, et al. Effects of intensive blood pressure lowering on the progression of chronic kidney disease: a systematic review and meta-analysis. CMAJ (online). 2013 (consulted 22/09/2016);185(11):949–57. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23798459
29. Xie X, Atkins E, Bennet A, Neal B, Ninomiya T, Woodward M, et al. Effects of intensive blood pressure lowering on cardiovascular and renal outcomes: updated systematic review and meta-analysis. Lancet. 2016;30(387):435–43.














