Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Medicina Interna
versión impresa ISSN 2393-6797versión On-line ISSN 2393-6797
Rev. Urug. Med. Int. vol.1 no.2 Montevideo ago. 2016
Caso clínico
Hematoma postoperatorio en neurocirugía. Presentación de un caso y revisión.
Postoperative hematoma in neurosurgery. A case report and review.
Dr. Gabriel Castelluccio
Residente de Neurocirugía
Dr. Gonzalo Bertullo
Neurocirujano. Asistente
Dr. Fernando Martínez
Neurocirujano. Profesor Adjunto
Dr. Federico Salle
Neurocirujano. Asistente
Dra. Verónica Bentancourt
Residente de Neurocirugía
Dra. Mariana Romero
Residente de Neurocirugía
Dra. Verónica de los Santos
Residente de Neurocirugía
Recibido: 11/6/16 - Aceptado: 11/7/16
Departamento e Institución responsables: Servicio de Neurocirugía. Hospital de Clínicas “Dr. Manuel Quintela”. Facultad de Medicina. Universidad de la República. Montevideo – Uruguay.
Correspondencia: Dr. Gabriel Castelluccio. Colonia 1323. CP: 11100. Montevideo, Uruguay. (00598) 29013807 / (00598) 98868081. Email: gcasna@gmail.com
RESUMEN
El hematoma postoperatorio es una de las complicaciones más graves en neuro-cirugía, con una mortalidad que varía entre un 18 y 32%, y una morbilidad significativa. Se han identificado factores de riesgo clínicos, perioperatorios y patológicos que aumentan la probabilidad de sufrir esta complicación. Los autores reportan el caso de un paciente que presentó un hematoma postoperatorio luego de la exéresis de una metástasis cerebral y analizan las posibles causas que llevaron a dicha complicación. Asimismo realizan una exhaustiva revisión no sistemática de la literatura referente a la hemorragia postoperatoria, sus factores de riesgo y manejo perioperatorio.
Palabras clave: hematoma postoperatorio, factores de riesgo, hipertensión arterial perioperatoria, tumores del sistema nervioso central.
ABSTRACT
Postoperative haematoma is one of the most severe complications in neurosurgery, with a mortality rate ranging between 18 and 32% and a significant morbidity. Risk factors clinicals, perioperatives and pathologicals have been indentified that increase the likelihood of this complication. The authors report the case of a patient who suffered a postoperative haematoma after the resection of a brain metastasis and analyze the possible causes that led to this complication. They also perform an exhaustive non systematic review of the literature about postoperative haemorrhage, their risk factors and perioperative management.
Key words: postoperative haematoma, risk factors, perioperative hypertension, central nervous system tumors.
Introducción
El hematoma postoperatorio (HPO) es una de las complicaciones más temidas luego de un procedimiento neuroquirúrgico, al punto que algunos autores plantean que evitar su ocurrencia es una de las medidas más importantes para reducir la mortalidad quirúrgica.(1)
Siguiendo a Seifman et al. la hemorragia intracraneana postoperatoria es aquella que aparece luego de craniotomía y genera un deterioro clínico significativo, requiriendo reintervención (2). Su incidencia varía entre un 0,6 a 4%.(1,3-12)
Se ha reportado una mortalidad global que varía entre un 18 y 32% (1,13-15), y hasta un 55% de muerte o discapacidad severa a los 6 meses de postoperatorio (14).
Varios factores de riesgo han sido identificados, dentro de los cuales destacamos: comorbilidades médicas, como hipertensión arterial, coagulopatías y anomalías hematológicas; hipertensión y pérdida sanguínea intraoperatoria; ciertas patologías como tumores, MAVs o el hematoma subduralcrónico (HSDC); así como deficiencias en la hemostasisquirúrgica.(2)
Los autores reportan el caso de un paciente que presentó un HPO, luego de ser intervenido por una metástasis supratentorial y analizan las posibles causas que llevaron a esta complicación. Se realiza una búsqueda no sistemática de la literatura concerniente a la hemorragia postoperatoria y a los factores que aumentan el riesgo de presentar esta complicación y sus opciones de manejo.
Caso clínico
Paciente de 64 años, sexo masculino, fumador.
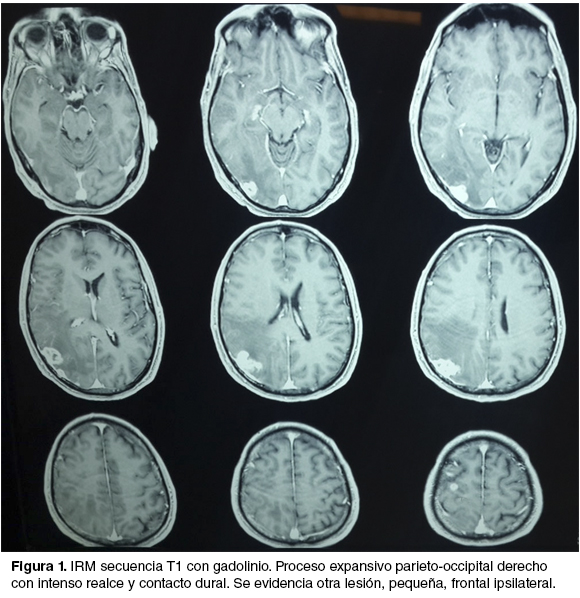
Historia de 3 meses de evolución de cefalea progresiva y déficit motor leve de hemicuerpo izquierdo, que retrocede con la corticoterapia. Se realizó imagen por resonancia magnética (IRM) que evidencia una lesión expansiva parieto-occipital derecha con contacto dural y otra más pequeña frontal ipsilateral (figura 1). Con planteo de secundarismo encefálico se realiza cirugía electiva de la lesión parieto-occipital. Se reseca la misma en bloque junto con la duramadre infiltrada y se realiza una plastia de duramadre con periostio. Durante la mayor parte del acto anestésico-quirúrgico el paciente se mantiene hipertenso, con cifras mayores a 160/90 mmHg. Se realiza hemostasis con PA de 170/100 mmHg, momento en el cual el paciente instala una arritmia y un infradesnivel del segmento ST, que revierten rápidamente.
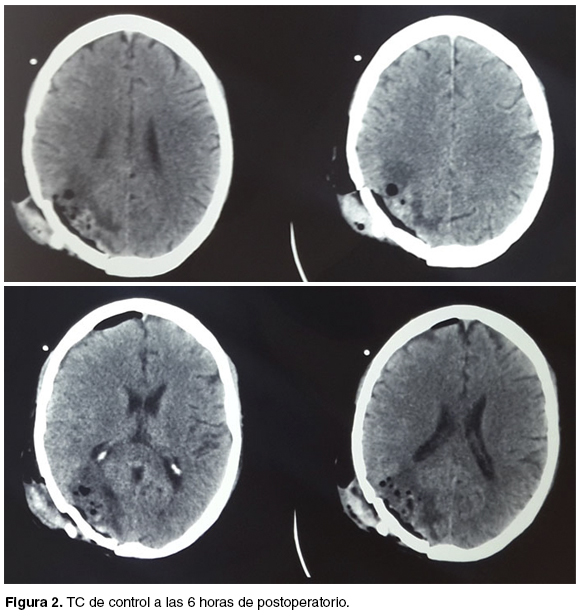
Egresa de block quirúrgico a la Unidad de Cuidados Intensivos (UCI) intubado, bajo sedoanalgesia. La tomografía (TC) de control a las 6 horas de postoperatorio, no muestra complicaciones hemorrágicas en el lecho (figura 2). El paciente lograba una apertura ocular al llamado y cumplía órdenes.
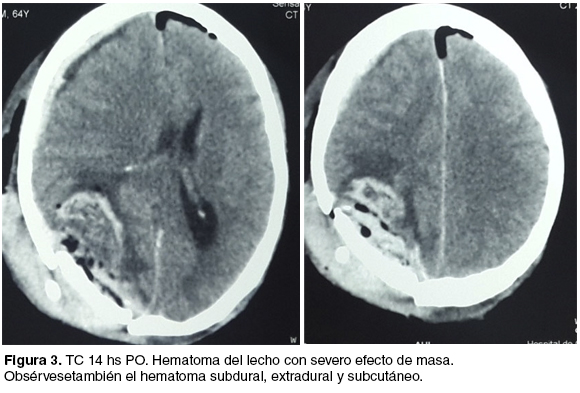
Las horas siguientes se mantuvo hipertenso con cifras de PA de hasta 200/120 mmHg, constatándose en la evolución un score de Glasgow de 9 y una anisocoria con pupila mayor a derecha, que revierte con medidas médicas. Se realiza una TC de emergencia (llevando 14 horas de postoperatorio) que evidencia hematoma en todos los planos: subcutáneo, extradural del colgajo, subdural y del lecho quirúrgico, con severo efecto de masa (figura 3). El recuento plaquetario y la crasis se encontraban dentro de los parámetros normales. Se reopera de emergencia, evacuándose el hematoma del lecho, así como el componente extradural y subdural, no encontrándose una fuente de sangrado activa.
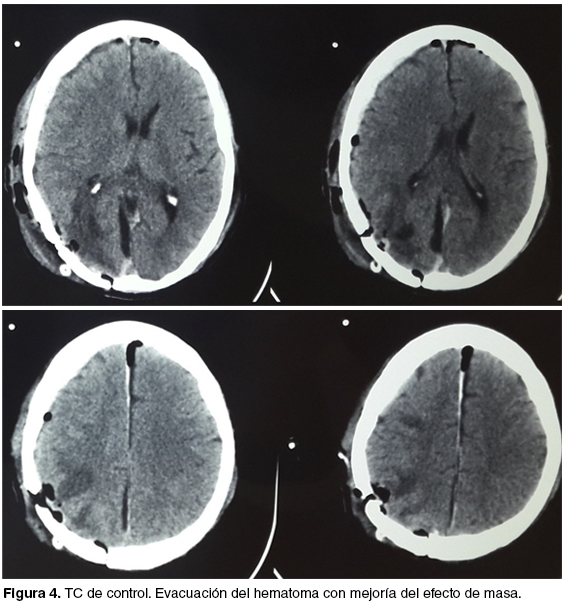
La TC de control muestra una evacuación completa con franca mejoría del efecto de masa (figura 4). La evolución ulterior fue favorable; lográndose desvincular al paciente de la asistencia ventilatoria a las 48 horas, pasando luego a sala general donde se mantiene lúcido y sin déficit focal neurológico. La anatomía patológica confirma metástasis de primitivo renal y se vincula al paciente con oncólogo para continuar el tratamiento de su enfermedad neoplásica.
Discusión
En el presente caso debemos analizar en primer lugar las posibles causas que llevaron a la complicación hemorrágica.
Se ha implicado a la hipertensión pre, intra y postoperatoria en el desarrollo de HPO. (2,13,16-18) Nuestro paciente no tenía historia de hipertensión arterial conocida, pero se mantuvo hipertenso durante la mayor parte del acto anestésico-quirúrgico. A pesar de esto, se logró una adecuada hemostasis con un campo quirúrgico “limpio” al finalizar la cirugía, teniendo una TC de control a las 6 horas de postoperatorio que no evidenció sangrado. Las cifras de PA elevadas se mantuvieron las horas siguientes y el paciente presentó un deterioro clínico atribuible a la complicación, que se trató de un hematoma diferido. Pensamos que fue fundamentalmente la hipertensión postoperatoria mantenida el principal factor que llevó a esta complicación.
Basali et al. estudiaron la relación entre la hipertensión perioperatoria y el sangrado postoperatorio mediante un diseño de caso-control. Observaron que el 62% de los pacientes que sangraron tuvieron hipertensión en el intraoperatorio comparado con un 34% de los controles (p < 0,001); y que el 62% de los que presentaron la complicación estuvieron hipertensos las primeras 12 horas de postoperatorio en comparación con un 25% de los controles (p < 0,001). A su vez se vió una relación temporal entre la hipertensión y el sangrado, siendo que el 65% de los episodios hipertensivos en las primeras 12 horas de postoperatorio, ocurrieron las 6 horas previas a la complicación. Estos autores plantean que cifras de PA mayores a 160/90 mmHg en el perioperatorio aumentan significativamente el riesgo de sangrado postoperatorio. En dicho estudio el HPO se asoció significativamente con mayor mortalidad y mayor estadía hospitalaria (18,2% vs 1,6% y 24,5 vs 11 días, respectivamente).(13)
La hipertensión aguda aumenta el riesgo de sangrado por disrupción de la hemostasis, alterando la formación del tapón hemostático (2,19,20); y por alteración de la autorregulación cerebral. Todo esto sumado a una BHE dañada por la cirugía puede llevar a un hematoma del lecho (2,20).
En nuestro caso, si bien se logró una buena hemostasis, la hipertensión (HA) de difícil manejo nos llevó a mantener al paciente intubado y sedado en el postoperatorio inmediato para minimizar el riesgo de complicaciones hemorrágicas intracraneanas y cardiovasculares. Sin embargo, no se mantuvo una sedoanalgesia apropiada en la UCI, factor que creemos favoreció la hipertensión persistente en el postopertorio.
Vassilouthis et al. estudiaron la hipótesis de que los ascensos tensionales abruptos en las últimas etapas de la cirugía y el rápido despertar, están relacionados con el desarrollo de HPO. Sometieron a sus pacientes a un protocolo estricto de analgesia opiode profunda (fentanyl) y una emergencia lenta de la anestesia, eliminando virtualmente, cualquier respuesta de estrés al trauma quirúrgico que pudiera ocasionar ascensos bruscos de la presión arterial. De los 526 pacientes que fueron a craniotomía en estas condiciones, niguno sangró, lo que les llevó a concluir que el HPO sería una complicación evitable.(18)
Otra de las causas que puede favorecer las complicaciones neurológicas y el HPO en pacientes con tumores, es la exéresisparcial de la lesión.(2,21-24) Si bien en nuestro caso no se realizó contraste en la TC de control, la misma fue resecada en forma completa dado el buen plano que suelen tener estas lesiones. Este riesgo es fundamental minimizarlo sobre todo en lesiones infiltrantes. La resección de tumores intracraneanos, per sé, se asocia con riesgo de hemorragia postoperatoria.(2,19,25)
La actividad enzimática tumoral al destruir la barrera entre el cerebro y la lesión podría ser responsable, en algunos casos, de la falta de una cápsula tumoral y de que el parénquima se torne más friable (2,26), favoreciendo que con la decompresión los vasos se vuelvan hiperperfundidos y sangrantes (2,19). En el trabajo de Palmer et al. La condición patológica que más frecuentemente llevó al HPO fue la cirugía por meningioma; sin embargo, al considerar la localización del hematoma en relación al diagnóstico, los hematomas intraparenquimatosos, fueron más frecuentes luego de cirugía de tumores intraaxiales y de malformaciones arterio-venosas (MAVs).(14)
Con respecto a la edad, no hay consenso en cuanto a un límite luego del cual la misma represente un factor de riesgo significativo para HPO.(2) Para algunos autores, la edad mayor a 60 años, como es el caso de nuestro paciente, es un factor de riesgo independiente para mortalidad quirúrgica luego de cirugía por tumores, así como también se asocia a mayor riesgo de HPO, planteándose que la mayor fragilidad tisular de estos pacientes favorecería la complicación hemorrágica.(1) Otros mencionan que la mortalidad quirúrgica es significativamente más alta, luego de los 55 años.(21)
Cuando se trata de un hematoma diferido, como en nuestro caso, la isquemia venosa puede estar en la base fisiopatológica, sobre todo en cirugías prolongados y con importante retracción cerebral. La trombosis difusa de las pequeñas venas corticales puede dar lugar a un hematoma de entidad.(27)
De la literatura revisada por los autores surge que se han identificado varios factores de riesgo para HPO en neurocirugía, algunos de los cuales hemos ido nombrando, al analizar el caso clínico.
Dentro de las comorbilidades, además de la hipertensión arterial; las anomalías hematológicas y las coagulopatías, pueden tener en algunos casos un rol preponderante. Palmer et al. plantean que para minimizar el riesgo de una complicación hemorrágica además de una adecuada técnica quirúrgica y el uso de hemostáticos tópicos, es fundamental contar con un número adecuado de plaquetas (PQT) funcionantes, una coagulación sanguínea normal y ausencia de una excesiva fibrinólisis.(14)
Las condiciones que lleven a una disminución del recuento plaquetario expondrán al paciente a un mayor riesgo de sangrado (2,25), considerándose significativo un número de PQT menores a 100.000/mm3 (2,28,29). Chan et al. hacen referencia a la mayor tendencia al sangrado en pacientes con trombocitopenia aguda (como ocurre ante una pérdida sanguínea intraoperatoria significativa) con respecto a aquellos con trombocitopenia crónica. Estos autores mostraron que es significativo un descenso del recuento plaquetario en el postopertorio inmediato, de valores normales, a valores entre 124.000 y 100.000/mm3.(2,28)
El alcoholismo puede dañar la función plaquetaria y disminuir el tiempo de sobrevida de las PQT (30). Tanto la ingesta crónica como la intoxicación alcohólica aguda pueden aumentar el riesgo de complicaciones hemorrágicas, debido a trombocitopenia y depresión de la médula ósea.(31,32)
La coagulación intravascular diseminada (CID), como puede verse en el politraumatizado grave (PTMG) y la deficiencia de factor XIII, también aumentan el riesgo de HPO.(2) Esta última condición genera una hiperfibrinólisis (33) que se ha vinculado a hematoma diferido por alteración en la etapa final de la coagulación (22). Hay autores que proponen realizar un screening de esta condición en pacientes que serán sometidos a neurocirugía.(33)
Los antiplaquetarios y los anticoagulantes merecerían un capítulo aparte, lo cual excede el objetivo de este trabajo. De todas formas haremos mención a algunos puntos. En el estudio de Palmer et al. sobre 6668 intervenciones en un período de 5 años, la administración de antiplaquetarios las 2 semanas previas a la cirugía fue el factor de riesgo más frecuente para HPO, estando presente en el 43% de los casos.(14) En general se recomienda discontinuar el ácido acetil salicílico (AAS) 7 días antes de cualquier procedimiento quirúrgico, y ante situaciones de emergencia la transfusión de concentrados plaquetarios y el uso de acetato de desmopresina.(2) Este último no como monoterapia sino como coadyuvante de la administración de PQT.(2,34) Esta droga actuaría aumentando el factor de von Willebrandplasmático así como la densidad de receptores de glicoproteínas en la superficie plaquetaria.(35,36) Para el caso del clopidogrel se ha planteado su discontinuación por un período de tiempo mayor, de 10 a 14 días.(2)
Con respecto a los anticoagulantes, se ha visto aumento del riesgo de sangrado postopertorio con el uso de heparina de bajo peso molecular (HBPM) en el preoperatorio como profilaxis de eventos tromboembólicos, recomendándose su suspensión al menos 18 horas antes del procedimiento.(2,37) Por otro lado, se ha demostrado que son seguros cuando se empiezan en el postoperatorio.(2,38,39) La warfarina, por su parte, debería suspenderse 5 días antes de la cirugía, pudiendo pasar a heparina de ser necesario.(2) El arsenal terapéutico en situaciones de emergencia incluye la administración de vitamina K(2,40), complejo protrombínico y/o plasma fresco congelado(2).
En el presente caso clínico no había alteraciones en el recuento plaquetario, el tiempo de protrombina se encontraba dentro de los parámetros normales y el paciente no estaba recibiendo ni antiagregantes ni anticoagulantes.
En lo referente a los factores de riesgo de HPO, vinculados al acto anestésicoquirúrgico o perioperatorios, ya hicimos referencia a la hipertensión perioperatoria y al rol preponderante que pensamos jugó en este caso.
Otro factor a considerar es la pérdida sanguínea intraoperatoria. En esta cirugía el sangrado intraoperatorio no fue de entidad. Hay trabajos que muestran que una pérdida media de 500 mL se asocia a un riesgo significativo de HPO.(41) Probablemente el riesgo se deba a la depleción de PQT y factores de la coagulación; siendo fundamental la adecuada reposición con concentrados plaquetarios y plasma fresco congelado durante la cirugía. En este ítem, se ha visto que los antifibrinolíticos (ácidotranexámico, ácidoépsilonaminocaproico e inhibidores de la plasmina, como la aprotinina) podrían ser de potencial beneficio.(2) Un meta-análisis de 211 ensayos clínicos mostró disminución de la hemorragia intraoperatoria así como de la necesidad de transfusión en cirugía no urgente, con el uso de estas drogas.(2,42)
Se debe insistir en una meticulosa hemostasis para minimizar las complicaciones y optimizar el resultado quirúrgico. Además de la coagulación bipolar, frecuentemente se requiere del uso de hemostáticos tópicos (2,25) como la celulosa oxidada, el gelfoam o la aprotinina(43). La realización de una maniobra de Valsalva puede ser de utilidad, ya que imita el ascenso de la PA durante la extubación y el despertar de la anestesia pudiendo alertarnos de posibles fuentes de sangrado en el lecho.(24)
Algunos autores hacen referencia a que la posición del paciente, como la posición vertical, podría predisponer a la hemorragia.(37,44) Una posible explicación sería la alteración de la dinámica intracraneana con disrupción de las venas puente.(44) La otra posible causa sería el desarrollo de una hiperperfusión al readoptar la posición supina en el postoperatorio, en un parénquima que estuvo sometido a un menor flujo sanguíneo durante la posición vertical.(2,41) Otros autores no han demostrado aumento del riesgo de HPO con la posición vertical.(45)
Determinadas entidades patológicas presentan un mayor riesgo de compliaciones hemorrágicas. Los tumores del sistema nervioso central (SNC), como fue analizado, son una de ellas. Otras entidades asociadas a mayor riesgo de HPO son: el trauma, donde pueden verse hemorragias postoperatorias vinculadas a injuria de la vasculatura cerebral o a CID; las MAVs, donde el fenómeno de “perfusión de lujo” puede estar en la génesis de la complicación (46,47) y el hematoma subdural crónico (HSDC).(2) En este último, factores como una reexpansión lenta y una relativa hipotensión intracraneana predisponen a que el hematoma vuelva a formarse. (2,48)
Con respecto a la localización del HPO, en nuestro caso se evidenció sangrado en el lecho, así como subdural (HSD), extradural (HED) y subcutáneo. Los hematomas extra-axiales pueden verse favorecidos por la hipotensión intracraneana posquirúrgica al evacuar la lesión expansiva, fundamentalmente la formación de un HED.(49) En cuanto a esto último, es importante acolar la duramadre a los bordes de la craniotomía y al colgajo óseo de forma de disminuir su ocurrencia.(2)
Debemos tener en cuenta que hay casos en los cuales no es posible encontrar factores de riesgo de HPO. En el estudio de Palmer et al. Ocurrió en el 35% de los casos. Estos autores no descartan la posibilidad de que el acto quirúrgico pueda inducir una coagulopatía, sobre todo considerando que el cerebro tiene el contenido más alto de tromboplastina que cualquier otro tejido. Su liberación a la circulación local podría inducir una coagulopatía por consumo.(14)
Por último, queremos hacer algunas consideraciones en cuanto al manejo postoperatorio.
En este caso, se solicitó una TC de control a las 6 horas del postoperatorio, considerando la hipertensión intraoperatoria que podía exponer al paciente a un mayor riesgo de complicaciones hemorrágicas y que además iba a permanecer sedado y ventilado. La oportunidad de la imagen de control antes de la aparición de cualquier síntoma ha sido motivo de controversias. Algunos autores realizan TC de control de rutina en las primeras 24 horas de postoperatorio (18,50), otros en las primeras 48 horas (51) y otros hasta 7 días del postoperatorio (19,49,52). De todas formas, si la sospecha de un hematoma postoperatorio es alta, una tomografía precoz puede permitir una intervenciónmás temprana.(2)
La tomografía y la resonancia intraoperatorias son herramientas que pueden ayudar a detectar y prevenir el sangrado postoperatorio, sobre todo en áreas no visibles del campo operatorio.(2,53,54)
Hay autores que plantean que el monitoreo de presión intracraneana (PIC), puede ser una opción válida cuando la lesión ha sido muy sangrante, con dificultades en la hemostasis, ha habido una pérdida sanguínea intraoperatoria importante o el paciente va a permanecer sedado y ventilado.(2)
Se debe realizar una estricta observación clínica y neurológica en el postoperatorio inmediato para detectar esta complicación.(15,17,26,30,38,55,56) Autores como Taylor et al. plantean que un período de observación en la UCI de 6 horas, debería alcanzar en la mayoría de los casos ya que en su trabajo que incluyó 2305 pacientes operados por diversas causas, el 88% de los hematomas postoperatorios ocurrieron en las primeras 6 horas de postoperatorio; planteando un período de observación mayor para el caso de craniotomías de emergencia o cirugía de fosa posterior.(15) Lassen et al. por su parte observaron sólo un 25% de reoperaciones por HPO en las primeras 6 horas. En este estudio el 80% de las reoperaciones por dicha causa, se dieron en las primeras 48 horas, planteando estos autores una observación estricta durante ese lapso de tiempo.(1)
Para finalizar, y como se mencionó en la introducción, el hematoma postoperatorio tiene una morbi-mortalidad significativa.(1,2,13-15) Lassen et al. reportaron la mortalidad quirúrgica así como la tasa de reoperación por hematoma e infección en 2630 craniotomías consecutivas por tumores intracraneanos. En este estudio, el HPO fue la causa más frecuente de muerte junto con la progresión tumoral, representando cada una un 35% de la mortalidad quirúrgica. La mortalidad del HPO en esta serie fue de 22%, junto con un 2% adicional de discapacidad severa.(1)
En el caso presentado por los autores, se logró resolver la complicación una vez detectada, logrando una mejoría del estado clínico y el paciente fue dado de alta de la UCI a las 72 horas de la reintervención, sin déficit neurológico, aguardando el comienzo del tratamiento adyuvante de su enfermedad neoplásica.
Conclusiones
El HPO es una de las complicaciones más graves en neurocirugía. Presenta una elevada morbi-mortalidad que hace relevante el conocimiento de los factores de riesgo en su prevención y tratamiento.
El adecuado tratamiento de la hipertensión arterial perioperatoria y el control de la hemostasisintraoperatoria son los principales factores a tener en cuenta. Tanto en cirugía de tumores como de MAVs, se agrega la resección completa de los mismos.
En pacientes que van a ser sometidos a cirugía electiva, el AAS debe suspenderse 7 días antes y el clopidrogrel entre 10 a 14 días. La HBPM debería discontinuarse al menos 18 horas antes del procedimiento y la warfarina 5 días previo a la cirugía.
Para situaciones de emergencia es esencial contar con concentrados plaquetarios y acetato de desmopresina en los pacientes antiagregados, y con vitamina K, complejo protrombínico y plasma fresco congelado en los anticoagulados.
En el postoperatorio se debe realizar un estricto control clínico y realizar un estudio imagenológico idealmente en las primeras 6 horas.
Bibliografía
1. Lassen B, Helseth E, Rønning P, Scheie D, Johannesen TB, Mæhlen J, et al. Surgical mortality at 30 days and complications leading to recraniotomy in 2630 consecutive craniotomies for intracranial tumors. Neurosurgery. 2011; 68(5): 1259-126.
2. Seifman MA, Lewis PM, Rosenfeld JV, Hwang PY. Postoperative intracranial haemorrhage: a review.Neurosurg Rev. 2011;34(4):393-407.
3. Barker FG II, Curry WT Jr, Carter BS. Surgery for primary supratentorial brain tumors in the United States, 1988 to 2000: the effect of provider case load and centralization of care. Neuro Oncol.2005; 7(1): 49-63.
4. Boviatsis EJ, Bouras TI, Kouyialis AT, Themistocleous MS, Sakas DE. Impact of age on complications and outcome in meningioma surgery. Surg Neurol.2007; 68(4): 407-411.
5. Brell M, Ibanez J, Caral L, Ferrer E. Factors influencing surgical complications of intra-axial brain tumours. Acta Neurochir (Wien). 2000; 142(7): 739-750.
6. Chang SM, Parney IF, McDermott M, Barker FG 2nd, Schmidt MH, Huang W, et al. Perioperative complications and neurological outcomes of first and second craniotomies among patients enrolled in the Glioma Outcome Project. J Neurosurg.2003; 98(6): 1175-1181.
7. Curry WT, McDermott MW, Carter BS, Barker FG II. Craniotomy for meningioma in the United States between 1988 and 2000: decreasing rate of mortality and the effect of provider case load.J Neurosurg. 2005; 102(6): 977-986.
8. Morokoff AP, Zauberman J, Black PM. Surgery for convexity meningiomas. Neurosurgery.2008; 63(3): 427-433.
9. Rabadán AT, Hernandez D, Eleta M, Pietrani M, Baccanelli M, Christiansen S, et al. Factors related to surgical complications and their impact on the functional status in 236 open surgeries for malignant tumors in a Latino-American hospital. SurgNeurol. 2007; 68(4): 412-420.
10. Rogne SG, Konglund A, Meling TR, Scheie D, Johannesen TB, Rønning P, et al. Intracranial tumor surgery in patients 70 years of age: is clinical practice worthwhile or futile? ActaNeurol Scand. 2009; 120(5): 288-284.
11. Sawaya R, Hammoud M, Schoppa D, Hess KR, Wu SZ, Shi WM, et al. Neurosurgical outcomes in a modern series of 400 craniotomies for treatment of parenchymal tumors. Neurosurgery. 1998; 42(5): 1044-1055.
12. Stark AM, Tscheslog H, Buhl R, Held-Feindt J, Mehdorn HM. Surgical treatment for brain metastases: prognostic factors and survival in 177 patients. Neurosurg Rev. 2005; 28(2): 115-119.
13. Basali A, Mascha EJ, Kalfas I, Schubert A. Relation between perioperative hypertension and intracranial hemorrhage after craniotomy. Anesthesiology. 2000; 93(1): 48-54.
14. Palmer JD, Sparrow OC, Iannotti F. Postoperative hematoma: a 5-year survey and identification of avoidable risk factors. Neurosurgery. 1994; 35(6): 1061-1064.
15. Taylor WA, Thomas NW, Wellings JA, Bell BA. Timing of postoperative intracranial hematoma development and implications for the best use of neurosurgical intensive care. J Neurosurg. 1995; 82(1): 48-50.
16. Haines S, Maroon J, Jannetta P. Supratentorialintracerebralhaemorrhage following posterior fossa surgery. J Neurosurg. 1978; 49:881–886.
17. Kalfas I, Little J. Postoperative haemorrhage: a survey of 4992 intracranial procedures. Neurosurgery. 1998; 23: 343–347.
18. Vassilouthis J, Anagnostaras S, Papandreou A, Dourdounas E. Is postoperative haematoma an avoidable complication of intracranial surgery? Br J Neurosurg. 1999; 13: 154–157.
19. Fukumachi A, Koizumi H, Nukui H. Postoperative intracerebralhaemorrhages: a survey of computed tomographic findings after 1074 intracranial operations. SurgNeurol. 1985; 23:575–580.
20. Thiagarajah S. Postoperative care of neurosurgical patients. IntAnesthesiolClin. 1983; 21: 139–156.
21. Fadul C, Wood J, Thaler H, Galicich J, Patterson R, Posner J. Morbidity and mortality of craniotomy for excision of supratentorialgliomas. Neurology. 1988; 38: 1374–1379.
22. Gerlach R, Raabe A, Zimmermann M, Siegemund A, Seifert V. Factor XIII deficiency and postoperative haemorrhage after neurosurgical procedures. SurgNeurol. 2000; 54: 260–266.
23. Jelsma R, Bucy P. The treatment of glioblastomamultiforme of the brain. J Neurosurg. 1967; 27: 388–400.
24. Wilson C. General considerations. In: Apuzzo M (ed). Brain surgery: complication avoidance and management. New York: . Churchill Livingstone ;1993. pp 177–185.
25. Palmer J, Francis J, Pickard J, Iannotti F. The efficacy and safety of aprotinin for hemostasis during intracranial surgery. J Neurosurg. 2003; 98: 1208–1216.
26. Samii M, Matthies C. Management of 1000 vestibular schwannomas (acoustic neuromas): surgical management and results with an emphasis on complications and how to avoid them. Neurosurgery. 1997; 40: 11–23.
27. Sakaki T, Matsuyama T, Nagata K, Nakase H, Hirabayashi H, Morimoto T. Delayed intracerebralhaemorrhage after intracranial surgery. J ClinNeurosci. 1999;6(1):54-7.
28. Chan K, Mann K, Chan T. The significance of thrombocytopaenia in the development of postoperative intracranial haematoma. J Neurosurg. 1989; 71: 38–41.
29. Harker L, Slichter S. The bleeding time as a screening test for evaluation of platelet function. N Engl J Med. 1972; 287: 155–159.
30. Bullock R, Hannemann C, Murray L, Teasdale G. Recurrent haematomas following craniotomy for traumatic intracranial mass. J Neurosurg. 1990; 72: 9–14.
31. Lindenbaum J, Lieber C. Haematologic effects of alcohol in man in the absence of nutritional deficiency. N Engl J Med. 1969; 281: 333–338.
32. Ryback R, Desforges J. Alcoholic thrombocytopaenia in three inpatient drinking alcoholics. ArchIntern Med.1970; 125: 475–477.
33. Gerlach R, Tölle F, Raabe A, Zimmermann M, Siegemund A, Seifert V. Increased risk for postoperative haemorrhage after intracranial surgery in patients with decreased factor XIII activity: implications of a prospective study. Stroke. 2002; 33: 1618–1623.
34. Perkins J, Cap A, Weiss B, Reid T, Bolan C. Massive transfusion and nonsurgical hemostatic agents. CritCareMed. 2008. 36: S325–S339.
35. Lethagen S, Rugarn P, Aberg M, Nilsson I. Effects of desmopressin acetate (DDAVP) and dextran on hemostatic and thomboprophylactic mechanisms. Acta ChirScand. 1990; 156:597–602.
36. Mannucci P, Levi M. Prevention and treatment of major blood loss. N Engl J Med. 2007; 356: 2301–2311.
37. Harders A, Gilsbach J, Weigel K. Supratentorial space occupying lesions following infratentorial surgery: early diagnosis and treatment. Acta Neurochir. 1985; 74: 57–60.
38. Gerlach R, Scheuer T, Beck J, Woszczyk A, Böhm M, Seifert V, Raabe A. Risk of postoperative haemorrhage after intracranial surgery after early nadroparin administration: results of a prospective study. Neurosurgery.2003; 53:1028–1035.
39. Kleindienst A, Harvey H, Mater E, Bronst J, Flack J, Herenz K et al. Early antithrombotic prophylaxis with low molecular weight heparin in neurosurgery. Acta Neurochir 2003; 145:1085–1091.
40. Perel P, Roberts I, Shakur H, Thinkhamrop B, Phuenpathom N, Yutthakasemsunt S. Haemostatic drugs for traumatic brain injury. The Cochrane database of systematic reviews. 2010;(1):CD007877. doi:10.1002/14651858.CD007877.pub2.
41. Zetterling M, Ronne-Engström E. High intraoperative blood loss may be a risk factor for postoperative haematoma. J NeurosurgAnesthesiol. 2004; 16:151–155.
42. Henry D, Carless P, Moxey A, O"Connell D, Stokes B and McClelland B. Anti-fibrinolytic use for minimising perioperative allogenic blood transfusion. Cochrane Database of Systematic Reviews. 2007. Art No: CD001886.
43. Arand A, Sawaya R (1986) Intraoperative chemical haemostasis in neurosurgery. Neurosurgery. 1986; 18:223–233.
44. Seiler R, Zurbrügg H. Supratentorialintracerebralhaemorrhageafter posterior fossaoperation. Neurosurgery. 1986; 18: 472–474.
45. Abouzari M, Rashidi A, Rezaii J, Esfandiari K, Asadollahi M, Aleali H, et al.(2007) The role of postoperative patient posture in the recurrence of traumatic chronic subdural haematoma after burr-hole surgery. Neurosurgery. 2007; 61: 794–797.
46. Day A, Friedman W, Sypert G, Mickle J. Successful treatment of normal perfusion pressure breakthrough syndrome. Neurosurgery. 1982; 11: 625–630.
47. Spetzler R, Wilson C, Weinstein P, Mehdorn M, Townsend J, Telles D. Normal perfusion pressure breakthrough theory.ClinNeurosurg. 1978; 25: 651–672.
48. Stanisic M, Lund-Johansen M, Mahesparan R. Treatment of chronic subdural haematoma by burr-hole craniostomy in adults: influence of some factor on postoperative recurrence.ActaNeurochir. 2005; 147: 1249–1257.
49. Fukumachi A, Koizumi H, Nagaseki Y, Nukui H. Postoperative extradural haematomas: computed tomographic survey of 1105 intracranial operations. Neurosurgery. 1986. 19: 589–593.
50. Touho H, Hirakawa K, Hino A, Karasawa J, Ohno Y. Relationship between abnormalities of coagulation and fibrinoylsis and postoperative intracranial haemorrhage in head injury. Neurosurgery. 1986; 19: 523–531.
51. Izumihara A, Ishihara T, Iwamoto N, Yamashita K, Ito H. Postoperative outcome of 37 patients with lobar intracerebralhaemorrhage related to cerebral amyloid angiopathy. Stroke. 1999; 30:29–33
52. Koizumi H, Fukumachi A, Nukui H. Postoperative subdural fluid collections in neurosurgery. Surg Neurol.1987; 27: 147–153.
53. Rohde V, Rohde I, Thiex R, Küker W, Ince A, Gilsbach J. The role of intraoperative magnetic resonance imaging for the detection of hemorrhagic complications during surgery from intracerebral lesions. An experimental approach. SurgNeurol. 2001; 56: 266–275.
54. Schwartz R, Hsu L, Wong T, Kacher D, Zamani A, Black P, et al. Intraoperative MR imaging guidance for intracranial neurosurgery: experience with the first 200 cases. Radiology. 1999; 211: 477–488.
55. Dickinson L, Miller L, Patel C, Gupta S. Enoxaparin increases the incidence of postoperative intracranial haemorrhage when initiated preoperatively for deep venous thrombosis prophylaxis in patients with brain tumours. Neurosurgery. 1998; 43:1074–1079.
56. Richards T, Hoff J. Factors affecting survival from acute subdural haematoma. Surgery. 1974; 75: 253–258.