Introducción
El propóleos es un producto natural elaborado y utilizado por la abeja melífera (Apis mellifera) en la construcción, adaptación y protección de la colmena1. Este material es duro y frágil si se encuentra frío, tornándose blando, flexible y pegajoso a medida que aumenta la temperatura2. Exhibe diferentes características debido a la variabilidad en su composición química, la que a su vez depende del origen geográfico, las fuentes vegetales y la época de recolección3)(4. Los principales componentes del propóleos son resinas y bálsamos (50 - 55 %), ceras (25 -35 %), aceites aromáticos y etéreos (10 %), polen (5 %) y sustancias orgánicas y minerales (5 %)5)(6)(7.
El propóleos es valorado desde la antigüedad por su acción antioxidante, bacteriostática, antifúngica y por las diversas propiedades terapéuticas que posee, estando su actividad biológica directamente relacionada con los contenidos de fenoles y flavonoides8)(9)(10. Es ampliamente utilizado en la industria farmacéutica, cosmética, veterinaria y alimentaria11. En el ámbito agrícola, se ha reportado la acción antifúngica del propóleos sobre distintos hongos fitopatógenos12)(13)(14.
En Argentina se pueden encontrar diferentes tipos de propóleos, ya que a lo largo del territorio existen una gran variedad de ambientes y especies vegetales15. Bedascarrasbure y otros16 consideran que, aun exhibiendo diferencias según la región, los propóleos argentinos presentan un elevado contenido de compuestos biológicamente activos. Estas características convierten a los propóleos en potencial materia prima para la elaboración de biofungicidas, herramientas promisorias para una agricultura de bajo impacto ambiental en numerosos cultivos de pequeña escala.
Con el fin de avanzar en el desarrollo de un biofungicida de uso agrícola, este trabajo tiene como objetivo caracterizar algunos parámetros relevantes de propóleos argentinos y su actividad antifúngica sobre el hongo fitopatógeno Penicillium sp., agente causal de la «mufa del ajo» (Allium sativum).
Materiales y métodos
Origen y caracterización de las muestras de propóleos
La información sobre el origen de las muestras de propóleos se resume en la Tabla 1. Dichas muestras fueron almacenadas al abrigo de la luz, a -15 ± 2 °C.
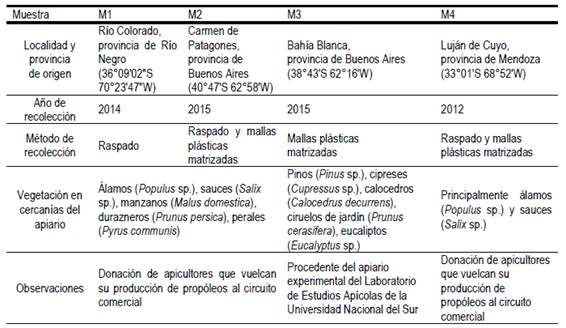
Tabla 1: Identificación y características del lugar de origen de las muestras de los propóleos argentinos estudiados.
La caracterización sensorial de los propóleos en bruto se realizó mediante un panel de diez personas semientrenadas que describieron el aroma, color, sabor, sensaciones en boca, aspecto, consistencia e impurezas visibles. Para ello, partes representativas de las muestras se colocaron en frascos de vidrio codificados, con tapa a rosca y se mantuvieron a 25 ± 2 °C durante las 72 h previas a la evaluación15.
Para realizar la caracterización físico-química de las muestras, se evaluaron los siguientes parámetros según la metodología propuesta por la norma IRAM-INTA 15935-1 de Propóleos en bruto: contenido porcentual de ceras, pérdidas por calentamiento y cenizas16. Asimismo, se estudió el punto de fusión adaptando la técnica descripta por Chaillou y otros17. Para esto se utilizó un microscopio integrado a una platina de calentamiento con termómetro de mercurio, sobre el que se colocó una fracción representativa de propóleos molido en un portaobjetos. Se registró el rango de temperaturas desde el comienzo hasta el final de la fusión y se estableció la temperatura media de fusión como el promedio entre ambas mediciones.
Elaboración y caracterización de los extractos hidroalcohólicos de propóleos
A partir de cada muestra de propóleos se elaboró un extracto hidroalcohólico (EH). Para esto se colocaron 15,0 g de propóleos molido en 150,0 ml de alcohol etílico al 70 % en volumen. La mezcla se llevó a estufa a 40 ± 2 °C, con agitación continua durante 24 h, y la solución resultante se filtró con papel Whatman n.° 40 para retener impurezas. Los extractos obtenidos se conservaron en frascos color ámbar, en un lugar oscuro y fresco.
Los EH se caracterizaron de acuerdo con la norma IRAM-INTA 15935-2 de Extractos de Propóleos16. Los parámetros medidos fueron: porcentaje de extracto seco, índice de oxidación, contenido de fenoles y flavonoides totales18. Las curvas de calibración para fenoles y flavonoides totales se hicieron con base en ácido gálico (98,0 % Sigma-Aldrich) y quercetina (95,0 % Sigma-Aldrich) respectivamente, y ambas mostraron coeficientes de regresión adecuados (R2 = 0,9975; R2 = 0,9997). Asimismo, se determinaron las absorbancias de cada extracto en un espectrofotómetro Lambda 265 UV-VIS utilizando cubetas de cuarzo19.
Evaluación in vitro de la actividad antifúngica de los extractos hidroalcohólicos de propóleos
Se realizó un ensayo para evaluar la actividad antifúngica de los extractos de propóleos sobre la germinación de conidios del hongo Penicillium sp. fitopatógeno de ajo. Se siguió la técnica del envenenamiento del medio de cultivo20 y se aplicaron siete tratamientos: cuatro correspondientes a los EH de propóleos descriptos (EH-M1, EH-M2, EH-M3, EH-M4); uno a base de un fungicida sintético comercial: Carbendazim SC 50 %, a razón de 2 mL.L-1 según las especificaciones de la Guía fitosanitaria para el control de la mufa del ajo en la República Argentina21; un control del solvente de los EH (alcohol al 70 %), y un control negativo sin agregados.
Los distintos productos se mezclaron en cajas de Petri a razón de 1,5 ml en 20 ml de medio de cultivo para Hongos y Levaduras (Britania, Argentina) fundido y enfriado hasta 45 °C. Una vez solidificado el agar, se diseminaron sobre su superficie 100 µL de una suspensión de esporas de 1.105 conidios mL-1 obtenida a partir de un cultivo monospórico y cuantificada con Cámara de Neubauer (Boeco, Alemania). Las cajas se incubaron a 25 ± 2 °C por 216 h. A las 72 y 144 h se cuantificó el número de conidios germinados presentes en cada tratamiento por observación directa bajo microscopio estereoscópico Nikon SMZ 745T22.
El diseño experimental fue completamente aleatorizado con cuatro réplicas por tratamiento.
Análisis estadístico de los datos
Se evaluaron las diferencias en los resultados de las determinaciones físico-químicas y en la caracterización antimicrobiana mediante análisis de la varianza (ANAVA). Para la comparación de medias se utilizó el test de Tukey. Los análisis estadísticos mencionados se realizaron con el software Infostat23.
Resultados
Los resultados de la caracterización sensorial de las muestras de propóleos en bruto se presentan en la Tabla 2a. En esta se observa que existe una gran similitud entre M1 y M2. El aroma dominante en las muestras del centro-sur de Argentina (M1, M2 y M3) fue el resinoso, mientras que M4 se diferenció por ser levemente químico. Todos los propóleos presentaron una coloración amarronada, con vetas amarillas, rojas o verdosas (Fig. 1). En cuanto al gusto, todas las muestras se percibieron amargas. La consistencia diferenció a M1, M2 y M4 (poco blandas) de M3 (dura). Los propóleos presentaron aspecto de trozos irregulares, siendo M1 y M2 opacos, M3 brilloso y M4 ligeramente brilloso. El contenido de impurezas visibles fue inferior al 5 % en todas las muestras, encontrando entre ellas astillas de madera, restos de panales y partes de abeja.

Figura 1: Muestras de propóleos (M) argentinos estudiados: Río Colorado (M1), Carmen de Patagones (M2), Bahía Blanca (M3), Luján de Cuyo (M4).
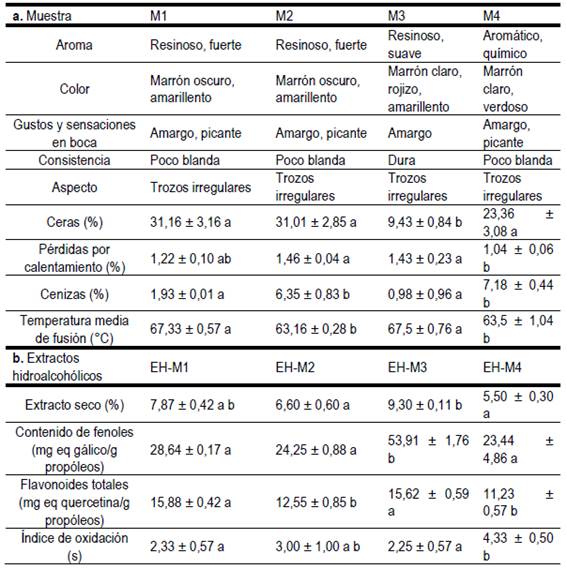
Tabla 2: Características sensoriales y físico-químicas de las muestras (a) y de los extractos hidroalcohólicos (b) de propóleos.
Los resultados de la caracterización físico-química de las muestras de propóleos se presentan en la Tabla 2a. En relación al contenido de ceras, M3 presentó valores significativamente menores que las otras muestras. Las pérdidas por calentamiento se encontraron en el rango de 1,04 a 1,46 %. Las determinaciones de cenizas y de la temperatura media de fusión diferenciaron estadísticamente a M1 y M3 de M2 y M4. Los rangos de temperaturas desde el comienzo hasta el final de la fusión (máximos y mínimos) de las muestras fueron: 61-73 °C para M1, 56-70 °C para M2, 64-71 °C para M3 y 62 - 65 °C para M4.
En la Tabla 2b se muestran los resultados de los análisis efectuados a los extractos hidroalcohólicos de propóleos. EH-M3 se destacó por presentar el valor más alto en las determinaciones de extracto seco y contenido de fenoles. La variable flavonoides totales diferenció a EH-M1 y EH-M3, por sus valores estadísticamente superiores, de EH-M2 y EH-M4. En cuanto al índice de oxidación, los extractos presentaron valores en el rango de 2 a 5 segundos.
Los análisis del espectro de absorción UV-Vis se presentan en la Figura 2. Todos los EH exhibieron un perfil de absorción con una banda amplia entre 240 nm y 340 nm, con máximos cercanos a los 290 nm y una banda levemente insinuada entre los 320 y 330 nm. Los picos más elevados correspondieron a EH-M1 y EH-M3.
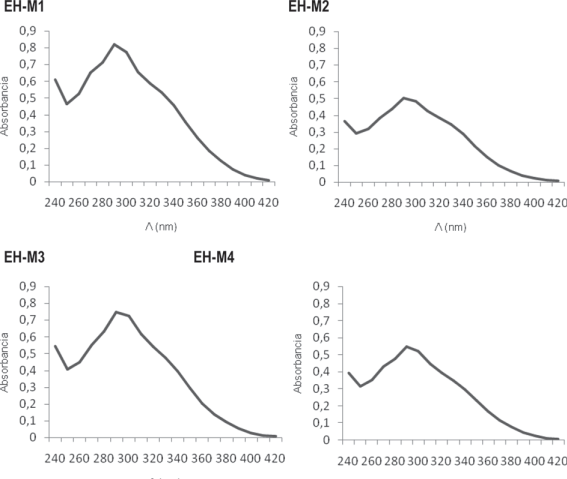
Figura 2: Espectro UV-VIS de los extractos hidroalcohólicos de propóleos estudiados: Río Colorado (EH-M1), Carmen de Patagones (EH-M2), Bahía Blanca (EH-M3), Luján de Cuyo (EH-M4).
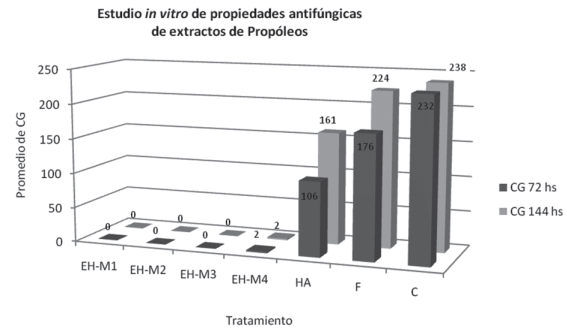
En el ensayo in vitro (Fig. 3), los tratamientos a base de extractos de propóleos mostraron un menor número de conidios germinados y se diferenciaron estadísticamente (p<0,05) de los demás. Las colonias fúngicas que se desarrollaron luego de las 72 h en EH-M4 presentaron una morfología diferente al testigo y menor diámetro.
Discusión
Los resultados del estudio sensorial (Tabla 2a) fueron consistentes con las descripciones reportadas en la bibliografía internacional, donde se menciona que las características de los propóleos de distintas regiones geográficas dependen de las resinas utilizadas en su elaboración7)(24. La semejanza que presentaron M1 y M2 es atribuible a un origen botánico similar y a una relativa cercanía geográfica (Tabla 1). La presencia de brillo y la dureza de M3 podrían deberse a la abundancia de especies coníferas en el entorno del colmenar. Estas observaciones fueron similares a las de Días y otros25, quienes encontraron que las muestras cuyo origen botánico incluía Pinus sp. presentaron una consistencia más dura que las que provienen de Populus sp.
La fracción ceras carece de compuestos fenólicos y de otras moléculas bioactivas, no obstante, su determinación resulta de interés, ya que un alto contenido de ceras indicaría un bajo contenido de resinas26. Todas las muestras analizadas en este trabajo presentaron valores comprendidos dentro de la tolerancia establecida por la norma IRAM-INTA 15935-1 de propóleos de Argentina (Tabla 2a), que fija un máximo del 35 % en peso. La muestra M3 se destacó por su bajo contenido de ceras, mientras que M4 presentó valores cercanos a los reportados por distintos autores27)(28)(29. El mayor contenido de ceras de M1 y M2 podría ser atribuido al método de cosecha utilizado y a la disponibilidad de resinas en la flora cercana al apiario (Tabla 1). De acuerdo con Vázquez30, el uso de mallas plásticas matrizadas, a diferencia de lo que ocurre con el raspado, evita la adición accidental de otros materiales al propóleos durante la recolección. Agra da Silva y otros31 mencionaron que las abejas adicionan mayor cantidad de ceras al propóleos cuando la oferta de resinas vegetales es baja.
Las pérdidas por calentamiento cuantifican fundamentalmente la evaporación de agua. El contenido de humedad es determinante en la preservación de los propóleos, ya que el exceso de agua puede conducir a reacciones de hidrólisis de las moléculas bioactivas y favorecer el crecimiento de microorganismos32. Los valores de las muestras analizadas en este trabajo (Tabla 2a) fueron inferiores a los obtenidos por otros autores16)(33)(34. Esto podría deberse a que provienen de regiones áridas y a que el período de almacenamiento en un ambiente seco fue relativamente largo.
En cuanto al contenido de cenizas, las muestras M1 y M3 presentaron porcentajes bajos, inferiores al 2 %(Tabla 2a), y cercanos a lo reportado por distintos autores15)(35. Los valores de M2 y M4 fueron notablemente más elevados. Angulo Vaca36 encontró porcentajes superiores al 6 % y los atribuyó a que en determinadas ocasiones las abejas adicionan lodo, maderas, etc., al propóleos para brindarle mayor consistencia.
La consistencia del propóleos a temperatura ambiente es una característica valorada desde el punto de vista comercial. La mayoría de las muestras pasan al estado líquido entre los 60 y 70 °C17)(37, tal como se observó en nuestro estudio (Tabla 2a). Es destacable que muestras con temperaturas medias de fusión muy similares (M1-M3 y M2-M4) presentaron diferente amplitud en los rangos de fusión.
El extracto seco de todas las soluciones hidroalcohólicas de propóleos analizadas fue inferior al 10 % de peso en volumen (Tabla 2b), valores cercanos a los reportados por otros autores que utilizaron el mismo solvente38)(39. En este sentido, Talero y otros39 describen que las extracciones con etanol al 70 % muestran valores promedio de extractos secos menores a los obtenidos con etanol al 96 %. Esto contribuye a explicar que los resultados de este estudio estén por debajo de los umbrales establecidos por las normas para extractos etanólicos de Argentina y de Brasil, que fijan un mínimo del 10 y 11 %, respectivamente. La elección de hidroalcohol queda respaldada por los estudios de Da Silva Frozza y otros40, Miguel y otros41 y Woisky y Salatino42, que indican que este extractante es capaz de solubilizar fenoles y distintos compuestos bioactivos en cantidades considerables, siendo menos tóxico que otros solventes.
Los fenoles y flavonoides del propóleos son los mayores responsables de su actividad biológica43. Los resultados del contenido de fenoles y de flavonoides totales de EH-M1, EH-M2 y EH-M4 (Tabla 2b) fueron acordes con los reportados por otros autores17)(44)(45. El extracto EH-M3 se diferenció y se destacó por su elevado contenido de fenoles, que podría atribuirse a la gran diversidad de especies forestales presentes en cercanías del apiario que pudieron ser fuentes de resinas de M346. Si bien estos valores no son directamente comparables con las normas para extractos etanólicos, los niveles obtenidos en los propóleos analizados fueron notablemente superiores al mínimo establecido por las normas de Argentina y Brasil, que es del 0,25 % para ambos parámetros.
Los índices de oxidación (Tabla 2b) fueron inferiores a los resultados reportados por otros autores para extractos de distintos orígenes15)(36. Este parámetro es uno de los indicadores de la calidad del propóleos, ya que mantiene una relación inversamente proporcional al contenido de compuestos fenólicos47.
La espectrofotometría UV (Fig. 2) permitió confirmar la presencia de compuestos fenólicos en los extractos. Las curvas fueron similares a las obtenidas por Bedascarrasbure y otros19 para propóleos de las mismas regiones.
Los resultados del ensayo in vitro referido al control de Penicillium sp. (Fig. 3) mostraron que bajo la aplicación de los extractos hidroalcohólicos de propóleos la germinación de conidios de este hongo fitopatógeno es menor, pese a las diferencias físico-químicas presentes entre los mismos. En este sentido, Bankova48 y Kujumgiev y otros10 sostienen que las propiedades biológicas de los propóleos suelen ser similares, a pesar de tener un origen botánico diferente.
Las diferencias observadas entre el número de conidios germinados de los extractos y el control de hidroalcohol confirman que la actividad antifúngica observada es atribuible al propóleos y no al extractante.
Conclusiones
Los propóleos analizados en este trabajo presentaron diferentes características sensoriales y físico-químicas, sin embargo, coincidieron en la excelente actividad antifúngica sobre el hongo Penicillium sp. Los resultados demuestran la potencialidad de diversos propóleos para el tratamiento y control de fitopatógenos. Esto permitiría avanzar hacia el desarrollo de biofungicidas agrícolas formulados a base de propóleos.