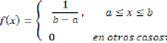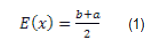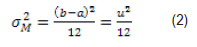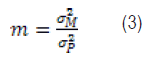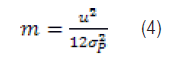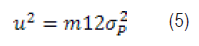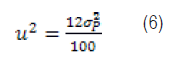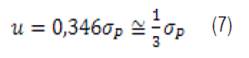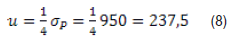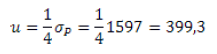Introducción
Las parasitosis gastrointestinales (PGI) causadas por nematodos constituyen una de las principales limitantes sanitarias y económicas de la producción ovina en sistemas pastoriles1. Su control ha dependido del tratamiento con productos antihelmínticos. Esta estrategia ha resulta-do en el desarrollo de resistencia de los parásitos a los productos utilizados, y la consiguiente pérdida de efectividad. Las consecuencias de las PGI sobre la producción ovina varían de acuerdo a la severidad del efecto del pará-sito considerado, la carga parasitaria, la categoría ovina considerada, y el estado nutricional y fisiológico. Castells y otros2 determinaron que en Uruguay el impacto en corderos puede alcanzar hasta un 50 % de mortandad, afectar en un 24 % la evolución del peso vivo y reducir en un 29 %la producción de lana. Estos autores estimaron que si no se aplicase ningún control de parásitos internos, las pérdidas económicas alcanzarían anualmente U$S 41 millones, solamente contabilizando la disminución en producción de lana. En otros países, las pérdidas son igualmente alarmantes (Australia U$S 123 millones, India U$S 81 millones3).
Los métodos para la determinación de la resistencia genética se clasifican en directos, a través de la genética molecular (estudio del complejo principal de histocompa-tibilidad (MHC)), o indirectos basados en la expresión fenotípica de la resistencia. Esta última se puede determinar directamente mediante la estimación de la carga parasitaria a través de la identificación y conteo de parásitos. También puede estimarse indirectamente a través del conteo de huevos por gramo (HPG) en la materia fecal, y por estudio del hematocrito (titulación de anticuerpos, estudio de antígenos linfocitarios ovinos y conteo de eosinófilos). El método más difundido para la identificación de ovinos resistentes es el conteo de huevos de parásitos por gramo de materia fecal4.
Para medir HPG la técnica utilizada es la de Mac Master modificada4. En el contexto de este trabajo llamamos ‘precisión’ a la diferencia entre dos valores consecutivos de medición. La precisión utilizada más comúnmente es de 100 HPG (i.e. los registros toman los valores 0, 100, 200, y así sucesivamente). Para evitar un porcentaje alto de contajes de «cero», algunos laboratorios aumentan la precisión a 50 HPG o menos.
La pregunta que surge es: ¿con qué precisión es aconsejable tomar el registro de HPG? Es válido preguntarnos si un conteo más preciso (intervalos de menor magnitud) sería beneficioso, o si un conteo menos preciso sería per-judicial por aumentar el porcentaje de ceros y reducirse la capacidad de discriminación entre animales que caen entre mediciones consecutivas. El objetivo de este trabajo es efectuar una serie de consideraciones que provean un marco lógico para decidir con qué precisión se debe medir una característica, prestando especial atención a HPG.
Materiales y métodos
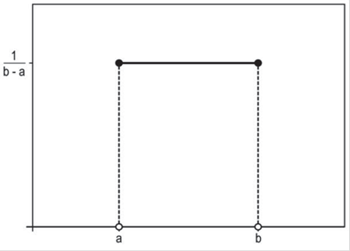
Siempre que realicemos una medición con un instrumento o técnica, estaremos suponiendo un cierto error de medición, la misma no será perfecta. La distribución uniforme (conocida también como distribución rectangular por el aspecto de su función de densidad) es un buen modelo para describir el error de medición (distribución de la probabilidad que tienen los distintos valores comprendidos entre dos unidades de la escala en una determinada medición, Figura 1)5)(6)(7. La distribución uniforme es útil para describir una variable aleatoria con probabilidad constante sobre el intervalo (a,b) en el que está definida, y se denota por U(a,b). Una peculiaridad importante de esta distribución es que la probabilidad de un suceso de-pende exclusivamente de la amplitud del intervalo considerado y no de su posición en el campo de variación de la variable.
La función de densidad de la distribución uniforme es definida por:
Usando la definición de valor esperado se llega a:
De acuerdo a la fórmula de varianza podemos derivar ese parámetro para la distribución del error de la medición como:
donde u es la precisión con que se mide el carácter en cuestión (por ejemplo 1/10 kg, o 1/100 kg, o 100 HPG).
Llamemos m a la relación entre varianza del error de medición (σ2M) y la varianza fenotípica de la característica (σ2P);
Sustituyendo la ecuación (2) en la (3) obtenemos:
Reordenando la ecuación (4) surge:
Supongamos que queremos que la varianza debida al error de medición sea 100 veces menor que la varianza fenotípica de la característica, o sea que m = 1/100.
Sustituyendo dicho valor de m en la ecuación (5) obtenemos:
De la ecuación (6) podemos despejar la precisión con que se mide el carácter en cuestión como:
Por lo tanto, la precisión tal como la definimos, con el requisito que la varianza del error sea un centésimo de la varianza fenotípica total, es aproximadamente un tercio del desvío estándar fenotípico del carácter. He aquí entonces un criterio para decidir qué precisión necesitamos para registrar determinada característica. Nótese que lo que importa es la dispersión de la variable (σP) y no la media. Las ecuaciones presentadas se pueden usar con otros valores, más o menos exigentes de m.
Resultados y discusión
Las técnicas que se utilizan en los laboratorios que prestan el servicio de medición de HPG lo miden con una precisión de 100 y en algunos casos de 50 HPG. No existe actualmente un criterio definido para determinar con qué precisión se debe realizar el conteo de HPG. En la sección anterior llegamos a la conclusión de que para un valor de m bastante exigente (1/100), la precisión solo necesita ser de alrededor de 1/3 del desvío estándar feno-típico del carácter. A continuación presentamos ejemplos numéricos ilustrando cómo proceder a efectos de decidir con qué precisión debemos realizar el conteo de HPG.
Supongamos que contamos con un cúmulo de re-gistros de HPG que nos permiten estimar los paráme-tros media y desvío estándar para esta característica (Cuadro 1).
Usando el valor del desvío estándar de HPG arriba presentado en primer término, y aumentando la exigencia para que en lugar de que la precisión sea un tercio del desvío estándar fenotípico, esta sea de un cuarto del des-vío estándar fenotípico; la precisión necesaria para el con-teo de HPG sería:
Por lo tanto, para HPG, medir con una precisión de unos 200 huevos por gramos es suficiente dado el desvío estándar de la característica en este ejemplo. Podemos repetir el ejercicio usando los datos de Goldberg y otros8. En este caso, con una exigencia de un cuarto del desvío estándar fenotípico; la precisión necesaria en el conteo de HPG sería:
Medir con una precisión de unos 400 huevos por gramo aproximadamente sería suficiente dado el desvío estándar de la característica.
La precisión usada en general de 100 HPG correspondería a valores de ꭒ obtenidos multiplicando σP por 1/10 y 1/16 aproximadamente, para los dos ejemplos presenta-dos, respectivamente. Estos valores son marcadamente menores que lo indicado (1/3) por la Ecuación (7), y co-rresponden a valores de m de aproximadamente 1/1000 y 1/3000 para los dos ejemplos, respectivamente, siendo excesivamente pequeños.
Conclusión
Desde el punto de vista estadístico los cálculos presen-tados indican que la práctica común de conteo de HPG en intervalos de 100 es de suficiente precisión dado el desvío estándar del carácter. Desde el punto de vista de la mejora genética es mejor pensar en registrar muchos animales y repetir registros para aumentar la exactitud de la evalua-ción genética, que en aumentar innecesariamente la pre-cisión de cada medición (por ejemplo, pasar de intervalos de 100 HPG a intervalos de 50 o de 10), especialmente si esto requiere más trabajo y costo.