Introducción
La citricultura en el Uruguay tiene un enfoque exportador, que se ha consolidado en los últimos 25 años. De las especies producidas, las mandarinas han presentado el mayor aumento en este período, tanto en superficie cultivada como en producción. El grupo de mandarinas Satsuma tuvo una fuerte expansión en la década de 1990, estabilizándose durante la década de 2000 y alcanzando en 2016 una superficie de 1.079 ha y una producción de 21.090 toneladas (DIEA, 2003, 2006, 2017). Estas mandarinas son las de maduración más temprana y alcanzan la madurez fisiológica cuando su cáscara aún mantiene el color verde. Por tanto, para su exportación es imprescindible desverdizarlas (Pons et al., 1992, Goldschmidt, Huberman y Goren,1993).
Esta técnica, que consiste en la aplicación de etileno (C2H4), acelera la pérdida de lorofilas (Shimokawa, Shimada y Yaeo, 1978, Katz et al., 2004) y la síntesis de carotenoides coloreados en la cáscara (Rodrigo y Zacarías, 2007), sin afectar otros parámetros vinculados al proceso de maduración tales como síntesis de azúcares y degradación de ácidos. (Mayuoni et al., 2011). El C2H4 es una hormona promotora de la senescencia, por lo que su aplicación en planta de empaque también la promueve, con la consecuente aparición de desórdenes fisiológicos y podredumbres causadas por hongos (Eckert y Eaks, 1989; Porat et al, 1999; Plaza et al., 2004; Cronjé, Barry y Huysamer, 2011).
Sin embargo, se ha propuesto un efecto protector de este fitorregulador frente al estrés (Yang y Hoffman, 1984), disminuyendo la incidencia de daños causados por frío en naranja ‘Navelate’ (Lafuente, Sala y Zacarías, 2004) y el colapso de la corteza en naranjas ‘Navelina’ y ‘Navelate’ (Lafuente y Sala, 2002). Esta respuesta se ha asociado al estímulo del metabolismo fenólico en la cáscara de los frutos y probablemente a la activación de mecanismos adicionales de defensa (Cajuste y Lafuente, 2007). Por otro lado,el incremento de H2O2 y metabolitos relacionados al estrés tales como ornitina, prolina, GABA, d-xylosa y d-galactosa, ha sido asociado a un mejor comportamiento postcosecha de frutos de mandarina Satsuma tratados con brasinosteroides (Zhu et al., 2015).
La mayoría de los desórdenes fisiológicos que afectan la cáscara de los cítricos se asocia a aspectos genéticos y nutricionales, y a la concentración individual y relación entre concentraciones de las diferentes hormonas, así como a las condiciones ambientales ocurridas durante el desarrollo y maduración de los frutos y/o durante su almacenamiento (Agustí, 1999; Agustí, Almela y Juan, 2004; Kruger et al., 2004; Porat et al., 2004; Magwaza et al., 2013). La complejidad en el estudio de los desórdenes se debe a que un mismo factor puede afectar de manera diferente a los frutos, así como a varios factores que pueden inducir una sintomatología similar en estos, lo que dificulta identificar una causa específica que promueva el desarrollo de cada desorden. En general los desequilibrios hídricos y nutricionales relacionados a las condiciones ambientales incrementan la susceptibilidad de los frutos al momento de la cosecha (Agustí, Almela y Juan, 2004).
En el caso de las mandarinas, uno de los principales desórdenes reportados no relacionado a las bajas temperaturas es el colapso de la corteza (non-chilling rind breakdown). De acuerdo a Van Rensburg et al. (2006) y Cronjé, Barry y Huysamer (2011), este desorden que afecta principalmente a las mandarinas Clementinas y en menor medida a las Satsumas, se manifiesta como manchas de color marrón distribuidas en el flavedo, y se asocia a largos períodos de almacenamiento. El daño celular se hace evidente en las capas subepidérmicas del flavedo y en el área adyacente a las glándulas de aceite, lo que puede provocar su colapso con la consecuente fitotoxicidad del tejido, mientras que la epidermis permanece inalterada. El desorden se relaciona con las condiciones ambientales durante la precosecha y particularmente con la posición del fruto en el árbol, siendo los más afectados los ubicados en el interior. Sin embargo, un manchado similar fue descrito en mandarina Satsuma por Zócalo (2009), con una mayor incidencia en los frutos ubicados en el exterior de la copa.
Por otro lado, las naranjas de ombligo son propensas a desarrollar otro tipo de colapso de la corteza (rind breakdown o rind staining), que puede manifestarse a partir del cambio de color (Agustí et al., 2001), o durante el almacenamiento (Lafuente y Sala, 2002). Este desorden se asocia a la pérdida de agua de las células situadas en la zona de unión del flavedo con el albedo, que avanza hacia el exterior alcanzando la epidermis y hacia el interior afectando las capas más profundas del albedo. La morfología de las ceras, el grosor y la permeabilidad de la cutícula no son afectadas en este caso. La manifestación del desorden coincide con días de alta temperatura, baja humedad relativa (HR) y alta tasa de evapotranspiración, seguido de un período de baja temperatura, alta HR y baja evapotranspiración (Agustí et al., 2001). A diferencia de lo que ocurre con las Clementinas, la mayor proporción de frutos afectados se ubica en el exterior del árbol y en la cara externa del fruto (Agustí, Almela y Juan, 2004).
En Uruguay, en los últimos años se ha detectado durante la etapa postcosecha de mandarina Satsuma ‘Okitsu’, un manchado con características diferentes a las mencionadas anteriormente, que a nivel productivo se denomina ‘mancha mapa’. De acuerdo a la información proporcionada por la empresa Samifruit S.A., algunos años el porcentaje de frutos afectados alcanzó el 20 %, llegando incluso al rechazo completo de la partida. Estudios anatómicos en este tipo de manchas han demostrado que incluso dos meses antes de la cosecha se observan en el parénquima subepidérmico los primeros síntomas microscópicos en células, que pierden su turgencia debido al colapso del citoplasma. En etapas más avanzadas de la afección, las células epidérmicas presentan el contenido citoplasmático contraído, pero la cutícula no se ve afectada (Da Luz et al., 2014). Su incidencia es variable entre plantaciones y años, y se desconocen las causas que lo provocan. Considerando dichos antecedentes, el objetivo de este trabajo fue estudiar el efecto de factores precosecha y del manejo postcosecha, en la incidencia y severidad del manchado de frutos de mandarina Satsuma ‘Okitsu’ en las condiciones de Uruguay.
Materiales y métodos
Los experimentos se realizaron durante cuatro años consecutivos en un establecimiento comercial ubicado en la zona de Chapicuy (Uruguay, 31º 40’ S, 57º 52’ W), en un cuadro de mandarina Satsuma ‘Okitsu’ (Citrus unshiu Marc.), injertada sobre ‘Trifolia’ (P. trifoliata (L.) Raf.), en condiciones de fertirriego. Los registros del cuadro indicaban una incidencia entre 6 % y 20 % de frutos manchados en los últimos cuatro años. En la floración, se seleccionaron cuatro parcelas de cinco plantas homogéneas y en buen estado sanitario. Al alcanzar la madurez comercial (9/03, 14/03, 13/3 y 18/3, en los cuatro años de estudio respectivamente), se cosecharon frutos de color y tamaño homogéneo (relación a/b entre -0,20 y -0,15 CIELab y diámetro ecuatorial entre 55 mm y 65 mm).
Descripción anatómica del manchado
La descripción anatómica del desorden se realizó seleccionando frutos manchados luego de ser desverdizados durante 96 h (1-3 mg L-1 de C2H4, CO2 < 0 ,2 %, 18-22 ºC de temperatura (T) y 90-95 % HR), encerados, almacenados en frío durante 30 días (T: 4-8 ºC, HR > 90 %, CO2 < 0,5 %) y luego de 15 días de vida de mostrador (T media 15 °C, HR media 82 %). Se realizaron cortes de cáscara de zonas sanas y manchadas de cuatro frutos por parcela, seccionando trozos de 1-2 cm x 1-3 cm que se fijaron en una solución de formol, ácido acético y alcohol al 70 % (FAA, 5:5:90 v/v) hasta el procesamiento del material (Da Luz et al., 2014). Luego se realizaron cortes a mano alzada en micrótomo de rotación (American Optical Corp. Spencer 820 microtone, USA) de trozos de aproximadamente 0,5 cm x 0,5 cm del material fijado en FAA, que se incluyeron en parafina mediante la técnica clásica, utilizando vaselina como intermediario (Johansen, 1940; Locquin y Langeron, 1985) y Haupt como adhesivo para el pegado (30 °C durante 2 h).
El desparafinado se realizó con xilol I por 5 min, xilol II también por 5 min. Las muestras se colorearon con la doble coloración de Safranina-Fast Green (EtOH 100° 5 min, EtOH 70° 5 min, EtOH 30° 5 min, agua destilada 5 min, Safranina 10 min, agua destilada I 5 min, agua destilada II 5 min, EtOH 50° 5 min, EtOH 95º 5 min, EtOH I 100° 5 min, EtOH II 100° 5 min, Fast Green 4 s, aceite de clavo 10 s, mezcla aclarante 20 s., xilol I 5 min, xilol II 5 min) y se montaron en Bálsamo de Canadá. La observación de los preparados se realizó en microscopio óptico (Nikon E100, Japón) y se capturaron imágenes con máquina digital (Nikon Coolpix P5100, Japón).
Zona de manifestación del daño y grosor de cáscara
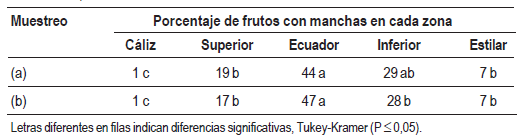
Durante los dos primeros años, a los 30 días de almacenamiento y luego de 15 días de vida de mostrador se seleccionaron tres frutos por parcela y por tratamiento en los que se midió, mediante un calibre digital (Mitutoyo Sul América Ltd., Brasil), el grosor de la cáscara en la zona del ecuador de frutos sanos y de zonas sanas y manchadas de frutos manchados. En el segundo año a los 30 días de almacenamiento y luego de 15 días de vida de mostrador, se evaluó la zona de aparición del daño en 180 frutos, definiendo las siguientes ubicaciones: cáliz, superior, ecuador, inferior y estilar.
Efecto del desverdizado y encerado de frutos
En los dos primeros años, los frutos provenientes de cada parcela se dividieron en cuatro tratamientos: Testigo (T: sin desverdizar, ni encerar), Encerado (E), Desverdizado (D), Desverdizado + Encerado (D+E). Se colocaron 100 frutos por caja (parcela de campo), totalizando 400 frutos por tratamiento.
El desverdizado se realizó en las siguientes condiciones: 1-3 mg L-1 de C2H4, CO2 < 0,2 %, 18-22 ºC de T y 90-95 % de HR, durante 72 h el primer año y 96 h en el segundo. En el primer año, los frutos no desverdizados permanecieron a temperatura ambiente (21-26 °C) y HR (60-70 %) ambiente durante las 72 h que tardó el desverdizado de los demás tratamientos (T-HR ambiente y T-HR controlada, respectivamente), mientras que a partir del segundo año los frutos no desverdizados se almacenaron en una cámara con la misma temperatura y HR que los desverdizados.
El encerado se realizó con cera comercial (18 % de sólidos solubles totales en base a 86 g L-1 de cera de polietileno y 56 g L-1 de goma laca) y se aplicó en línea de empaque convencional mediante pulverización sobre rodillos de cerdas de nylon. El almacenamiento se realizó durante 30 días a 4-8 ºC, HR > 85 % y CO2 < 0,5 %; posteriormente los frutos se mantuvieron a temperatura ambiente simulando la vida de mostrador durante siete días en el año 1 (T media 18,8 °C, HR media 84 %) y 15 días en el año 2 (T media 15 °C, HR media 82 %). El porcentaje de frutos manchados (incidencia) se evaluó a los 15 y 30 días de almacenamiento y luego del período de vida de mostrador.
Efecto de las condiciones ambientales en la incidencia de frutos manchados
Durante los cuatro años se registraron con pluviómetro las precipitaciones diarias ocurridas durante todo el ciclo de desarrollo y crecimiento de los frutos, y la temperatura y HR desde la última semana de diciembre hasta la cosecha con sensores (HygrochronTM, iButton DS-1923G-F5, Dallas Semiconductors, USA), colocados en el interior de la copa de dos plantas y programados para el registro horario. La incidencia del manchado a los 30 días de almacenamiento, se evaluó en frutos desverdizados y encerados en las condiciones de planta de empaque descriptas anteriormente.
Diseño estadístico
El diseño experimental fue de bloques completos al azar con cuatro repeticiones de cinco árboles en el campo y en postcosecha, 100 frutos por repetición y fecha de evaluación para cada tratamiento. La proporción de frutos afectados (incidencia) se analizó ajustando modelos lineales generalizados, asumiendo distribución binomial con función de enlace logit (Ln [p/(1-p)] y pruebas de tipo Wald para los efectos fijos, con separación de medias por Tukey-Kramer. El número de frutos manchados en cada zona se analizó ajustando modelos lineales generalizados, asumiendo distribución Poisson con función de enlace logaritmo natural [Ln (μ)] y separación de medias Tukey-Kramer (p ≤ 0,05). El efecto del tratamiento en la zona de aparición del desorden se analizó con la prueba Mantel-Haenszel Chi-Cuadrado, comparando perfiles de distribución de frecuencias. El grosor de cáscara se analizó mediante modelos lineales generales y la separación de medias se realizó mediante prueba Tukey-Kramer (p ≤ 0,05).
El primer año, atendiendo las diferencias en temperatura y HR entre los frutos que fueron o no desverdizados, el efecto del encerado se analizó anidado dentro de cada nivel. El segundo año se realizó un análisis con arreglo factorial de ambos factores (desverdizado, encerado y su interacción) en cada fecha de evaluación.
Resultados
Descripción anatómica del manchado
A los 15 días de almacenamiento comenzó a visualizarse el daño en la cáscara de algunos frutos (Figura 1A). Inicialmente se observó, entre las glándulas de aceite, una zona irregular de color pardo o marrón, que con el paso del tiempo avanzó en superficie y se oscureció (Figura 1 A-C). Finalmente, luego de la vida de mostrador, en los casos más severos dicha zona del tejido se deprimió.

Figura 1: Frutos manchados de mandarina Satsuma ‘Okitsu’, año 1: A) 15 días de almacenamiento (T 4-8 ºC, HR > 90 %, CO2 < 0,5 %), B) 30 días de almacenamiento y C) 30 días de almacenamiento + 7 días de vida de mostrador (T media 18,8 °C, HR media84 %).
Al observar microscópicamente el tejido en la zona manchada luego de 30 días de almacenamiento y 15 de vida de mostrador, se detectó que el desorden celular se ubicaba fundamentalmente en la zona subepidérmica (Figura 2 B y C) donde se observaron células con el contenido citoplasmático colapsado o retraído, teñidas intensamente de rojo con safranina, indicando la presencia de compuestos lipídicos (cutina, suberina, lignina, quitina). En las zonas más afectadas, las células parenquimáticas subyacentes presentaron el mismo deterioro que las células sub-epidérmicas; las células de la epidermis también colapsaron, mientras que la cutícula permaneció intacta. También se observó una pérdida en la integridad del tejido parenquimático, con un menor volumen celular y compactación del tejido desde etapas tempranas del daño (Figura 2 B y C). Las células del albedo no fueron afectadas.

Figura 2: Corte transversal de la cáscara de mandarina Satsuma ‘Okitsu’ a los 30 días de almacenamiento (T 4-8 ºC, HR > 90 %, CO2 < 0,5 %) y 15 días de vida de mostrador (T media 15 °C, HR media 82 %), donde se observa: A) tejido sano, B) tejido levemente dañado con células colapsadas y pérdida de contenido celular en la zona sub-epidérmica y C) tejido con daño severo, con células de la epidermis y zona sub-epidérmica colapsadas, células comprimidas por pérdida de turgencia y cutícula intacta. C: cutícula, E: epidermis, SE: sub-epidermis.
Zona del fruto afectada
El daño se manifestó en diferentes zonas del fruto, pudiendo abarcar más de una de las zonas evaluadas (Cuadro 1). Las zonas más frecuentemente dañadas fueron la ecuatorial (44-47 % de los frutos manchados) y la inferior (28-29 %). La zona del cáliz fue la menos afectada, alcanzando solamente 1 % de los frutos manchados.
Grosor de cáscara
En términos generales, en los dos años en que se estudió la posible asociación del desorden con el grosor de cáscara, los frutos manchados presentaron la cáscara más delgada que los sanos, alcanzando significancia estadística el segundo año (Cuadro 2). Adicionalmente, en frutos con mancha, la zona afectada de la cáscara siempre fue más delgada que la zona sana.
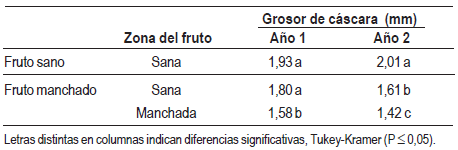
Cuadro 2: Grosor de cáscara en frutos sanos y manchados de mandarina Satsuma ‘Okitsu’después de 30 días de almacenamiento (T 4-8 ºC, HR > 90 %, CO2 < 0,5 %) más 7 días de vida de mostrador (T media 18,8 °C, HR media 84 %), (año 1) y más 15 días de vida de mostrador (T media 15 °C, HR media 82 %), (año 2).
Efecto de las condiciones ambientales en la incidencia de frutos manchados
La incidencia de frutos manchados varió entre años, alcanzando en los frutos desverdizados y encerados a los 30 días de almacenamiento, el 17 % el primer año, el 7 % el segundo año y sin aparición de mancha en los últimos dos años. Las precipitaciones ocurridas durante cada ciclo de crecimiento y desarrollo de los frutos, desde el mes de setiembre hasta el momento de la cosecha en el mes de marzo, presentaron diferencias entre las temporadas.
En el primer año las precipitaciones totales fueron notoriamente menores (420 mm) que en los tres años siguientes (857 mm, 1138 mm y 771 mm, respectivamente), (Figura 3). Adicionalmente, durante los 10 días previos a la cosecha, en el primer año prácticamente no se registraron precipitaciones, mientras que en los años posteriores fueron superiores a 30 mm (datos no presentados).
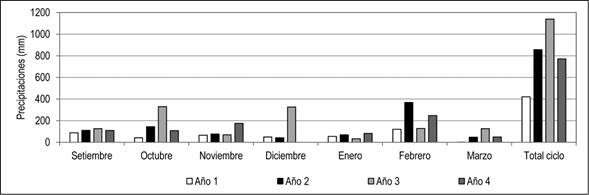
Figura 3: Precipitaciones (mm) registradas durante el ciclo productivo (floración-cosecha) en los cuatro años.
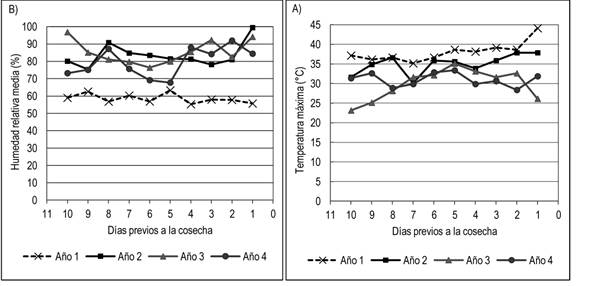
La temperatura media y mínima tuvieron leves variaciones entre temporadas (datos no presentados). Sin embargo, la temperatura máxima en los últimos 10 días del ciclo fue superior el primer año, superando en algunos días los 40 °C (Figura 4 A), con un promedio de 38 °C. Los dos últimos años, en los que no se registró manchado, la temperatura máxima en el período no superó los 35 °C, alcanzando promedios de 30 °C y 31 °C, respectivamente. La HR media diaria durante la primera temporada fue menor en comparación con las siguientes. Esta tendencia se acentuó en los últimos 10 días previos a la cosecha (Figura 4 B), promediando en dicho lapso, 59 %, 84 %, 85 % y 80 %, en los cuatro años respectivamente.
Efecto del desverdizado y encerado de frutos
Año 1. En la cosecha y luego del desverdizado no se observaron frutos manchados. La aparición del desorden recién se hizo evidente a partir de los 15 días de almacenamiento. El manchado se incrementó con el tiempo de almacenamiento y luego de siete días de vida de mostrador. Los tratamientos sin desverdizar, cuyos frutos permanecieron a temperatura y HR ambiente durante las 72 h que duró el desverdizado de los demás tratamientos, presentaron desde los 15 días de almacenamiento un porcentaje significativamente mayor de frutos manchados que los desverdizados. Esta diferencia se mantuvo durante toda la vida postcosecha (Figura 5).
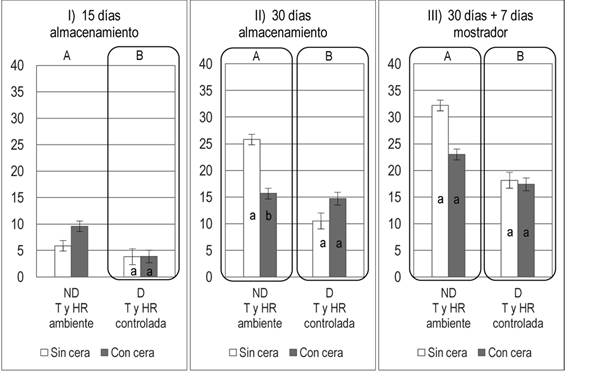
Figura 5: Efecto del encerado de frutos de mandarina Satsuma ‘Okitsu’ en el porcentaje de frutos manchados según condición previa al almacenamiento (72 h): ND (no desverdizado: T y HR ambiente, T 21-26 °C, HR 60-70 %) y D (desverdizado, T y HR controlada: 1-3 mg L-1 de C2H4, CO2< 0,2 %, T 18-22 ºC, HR 90-95 %), a los 15 (I) y 30 (II) días de almacenamiento (T 4-8 ºC, HR > 90 %, CO2 < 0,5 %) y luego de 7 días (III) de vida de mostrador (T media 18,8 °C, HR media 84 %), año 1. Letras diferentes indican diferencias significativas, Tukey-Kramer (P ≤ 0,05): letras mayúsculas indican el efecto de la condición previa al almacenamiento (ND y D), letras minúsculas indican el efecto encerado, anidado dentro de cada nivel de D.
En los frutos no desverdizados, la aplicación de cera disminuyó significativamente (P ≤ 0,05) la incidencia del manchado a los 30 días de almacenamiento, manteniéndose esa tendencia a los siete días de vida de mostrador. Por el contrario, en los frutos desverdizados, la aplicación de ceras no provocó diferencias significativas en la incidencia durante todo el período de estudio.
Año 2. La evolución de la incidencia presentó un comportamiento similar a la del primer año, aunque con valores menores en todos los tratamientos (Figura 6). Sin embargo, este año, controladas las condiciones ambientales previas a la entrada a cámara, no se encontraron diferencias significativas entre tratamientos para la combinación desverdizado y encerado a los 30 días de almacenamiento. No hubo interacción entre tratamientos de encerado y desverdizado en ninguna de las fechas evaluadas (P≤ 0,05). A los 15 días de vida de mostrador, el tratamiento de desverdizado no afectó la incidencia de frutos manchados, mientras que el encerado la redujo significativamente (Figura 7).
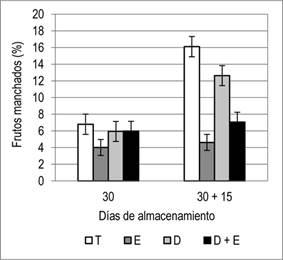
Figura 6: Evolución del manchado de frutos de mandarina Satsuma ‘Okitsu’, durante el almacenamiento (30 días) y luego de 15 días de vida de mostrador (30 + 15), expresado en porcentaje de frutos manchados de acuerdo a los tratamientos de desverdizado y encerado, año 2. T: Testigo, E: Encerado, D: Desverdizado, D + E: Desverdizado y Encerado. Condiciones de desverdizado: 1-3 mg L-1 de C2H4, CO2 < 0,2 %, T 18-22 ºC, HR 90-95 %, almacenamiento: T 4-8 ºC, HR > 90 %, CO2 < 0,5 % y mostrador: T media 15 °C, HR media 82 %.
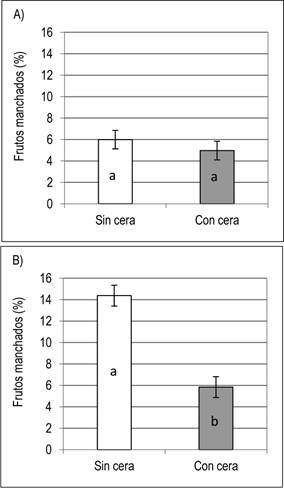
Figura 7: Efecto del encerado de frutos en la incidencia del manchado de mandarina Satsuma ‘Okitsu’, año 2. A) A los 30 días de almacenamiento y B) a los 30 días de almacenamiento más 15 días de vida de mostrador. Condiciones de desverdizado: 1-3 mg L-1 de C2H4, CO2 < 0,2 %, T 18-22 ºC, HR 90-95 %, almacenamiento: T 4-8 ºC, HR > 90 %, CO2 < 0,5 % y mostrador: T media 15 °C, HR media 82 %. Letras diferentes en cada gráfico indican diferencias significativas, Tukey-Kramer (p ≤ 0,05).
Discusión
La presencia de diferentes tipos de manchas en la cáscara de los frutos cítricos como respuesta a factores abióticos ha sido reportada en varias especies y cultivares (Cohen, Shalom y Rosenberger, 1990; Almela, Agustí y Juan, 1992; Vercher et al., 1994, Petraceck, Wardowski y Brown, 1995; Petraceck, Dou y Pao, 1998; Agustí et al., 2001; Agustí, Almela y Juan, 2004; Van Rensburg et al, 2006; Cronjé, Barry y Huysamer, 2011). El manchado de mandarina Satsuma ‘Okitsu’ en estudio, comenzó a manifestarse externamente a los 15 días de almacenamiento. La ocurrencia de los síntomas fue mayoritaria en la zona ecuatorial (más del 40 % de los frutos afectados) y prácticamente nula en la zona del cáliz (1 %). Al inicio se observó una zona irregular de color marrón entre las glándulas de aceite, que se fue incrementando y oscureciendo con el tiempo. A nivel microscópico, después de 30 días de almacenamiento y 15 de vida de mostrador, el daño se localizó fundamentalmente en el tejido subepidérmico, similar a lo encontrado en este cultivar en etapas más tempranas (Da Luz et al., 2014). Estos autores reportaron para el mismo desorden fisiológico que la afección se inicia dos meses antes de la cosecha en la zona subepidérmica y que el daño avanza hacia las células parenquimáticas subyacentes, aunque no más de un tercio de su espesor.
En nuestro trabajo también se observó la disgregación celular con el deterioro parcial de las paredes cuando el daño es leve, y con la consiguiente pérdida de turgencia provocando aplastamiento en las zonas con daño más severo. La epidermis mantuvo las características normales en las primeras etapas de la afección, pero en estados avanzados las células modificaron su citoplasma. Sin embargo, la cutícula permaneció intacta, aún en los frutos con mayores daños luego de 30 días de almacenamiento y 15 días de vida de mostrador. El deterioro celular con la posterior oxidación enzimática del contenido vacuolar, podría explicar la coloración marrón que se observa en la cáscara cuando se manifiesta este desorden, tal como ha sido sugerido en el colapso de la corteza de naranja ‘Navelate’ (Agustí et al., 2001). El oscurecimiento de las manchas del flavedo de mandarina ‘Encore’ también ha sido asociado al incremento en la velocidad de oxidación de sustancias fenólicas. En estos frutos, como consecuencia de la rotura del tonoplasto de las células dañadas, se redujo la actividad catalasa y se incrementó la superóxido dismutasa (Vitor et al., 2001).
El colapso de la corteza, reportado en mandarinas Satsumas y Clementinas en las condiciones productivas de Sudáfrica, también presenta el daño celular en las capas subepidérmicas del flavedo y en el área adyacente a las glándulas de aceite. La epidermis permanece inalterada, tanto en los frutos afectados como en los sanos (Van Rensburg et al, 2006; Cronjé, Barry y Huysamer, 2011). Daños similares se encontraron en el presente trabajo, con la diferencia que en las zonas severamente dañadas las células de la epidermis colapsaron. Por otro lado, a diferencia del desorden en estudio, los frutos de naranjas ‘Navelina’ y ‘Navelate’ afectados por el colapso de la corteza en las condiciones de España, se caracterizan por una depresión inicial del flavedo, que posteriormente se vuelve de color marrón rojizo (Agustí et al., 2001). Esta alteración está asociada a la pérdida de agua de las células situadas en la zona de coexistencia del flavedo con el albedo, avanzando hacia el exterior hasta alcanzar la epidermis, y hacia el interior afectando las capas más profundas del albedo.
En forma similar a nuestros resultados, al inicio del daño, la epidermis de los frutos de naranja ‘Navelate’ aparece intacta y tanto la composición de la cera de la superficie como la cutícula son similares en zonas sanas y dañadas (Agustí, Almela y Juan, 2004). Si bien los resultados del presente trabajo concuerdan parcialmente con las descripciones realizadas para los diferentes desórdenes fisiológicos mencionados previamente, difieren del manchado de la mandarina Satsuma ‘Okitsu’ causado por el frío. En estos frutos, desde el inicio, las células epidérmicas colapsan como consecuencia de la ruptura del tonoplasto y el deterioro del citoplasma, alterando la estructura y el metabolismo de las ceras que protegen la epidermis (Cohen, Shalom y Rosenberger, 1990; Almela, Agustí y Juan, 1992; Vercher et al., 1994; Agustí, Almela y Juan, 2004). El trastorno puede asociarse a una mayor permeabilidad de la cutícula en las zonas afectadas del fruto, lo que favorece la pérdida de agua hacia la atmósfera y altera el balance hídrico de dichas zonas (Vercher et al., 1994).
El manchado en estudio tampoco parece asociarse al picado de la corteza descrito en frutos de pomelo ‘Marsh’ y mandarina ‘Fallglo’, que se asocia al colapso de las glándulas de aceite, provocando leves depresiones en las regiones por encima de estas. Microscópicamente, se observa colapso celular y células con pérdida de la orientación característica en el tejido epidérmico, subepidérmico y albedo subyacente a las glándulas, (Petraceck, Wardowski y Brown, 1995; Petraceck, Dou y Pao, 1998).
En nuestro experimento, el porcentaje de frutos manchados varió entre años y se incrementó con el tiempo de almacenamiento y la vida de mostrador. La incidencia de frutos manchados luego del desverdizado, encerado y 30 días de almacenamiento, fue de 17 % el primer año y 7 % el segundo, mientras que no se presentó en los dos años siguientes. Las condiciones ambientales previas a la cosecha son determinantes en la manifestación de desórdenes fisiológicos, ya que estarían generando una mayor o menor sensibilidad de los frutos al manchado (Agustí, Almela y Juan, 2004; Magwaza et al., 2013). En el primer año desde la floración hasta la cosecha, las precipitaciones fueron 420 mm, mientras que en los tres años siguientes las superaron en 104 %, 170 % y 80 %, respectivamente. Durante los 10 días previos a la cosecha, en el primer año fueron menores a 1 mm, y en los años siguientes fueron mayores a 30 mm. Adicionalmente, en el primer año la temperatura máxima en el mismo período fue siempre superior (38 °C) a los tres restantes (35 °C, 30 °C y 31 °C). Por el contrario, la HR media fue menor a 60 % el primer año y superior a 80 % en los siguientes años. Considerando en conjunto las variables ambientales, la incidencia del daño se relacionó con bajas precipitaciones, menor HR y alta temperatura durante los días previos a la cosecha. Probablemente el estrés ocasionado por la deshidratación de la planta determinó una mayor sensibilidad de los frutos a manifestar el manchado en estudio, tal como ha sido reportado para el colapso de la corteza de naranja ‘Navelate’, tanto en precosecha (Almela, Agustí y Juan, 1992) como en postcosecha (Agustí et al., 2001; Agustí, Almela y Juan, 2004).
Si bien el tratamiento de desverdizado con C2H4 ha sido reportado como promotor de varios desórdenes de la cáscara en mandarinas y podredumbre de cáliz en naranja ‘Shamouti’ y en mandarinas Satsumas (Porat et al., 1999; Vázquez, 2005), en este caso no afectó el porcentaje de frutos manchados (Figura 7). Por otro lado, se ha propuesto un efecto protector de este fitorregulador frente al estrés (Yang y Hoffmann, 1984), disminuyendo la sensibilidad al daño por frío en naranjas ‘Navelate’ (Lafuente, Sala y Zacarías, 2004), la incidencia de peteca en limones (Wild, 1991) y el colapso de la corteza en naranjas ‘Navelina’ y ‘Navelate’ (Lafuente y Sala, 2002; Sala et al., 2005; Cajuste y Lafuente, 2007). Adicionalmente, el tratamiento con etileno en esta última disminuye el manchado, mientras que al inhibir la acción del etileno con 1-MCP, el desorden se incrementa (Estables-Ortiz et al., 2009). El efecto beneficioso del etileno se ha asociado al estímulo del sistema antioxidante, vinculado al incremento de la actividad fenilalanina-amonioliasa (PAL) y a la reducción de la actividad enzimática peroxidasa (POD) (Cajuste y Lafuente, 2007).
Al finalizar la vida de mostrador, el encerado de los frutos disminuyó la incidencia y severidad del manchado en ambas temporadas. La disminución del daño puede deberse a que las ceras (goma laca y polietileno) aplicadas en postcosecha reducen la pérdida de agua, al proporcionar una barrera que limita el intercambio gaseoso, logrando una menor deshidratación, como se ha citado en mandarinas y pomelos (Kaplan, 1986; Hagenmaier y Baker, 1994, 1995; Dou, 2004; Zócalo, 2009). Por otro lado, el tiempo de almacenamiento en cámara incrementó la incidencia y severidad del manchado, acelerándose en el período de vida de mostrador con una temperatura media entre 15 °C y 19 °C. Esta intensificación del daño es esperable, ya que una vez colapsadas las células, la pérdida del contenido celular, su degradación y oxidación, es un proceso asociado a la respiración, evaporación y activación de enzimas a temperaturas más altas. Dou, Jiuxu y Mohamed (2001) determinaron que el nivel de daño del colapso de la corteza de naranja ‘Valencia’ fue mayor en frutos almacenados a 21 °C que a 4 °C. El encerado de los frutos logró disminuir estos efectos negativos durante el almacenamiento y su vida poscosecha. Nuestros resultados confirman el efecto protector de las ceras, reduciendo la incidencia de frutos manchados durante el almacenamiento y la vida de mostrador.
En síntesis, el manchado de mandarina Satsuma ‘Okitsu’ comenzó a manifestarse, principalmente en la zona ecuatorial, luego de 15 días de conservación, observándose en la zona manchada una distorsión del tejido subepidérmico, con colapso celular, pero sin llegar a afectar la cutícula. La incidencia y severidad del manchado fue variable entre años, incrementándose con el tiempo de almacenamiento y durante la vida de mostrador. De acuerdo a los resultados, podemos concluir que la mayor incidencia podría estar asociada a condiciones de menor HR, mayor temperatura y menores precipitaciones durante los 10 días previos a la cosecha. El tratamiento de desverdizado no afectó el nivel de manchado, mientras que el encerado de los frutos disminuyó la incidencia y severidad del mismo.