Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Agrociencia (Uruguay)
versión impresa ISSN 1510-0839versión On-line ISSN 2301-1548
Agrociencia Uruguay vol.20 no.2 Montevideo dic. 2016
Variabilidad interanual en comunidades de acridios (Orthoptera: Caelifera: Acridoidea) en la región centro-sur del Uruguay
Zerbino María Stella1, Lorier Estrellita 2, Miguel Lucía1
1Instituto Nacional de Investigación Agropecuaria (INIA ) La Estanzuela, 70000 Colonia , Uruguay.
2Universidad de la República, Facultad de Ciencias. Iguá 4225, Montevideo, Uruguay. Correo electrónico: szerbino@inia.org.uy
Recibido: 3/12/15 Aceptado: 16/6/16
Resumen
Los acridios (Orthoptera: Caelifera: Acridoidea) son insectos nativos que habitan pastizales en Uruguay. En ciertas ocasiones incrementan la abundancia exponencialmente, como en los años 1950´ y en 2008/09, causando importantes pérdidas económicas. Este trabajo tuvo como objetivo describir la variación interanual de la abundancia y diversidad de las comunidades que habitan pastizales de la región centro-sur. El seguimiento de las poblaciones se realizó durante cinco temporadas, en sitios de Florida y Durazno. Se estimaron: riqueza acumulada y específica por sitio (S), índices de diversidad de Shannon-Weiner (H´), equitatividad de Pielou (J´), similitud cualitativa de Sorensen (Is), constancia de presencia (C), y abundancia total (A), específica absoluta y relativa. A través de las variaciones temporales de dichos descriptores comunitarios se identificaron y caracterizaron períodos de explosión poblacional, transición y equilibrio. En 2009/10 (explosión poblacional) S, A, e Is fueron máximos, J’ y H’ bajos y Borellia bruneri (Rehn, 1906) fue la más abundante. El período 2010/11-2011/12 (transición), se caracterizó porque J´ e Is fueron intermedias, A y S bajas, y continuó el predominio de B. bruneri. Durante 2012/13 y 2013/14 (equilibrio), se registraron los más altos J´ y H´, y la abundancia relativa de B. bruneri disminuyó significativamente. En este período Scotussa lemniscata (Stål, 1861) fue predominante. Los resultados obtenidos indican que en pastizales de la región centro-sur del Uruguay, el predominio de B. bruneri, la disminución en J´ y el aumento de Is serían indicadores de un período de transición hacia una explosión poblacional.
Palabras clave: TUCURAS, VARIACIÓN TEMPORAL, EXPLOSIÓN POBLACIONAL, BORELLIA BRUNERI, PASTIZALES
Summary
Interannual Variability in Acridian Community (Orthoptera: Caelifera: Acrididae) in Central-southern Uruguay
Acridians (Orthoptera: Caelifera: Acrididae) are native insects that inhabit Uruguayan grasslands. Occasionally, abundance increases exponentially, as in the 1950' and in 2008/09, causing significant economic losses. This work aimed to describe the variation in the abundance and diversity of the communities that inhabit the grasslands of south-central region. Acridian populations were monitored during five seasons in Florida and Durazno sites. Cumulative and site-specific (S) richness, Shannon-Weiner (H ‘) diversity index, Pielou evenness (J’), qualitative similarity of Sorensen (Is), constance of presence (C), total abundance (A), and absolute and relative specific abundance were estimated. Based on these community descriptors and their temporal variations, we identified and characterized outbreak, transition and non-outbreak periods. In 2009/10 (outbreak) S, A, and Is, were highest, J ‘ and H’ were low, and Borellia bruneri (Rehn, 1906) was the most abundant species. The 2010/11 -2011/12 period (transition), was characterized by intermediate J’ and Is, low A and S, and B. bruneri remained predominant. During 2012/13 and 2013/14 (equilibrium), higher values of J ‘and H’, and low values of A, S and Is were recorded, and the relative abundance of B. bruneri decreased significantly. In this period Scotussa lemniscata (Stål, 1861) was the predominant species. These results indicate that in the grasslands of south-central region of Uruguay, the prevalence of B. bruneri, the decrease in J’ and increase in Is, would be indicators of a transition period to an outbreak.
Keywords: GRASSHOPPER, TEMPORAL VARIATION, OUTBREAK, BORELLIA BRUNERI, GRASSLANDS
Introducción
Los acridios (Orthoptera: Caelifera: Acridoidea) conocidos vulgarmente como tucuras, langostas criollas o langostas del país, son insectos nativos que habitan los pastizales del Uruguay, por lo que constituyen un ensamble característico de estos ecosistemas (Bernays y Barbehenn, 1987). Como consumidores primarios cumplen funciones en los ciclos de nutrientes y de la energía (Belovsky, 2000). A nivel mundial, esta superfamilia que está integrada por aproximadamente 10000 especies, representa casi un tercio de la totalidad de especies que conforman el orden (Eades et al., 2016).
La dinámica de poblaciones de estos insectos es altamente variable, no sigue simples direcciones, las respuestas no son lineales y resultan de los efectos combinados de fuerzas abióticas y de interacciones bióticas (Joern, 2000). Normalmente los daños que causan son insignificantes, pero cuando las condiciones ambientales son favorables es frecuente que se produzca un aumento significativo de la abundancia, lo que causa importantes pérdidas en la producción de forraje y en los cultivos para granos (Burleson y Hewitt, 1982; Hewitt y Onsager, 1983; Sánchez y de Wysiecki, 1993; Cigliano et al., 1995, 2000, 2002; Fielding y Brusven,1995; Torrusio et al., 2002; de Wysiecki et al., 2004; Bulacio et al., 2005; Lorier et al., 2010; Mariottini et al., 2011, 2012, 2013). El incremento de la abundancia está asociado a factores climáticos, composición y uso del suelo, diversidad de la vegetación, técnicas de pastoreo utilizadas, eficacia de los enemigos naturales, y/o a ciclos supra-anuales característicos de este grupo (Gage y Mukerji, 1977; Joern y Pruess, 1986; Kemp, 1992a; Cigliano et al., 1995; Lockwood, 1997).
Se define como una explosión poblacional el incremento exponencial en la abundancia de una especie en particular, que ocurre en un período relativamente corto de tiempo (Berryman, 1987). Lockwood (1997) establece tentativamente que una explosión poblacional de acridios se produce cuando la densidad supera los seis individuos por metro cuadrado durante un período de uno a dos años, en uno o más tipos de hábitat. Las explosiones poblacionales se caracterizan por ser eventos cíclicos intermitentes, que han sido difíciles de predecir (Lockwood, 1997). Existe gran variabilidad en la composición específica de las comunidades (Branson et al., 2006; Jonas y Joern, 2007). Estos es consecuencia de que las distintas especies responden de manera diferencial a los factores bióticos y abióticos, los cuales varían espacial y temporalmente (Branson, 2008).
En Uruguay los registros de problemas con acridios datan desde los años 50 del siglo pasado. En las explosiones poblacionales de esa época, las especies que causaron mayores daños fueron: Borellia bruneri (Rehn, 1906), Borellia pallida (Bruner, 1900), Dichroplus pratensis Bruner, 1900 y Dichroplus conspersus Bruner, 1900 (Carbonell, 1957). Durante la primavera-verano 2008-2009 se registró un aumento significativo de la densidad poblacional de tucuras, principalmente en los departamentos: Durazno, Florida, Flores, Lavalleja, Río Negro, San José, Soriano, y Tacuarembó, con algunas referencias puntuales en algunos campos forestados de Rivera; las especies problemáticas observadas fueron las mismas que en el episodio anterior (Lorier et al., 2010).
El conocimiento de la taxonomía del grupo en la región y particularmente en el Uruguay es avanzado (Lorier, 2005). En nuestro país hasta el momento fueron registradas 103 especies, agrupadas en 54 géneros y tres familias (Liebermann y Pirán, 1941; Liebermann y Ruffinelli, 1946; Ruffinelli y Carbonell, 1953; Carbonell, 2007; Eades et al., 2016). Más del 75 % de las mismas son habitantes de pastizales, y corresponden a las familias Acrididae, Ommexechidae y Romaleidae. Sin embargo la información sobre la estructura de las comunidades de acridios es insuficiente, porque es el resultado de observaciones aisladas y no de estudios cuantitativos prolongados en espacio y tiempo (Miguel et al., 2014). El objetivo de este trabajo fue describir la variación interanual en riqueza, diversidad, abundancia total/específica y constancia de presencia en comunidades de acridios en pastizales de la región centro-sur del Uruguay. De esta manera se trata de encontrar indicadores que sugieran que es posible que se produzca una explosión poblacional si se dan condiciones favorables.
Materiales y métodos
En ocho sitios localizados en los Departamentos de Florida (5) y Durazno (3) (latitud S 33 º 01´45´´- 33 º 45´02´´ y longitud W 56 º 35´25´´- 55 º 46´57´´), se realizó el seguimiento de la población de acridios en pastizales entre principios de octubre y fines de abril, durante cinco temporadas consecutivas (2009-2014) (Figura 1). En esta región la temperatura media de verano e invierno es 22 y 11 °C, respectivamente; y la precipitación media anual es de 1178 mm.
La fisionomía del tapiz en la mayoría de los sitios en los que se realizaron los muestreos se caracterizó por presentar un estrato de mayor altura dominado por gramíneas erectas y un estrato bajo dominado por gramíneas postradas, con una cobertura vegetal superior al 80 %. En dos de los sitios muestreados predominó el estrato herbáceo de bajo porte, otro se caracterizó por la presencia de rocosidad en la superficie del suelo.
En cada sitio fueron realizadas 200 segadas con red entomológica (aro de 42 cm diámetro, red de 70 cm profundidad) distribuidas en tres transectas. Los muestreos fueron realizados con frecuencia quincenal, totalizando 342 muestreos. Los insectos colectados (ninfas y adultos) fueron llevados al laboratorio a los efectos de realizar la determinación específica. Para los diferentes sitios y en cada temporada, se estimó la riqueza acumulada y específica por sitio (S), el índice de diversidad de Shannon-Weiner (H´), el índice de equitatividad de Pielou (J´), y la abundancia total y específica, absoluta y relativa. También para las distintas temporadas se calculó el índice de similitud cualitativo de Sorensen (Is) entre sitios (Magurran, 1988).
Estas variables fueron analizadas con modelos lineales mixtos considerando los efectos año y sitio como aleatorios con el objetivo de estimar las componentes de varianza entre años (variabilidad temporal) y entre sitios dentro de años (variabilidad espacial). A fin de determinar la significancia de la variabilidad entre sitios dentro de años y la varianza residual, se realizó la comparación de dos modelos lineales mixtos, uno con años y sitios dentro de años como factores aleatorios y el otro únicamente con el efecto año como aleatorio (prueba de cociente de verosimilitud) (Di Rienzo et al., 2012). Complementariamente se realizó un análisis de componentes principales con los descriptores comunitarios riqueza, abundancia, diversidad y equitatividad para determinar el ordenamiento de las temporadas y la correlación entre las variables. El software utilizado en todos los análisis estadísticos fue InfoStat con interfaz con el software R. También, para cada temporada se estimó la constancia de presencia (C) de las distintas especies expresada como la relación entre el número de muestreos en los que la especies estuvo presente y el número total de muestreos realizados. De acuerdo a los porcentajes obtenidos las especies en las diferentes temporadas fueron categorizadas en: I) constantes-presentes en más de 75 % de las colectas; II) muy comunes-presentes entre 50 y 75 % de las colectas, III) comunes-presentes entre 25 y 50 % de las colectas, IV) poco comunes-presentes entre 12 y 25 % de las colectas, y V) rara-presentes en menos del 12 % de las colectas.
Resultados
En la totalidad de los muestreos fueron colectados aproximadamente 15000 individuos pertenecientes a 26 especies de la superfamilia Acridoidea, correspondientes a las familias Acrididae (22), Romaleidae (3) y Ommexechidae (1). La subfamila Melanoplinae fue la más representada (9 especies), seguida por la subfamilia Gomphocerinae con ocho especies (Cuadro 1). El número de especies totales colectadas en los cinco períodos de muestreo fueron 21 (2009/10), 14 (2010/11), 17 (2011/12), 18 (2012/13), y 22 (2013/14). Como se puede apreciar en el Cuadro 1, en aquellas especies que tuvieron una colecta total superior a 80 individuos, la mayor cantidad se capturó en 2009/10, temporada en la que continuó la explosión poblacional iniciada el año anterior (Lorier y Zerbino, 2009). Del total de especies colectadas, cuatro de ellas, Amblytropidia australis Bruner, 1904, Leiotettix pulcher Rehn, 1913, Coryacris angustipennis (Bruner, 1900), y Staleochlora viridicata orientalis Roberts y Carbonell, 1992, estuvieron ausentes durante la explosión poblacional.
La estimación de componentes de varianza para los descriptores comunitarios demostró que, con excepción de la diversidad (H´), la variación interanual fue mayor que la registrada entre sitios dentro de años (temporadas) (Cuadro 2). Para todas las variables, el cociente entre la verosimilitud de los modelos lineales mixtos con año y sitio dentro de año y aquellos con sólo año, como efectos aleatorios, fueron similares (p > 0,9999), lo que indica que la variación entre sitios no fue estadísticamente significativa.
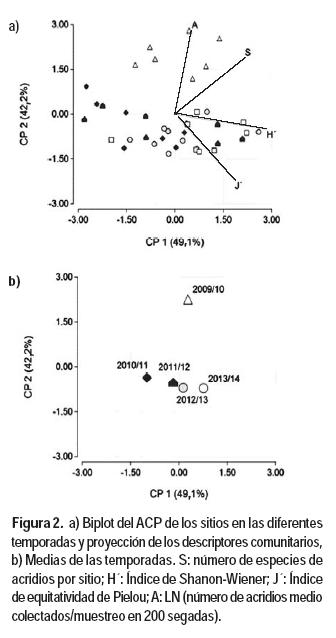
Los dos primeros ejes del análisis de componentes principales (CP1 y CP2) para las temporadas y descriptores comunitarios expresaron aproximadamente el 100 % de la variación total de los datos (Figura 2). El índice de diversidad de Shannon-Weiner (H´) fue la variable que ordenó las temporadas en el CP1, mientras que la abundancia total y el índice de equitatividad de Pielou (J´) lo hicieron en el CP2. El análisis ordenó las temporadas en tres grupos, 2009/10 (explosión poblacional), 2012/13 y 2013/14 (equilibrio poblacional) y 2010/11 y 2011/12 (transición). En 2009/10, la riqueza (S) y la abundancia total (A) registraron los valores más altos (Cuadro 3). En este período, respecto al promedio de las restantes temporadas, se colectó casi el doble de especies (12,5 vs. 7,4 especies/sitio) y la abundancia total media fue 23 veces mayor (141 vs 6,13 individuos/200 redadas) (Cuadro 3). En 2012/13 y 2013/14 los índices de diversidad (H´) y equitatividad (J´) fueron máximos. Estos índices tendieron a aumentar a medida que se sucedieron los años desde 2009/10. Los valores de H´ registrados en 2013/14 fueron mayores que los correspondientes a 2009/10 y 2010/11. Por su parte J´ en 2012/13 y 2013/14 fue mayor que en 2009/10 y 2010/11 (Cuadro 3). El tercer grupo que estuvo integrado por las temporadas 2010/11 y 2011/12, se caracterizó por bajos registros de A, S y H´, e intermedios los de J´ (Cuadro 3). En 2010/11 se registró la menor S, que fue significativamente diferente del valor correspondiente a 2013/14.
El índice de similitud entre sitios promedio (Is) fue máximo en 2009/10, posteriormente el porcentaje de especies compartidas entre los sitios disminuyó notoriamente. El Is promedio de la temporada 2009/10 fue 1,4 veces superior que la media de las restantes temporadas (Cuadro 3).
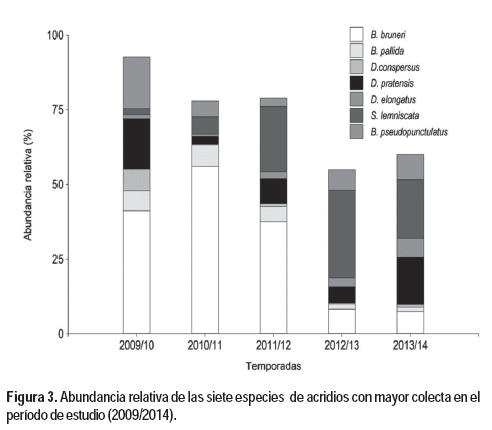
En 2009/10, B. bruneri, B. pallida, D. conpersus, D. pratensis y Baeacris pseudopunctulatus (Ronderos, 1964) fueron las especies más abundantes en la mayoría de los sitios, en conjunto representaron 89 % del total de insectos colectados (Cuadro 4, Figura 3). En las temporadas siguientes la abundancia de estas especies disminuyó notoriamente (Cuadro 4). Por otra parte, Laplatacris dispar (Rehn, 1939), Sinipta dalmani (Stål, 1861) y Aleaus lineatus (Stål, 1878), en algún momento del período 2010/2011- 2013/2014 registraron incrementos en la abundancia, aunque no muy importantes en magnitud.
En el transcurso de las temporadas hubo importantes variaciones en el predominio de las especies. En la Figura 3 se presenta la abundancia relativa de las especies con mayor número de individuos colectados (ver Cuadro 1), de la misma se destaca que B. bruneri fue la especie predominante entre 2009/10 y 2011/12, y que en las dos últimas temporadas su importancia relativa disminuyó considerablemente. Un comportamiento similar tuvieron B. pallida y D. conpersus, aunque los valores de abundancia relativa fueron menores. Por el contrario, la abundancia relativa de Scotussa lemniscata (Stål, 1861), que fue muy baja al inicio del estudio, a partir de 2011/12 comenzó a aumentar y desde la temporada 2012/13 fue la especie predominante.
De acuerdo a los valores de constancia de presencia (C) registrados, en el período de estudio la mayoría de las especies fueron tipificadas entre comunes y raras (Cuadro 5). En los casos de B. bruneri, B. pallida, Orphulella punctata (De Geer, 1773), D. conpersus, Dichroplus elongatus Giglio-Tos, 1894, D. pratensis y B. pseudopunctulatus esta variable tendió a disminuir a medida que se sucedieron las temporadas.
Entre 2009 y 2012 B. bruneri fue la que registró los valores más altos de C. Fue la única especie tipificada como «constante» en 2009/10 y como «muy común» en 2010/11 y 2011/12. A partir de 2012/13, el valor de C disminuyó significativamente, por lo que desde ese momento integró el grupo de las «poco comunes».
De las especies que fueron consideradas como «comunes» en 2009/10, S. lemniscata fue la única que en el transcurso del tiempo tuvo las menores oscilaciones en el valor de C. Por su parte, aquellas que fueron tipificadas como «poco comunes» y/o «raras», Fenestra bohlsii Giglio-Tos, 1895, L. dispar, S. dalmani, Neopedies orientalis Ronderos, 1991, Scotussa cliens (Stål, 1861), A. lineatus y Allotruxalis gracilis (Giglio-Tos, 1897) a través del tiempo registraron leves variaciones en esta variable.
Discusión
Las comunidades de acridios se caracterizan porque registran variaciones temporales y espaciales en la abundancia total y relativa y en el número de especies que las componen. Estos cambios son atribuidos a los efectos integrados de los factores abióticos y bióticos (Joern y Pruess, 1986; Kemp, 1987, 1992b; Joern y Gaines, 1990; Cigliano et al., 1995, 2002; Joern, 2000; Jonas y Joern, 2007). Poder predecir con cierta antelación la ocurrencia de una explosión poblacional, un requisito previo para el desarrollo de métodos de pronóstico, permitiría tomar decisiones tendientes a minimizar los daños (Berry et al., 1996; Joern, 2000). Esto es algo muy complejo, dado que las respuestas resultantes de los efectos combinados de los distintos factores abióticos y bióticos no son lineales y causan incertidumbre (Joern, 2000). Las variaciones en los descriptores comunitarios podrían ser útiles para indicar alteraciones en el estado de la comunidad (explosión, transición y equilibrio poblacional).
Establecer un programa de manejo integrado de acridios requiere de estudios sostenidos en el tiempo y el espacio que permitan realizar avances en el conocimiento de la ecología de estos insectos (variabilidad espacial y temporal de la distribución de las especies y de la densidad) (Sánchez y de Wysiecki, 1993; Mariottini, 2009). Estos estudios son la base para el desarrollo de un control racional basado en un enfoque preventivo (evitar o disminuir la ocurrencia de explosiones demográficas), en vez de curativo (combatir la plaga una vez ya instalada) que es lo que generalmente se realiza (Cigliano y Torrusio, 2003; Mariottini, 2009).
A través de los resultados de estudio fue posible obtener información sobre la estructura de las comunidades de acridios en los lugares en donde se trabajó en épocas determinadas. Para obtener datos que permitan generalizar las variaciones poblacionales y específicas de estas comunidades se requiere ampliar el conocimiento a partir de nuevos muestreos, sobre todo teniendo en cuenta que queda ampliamente demostrada la dependencia climática y que estamos en épocas de grandes variaciones debidas a fenómenos estacionales como El Niño y La Niña y el cambio climático.
Con este marco teórico podemos analizar los datos obtenidos y hacer las siguientes aseveraciones: las importantes variaciones interanuales en la estructura del ensamble a nivel de comunidad en términos de riqueza por sitio (S), diversidad (H´), equitatividad (J´), similitud entre sitios (Is), abundancia total (A) y específica, absoluta y relativa, y constancia de presencia (C), permitieron clasificar y caracterizar las temporadas (explosión, transición y equilibrio poblacional) comprendidas en el período de estudio, y entender los cambios naturales que ocurren en las comunidades cuando evolucionan desde la explosión al equilibrio poblacional (Cigliano et al., 2002). En 2009/10 continuó la explosión poblacional iniciada el año anterior, en algunos sitios se registraron densidades poblacionales superiores a 25 individuos/m2 (Lorier y Zerbino, 2009; Lorier et al., 2010). En esta temporada los valores de S, A, e Is fueron máximos. Este período también se caracterizó porque B. bruneri fue la especie más abundante y con el valor de C más alto. Durante 2012/13 y 2013/14 las comunidades de acridios retornaron al equilibrio, la abundancia total fue baja y los valores de J´ y H´ fueron los más altos. La abundancia absoluta y relativa de B. bruneri fue considerablemente menor que en la explosión poblacional, y otras especies como S. lemniscata comenzaron a ser predominantes. El período de transición (2010/11 y 2011/12) se caracterizó por valores intermedios de J´ e Is entre los correspondientes a la explosión y al equilibrio poblacional. En este período B. bruneri, continuó siendo la especie predominante y con los valores de C más altos. Estos cambios temporales sugieren que las especies tienen diferente sensibilidad a la fluctuación de recursos (alimento y hábitat) y responden de manera diferencial a factores climáticos (Kemp, 1992a).
El número total de especies (26) registrado, se encuentra dentro del rango que se mencionan en distintos trabajos realizados en Argentina. Sánchez y de Wysiecki (1990), Zequín et al. (1999), Cigliano et al. (2000) y de Wysiecki et al. (2000, 2004), en pastizales y/o pasturas cultivadas de diferentes localidades de las provincias de La Pampa, Santa Fe, Córdoba y Buenos Aires, reportan valores que varían entre 15 y 34 especies. Los valores de riqueza en otros continentes son mayores, Kemp (1992b) y Andersen et al. (2001) determinaron la presencia de 40 especies en pastizales de Montana (USA) y Australia, respectivamente. Ricklefs y Latham (1993) establecen que la riqueza de una determinada región está explicada en parte por su historia y su biogeografía.
El número de especies por sitio durante la explosión poblacional fue aproximadamente dos veces superior respecto a la situación de equilibrio. El aumento en el número de especies por sitio durante los períodos de explosión poblacional, es un fenómeno que se ha observado en pastizales nativos en distintas regiones del mundo. Esto probablemente es debido a que las especies consideradas raras comienzan a ser suficientemente abundantes como para que su presencia pueda ser detectada (Kemp, 1992a; Cigliano et al., 2000, 2002). La magnitud de este incremento que reportaron Kemp (1992a), Cigliano et al. (2000, 2002) y Torrusio (2003), varió entre dos y tres veces. Por el contrario, Mariottini et al. (2012), en el sur de la región Pampeana (Laprida, Provincia de Buenos Aires) determinaron que el número de especies por sitios disminuyó durante la explosión poblacional. Estas diferencias pueden ser debidas a que las distintas especies que componen los ensambles responden de forma diferencial a la interacción de factores externos (condiciones climáticas, vegetación, suelo) e internos (interacciones bióticas) (Branson, 2008). Esta interacción también podría explicar la ausencia de algunas especies durante la explosión poblacional.
Los resultados de J´, indican que durante la explosión poblacional son pocas las especies dominantes y que a medida que la comunidad ingresa al estado de equilibrio las mismas tienden a estar representadas en similar proporción. En pastizales nativos de la región de Laprida (Provincia de Buenos Aires), Mariottini et al. (2013) encontraron que la equitatividad fue mayor durante el periodo de no explosión (= equilibrio poblacional) que en condiciones de explosión poblacional. Los valores registrados en ambos períodos por estos autores fueron menores (equilibrio J´ = 0,69, explosión poblacional J´ = 0,39) que los obtenidos en este trabajo (equilibrio J´ = 0,84, explosión poblacional J´ = 0,57). Estas diferencias de J´ entre las comunidades de estas dos regiones indican que en nuestro país las especies están representadas en proporciones más similares que en Laprida.
Las importantes variaciones en los valores de abundancia total y específica absoluta registrados entre los períodos de explosión poblacional y equilibrio son característicos de este grupo (Joern, 1982; Joern y Pruess, 1986; Kemp, 1992a, Cigliano et al., 1995, 2000). Borellia bruneri fue la especie que registró las mayores variaciones en abundancia relativa entre el período de explosión poblacional y el de equilibrio, lo que sugiere que es muy sensible a la fluctuación temporal de recursos, alimento y fundamentalmente hábitat. Especies que pertenecen a otra subfamilia (Melanoplinae), con otros hábitos de alimentación y preferencia de hábitat, como Melanoplus sanguinipes (Fabricius, 1798) en Montana (USA), y D. elongatus en Benito Juárez (Provincia de Buenos Aires), tuvieron un comportamiento similar en cuanto a las variaciones en la abundancia relativa (Kemp, 1992a; Cigliano et al., 2002).
En todas las temporadas pocas especies representaron la mayor proporción de la comunidad, independientemente de la abundancia total, esta es otra peculiaridad del grupo (Joern, 1982; Joern y Pruess, 1986; Cigliano et al., 2002; de Wysiecki et al., 2004; Mariottini et al., 2012). Las cinco especies más abundantes durante la explosión poblacional fueron B. bruneri, B. pallida, D. conpersus, D. pratensis y B. pseudopunctulatus, mientras que en el período de equilibrio B. pallida y D conpersus no integraron este grupo. Lo contrario sucedió con S. lemniscata, que durante la explosión poblacional fue una especie poco abundante y durante el periodo de equilibrio fue la especie que predominó. Sin embargo la situación registrada en este estudio fue diferente a la descrita por Joern y Pruess (1986) y Cigliano et al. (2002), quienes reportaron que las especies más comunes fueron las mismas en condiciones de explosión poblacional y de equilibrio. Cigliano et al. (2002) reportan que D. elongatus y S. lemniscata fueron las especies que durante una explosión poblacional registraron los incrementos poblacionales más importantes en la región de Benito Juárez (Provincia de Buenos Aires). Por su parte Mariottini et al. (2012) determinaron que en la localidad de Laprida (Provincia de Buenos Aires) las especies que más contribuyeron al aumento de la densidad de la comunidad fueron D. maculipennis (Blanchard, 1851) y B. bruneri. Estas diferencias entre distintas localidades geográficamente próximas enfatizan la importancia de estudios locales de largo plazo que permitan realizar avances en el conocimiento de la ecología de estos insectos.
Las variables A, C e Is tuvieron una relación positiva entre sí. La disminución continua desde la explosión poblacional hasta el equilibrio en los valores de Is y de C de las especies B. bruneri, B. pallida, O. punctata, D. conpersus, D. elongatus y D. pratensis, sugiere que en el momento de la explosión poblacional algunas especies colonizan de manera indiscriminada diferentes hábitat como consecuencia de la competencia por recursos. A medida que las poblaciones retornan al equilibrio y los recursos dejan de ser una limitante, las especies son más selectivas al momento de escoger un hábitat.
La composición de las comunidades durante la explosión poblacional registrada en 2008/10, fue similar a la registrada en la mitad del siglo pasado (Carbonell, 1957; Lorier y Zerbino, 2009; Lorier et al., 2010, 2012; Zerbino et al., 2010). Ambos eventos se caracterizaron porque B. bruneri fue la especie que más contribuyó al aumento de la densidad de la comunidad en su conjunto, con valores que superaron varias veces a los registrados para las otras especies presentes (Liebermann y Piran, 1941; Liebermann y Ruffinelli, 1946; Ruffinelli y Carbonell, 1953; Carbonell, 1957; Silveira Guido et al., 1958; Lorier et al., 2010, Zerbino et al., 2010). Esta especie es reportada como una de las más destructivas en pastizales y praderas artificiales (COPR, 1982; Carbonell, 1957,1995; Lorier y Zerbino, 2009; Lorier et al., 2010).
Borellia bruneri se distribuye en todo el territorio nacional. Tiene preferencia por ambientes secos y zonas de escasa vegetación con parches de suelo desnudo (Carbonell, 1995; Lorier et al., 2010; Mariottini et al., 2012) por lo que esta especie está asociada a comunidades vegetales donde prevalecen las gramíneas de porte bajo (Silveira Guido et al., 1958; COPR, 1982; Carbonell et al., 2006). Estudios en distintas comunidades vegetales de la región Pampeana demuestran una alta asociación de B. bruneri con vegetación tipo halófilo (Torrusio et al., 2002; de Wysiecki et al., 2004; Mariottini et al., 2012, 2013). Periodos con déficit hídricos importantes y prolongados, como los registrados previo y durante al 2008/09, son los más favorables para su reproducción y propician las explosiones poblacionales. Históricamente fue una especie poco importante en Argentina (Carbonell, 1995). En los seguimientos realizados en la Pampa en los últimos años fue una de las dos especies que más contribuyó al aumento de la densidad de la comunidad en su conjunto. Este fue el primer registro de altas densidades de esta especie en esa región, y los autores lo atribuyeron al inusual déficit hídrico registrado durante 2008/09 (Mariottini et al., 2012).
Conclusiones
A través de los resultados obtenidos en este estudio, inédito en el país, fue posible generar conocimientos sobre la estructura de las comunidades de acridios. Las variaciones temporales en los diferentes descriptores comunitarios permitieron identificar y caracterizar los períodos de explosión y equilibrio poblacional, y la transición entre ambos períodos.
En las comunidades de acridios que habitan pastizales nativos de la región centro-sur del Uruguay, cambios en algunos descriptores comunitarios como la disminución en la equitatividad, el incremento en la similitud entre sitios y el predominio notorio de B. bruneri (abundancia relativa y constancia de presencia) sobre el resto de las especies, pueden ser algunos indicadores de un período de transición hacia una explosión poblacional.
En este trabajo se analizaron datos de cinco temporadas, sin embargo sería fundamental continuar con el seguimiento de las comunidades en el largo plazo a fin de obtener información para identificar los factores bióticos y abióticos que influyen en la dinámica de las comunidades y determinan las explosiones poblacionales de modo que se puedan crear modelos con adecuada capacidad predictiva.
Agradecimientos
A la Ing. Agr. Ph.D. Mónica G. Balzarini por sus importantes aportes en los análisis estadísticos. A la Lic. Andrea Listre por su colaboración en el trabajo de campo y en la identificación del material colectado. A Mabel Pessio y Eduardo García por su permanente asistencia en los muestreos. A los revisores anónimos por su lectura crítica y valiosos aportes que permitieron mejorar este manuscrito.
Bibliografía
Andersen AN, Ludwig JA, Lowe LM, Rentz DCF. 2001. Grasshopper biodiversity and bioindicators in Australian tropical savannas : responses to disturbance in Kakadu National Park. Austral Ecology, 26: 213 – 222.
Belovsky GE. 2000. Do grasshoppers diminish grassland productivity? : A new perspective for control based on conservation. En: Lockwood JA, Latchininsky AV, Sergeev G. [Eds.]. Grasshoppers and Grassland Health : Managing Grasshopper Outbreaks without Risking Environmental Disaster. Boston : Kluwer Academic. pp. 7 – 29.
Bernays EA, Barbehenn R. 1987. Nutritional ecology of grass foliage-chewing insects. En: Slansky F, Rodríguez JG. [Eds.]. Nutritional Ecology of Insects, Mites, Spiders and Related Invertebrates. Nueva York : John Wiley & Sons. pp. 147 - 175.
Berry JS, Onsager JA, Kemp WP, Mcnary T, Larsen J, Legg D, Lockwood JA, Foster RN. 1996. Assessing rangeland grasshopper populations. En: Cunningham GL, Sampson MW [Eds.] Grasshopper integrated pest management user handbook. Washington : USDA. (Technical Bulletin ; 1809). pp. 1 – 12.
Berryman M. 1987. The theory and classification of outbreaks. En: Barbosa P, Schultz JC. [Eds.]. Insect outbreaks. London : Academic Press. pp. 3 – 29.
Branson DH. 2008. Influence of large late summer precipitation event on food limitation and grasshopper population dynamics in a northern Great Plains grassland. Environmental Entomology, 37(3): 686 – 695.
Branson DH, Joern A, Sword GA. 2006. Sustainable management of insect herbivores in grassland ecosystems: new perspectives in grasshopper control. Bioscience, 56(9): 743 – 755.
Bulacio N, Luiselli S, Salto C. 2005. Cuantificación del daño potencial de Dichroplus elongatus y Orphulella punctata (Orthoptera: Acrididae) en sorgo y alfalfa [En línea]. Consultado 20 diciembre 2008. Disponible en: http://www.inta.gov.ar/Rafaela/info/documentos/anuario2005/a2005_p187.htm.
Burleson WH, Hewitt GB. 1982. Response of needle-and-thread and western wheatgrass to defoliation by grasshoppers. Journal of Range Management, 35(2): 223 – 226.
Carbonell CS. 2007. Lista de los acridomorfos señalados para el Uruguay. Montevideo : Facultad de Ciencias. Universidad de la República. 6p.
Carbonell CS. 1995. Revision of the tribe Scyllinini, Nov. (Acrididae: Gomphocerinae), with descriptions of new genera and species. Transactions of the American Entomology Society, 121(3): 87 – 152.
Carbonell CS. 1957. Vuelos en masa de acridoideos (Orthoptera) en el Uruguay. Revista de la Sociedad Uruguaya de Entomología, 2(1): 73 – 77.
Carbonell CS, Cigliano MM, Lange CE. 2006. Especies de acridomorfos (Orthoptera) de Argentina y Uruguay [Cd-Rom] . La Plata : The Orthopterist´s Society at the Museo de La Plata, Argentina. (Publications on Orthopteran Diversity).
Cigliano MM, Torrusio S. 2003. Sistemas de información geográfica y teledetección en entomología : aplicación en tucuras y langostas (Orthoptera: Acridoidea). Revista de la Sociedad Entomología Argentina, 62(1-2): 1 – 14.
Cigliano MM, Torrusio S, de Wysiecki ML. 2002. Grasshopper (Orthoptera: Acridoidea) community composition and temporal variation in the Pampas, Argentina. Journal of Orthoptera Research, 11(2): 215 – 221.
Cigliano MM, de Wysiecki ML, Lange CE. 2000. Grasshopper (Orthoptera:Acridoidea) species diversity in the Pampas, Argentina. Journal of Diversity and Distributions, 6(2): 81 - 91.
Cigliano MM, Kemp WP, Kalaris TM. 1995. Spatio temporal characteristics of rangeland grasshopper (Orthoptera:Acrididae) regional outbreaks in Montana. Journal of Orthoptera Research, 4(1): 111 – 126.
COPR. 1982.The locust and grasshopper agricultural manual. London : Published by the Centre for Overseas Pest Research. 660p.
de Wysiecki ML, Torrusio S, Cigliano MM. 2004. Caracterización de las comunidades de acridios (Orthoptera:Acridoidea) del partido de Benito Juárez, sudeste de la provincia de Buenos Aires, Argentina. Revista de la Sociedad Entomológica Argentina, 63(3-4): 87 – 96.
de Wysiecki ML, Sánchez N, Ricci S. 2000. Grassland and shrubland grasshopper community composition in northern La Pampa province, Argentina. Journal of Orthoptera Research, 9: 211 – 221.
Di Rienzo JA, Macchiavelli R, Casanoves F. 2012. Modelos lineales mixtos aplicaciones en InfoStat. 1a. ed. Córdoba : Grupo Infostat. 193p.
Eades DC, Otte D, Cigliano MM, Braun H. 2016. Orthoptera Species File. Versión 5.0/5.0. [En línea]. Consultado 31 marzo 2016. Disponible en: http://orthoptera.speciesfile.org/HomePage/Orthoptera/HomePage.aspx.
Fielding DJ, Brusven MA. 1995. Ecological correlates between rangeland grasshopper (Orthoptera:Acrididae) and plant communities of southern Idaho. Environmental Entomology, 24(6): 1432 – 1441.
Gage SH, Mukerji MK. 1977. A perspective of grasshopper population distribution in Saskatchewan and interrelationship with weather. Environmental Entomology, 6(3): 469 – 479.
Hewitt GB, Onsager JA.1983.Control of grasshoppers on rangeland in the United States : a perspective. Journal of Range Management, 36(2): 202 – 207.
Joern A. 2000. What are the consequences of nonlinear ecological interactions for grasshopper control strategies? En: Lockwood JA, Latchininsky AV, Sergeev MG. [Eds.]. Grasshoppers and Grassland Health : Managing Grasshopper Outbreaks without Risking Environmental Disaster. Boston : Kluwer Academic. pp. 131 – 143.
Joern A. 1982. Distributions, densities, and relative abundances of grasshoppers (Orthoptera: Acrididae) in Nebraska Sandhillspraire. The Praire Naturalist, 14(2): 37 - 45.
Joern A, Gaines SB. 1990. Population dynamics and regulation in grasshoppers. En: Chapman RF, Joern AJ. [Eds.]. Biology of grasshoppers. New York : Wiley and Sons. pp. 415 – 482.
Joern A, Pruess KP. 1986. Temporal constancy in grasshopper assemblies (Orthoptera:Acrididae). Ecological Entomology, 11(4): 379 – 385.
Jonas JL, Joern A. 2007. Grasshopper (Orthoptera: Acrididae) communities respond to fire, bison grazing and weather in North American tallgrass prairie : a long-term study. Oecologia, 153(3): 699 – 711.
Kemp WP. 1992a. Temporal variation in rangeland grasshopper (Orthoptera: Acrididae) communities in the steppe region of Montana, USA. Canadian Entomologist, 124(3): 437 – 450.
Kemp WP. 1992b. Rangeland grasshopper (Orthoptera: Acrididae) community structure : a working hypothesis. Environmental Entomology, 21(3): 462 – 470.
Kemp W P. 1987. Probability of outbreak for rangeland grasshopper (Orthoptera: Acrididae) in Montana : application of Markovian principles. Journal Economic Entomology, 80: 1100 – 1105.
Liebermann J, Ruffinelli A. 1946. Catálogo de acridoideos uruguayos. Revista de la Asociación de Ingenieros Agrónomos, 74: 9 – 21.
Liebermann J, Pirán AA. 1941. Primera lista de acridios uruguayos. Montevideo : Dirección General y de Contralor de la Lucha Contra la Langosta. 12p.
Lockwood JA.1997. Rangeland grasshopper ecology. En: Gangwere SK, Muralirangan MC, Muralirangan M. [Eds.]. The Bionomics of Grasshoppers, Katydids and Their Kin. Wallingford : CAB International. pp. 83 – 101.
Lorier E. 2005. Taxonomía en Insectos y estado actual del conocimiento en la sistemática del orden Orthoptera en el Uruguay. En: Langguth A. [Eds.]. Biodiversidad y Taxonomía : Presente y futuro en el Uruguay. Montevideo : UNESCO. pp. 57 – 68.
Lorier E, Miguel L, Listre A, Zerbino MS. 2012. Cambios en la composición de las comunidades de Acridios (Orthoptera: Acridoidea) con posterioridad a una explosión poblacional, en praderas de Uruguay. En: VIII Congreso Argentino de Entomología; 17-20 abril. 2012; San Carlos de Bariloche, Argentina. [S.l.] : Sociedad Entomológica Argentina, INTA. pp. 324.
Lorier E, Miguel L, Zerbino MS. 2010. Manejo de tucuras. En: Altier N, Rebuffo M, Cabrera K. [Eds.]. Enfermedades y plagas en pasturas. Montevideo : INIA. (Serie técnica ; 183). pp. 51 – 71.
Lorier E, Zerbino S. 2009. Tucura : radiografía de una plaga. El País Agropecuario, 175: 36 – 38.
Magurran AE. 1988. Ecological diversity and its measurement. London : Chapman and Hall. 179p.
Mariottini Y. 2009. Biología y ecología de acridios (Orthoptera: Acridoidea) del Sur de la región Pampeana [Tesis de doctorado]. La Plata : Facultad de Ciencias Naturales y Museo. Universidad Nacional de La Plata. 203p.
Mariottini Y, de Wysieki ML, Lange CE. 2013. Diversidad y distribución de acridios (Orthoptera :Acridoidea) en pastizales del sur de la región pampeana, Argentina. Revista de Biología Tropical, 61(1): 111 - 124.
Mariottini Y, de Wysieki ML, Lange CE. 2012. Variación temporal de la riqueza, composición y densidad de acridios (Orthoptera:Acridoidea) en diferentes comunidades vegetales del Sur de la provincia de Buenos Aires. Revista de la Sociedad Entomológica Argentina, 71(3-4): 275 – 288.
Mariottini Y, de Wysiecki ML, Lange CE. 2011. Seasonal occurrence of life stages of grasshoppers (Orthoptera: Acridoidea) in the Southern Pampas, Argentina. Zoological Studies, 50(6): 737 – 744.
Miguel L, Lorier E, Zerbino S. 2014. Caracterización y descripción de los estadios ninfales de Borellia bruneri (Rhen, 1906) (Orthoptera:Gomphocerinae). Agrociencia (Uruguay), 18(2): 72 – 81.
Ricklefs RE, Latham RE. 1993. Global patterns of diversity in mangrove floras. En: Ricklefs RE, Schluter D. [Eds.]. Species Diversity in Ecological Communities. Chicago : University of Chicago Press. pp. 215 – 229.
Ruffinelli A, Carbonell CS. 1953. Segunda lista de insectos y otros artrópodos de importancia económica en el Uruguay. AIA : Revista de la Asociación de Ingenieros Agrónomos, 94: 33 - 82.
Sánchez NE, de Wysiecki ML. 1993. Abundancia y diversidad de acridios (Orthoptera: Acrididae) en pasturas de la Provincia de La Pampa, Argentina. Revista de Investigaciones Agropecuarias, 24(1): 29 – 39.
Sánchez NE, de Wysiecki ML. 1990. Quantitive evaluation of feeding activity of the grasshopper Dichroplus pratensis (Orthoptera: Acrididae) in natural grassland of La Pampa, Argentina. Environmental Entomology, 19(5): 1392 – 1395.
Silveira Guido A, Carbonell JF, Núñez O, Valdés E. 1958. Investigaciones sobre acridoideos en el Uruguay. Montevideo : Facultad de Agronomía. Universidad de la República. 485p.
Torrusio S. 2003. Teledetección y sistemas de información geográfica aplicados a la dinámica de la distribución espacial y temporal de densidades de Acridios (Orthoptera: Acridoidea) en el Sudeste de la Provincia de Buenos Aires (Partido de Benito Juárez) [Tesis de Doctorado]. La Plata : Universidad Nacional de La Plata. 152p.
Torrusio S, Cigliano MM, de Wysiecki ML. 2002. Grasshopper (Orthoptera: Acridoidea) and plant community relationships in the Argentine Pampas. Journal of Biogeography, 29(2): 221 – 229.
Zequín L, Beltrame R, Luiselli S, Salto C, Strasser R. 1999. Abundancia y diversidad de tucuras (Orthoptera: Acridoidea) en el centro oeste de Santa Fe y centro este de Córdoba. En: Anuario 1999. Santa Fe : INTA EEA Rafaela. pp. 113 – 125.
Zerbino MS, Lorier E, Miguel L. 2010. Ensamble de acridios (ORTHOPTERA: ACRIDOIDEA) en campos de Uruguay durante una explosión poblacional [Cd-Rom]. En: XXIII Congresso Brasileiro de Entomología; 26 - 30 setiembre, 2010; Natal, Brasil. Natal : SBE.