Services on Demand
Journal
Article
Related links
Share
Agrociencia (Uruguay)
Print version ISSN 1510-0839On-line version ISSN 2301-1548
Agrociencia Uruguay vol.19 no.2 Montevideo Dec. 2015
Nota Técnica
Medición de pH del suelo con papel reactivo
Beretta Andrés1 2, Bassahun Daniel1, Musselli Raquel1, Torres Deborah1
1INIA La Estanzuela. Laboratorio de Suelos, Plantas y Aguas. Ruta 50, km 11, 70.000 Colonia, Uruguay
Correo electrónico: aberetta@inia.org.uy
2Facultad de Agronomía, Universidad de la República
Recibido: 25/6/14 Aceptado: 6/2/15
Resumen
Los papeles reactivos al pH (tirillas) podrían ser útiles para medir pH del suelo. El objetivo fue evaluar la precisión y exactitud de estas medidas. Se comparó la medición de pH (suelo:agua 1:2,5) en 51 muestras de suelo, por tres métodos: con electrodo (pH_electrodo); con tirilla inmediatamente de ser sumergida en el sobrenadante luego de 20 minutos de reposo (pH_T); y con la misma tirilla luego de dos horas de secada, rehumedecida y lavada (pH_T_RL). Se utilizaron tirillas Millipore®, graduadas por unidad de pH, estimándose los valores intermedios. Se analizó carbono orgánico del suelo (COS) y conductividad eléctrica (CE) en cada muestra. Los valores pH_electrodo fueron tomados como referencia. Las lecturas pH_T y pH_T_RL tuvieron una relación aceptable (R2 de 0,50 y 0,48, respectivamente) con pH_electrodo, aunque subestimaron en promedio 0,44 y 0,21 unidades de pH, respectivamente. Con el contenido de carbono orgánico y pH_T o pH_T_RL, se estimó satisfactoriamente el valor de pH_electrodo y la diferencia promedio fue de -0,02 y 0,24 unidades de pH, respectivamente. Hubo concordancia aceptable al clasificar la acidez del suelo por pH_electrodo, por pH_T_RL o por pH estimado a partir de pH_T y carbono orgánico. Al realizar una calibración entre lecturas de pH con tirillas en función del contenido de COS y las mediciones de pH con electrodo, es posible utilizar las lecturas de pH con tirilla como una medida orientativa para clasificar la acidez del suelo.
Palabras clave: CARBONO ORGÁNICO, PH, COLORIMETRÍA, POTENCIOMETRÍA
Summary
Soil pH Measurement with Reactive Paper Test
The pH test papers (strips) may be useful for measuring soil pH. The pH values for 51 samples were measured. The objective was evaluate the precision and accuracy of these measures. We compared three methods to measure the pH (soil:water 1:2.5): electrode (pH_electrodo); paper test strips either immediately after inmersion (pH_T), or two hours after inmersion (pH_T_RL). Millipore® pH paper strips graduated per unit of pH were used. Electrical conductivity (EC) and soil organic carbon (SOC) were analyzed in each sample. The pH_electrodo values were taken as reference. The pH_T and pH_T_RL values had an acceptable relationship with pH_electrode values, with R2 of 0.50 and 0.48, respectively. These methods, however, underestimated the average pH_electrodo values in 0.44 and 0.21 pH units, respectively. When the value of pH_electrodo was estimated by organic carbon, pH_T or pH_T_RL showed acceptable fits were obtained and the average differences between pH_electrodo and estimated pH_electrodo were -0.02 and 0.24 units, respectively. Therefore, would be no differences when assigning soils to acidity classes if pH were measured by pH_T_RL methods or estimated by pH_T or pH_T_RL and organic carbon. The pH measured by strip can be used as value to classify soil acidity if previously a calibration based on SOC contents and pH measurements by electrode was made.
Keywords: ORGANIC CARBON, PH, COLORIMETRY, POTENTIOMETRY
Introducción
La concentración del ion hidrógeno es un parámetro relevante tanto en el estudio de las funciones como de la taxonomía de los suelos (Altamirano et al., 1976; IUSS_WRB, 2007). Para la determinación de la concentración del ion hidrógeno frecuentemente se recurre a metodologías volumétricas, colorimétricas o potenciométricas, que expresan la concentración a través de unidades de pH, a partir del logaritmo recíproco de la concentración del ión hidrógeno. De las múltiples metodologías e instrumentos para cuantificar el pH del suelo, los métodos potenciométricos basados en electrodos son los más precisos y exactos (Thomas, 1996). La medición de pH con electrodo, sin embargo, no es una técnica robusta para un uso extensivo en condiciones de campo, ya que es necesario controlar frecuentemente la calibración, lo que reduce la eficiencia del trabajo. En este contexto, surge como una solución potencial el método colorimétrico para determinación del pH del suelo, en particular el implementado en las tirillas indicadoras de pH.
Las tirillas para determinación de pH están constituidas por una matriz de papel o polímero sintético impregnado con reactivos que cambian su color a diferentes pH (Sheppard y Guiseppi–Elie, 1999). La medición de pH con tirillas es una metodología rápida y económica, y es una opción razonable cuando la precisión de las determinaciones requiere una sensibilidad igual o mayor a 0,5 unidades de pH (Thomas, 1996; Sheppard y Guiseppi–Elie, 1999). La principal limitante de este método es la capacidad del ojo humano, que solo es capaz de discriminar el cambio de color de la sustancia indicadora de pH cuando una de las formas coloreadas de la sustancia está presente en una concentración 10 veces superior a la otra, lo que corresponde a variaciones de una unidad de pH (Sheppard y Guiseppi–Elie, 1999). Además, la precisión de la determinación de pH con tirillas es afectada por la concentración de sales, por la temperatura y por la reacción con sustancias orgánicas (Sheppard y Guiseppi–Elie, 1999; Yuqing et al., 2005). En el caso de las determinaciones de pH con tirillas el nivel de carbono orgánico del suelo (COS) es un factor relevante. Pandey et al. (2013) han observado una relación negativa entre el pH y el COS. Esta relación fue identificada también por Gallardo Lancho (1999), quién encontró una correlación negativa significativa entre el carbono orgánico total extraíble y el pH en agua del suelo. Dicha correlación se redujo al determinar el COS por combustión húmeda. Por el contrario, Paz González et al. (1997) no encontraron correlación alguna entre los valores de pH medidos con tirillas y el COS.
El Departamento de Agricultura de Estados Unidos ha sugerido que la evaluación del pH con métodos colorimétricos como las tirillas presenta una exactitud aceptable para la caracterización de suelos, ya que las mediciones de pH no difieren en más de 0,3 unidades de pH respecto a las realizadas con electrodos en condiciones de laboratorio (USDA, 2005). En el mismo sentido FAO (2006) señala que la medición de pH con tirillas es una opción válida para trabajos de campo, pero que requiere una determinación de la correlación de estas lecturas con el método de determinación de pH por electrodo.
De acuerdo a los antecedentes mencionados se puede asumir como hipótesis que es posible lograr una determinación del pH por el método colorimétrico de tirillas de pH con una precisión y exactitud adecuadas para la medición de pH en suelo. Para probar la validez de esta hipótesis el presente trabajo evaluó la existencia de una correlación estadísticamente significativa entre la determinación de pH con electrodos y la determinación mediante tirillas de pH, y la relevancia del COS de la muestra como cofactor.
Materiales y métodos
Se midieron los valores de pH en 51 muestras de horizontes A de suelos de diferentes valores de pH, CE y COS (Cuadro 1). A cada muestra se le midió el pH en agua con electrodo (pH_electrodo) al cabo de tres minutos de agitación de la mezcla suelo:agua en una proporción 1:2,5 (Beretta et al., 2014). Posteriormente cada muestra se dejó reposar 20 minutos, se sumergió la tirilla en el sobrenadante por no más de cinco segundos y se la dejó orear por no más de 10 segundos para realizar la medición (pH_T). A cada una de estas tirillas se las dejó secar durante dos horas, luego se rehumedecieron y se lavaron con el fin de eliminar partículas visibles de su superficie, y se realizó una nueva lectura (pH_T_RL). Al momento de medir el pH con tirillas se comparó el color desarrollado con la escala provista por el fabricante. Se utilizaron tiras indicadoras de pH Merck Milipore® (cod 109535). Estas tirillas poseían una escala de 0 a 14, graduada por unidad de pH, por lo cual los valores intermedios fueron estimativos.
En cada muestra se determinó COS por combustión seca a 900 °C y detección con infrarrojo utilizando un equipo LECO Truspec (Wright y Bailey, 2001). La CE se determinó por el método de Dahnke y Whitney (1988).
A partir de los valores de pH medidos con tirillas y los contenidos de COS de 35 muestras se ajustaron dos modelos de regresión para estimar los valores de pH_electrodo. A estas estimaciones las denominamos pH_T+COS y pH_T_RL+COS, según la lectura utilizada fuera pH_T o pH_T_RL, respectivamente. A partir de estas regresiones se estimaron los valores pH_T+COS o pH_T_RL+COS para las 16 muestras que no se utilizaron en el ajuste de las regresiones y luego se compararon con los valores de pH_electrodo.
En 19 muestras se realizaron lecturas pH_T por triplicado para evaluar la precisión de la medida a través del coeficiente de variación.
Los suelos se clasificaron por su valor de pH de acuerdo a la Soil Survey Division Staff (1993), según la lectura: pH_T; pH_T_RL; pH_electrodo estimado en función de pH_T (pH_electrodo_T) o en función de pH_T_RL (pH_electrodo_T_RL); pH_T+COS; y pH_T_RL+COS.
En las comparaciones de medias apareadas a través de la prueba t y ajustes de regresiones por máxima verosimilitud se utilizó el software InfoStat/P. Se calculó el índice de Kapplar entre la clasificación obtenida por cada medición o estimación de pH a partir de lecturas con tirilla y la clasificación obtenida al medir pH_electrodo.
Resultados y discusión
Las determinaciones con tirillas tuvieron una relación aceptable con las determinaciones pH_electrodo (P<0,001) (Cuadro 2). La subestimación del valor de pH_T fue en promedio de -0,44 unidades de pH respecto al valor promedio de pH_electrodo y estadísticamente diferente a la subestimación de pH_T_RL de -0,21 unidades de pH. En ambos casos la subestimación fue significativa. Aunque estos valores se encuentran dentro de los citados por otros autores (USDA, 2005), se observaron diferencias de más de una unidad de pH para ambas determinaciones con tirillas. Beretta et al. (2014), observaron que los valores de pH medidos con electrodo durante el agitado de la mezcla suelo:agua eran 0,16 unidades superiores al determinado en el sobrenadante luego de dejar reposar la muestra, lo cual pudo ser una fuente de variación entre las mediciones realizadas, ya que las tirillas se midieron al dejar reposar la mezcla suelo:agua. Al dejar secar las tirillas y luego lavarlas para eliminar los restos sólidos de la superficie hubo un mayor tiempo de reacción, que permitió desarrollar mejor el color de la tirilla, lo cual disminuyó las diferencias entre los valores de pH obtenidos por tirillas y electrodo.
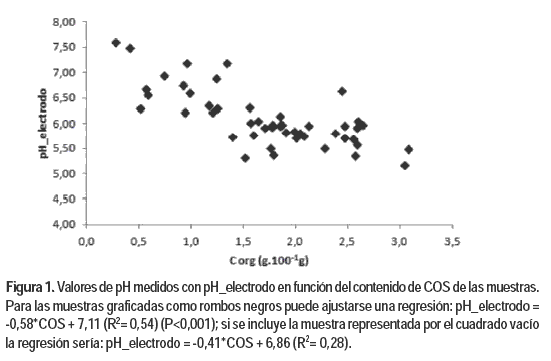
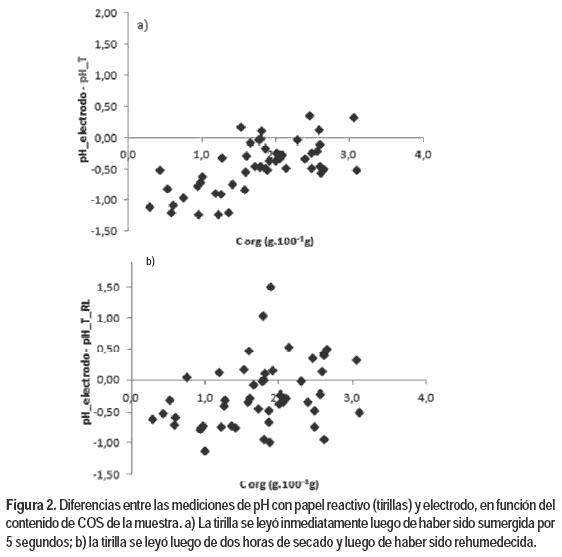
Los valores pH_electrodo disminuyeron a mayores contenidos de COS de las muestras, aunque esta relación fue evidente hasta valores de COS inferiores a 4,0 g.100 g-1 (Figura 1). Los valores de pH medidos con tirillas, sin embargo, no se correlacionaron con los valores de COS. Las diferencias entre las determinaciones con tirillas y pH_electrodo, variaron con el contenido de COS de las muestras (Figura 2). Es posible que la materia orgánica haya incidido en el desarrollo del color de las tirillas (Sheppard y Guiseppi–Elie, 1999; Yuqing et al., 2005), pero no es posible concluir eso a partir de este estudio. No hubo relación entre los valores de pH_electrodo, pH_T, pH_T_RL o sus diferencias y los valores de CE de las muestras.
El valor de pH_electrodo se estimó satisfactoriamente (Cuadro 3) a partir del contenido de COS de las muestras y el pH medido con tirillas. La diferencia promedio de esta estimación respecto a los valores pH_electrodo fue de -0,02 y 0,24 unidades de pH y las máximas diferencias no superaron las 0,74 y 0,60 unidades, según la medida de pH en tirilla fuera pH_T o pH_T_RL, respectivamente. En esta estimación, la lectura pH_T permite llegar a mayor exactitud que la lectura pH_T_RL.
Las medidas pH_T presentaron, en promedio, un coeficiente de variación de 4 %, aunque en algunas muestras se observaron coeficientes de hasta 11 % entre las tres repeticiones. La máxima diferencia observada entre repeticiones fue de una unidad de pH pero en promedio no alcanzó a media unidad, que fue la escala mínima de valor de pH al medir con tirilla.
Clasificación de las muestras de acuerdo a su pH
La clasificación de las muestras de acuerdo a su pH tuvo una distribución muy dispar según la medición o estimación de pH utilizada (Cuadro 4). El índice de Kappa fue pobre (Landis y Koch, 1977) para pH_T, pH_electrodo_T y pH_RL. Las mediciones o estimaciones de pH, identificadas como pH_electrodo_T_RL, pH_T+COS y pH_T_RL+COS, tuvieron un índice moderado.
Conclusión
El tiempo de reacción de la tirilla con la solución y/o la limpieza de la tirilla de restos de suelos en suspensión son dos aspectos a mejorar en el procedimiento de lectura de pH en suelo. Al realizar una calibración entre lecturas de pH con tirillas en función del contenido de COS y mediciones de pH con electrodo es posible utilizar las lecturas de pH con tirilla como una medida orientativa para clasificar la acidez del suelo.
Agradecimientos
A todo el equipo de trabajo del Laboratorio de Suelos, Plantas y Aguas de INIA-La Estanzuela. A Andrés Quincke y Leonidas Carrasco por sus aportes.
Bibliografía
Altamirano A, Da Silva H, Durán A, Echevarría A, Panario D, Puentes R. 1976. Carta de reconocimiento de suelos del Uruguay: Tomo I. Clasificación de suelos. Montevideo : MAP. 97 p.
Beretta A, Bassahún D, Musselli R. 2014. ¿Medir el pH del suelo en reposo o agitando la mezcla suelo:agua? Agrociencia, 18(2): 90 – 94.
Dahnke WC, Whitney DA. 1988. Measurement of Soil Salinity. En: Dahnke WC [Ed.] . Recommended chemical soil test procedures for the North Central Region. Illinois: USDA. (North Dakota Agricultural Exeriment Station Bulletin ; 22). pp. 32-34.
FAO. 2006 Guidelines for soil description. 4th ed. Rome : FAO. 97 p.
Gallardo Lancho J. 1999. Relationship between total extractable organic carbon and dome parameters of soil from western Spain. Humic Substances in the Environment, 1(3/4): 15 - 20.
Landis J, Koch G. 1997. The measurement of observer agreement for categorical data. Biometrics, 33: 159-174.
IUSS_WRB. 2007. Base Referencial Mundial del Recurso Suelo : Primera actualización 2007. Roma : FAO. 130p. (Informes sobre Recursos Mundiales de Suelos ; 103).
Pandey S, Thapa KB, Oli IB. 2013. Correlations of available phosphorus and potassium with soil pH and organic matter content at different soil reactions categories in soils of Western Development Region, Nepal. Journal of Chemical, Biological and Physical Sciences, 1(3): 128-133.
Paz González A, Taboada Castro MT, Gómez Suárez MJ. 1997. Relación entre textura, pH, materia orgánica y complejo de cambio en el horizonte superior de un suelo sobre serpentinas. Cuaderno Laboratorio Weolóxico de Laxe, 22: 5 – 14.
Sheppard NF, Guiseppi–Elie A. 1999. pH Measurement. En: Webster JG [Ed.]. The measurement, instrumentation and sensors handbook. Boca Raton : CRC Press. 16p.
Soil Survey Division Staff. 1993. Soil survey manual. Washington : USDA. 437 p. (Handbook ; 18).
Thomas. 1996. Soil pH and Soil Acidity. En: Sparks DL, Page AL, Helmke PA, Loeppert RH, Soltampour PN, Tabatabai MA, Johnston CT, Sumner ME [Eds.]. Methods of Soil Analysis. Part 3. Chemical Methods. Madison : Soil Science Society of America. (Soil Science Society of America Book Series ; 5). pp. 475 – 490.
USDA 2005. Soils use of reaction (pH) in soil taxonomy [En linea]. (Soil Survey Technical Note ; 8). Citado 26 junio 2014. Disponible en: http://www.nrcs.usda.gov/wps/portal/nrcs/detail/soils/scientists/?cid=nrcs142p2_053575
Wright AF, Bailey JS. 2001. Organic carbon, total carbon, and total nitrogen determinations in soils of variable calcium carbonate contents using a Leco CN-2000 dry combustion analyzer. Communications in Soil Science and Plant Analysis, 32: 3243 – 3258.
Yuqing M, Jianrong C, Keming F. 2005. New technology for the detection of pH. Journal of Biochem Biophys Methods, 63(1): 1- 9.