Services on Demand
Journal
Article
Related links
Share
Agrociencia (Uruguay)
Print version ISSN 1510-0839On-line version ISSN 2301-1548
Agrociencia Uruguay vol.19 no.1 Montevideo June 2015
Evaluación de desinfectantes para prevenir la trasmisión de Clavibacter michiganensis subsp. michiganensis en tomate mediante tijeras de poda
1 INIA Las Brujas. Ruta 48 km 10, Rincón del Colorado, 90200 Canelones, Uruguay. Correo electrónico: dmaeso@inia.org.uy
Recibido: 15/8/14 Aceptado: 5/5/15
Resumen
El cancro bacteriano del tomate causado por Clavibacter michiganensis subsp. michiganensis (Cmm) es una de las enfermedades más importantes del cultivo en Uruguay. Su control se basa en el uso de semillas libres del patógeno y la prevención de su diseminación mediante labores. El objetivo de este trabajo fue comparar productos desinfectantes para evitar la trasmisión Cmm mediante tijeras. En un experimento las tijeras fueron sumergidas en una solución bacteriana y en otro utilizadas en plantas enfermas. Luego fueron usadas para cortar plantas sanas previa inmersión en los desinfectantes. Se evaluaron: 1) testigo inoculado sin desinfectar, 2) testigo sin inocular, 3) hipoclorito de sodio (1 % cloro activo), 4) mono persulfato potásico, solución al 1 % (Virkon S®), 5) solución al 0,15 % de agentes tensoactivos en complejo con iodo (desinfectante a base de iodo Perrin) y 6) cloruro de didecildimetilamonio, solución al 1 % (Sporekill®). Se usó un diseño de bloques al azar con seis repeticiones con 20 plantas por unidad experimental. Se evaluó el porcentaje de plantas enfermas con Cmm mediante síntomas, aislamiento y serología. La desinfección de las tijeras con hipoclorito de sodio, Virkon S® y Sporekill® logró reducir significativamente los niveles de infección con Cmm; mientras que el desinfectante a base de iodo no resultó efectivo. Si bien la reducción de plantas enfermas fue significativa, ninguno de los tratamientos previno completamente la trasmisión por lo que esta medida deberá ser complementada dentro de un manejo integrado de la enfermedad.
Palabras clave: CLAVIBACTER MICHIGANENSIS SUBSP. MICHIGANENSIS, CANCRO BACTERIANO, TOMATE, DESINFECCIÓN
Evaluation of Disinfectants to Prevent Clavibacter michiganensis subsp. michiganensis Transmission in Tomato by Pruning Shears
Summary
Bacterial canker caused by Clavibacter michiganensis subsp. michiganensis (Cmm) is one of the most important tomato diseases in Uruguay. Its control is based on the use of pathogen-free seed and the transmission prevention during cultural practices. The objective of this work was to compare different disinfectants to prevent Cmm transmission by shears. In one experiment shears were immersed in a bacterial suspension while in the other, they were used in diseased plants. In both trials, healthy plants were then cut once with shears dipped in different disinfectants. Treatments included: 1) an inoculated control without disinfection, 2) a non-inoculated control, 3) sodium hypochlorite (1 % active chlorine), 4) potassium peroxymonosulfate, 1 % solution (Virkon S®), 5) a 0.15 % solution of tensoactive agents complexed with iodine (Perrin iodine-based disinfectant), and 6) a 1 % solution of didecyldimethylammonium chloride (Sporekill®). A randomized complete block design with six replications was used with 20 plants per plot. Percentage of diseased plants was assessed by visual symptoms, bacterial isolation and serology. Shear disinfection with sodium hypochlorite solution (1 % active chlorine) Virkon S®, and Sporekill® managed to significantly reduce the levels of infection with Cmm; while iodine was not effective. Even though the number of infected plants decreased significantly, none of the treatments completely prevented transmission; suggesting that this measure should be complemented in an integrated management of the disease.
Keywords: CLAVIBACTER MICHIGANENSIS SUBSP. MICHIGANENSIS, BACTERIAL CANKER, TOMATO, DISINFECTION
Introducción
El cancro bacteriano causado por Clavibacter michiganensis subsp. michiganensis (Cmm) es una enfermedad importante del cultivo del tomate (Strider, 1969; Davis et al., 1984). Provoca marchitamiento, muerte de plantas y pérdidas en la producción. Esta bacteria es un actinomicete fitopatógeno, gram positivo, perteneciente a la familia Microbacteriaceae con capacidad de sobrevivir en semillas (Gartemann et al., 2003). Dada la facilidad con que se disemina esta enfermedad por labores y la prolongada latencia de la infección (Chang et al., 1992), niveles muy bajos de infección de semillas (0,01 %) pueden traducirse en importantes epidemias en cultivo (Chang et al., 1991; Gitaitis et al., 1991). Hasta el momento, en Uruguay no existen cultivares resistentes disponibles a nivel comercial con capacidad de reemplazar a los usados actualmente, por lo que el control de la enfermedad se basa en la prevención utilizando semilla libre del patógeno y evitando su diseminación.
En el cultivo de tomate para consumo fresco se realizan tareas de desbrotado y deshoje utilizando tijeras o navajas, las cuales generan heridas y favorecen la trasmisión de Cmm, ya sea desde poblaciones epifíticas sobre el follaje (Chang et al., 1991, 1992; Gleason et al., 1991; Carlton et al., 1994), o a partir de plantas con infección sistémica (Ark, 1944; Thomas, 1930). Tradicionalmente, las herramientas de poda y deshoje se desinfectan con hipoclorito de sodio. Sin embargo, algunos productores lo han reemplazado por otros desinfectantes buscando superar algunas de las limitantes del hipoclorito (efecto corrosivo, inactivación por materia orgánica y fotosensibilidad, entre otras). El presente trabajo tuvo como objetivo comparar la efectividad de varios productos desinfectantes usados por productores de tomate en Uruguay en la prevención de la trasmisión de Cmm mediante tijeras.
Materiales y métodos
Material vegetal y tratamientos evaluados
Se utilizaron plantas de tomate, cultivar Loica, de aproximadamente 50 días de edad (seis hojas extendidas). Las plantas fueron cultivadas en macetas con sustrato esterilizado (autoclavado a 121 ºC por 20 minutos), utilizando semilla desinfectada (inmersión en agua caliente a 50 ºC por 25 minutos). Las mismas fueron cultivadas en un invernadero con control de temperatura (20-28 ºC). Las plantas fueron cubiertas con bolsas de polietileno por 48 h previo a la aplicación de los tratamientos, y reembolsadas por 48 h luego de aplicarse los mismos.
Los tratamientos evaluados se muestran en el Cuadro 1. Se utilizó un tubo individual con la solución desinfectante para cada planta.
Cultivo de Cmm y preparación de inóculo
Se utilizó la cepa de Cmm LB 17 de la colección del laboratorio de fitopatología de INIA Las Brujas. La misma fue aislada de tomate en el 2010 y mantenida en suspensión en glicerol (30 %) a -20 ºC. La patogenicidad de la cepa se chequeó cada seis meses inoculándola en plantas de tomate, recuperándola y almacenándola nuevamente. Para la preparación del inóculo la cepa seleccionada se cultivó en agar nutritivo dextrosado (Lelliot y Stead, 1987) y se resuspendió en agua estéril.
Trasmisión de Cmm a partir de una suspensión bacteriana
La trasmisión se realizó empleando tijeras sin uso previo de 140 mm de hoja las cuales fueron sumergidas durante diez segundos en la suspensión de Cmm e inmediatamente después en las soluciones del tratamiento correspondiente. Posteriormente, se realizó un corte en el tallo de las plantas de tomate a la altura del primer par de hojas completamente desarrolladas. La tijera fue sumergida en agua estéril en el caso del tratamiento testigo. Las plantas de cada unidad experimental fueron inoculadas con una misma solución bacteriana y una única tijera. La concentración del inóculo fue ajustada a una densidad óptica de 0,1 a 530 nm correspondiente a 1,9 x 108 ufc ml-1, concentración corroborada posteriormente con el método de dilución en placas.
Trasmisión Cmm a partir de plantas enfermas
La trasmisión fue realizada a partir de las plantas enfermas del tratamiento sin desinfección del experimento descrito anteriormente o plantas sanas para el tratamiento sin inocular. Para ello se realizaron tres cortes sucesivos en los tallos de las plantas infectadas. Inmediatamente las tijeras fueron sumergidas en las soluciones desinfectantes o en agua estéril según el tratamiento correspondiente. Luego se realizó un corte en el tallo de las plantas de tomate a la altura del primer par de hojas completamente desarrolladas.
Evaluación de la trasmisión
A los 14 días post tratamiento se registró la presencia de síntomas externos atribuibles a cancro bacteriano (marchitamiento, necrosis foliar, emisión de raíces aéreas, amarillamiento). Los datos fueron expresados en porcentaje de plantas enfermas en cada repetición.
A los 42 días de establecidos los tratamientos, los tallos de todas las plantas fueron cortados en forma longitudinal y se observó el estado de su sistema vascular registrándose el porcentaje de plantas que presentaban amarronamiento de vasos y/o médula. Se conservaron secciones de 5 cm de longitud a partir del punto de inoculación para confirmar la presencia de Cmm mediante aislamiento (experimento de trasmisión por suspensión bacteriana) o por serología (ambos experimentos).
En el experimento de trasmisión por suspensión bacteriana una parte de las secciones de tallo fue desinfectada superficialmente con alcohol 70 % y sumergida por dos horas en 10 ml de agua estéril. Esa suspensión fue sembrada en una placa con agar nutritivo dextrosado. A las 48 h se registró el número de placas en las que crecieron colonias con características similares a Cmm (apariencia y Gram positivas), registrándose el porcentaje de plantas a partir de las cuales se aisló este tipo de colonias.
En ambos experimentos, parte de las secciones obtenidas fueron utilizadas para la detección de Cmm por la prueba DAS-ELISA (Double Antibody Sandwich Enzyme Linked Immunosorbent Assay) empleando el antisuero monoclonal MAb Cmm1 (Alvarez et al., 1993; Kaneshiro et al., 2006) incluido en el kit comercializado por AGDIA Inc. (Elkhard, IN46514, EEUU). Se siguió el protocolo recomendado por el fabricante y se calculó el porcentaje de plantas en que se detectó serológicamente Cmm.
Diseño y análisis estadístico
En total se inocularon 120 plantas por tratamiento distribuidas en seis repeticiones de veinte plantas por unidad experimental. Se usó un diseño de bloques completos al azar y cada bloque correspondió a una misma mesa en el invernadero. En cada mesa las plantas fueron colocadas con una separación entre tratamientos de aproximadamente 0,5 m. Los datos fueron sometidos a un análisis de variancia y cuando este indicó efecto significativo del tratamiento (P>0,01) se procedió a la separación de medias mediante la prueba de rangos múltiples de Duncan. Previo a su análisis estadístico los datos en porcentaje fueron transformados por la fórmula arc sen Ö%. Para el análisis estadístico se utilizó el programa de acceso libre Infostat (www.infostat.com.ar).
Resultados
En el experimento de transmisión de Cmm a partir de una solución bacteriana los mayores porcentajes de plantas con síntomas, tanto externos como internos, se observaron en el testigo sin desinfectar y en el tratamiento con el desinfectante a base de iodo, siendo superiores al 85 %. El tratamiento con hipoclorito de sodio no difirió estadísticamente del testigo sin inoculación no presentando síntomas externos y solamente 3 % de plantas con haces vasculares necrosados. Los tratamientos con Sporekill® y Virkon S® exhibieron valores intermedios en la evaluación de síntomas (Cuadro 2).
En el 20 % de las plantas del testigo sin inocular y en el 50 % de las correspondientes a la desinfección con Virkon S® se aislaron colonias bacterianas similares a Cmm que no reaccionaron serológicamente con el antisuero específico para este patógeno. En el 95 % de las plantas correspondientes al testigo sin tratar y a la desinfección con el desinfectante a base de iodo se aislaron bacterias similares a Cmm y en el 100 % de las plantas se detectó al patógeno mediante serología. Estos valores no se diferenciaron estadísticamente del 45 % de plantas con detección serológica de Cmm encontrado en el tratamiento con hipoclorito.
En el testigo sin inocular y en las plantas con desinfección con Virkon S® no se detectó serológicamente Cmm no existiendo diferencias significativas con el 10 % de detección en el tratamiento con Sporekill®.
En el experimento de trasmisión a partir de plantas, los mayores porcentajes de trasmisión también se observaron en el testigo sin desinfectar y en el tratamiento con el desinfectante a base de iodo. El porcentaje de plantas con síntomas fue superior al 85 % diferenciándose significativamente del resto de los tratamientos. Nuevamente, el tratamiento con hipoclorito de sodio no fue significativamente diferente del testigo sin inocular expresando solo 3 % de plantas con haces vasculares necrosados. Los tratamientos con Sporekill® y Virkon® tuvieron valores intermedios con 17-27 % de las plantas con síntomas pero diferenciándose significativamente del testigo sin desinfección (Cuadro 3).
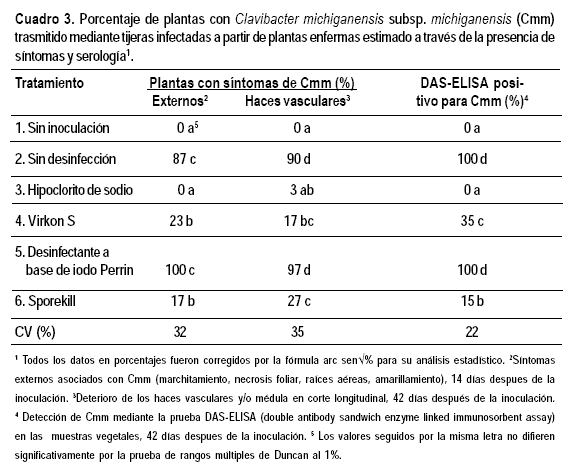
En el 100 % de las plantas del testigo sin desinfección y en las del tratamiento desinfectante a base de iodo se detectó Cmm mediante análisis serológico. No se detectó Cmm por serología en las plantas sin inocular y en las con desinfección por hipoclorito, mientras que en los tratamientos con Virkon S® y Sporekill® Cmm fue detectado en el 35 y 15 % de las plantas diferenciándose estadísticamente entre sí (Cuadro 3).
Discusión
Los resultados obtenidos confirman la importancia de la trasmisión de esta enfermedad mediante los elementos de corte normalmente utilizados en el cultivo. En ambos experimentos se obtuvo una infección cercana al 100 % al utilizar tijeras contaminadas con el patógeno. En algunos casos este porcentaje se redujo si las tijeras fueron sumergidas en las soluciones desinfectantes previo al corte de plantas sanas. La trasmisión obtenida utilizando una solución bacteriana o una planta enferma como fuente de inóculo fue muy similar.
Ninguno de los desinfectantes evaluados logró prevenir totalmente la trasmisión de Cmm. Eso concuerda con lo expresado por Kleinhempel et al. (1987) quienes sostienen que aún los mejores métodos de desinfección y limpieza son inefectivos para eliminar totalmente bacterias de las herramientas de corte. Según estos autores en las superficies de la hoja de corte existen orificios microscópicos de los cuales el exudado bacteriano no puede ser quitado. Otro aspecto que pudo haber perjudicado el desempeño de los desinfectantes en este trabajo fue el tiempo de contacto con el material a desinfectar, el cual debe ser por lo menos de diez minutos (Mebalds et al., 1997; van der Wolf et al., 2005; Teviotdale et al., 1991). Por ello, una desinfección rápida como la que se realiza entre plantas durante las labores de desbrote y deshoje en un cultivo comercial no sería suficiente para prevenir la trasmisión.
Sin embargo, en este trabajo se encontraron diferencias significativas en la eficiencia de desinfección entre los tratamientos evaluados. Al respecto se destacan los tratamientos en los que la desinfección de herramientas fue efectuada con hipoclorito de sodio, Virkon S® y Sporekill®. Los tres tratamientos presentaron los menores porcentajes de plantas con síntomas externos e internos y de presencia de Cmm detectada por la prueba DAS-ELISA frente al testigo sin desinfección, coincidiendo con lo observado por Baysal-Gurel et al. (2010).
Si bien la prevención de la trasmisión no fue total y se mantiene el riesgo de diseminación de la enfermedad, se debe tener en cuenta que en este trabajo se utilizaron fuentes de inóculo con alta concentración de bacterias. Según Thyr (1968), Meletzus et al. (1993) y Gartemann et al. (2003), la aparición de síntomas depende de la población bacteriana colonizando el huésped. Cmm puede vivir como endófito en la planta de tomate pero para ocasionar síntomas debe superar una población de 108 cfu/g de tejido además de poseer algunos plásmidos involucrados en la patogenicidad (Meletzus et al., 1993). A ese nivel la bacteria es capaz de provocar la alteración física del xilema lo cual junto a la producción de extrapolisacáridos impide la normal circulación de agua.
En un cultivo comercial las plantas con síntomas seguramente son eliminadas previamente al deshoje o desbrote o no se realizan labores en el resto del cultivo usando la misma herramienta.
A pesar de que en trabajos se obtuvieron buenos resultados utilizando desinfectantes a base de iodo para Clavibacter michiganensis ssp. sepedonicus (Koponen et al., 1992), en nuestro estudio la solución de iodo jabonosa empleada no tuvo efecto en la prevención de la trasmisión. Los valores obtenidos fueron muy similares a los del testigo sin desinfección, por lo que su uso no sería recomendable en cultivos comerciales para ese fin. Probablemente la diferencia radique en la naturaleza química de los compuestos a base de iodo evaluados.
De acuerdo a los resultados obtenidos de mantenerse las condiciones de uso (tiempo de acción) el mejor desinfectante para evitar la trasmisión por tijeras es la solución de hipoclorito de sodio. Sin embargo, en las condiciones de campo deberán tenerse en cuenta la pérdida de su efectividad por fotodegradación o por acumulación de materia orgánica, aspectos que no son mencionados como limitantes para los otros productos evaluados. Una alternativa para mejorar el desempeño de esta medida puede ser el uso de múltiples tijeras de forma de aumentar el tiempo de permanencia en la solución desinfectante.
De todas formas la falta de prevención total de la trasmisión hace imprescindible que esta medida sea incluida como parte de un manejo integrado de la enfermedad y no en forma aislada.
En este trabajo se encontraron diferencias entre los porcentajes de infección con Cmm estimados mediante el aislamiento en medio de cultivo, serología y presencia de síntomas. La utilización de medios de cultivo que no fueron semiselectivos, tal como se recomienda para la detección de este patógeno (OEPP, 2003), permitió el aislamiento de bacterias con colonias similares a Cmm pero que no correspondían al patógeno en estudio, aún en el tratamiento testigo sin infectar. Kaneshiro et al. (2006) mencionan varias bacterias similares a Cmm aisladas de tomate que no reaccionan con el antisuero monoclonal Cmm1 (Microbacterium saperdae, M. laevaniformans, Sanguibacter keddieii, Curtobacter citreum, C. pusillhum).
El hecho de que los porcentajes de detección de Cmm por ELISA fueran mayores a los porcentajes de plantas con síntomas visibles en los tratamientos puede ser debido a la ocurrencia de un período de latencia prolongado (Tsiantos, 1987; Chang et al., 1992) y/o a su presencia como endófito sin llegar a concentraciones que hayan causado síntomas (Thyr, 1968; Meletzus et al., 1993; Gartemann et al., 2003).
Bibliografía
Alvarez A, Derie M, Benedict A, Gabrielson R. 1993. Characteristics of a monoclonal antibody to Clavibacter michiganensis subsp. michiganensis. Phytopathology, 83: 1405.
Ark PA. 1944. Studies on bacterial canker of tomato. Phytopathology, 34: 394 – 400.
Baysal-Gurel F, Xu X, Rajashekara G, Miller SA. 2010. Effect of disinfectants on transmission of Clavibacter michiganensis subsp. michiganensis during grafting. Phytopathology, 100: S13.
Carlton WM, Gleason ML, Braun EJ. 1994. Effects of pruning on tomato plants supporting epiphytic populations of Clavibacter michiganensis subsp. michiganensis. Plant Disease, 78: 742 – 745.
Chang RJ, Ries SM, Pataky JK. 1992. Effects of temperature, plant age, inoculum concentration and cultivar on the incubation period and severity of bacterial canker of tomato. Plant Disease, 76: 1150 – 1155.
Chang RJ, Ries SM, Pataky JK. 1991. Dissemination of Clavibacter michiganensis subsp. michiganensis by practices used to produce tomato transplants. Phytopathology, 81: 1276 – 1281.
Davis MJ, Gillespie AG, Vidaver AK, Harris RW. 1984. Clavibacter: a new genus containing some phytopathogenic coryneform bacteria, including Clavibacter xyli subsp. xyli sp. nov., subsp. nov. and Clavibacter xyli subsp. cynodontis subsp. nov., pathogens that cause ratoon stunting disease of sugarcane and bermudagrass stunting disease. International Journal of Systematic Bacteriology, 34: 107 – 117.
Gartemann KH, Kirchner O, Engemann J, Gräfen I, Eichenlaub R, Burger A. 2003. Clavibacter michiganensis subsp. michiganensis: ûrst steps in the understanding of virulence of a Gram-positive phytopathogenic bacterium. Journal of Biotechnology,106: 179 – 191.
Gitaitis RD, Beaver RW, Voloudakis AE. 1991. Detection of Clavibacter michiganensis subsp. michiganensis in symptomless tomato transplants. Plant Disease, 75: 834 – 838.
Gleason ML, Braun EJ, Carlton WM, Peterson RH 1991. Survival and dissemination of Clavibacter michiganensis subsp. michiganensis in tomatoes. Phytopathology, 81: 1519 – 1523.
Kaneshiro W, Mizumoto C, Alvarez A. 2006. Differentiation of Clavibacter michiganensis subsp. michiganensis from seed-borne saprophytes using ELISA, Biolog and 16S rDNA sequencing. European Journal of Plant Pathology, 116: 45 – 56.
Kleinhempel H, Nachtigall M, Ficke W, Ehrig F. 1987. Disinfection of pruning shears for the prevention of the fire blight. Acta Horticulturae, 217: 211 – 218.
Koponen H, Manninen M, Harji P, Avikainen H, Rahvonen R. 1992. The effect of disinfectants on Clavibacter michiganensis ssp. sepedonicus and Erwinia carotovora ssp. atroseptica on different surface materials. Agricultural Science in Finland, 1(6): 597 – 602.
Lelliot R, Stead D. 1987. Methods in Plant Pathology : Methods for the Diagnosis of Bacterial Diseases of Plants. Vol. 2. Oxford : Blackwell Scientific Publications. 216p.
Mebalds M, Tregea W, van der Linden, A. 1997. Disinfection protocols for equipment used in the nursery industry. Gordon, AU : Horticultural Research & Development Corporation. 65p. (NY ; 612).
Meletzus D, Bermpohl A, Dreier J, Eichenlaub R. 1993. Evidence for plasmid-encoded virulence factors in the phytopathogenic bacterium Clavibacter michiganensis subsp. michiganensis NCPPB382. Journal of Bacteriology, 175(7): 2131 – 2136.
OEPP. 2003. Quarantine pest Prepared by CABI and EPPO for the EU under Contract 90/399003 Data Sheets on Quarantine Pests.Clavibacter michiganensis subsp. michiganensis [En línea]. Consultado agosto 2011. Disponible en: http://www.eppo.org/QUARANTINE/bacteria/Clavibacter_m_michiganensis/CORBMI_ds.pdf.
Strider DL. 1969. Bacterial canker of tomato caused by Corynebacterium michiganense. A literature review and bibliography. North Carolina Agricultural Experiment Station Technical Bulletin, 193.
Teviotdale BL, Wiley MF, Harper DH. 1991. How disinfectants compare in preventing transmission of fire blight. California Agriculture, 45: 21 - 23.
Thyr BD. 1968. Bacterial canker of tomato : Inoculum level needed for infection. Plant Disease Reporter, 52: 741 - 743.
Thomas RC. 1930. The canker disease of tomato. Ohio Agricultural Experiment Station Bulletin, 145: 116 – 122.
Tsiantos J. 1987. Transmission of bacterium Corynebacterium michiganense pv. michiganense by seeds. Journal of Phytopathology, 119: 142 – 146.
van der Wolf JM, Elphinstone JG, Stead DE, Metzler M, Müller P, Hukkanen A, Karjalainen R. 2005. Epidemiology of Clavibacter michiganensis subsp. sepedonicus in relation to control of bacterial ring rot [En línea]. Wageningen : Plant Research International. Consultado 6 junio 2014. Disponible en: http://edepot.wur.nl/39352.














